SOP-B-QC008-00 留样管理制度 2
- 格式:doc
- 大小:25.18 KB
- 文档页数:2

留样管理规定留样管理规程⼀、⽬的:建⽴留样管理规程,确保留样管理及检测⼯作的顺利进⾏。
⼆、适⽤范围:原料、辅料、包装材料、中间体、成品的法定留样和稳定性考察。
三、责任⼈:QA室主任:负责法定留样样品的使⽤和留样样品销毁的审批。
QC室主任:负责监督本程序的实施。
留样管理员:严格执⾏本程序的各项规定。
四、管理规程:1.留样品留样品是指为满⾜产品质量稳定性考察及质量复查的需要⽽预留下的产品样品。
留样分为两部份:法定留样和稳定性考察留样,且两部份样品应分开存放。
2. 留样观察样品的取样⽅法需留样观察的原辅料、包装材料、中间体样品由QC化验员取样,成品由QA 从包装完整的产品中抽取。
3. 留样数量3.1 原料、辅料、中间体凡进⼚的原料、辅料,以及⽣产的中间体在取样时取约检验量的三倍样品,⼀份做进⼚检验,另2份做留样观察,放⼊⼲净的容器内封⼝,贴上标签,注明品名、批号、⽣产⼚家、留样⽇期等,及时填写《原辅料留样记录》。
3.2 包装材料包装材料改版、更换供应商或新包装材料时需留样,留样量为全检量的2倍,留样后及时填写《包装材料留样记录》。
3.3 成品成品法定留样通常为全检量的2倍(⼀般情况下不包括微⽣物限度检验⽤量)。
3.4稳定性考察的留样量根据稳定性考察的项⽬、每次试验的⽤量、考察期的长短等因素来决定。
⼀般为检验量的5倍。
由留样管理员下发《加⼤留样通知书》交车间外包装⼯⼈,由车间外包装⼯⼈加⼤留样。
需作稳定性考察的产品3.5 新品种投产的前三批产品,其余同常规品种⼀样处理。
3.6常规品种常规⽣产的品种每年应重点留样考察1⾄3批,具体⽅案如下:每年⽣产少于10批:考察1批;每年⽣产10~25批:考察2批;每年⽣产多于25批:考察3批;3.7 永久性变更的品种当作出永久性变更,如处⽅、⽣产⼯艺或内包装材料的变更,⽽这些变化会影响产品的稳定性时,变更后的前三批须包括在考察计划内。
其它按常规品种处理。
3.8 临时变更的品种如果某⼀批产品⽣产过程中因特殊原因,做出了可能影响产品稳定性的临时决定,如处⽅、⽣产⼯艺或内包装材料的变更,则该批必须包括在稳定性考察的⽅案内。

留样室管理规程目录1.目的 (3)2.范围 (3)3.职责 (3)4.程序 (3)4.1留样 (3)4.2留样的条件 (3)4.3留样原则和留样形式 (4)4.4成品的留样抽查 (5)4.5留样样品的管理 (5)5.派生记录 (5)6.变更历史 (6)1.目的建立一个留样室管理规程,用于产品质量追溯或调查,为保证产品的质量提供重要依据。
2.范围适用于物料、中间产品、待包装产品、成品的留样室的管理。
3.职责3.1品质部QC:负责本文件的制订。
3.2品质部QC主任:负责本文件的一次审核。
3.3品质部QA:负责本文件的二次审核。
3.4质量授权人:负责本文件的批准。
3.5品质部QA、QC负责本文件的执行工作。
4.程序4.1留样按规定保存的、用于产品质量追溯或调查的物料、产品样品为留样。
用于产品稳定性考察的样品不属于留样。
4.2留样的条件4.2.1留样条件应符合留样样品的储藏要求,有温、湿度相应的控制设施,留样室分为常温、阴凉、两种留样室。
4.2.2常温留样室温度应控制在10℃-30℃,相对湿度45%-75%;阴凉留样室温度应控制在20℃以下,相对湿度应控制在60%±10%。
4.2.3每天观察留样室温湿度是否在规定的范围内,并及时记录。
当发现温湿度不符合要求时,应立即采取相应措施(开空调或吸湿机),同时上报品质经理,并在《温湿度监测记录》中注明。
4.3留样原则和留样形式4.3.1成品所有样品均需按批留样,如果一批产品分成数次进行包装,则每次包装至少应当保留一个最小市售包装的成品,并及时登记《留样台账》,根据贮存条件进行管理。
4.3.2与产品直接接触的包装材料可以追溯到成品留样的可以不留样(如聚乙烯瓶等)。
4.3.3成品生产所用的原料、外购中药提取物、辅料留样包装形式原则上按进厂物料包装进行留样。
4.3.4物料由取样员取样后送至留样室,登记后按照样品的贮存条件贮存,易变质、易挥发的物料按照样品的贮存条件在各留样室留样。

留样管理制度留样管理制度文件编号:分发编号:编制:审核:批准:主管部门:品质部适用部门:品质部发布日期:*年*月*日实施日期:*年*月*日文件修改记录序号修订日期修订内容修订人备注1目的本标准规定了留样管理的操作程序,旨在通过留样观察考察原辅料、中间产品和成品的稳定性。
适用范围本标准适用于原料、辅料、直接接触医疗器械的包装材料、中间产品和成品的留样观察。
职责3.1 品质部部长a)负责规定留样样品的使用和销毁审批。
3.2 QCb)严格执行本程序的规定。
规范说明4.1 成品留样原则所有正式生产的产品都需留样,留样分为重点留样和一般留样。
4.1.1 重点留样新投产的产品、改变工艺后的产品、企业主导产品以及产量不稳定的产品都需重点留样。
4.1.2 一般留样除重点留样外的产品均作为一般留样。
4.2 留样样品的取样方法4.2.1 需留样的原辅料包装材料、中间产品和成品在抽样检验时由QC一并抽取样品。
4.3 留样数量4.3.1 进厂的原料、辅料、直接接触医疗器械的包装材料以及生产的中间体,应留取一次全检量的样品,放入干净的内封口,贴上标签,注明品名、批号、生产厂家、产地、留样日期等。
4.3.2 成品成品一般留样应留足一次全检量的样品。
重点留样根据观察次数、时间计算应留样的数量。
4.4 留样样品的接收留样样品抽取后,由QC按批登记,填写《留样登记表》,贮存在留样室内,按年度、品种、批号顺序进行排列,以便查找。
4.5 留样样品的贮存留样样品应贮存在专用的留样室内,由专人负责。
留样室应符合样品的贮存条件,QC应按时填写《温湿度监测记录》。
4.6 留样样品的观察4.6.1 成品留样样品在留样时做一次全检。

样品留样管理制度第一篇:样品留样管理制度连云港新浦区地赐饲料厂原辅料观察制度保密级别:秘密文件名称:原辅料样品留样管理制度文件名称:样品留样管理制度起草人:审核人:受控部门:生产管理部、质量保证部1.目的提供和规范本公司留样样品管理方法。
2.范围本公司留样样品的使用和管理。
质量保证部负责人、检定人员、留样观察样品管理人员。
3.内容3.1质量保证部设置产品留样观察室,室内有必要的样品存放条件和温湿度测试设施。
指派专人负责留样观察工作。
3.2留样观察人员接收样品时,检查封口是否完好、外标签是否完好、清楚,合格后双方填写《留样样品接收台帐》,包括名称、日期、批号、规格、数量、厂家、送样人、收样人。
3.3留样数量:3.3.1物料(主要物料):全检量的3倍; 3.3.2中间产品:全检量的2倍; 3.3.3成品:全检量的8倍;3.3.4稳定性试验考察:全检量的2倍。
3.4留样包装应与市售一致,贮存场所的环境温度、湿度与产品标签所述一致。
3.5每批留样均应贴上留样证,注明:品名、规格、留样数量、批号、留样日期、抽样人等。
3.6样品管理人员将留样观察的样品按要求分类、整齐存放于指定条件的地点。
3.7样品存放间温湿度应符合要求,温度应不高于30℃,湿度应保持在45%~65%,且有温、湿度计与照明、排风设施。
3.8所有样品均应保存至规定的留样期限,一般药品留样保存期限为有效期后一年,如未制定效期,则保存期限为四年。
3.8.1原辅料留样时间至有效期后一年;3.8.2包材留样时间至版本更换后最后一批包材有效期后一年;日期:批准人:日期:日期:执行日期:颁发部门:质量保证部连云港新浦区地赐饲料厂原辅料观察制度保密级别:秘密文件名称:原辅料样品留样管理制度3.8.3中间产品留样时间至产品放行;3.8.4成品留样时间至产品的有效期后一年。
3.9留样由质量保证部专人保管,并建立留样台帐,定期登记清理。
3.10样品管理人员每天检查留样室温度、湿度,并作记录。
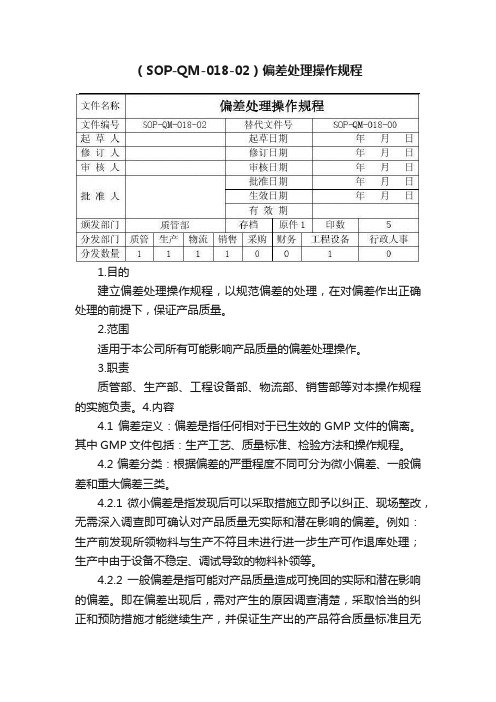
(SOP-QM-018-02)偏差处理操作规程1.目的建立偏差处理操作规程,以规范偏差的处理,在对偏差作出正确处理的前提下,保证产品质量。
2.范围适用于本公司所有可能影响产品质量的偏差处理操作。
3.职责质管部、生产部、工程设备部、物流部、销售部等对本操作规程的实施负责。
4.内容4.1 偏差定义:偏差是指任何相对于已生效的GMP文件的偏离。
其中GMP文件包括:生产工艺、质量标准、检验方法和操作规程。
4.2 偏差分类:根据偏差的严重程度不同可分为微小偏差、一般偏差和重大偏差三类。
4.2.1 微小偏差是指发现后可以采取措施立即予以纠正、现场整改,无需深入调查即可确认对产品质量无实际和潜在影响的偏差。
例如:生产前发现所领物料与生产不符且未进行进一步生产可作退库处理;生产中由于设备不稳定、调试导致的物料补领等。
4.2.2 一般偏差是指可能对产品质量造成可挽回的实际和潜在影响的偏差。
即在偏差出现后,需对产生的原因调查清楚,采取恰当的纠正和预防措施才能继续生产,并保证生产出的产品符合质量标准且无潜在质量风险。
例如:设备故障、损坏、清场不合格等。
4.2.3 重大偏差指已经或可能对产品质量造成不可挽回的实际和潜在影响的偏差。
偏差出现后,已明显对产品质量产生了影响,需对其重新处理或销毁处理等或者当时没有发现产品的质量发生变化,但产品质量在贮藏过程中可能存在隐患,对该产品进行重点留样及稳定性考察并可能采取产品召回等。
例如:关键参数偏离、测试结果未达到质量标准或超过警戒水平、混药、混批、包装材料混淆等。
4.3 偏差的处理方式:根据偏差的严重程度不同偏差的处理方式也不相同。
4.3.1 微小偏差的处理方式:微小偏差主要由发现人员采取应急措施并汇报工艺员和QA,工艺员负责对应急措施进行复核并对产生原因进行调查、提出纠正和预防措施。
QA对偏差的原因调查、处理措施和预防措施进行评估。
偏差发现部门经理和质管部部长对处理的过程和结果进行审核。

留样室管理制度范本一、目的为保证检验用原始样品具有可追溯性,避免对检验结果引起争议的处理产生不良影响,特制定本制度。
二、适用范围本制度适用于本中心药品、食品及相关产品、保健品、化妆品等留样管理工作。
三、留样室环境及设施要求1. 留样室应保持洁净干燥,温度控制在10-30℃之间,相对湿度控制在40%-75%之间。
2. 留样室的设备、设施应符合样品规定的贮存条件,设有防晒、防潮、降温通风、冷冻、冷藏设施、监控设施(如温湿度计)等。
四、留样管理要求1. 每个样品必须具有唯一性标识,在保存期间必须保证标识状态完好。
2. 留样室应由专人管理,要求留样保管人员定期检查、清点样品,在保管期间不得遗失、损毁。
室内不许存放与留样无关的物品。
3. 管理人员应对留样室温度、湿度及低温冷藏样品容器的温度、湿度进行监测,如温湿度超出范围应及时采取调控措施。
4. 凡接收检验的样品必须留样,留样由业务室负责。
留样数量不得少于一次检验量。
对于易腐败、霉变、挥发及开封后无保留价值的样品,可以不留样;微生物限度检验的样品不留样。
5. 留样的食品应采集在操作过程中或加工终止时,留样样品不得特殊制作。
留样容器应专用并经消毒确保清洁,样品应密闭保存在留样容器里。
6. 留样样品,采集完成后应及时存放在5℃以下的冷藏条件下,保存48小时以上,不得冷冻保存。
五、留样记录与监控1. 留样保管人员应做好留样记录,记录包括样品名称、来源、数量、留样时间、保存条件、监测结果等信息。
2. 留样室应配备监控设备,对留样室内进行24小时监控,确保留样样品的安全。
六、留样室安全与卫生1. 留样室应制定安全与卫生管理制度,确保留样室的安全与卫生。
2. 留样室内应定期进行清洁和消毒,防止细菌和病毒的滋生。
3. 留样室内禁止吸烟、饮酒、吃零食等不卫生的行为。
七、违规处理1. 对不遵守本制度的员工,留样室管理员有权对其进行批评教育,并报请上级处理。
2. 对违反本制度,导致样品遗失、损毁、污染等严重后果的,应追究相关人员的责任,并按有关规定进行处罚。
留样管理制度文件编号:分发编号:编制:审核:批准:主管部门:品质部适用部门:品质部发布日期:*年*月*日实施日期:*年*月*日1目的本标准规定了留样管理的基本操作程序,通过留样观察考察原辅料,中间产品和成品的稳定性。
2适用范围本标准适用于原料、辅料、直接接触医疗器械的包装材料、中间产品和成品的留样观察。
3职责3.1 品质部部长a)负责规定留样样品的使用和留样样品销毁的审批。
3.2 QCb)严格执行本程序的各项规定。
4 规范说明4.1 成品留样原则凡是正式生产的产品都需留样,留样分重点留样和一般留样。
4.1.1 重点留样新投产的产品,改变工艺后的产品,企业主导产品,产量不稳定产品。
4.1.2 一般留样除重点留样外的产品均作为一般留样。
4.2 留样样品的取样方法4.2.1 需留样的原辅料包装材料,中间产品、成品在抽样检验时由QC一并抽取样品。
4.3 留样数量4.3.1 凡进厂的原料、辅料,直接接触医疗器械的包装材料以及生产的中间体留取一次全检量的样品,放入干净的容器内封口,贴上标签,注明品名、批号、生产厂家、产地、留样日期等。
4.3.2 成品成品一般留样留足一次全检量样品。
重点留样根据观察次数,时间计算应留样的数量4.4 留样样品的接收留样样品抽取后,由QC按批登记,填写《留样登记表》、,贮存在留样室内,按年度、品种、批号顺序进行排列,以便查找。
4.5 留样样品的贮存留样样品应贮存在专用的留样室内,有专人负责,留样室应符合样品的贮存条件,由QC按时填写《温湿度监测记录》。
4.6 留样样品的观察4.6.1 成品留样样品在留样时做一次全检。
4.6.2 一般留样样品在留样期间每季度做一次外观性状检查,如遇该产品质量投诉时,做复核检验用。
4.6.3 重点留样样品,每季度检查外观性状、水分、含量等,每12个月全检一次。
4.6.4 重点留样品种,每年考察不少于3批。
原辅料、包装材料、中间产品在贮存期内观察1-2次外观性状。
留样室管理制度为了规范留样室的管理,确保留样工作的科学和有序进行,提高留样工作的效率和质量,特制定留样室管理制度。
一、留样室管理机构1.留样室管理由专门的留样室管理员负责,直接向实验室主管汇报工作。
2.实验室主管对留样室的管理负总责,对留样室管理员的工作进行考核。
3.留样室管理员负责留样室的日常管理工作,包括留样记录、留样标签、留样保管等。
二、留样室管理制度1. 留样室的开放时间为每个工作日的8:00-17:00,其他时间请提前填写留样申请表并得到批准。
2. 每个留样室的工作人员都必须经过留样室管理员的指导和考核,掌握留样工作的技能和规范。
3. 留样室管理员要定期对留样室进行清洁和消毒,确保留样操作的卫生和安全。
4. 留样室管理员要进行留样器具和材料的定期检查和清点,确保留样的准确性和可追溯性。
5. 对于留样物品的清理和处理,应严格按照相关规定和标准进行操作,不得擅自处理或外流。
6. 留样室管理员要认真记录每次留样的相关信息,包括留样时间、留样人员、留样物品等,确保记录的真实性和完整性。
7. 留样室管理员负责留样物品的保管和存储,确保留样物品的完整和不受污染。
8. 对于留样物品的回收和处置,应按照相关要求进行操作,确保留样物品的安全和环保。
9. 留样室管理员要积极参加相关的培训和学习,不断提高留样工作的水平和质量。
10. 留样室管理员要积极配合实验室的其他部门进行工作,确保留样工作与其他工作的无缝对接。
11. 留样室管理员要严格遵守实验室的各项管理制度和规定,不得违规操作或放任不管。
三、留样室管理的检查和考核1. 实验室主管定期对留样室的管理工作进行检查和考核,对留样室的工作效果和管理情况进行评估和总结。
2. 实验室主管要及时对留样室的管理工作进行指导和帮助,及时发现和解决留样工作中存在的问题和难点。
3. 对于留样室管理员的工作绩效,实验室主管要进行定期考核和评价,奖惩分明。
四、留样室管理制度的执行和改进1. 留样室管理员要严格按照留样室管理制度执行留样工作,不得擅自变更或违规操作。
目的:阐述物料、中间产品、成品留样类别、数量、贮藏、保存期、观察项目、异常情况报告、评价、销毁等管理办法,其目的主要在于:1.为制订物料的贮存期、产品的有效期获得数据;2.获得数据以证实产品质量和生产方法、检验方法等在有效期内的稳定性;3.便于在必要时及时采取补救措施。
范围:适用于留样管理。
职责:质保部、质检部对此规程的实施负责。
规程:1留样类别包括“法定”留样和留样考察留样。
2“法定”留样:2.1留样计划:2.1.1下列情况留取“法定”留样样品,以备检验、复检和有争议时使用:(1)药材;(2)化学原辅料;(3)内包装材料;(4)印刷性包装材料;(5)中间产品;(6)成品。
2.1.2留样量与留样时间:(1)每批药材、化学原辅料、内包装材料、印刷性包装材料、中间产品的“法定”留样量不少于完成质量标准中全部检验所需的量,留样保存时间至少1年,属于索赔或退货检品的留样,保留至该案完结时。
(2)每批成品的“法定”留样量不少于完成质量标准中全部检验所需量的2倍,至少留样保存至有效期后一年。
2.2贮藏条件:(1)样品容器应密封,存放在质检部留样观察室,按品种分开存放,并与留样考察样品分开,标准计量室标准标本管理员(以下简称管理员)负责日常管理,留样观察室在无人时必须加锁锁好。
(2)样品的贮藏应符合该品种规定的贮藏条件:室温指0-30℃,阴凉处指不超过20℃,凉暗处指避光且不超过20℃,冷处指2-10℃,当没有特殊规定时,相对湿度一般在50—70%。
(3)留样观察室内进口处设置温湿度计一个,管理员每工作日至少记录一次温湿度,当温湿度超出规定范围时,应立即采取开关空调等措施,以调节温湿度到规定范围,并随时做记录(见附件一)。
(4)留样观察室须保持清洁。
2.3样品接收:(1)取样人员负责留样样品的取样,一般在检验取样时一并抽取,填写“留样标签”(见附件二),在“留样标签”上注明样品的名称、代号、批号、数量、贮藏条件、留样保存期、取样日期、留样日期、取样人,并在“留样标签”的“备注”栏注明“法定”留样,粘贴在样品容器上,密封好样品容器,移交给管理员。
留样管理制度1.目的用于产品质量追溯以及产品性能研究等,定期检验产品来验证有效期的合理性,为产品开发、产品材料和工艺改进提供科学的依据。
2.范围适用于本公司生产的成品的留样。
3.职责3.1.生产部负责留样产品的制造。
3.2.质量部是产品留样的主管部门,负责对留样产品的保存、观察及检测。
负责对留样室的日常管理。
4.内容4.1.产品的留样量4.1.1.技术转移时质量部配合客户确认留样量,留样量一般为留样期间检测量的 1.5-2倍。
4.1.2.留样按每个生产批经检验合格且完成最后一道工序后进行留样。
4.2.留样样品的入库:质量部将检验合格的产品按留样量随机抽取,将留样产品的信息录入台账;内容至少包括:产品名称、规格/型号、留样批号、留样日期、留样期限等,将抽取的留样产品放入留样室。
4.3.留样保存期限4.3.1.技术转移时质量部配合客户确认留样期限,一般留样期限为产品拟定效期后的 6个月。
4.3.2.留样的产品已过留样期限时,若质量不变,则根据具体情况选择继续观察,以积累资料;有科研需要的特殊品种,可延长留样时间,积累资料;不需要继续留样的产品做报废处理,填写《产品报废单》。
4.4.留样观察4.4.1.技术转移时质量部配合客户确认留样观察项和观察周期,留样观察项一般前 6 个月外观检验,6 个月后每 3 个月对关键项检验。
4.4.2.待留样产品效期满后做一次全性能检测。
4.4.3.若发生用户投诉或质量争议时,则对留样产品进行全性能检测。
4.4.4.没有质量跟踪需要,不得随意打开留样产品的外包装,保持产品留样的完整。
4.5.留样的样品出库4.5.1.任何人借留样产品都必须通过质量部负责人同意才可以办理样品出库。
并做好《留样台帐》的记录。
4.5.2.留样样品借出的必须归还,报废的样品无需归还,借出的样品如有报废,应填写《产品报废单》,由质量部门执行。
4.6.留样样品的销毁4.6.1.留样期限的产品可根据情况进行性能测试,以评估产品的质量情况;若超过留样期限的质量不合格样品应销毁。
1.目的
建立留样管理规程,规范留样程序,以便于药品质量追溯或调查。
2.范围
2.1 原料药生产中的成品及其起始原料。
2.2 因特定要求需要留样的物料,如商业批的中间产品等。
3.责任
3.1 QC:负责制定并执行本规程,并对本规程的具体实施负责。
3.2 QA:负责会审与监控本规程的执行。
4.程序
4.1定义:企业按规定保存的、用于药品质量追溯或调查的物料、产品样品为留样。
4.2留样管理
4.2.1留样应由专人负责,留样室必须上锁,未经留样员的许可不得随便进出。
4.2.2留样分为常温留样及冷处留样。
常温留样室主要用于存放常温条件下贮存的留样,留样室温度应控制在10~30℃,湿度应控制在≤85%。
冷处留样主要是用于存放按规定需冷处保存的留样,应贮存于冷柜保存,冷柜温度应控制在2~8℃。
4.2.3每天上午9:00~9:30及下午17:00~17:30应及时记录常温留样区温、湿度。
4.2.4留样区温湿度控制出现偏差等异常情况时,留样管理人员应及时向QC负责人报告,以便及时调查原因并采取相应的解决措施。
4.2.5留样管理员负责保持留样室的清洁。
4.2.6成品留样的包装形式应与药品市售包装形式相同,原料药的留样如不采用市售包装形式的,应采用模拟包装。
4.2.7留样管理员应对留样按不同品种、规格、生产批号保管,便于查找。
并做好“留样台帐”(附件1)。
4.2.8留样在用于分析用户投诉原因等类似情况下,可由调用人提出书面“留样调用申请单”(附件2),并经质量保证部负责人批准后方可调用。
留样管理员应在留样台账上备注中注明调用人、调用日期及调用原因。
4.3留样程序
4.3.1 QC取样员在取样完毕后应及时将取样中的留样按规定送交留样管理员。
4.3.2留样管理员在接收留样后,应检查样品的包装,标签上内容应完整无误。
4.3.3留样管理员在确定留样都符合要求后,按规定存放并做好留样台账,内容应包括品名、批号、生产日期、数量、留样日期、留样人、贮存条件、有效期等。
4.4留样量
根据各产品和原辅材料检验规程规定,一般为2倍全检量(无菌检查和热原检查等除外)。
4.5留样的保存期
4.5.1原料药起始原料留样保存期:原料药起始原料留样按规定的条件应保存至有效期后一年。
4.5.2原料药成品留样保存期:原料药成品留样应保留到该批的有效期过后一年,或该批产品分发后三年,以长的为留样保存期。
4.5留样的销毁
留样在保存期满后,应及时进行清理,并将已过有效期的样品统一整理,统一保存,并做好相应标示,标明是已过有效期、待处理的样品。
并在每月月底(26-31号)进行销毁处理,按文件与物料报废销毁规程由留样管理员填写产品销毁申请,经批准后,在QA人员现场监督的情况下由留样管理员予以销毁,并在留样台帐备注上作好销毁相关记录。
5.附件列表
留样台帐SOP-B-QC008-00附件1。
留样调用申请单SOP-B-QC008-00附件2。
6. 修订历史。