烃的含氧衍生物的方程式
- 格式:doc
- 大小:433.00 KB
- 文档页数:9


烃的衍生物的化学方程式必背必会一、溴乙烷与卤代烃(化性:水解、消去)1、溴乙烷与氢氧化钠水溶液共热:CH3CH2Br+3CH2OH+NaBr2、溴乙烷与氢氧化钠的乙醇溶液共热:CH3CH2Br+2=CH2↑+NaBr+H2O二、乙醇与醇类(化性:取代、消去、氧化、酯化)3、乙醇燃烧:CH3CH2OH+3O2+3H2O4、乙醇与钠的反应:2CH3CH2OH+2Na2CH3CH2ONa+H2↑5、乙醇与溴化氢共热:CH3CH2OH+3CH2Br+H2O6、乙醇分子间脱水:2CH3CH23CH2OCH2CH3+H2O7、乙醇与浓硫酸共热170℃(乙醇分子内脱水、实验室制乙烯原理):CH3CH22=CH2↑+H2O8、乙醇的催化氧化:2CH3CH2OH+O3CHO+2H2O9、乙醇与乙酸和浓硫酸共热(酯化反应):CH3COOH+CH3CH23COOCH2CH3+H2O三、苯酚与酚类(化性:取代、加成、缩聚)10、苯酚燃烧:C6H6O+7O2+3H2O11、苯酚与氢氧化钠溶液反应:C6H5OH+NaOH C6H5ONa+H2O12、苯酚钠溶液中通入二氧化碳气体离子:化学方程式C6H5ONa+CO2+H2O===C6H5OH+NaHCO3离子方程式C6H5O-+CO2+H2O===C6H5OH+HCO3-13、苯酚溶液中加入浓溴水(生成白色沉淀):+3Br 2 ↓+3HBrBr14、苯酚溶液中加入氯化铁溶液(溶液变为紫色)15、苯酚在一定条件下与氢气反应:+3H16、酚醛树脂的制备(缩聚反应):四、乙醛与醛类(化性:还原、氧化、缩聚)17、乙醛与氢气反应:CH 3CHO +H 3CH 2OH18、乙醛的燃烧:2C 2H 4O +5O 2+4H 2O19、乙醛的催化氧化: 2CH 3CHO +O 3COOH20、乙醛与银氨溶液反应:CH 3CHO +2[Ag(NH 3)22O +2Ag +3NH 3↑+CH 3COONH 421、乙醛与新制的氢氧化铜反应:CH 3CHO +2Cu(OH)23COOH +Cu 2O↓+2H 2O22、甲醛与过量的银氨溶液反应:HCHO +4[Ag(NH 3)22↑+3H 2O +4Ag +8NH 3↑23、甲醛与过量的新制的氢氧化铜反应:HCHO +4Cu(OH)22↑+2Cu 2O↓+5H 2O五、乙酸与羧酸类(化性:取代、酯化、缩聚)24、乙酸与钠反应:2CH 3COOH +2Na 2CH 3COONa +H 2↑25、乙酸与氧化镁反应:2CH 3COOH +MgO (CH 3COO)2Mg +H 2O26、乙酸与氢氧化钠反应:CH 3COOH +NaOH CH 3COONa +H 2O27、乙酸与碳酸钙反应:CH 3COOH +CaCO 3(CH 3COO)2Ca +CO 2↑+H 2O28、乙酸与碳酸氢钠反应:CH 3COOH +NaHCO 3CH 3COONa +CO 2↑+H 2O29、乙酸与乙醇和浓硫酸共热:CH 3COOH +CH 3CH 23COOCH 2CH 3+H 2On OHCH 2+nH 2O30、乙二酸与足量的乙醇与浓硫酸共热:31、乙二醇与足量的乙酸和浓硫酸共热:3233、对苯二甲酸与乙二醇的缩聚:六、乙酸乙酯与酯类(化性:酸、碱条件下水解)34、乙酸乙酯的燃烧:C 4H 8O 2+5O 2+4H 2O 35、乙酸乙酯在酸性条件下的水解反应:CH 3COOCH 2CH 3+H 23COOH +CH 3CH 2OH 36、乙酸乙酯与氢氧化钠溶液共热: CH 3COOCH 2CH 3+3COONa +CH 3CH 2OH 完成下表:代表物能否与钠反应能否与NaOH 的反应能否与NaHCO3的反应能否与Na 2CO 3的反应乙醇苯酚乙酸乙酸乙酯+2H 2O +2H 2O附:其他一些化学反应方程式使用说明:在掌握上面的化学方程式的基础上尝试书写,不会写的请认真分析官能团在反应前后有何变化,再次理解官能团的概念。


第4讲烃的含氧衍生物【课标要求】1.能写出烃的衍生物的官能团、简单代表物的结构简式和名称;能够列举各类烃的衍生物的典型代表物的主要物理性质。
2.能描述和分析各类烃的衍生物的典型代表物的重要反应,能书写相应的反应式。
3.能基于官能团、化学键的特点与反应规律分析和推断含有典型官能团的烃的衍生物的化学性质,根据有关信息书写相应的反应式。
【学科素养】1.宏观辨识与微观探析:能从官能团的角度阐释烃的衍生物的主要性质,能分析烃的衍生物的性质与用途的关系。
2.证据推理与模型认知:能从类别、官能团、化学键等角度分析预测烃的衍生物的性质;能说明有机化合物的组成、官能团的差异对其性质的影响,形成“结构决定性质”的观念。
考点考题考点一:醇、酚、醚2021全国甲卷第10题2021全国乙卷第10题2021山东等级考第12题2020全国Ⅰ卷第8题2020全国Ⅲ卷第8题考点二:醛、酮2021全国甲卷第36(6)题2021全国乙卷第36(6)题2020全国Ⅱ卷第10题考点三:羧酸及其衍生物2021全国甲卷第10题2021全国乙卷第10题2020山东等级考第6题分析近五年高考试题,高考命题在本讲有以下规律:1.从考查题型和内容上看,高考命题以选择题和非选择题呈现,考查内容主要有以下两个方面:(1)考查烃的衍生物的性质与结构的关系;(2)考查烃的衍生物的原子共平面、同分异构体等。
2.从命题思路上看,侧重以陌生有机物的结构简式为情境载体考查烃的衍生物的重要性质。
3.从考查学科素养的角度看,注重考查宏观辨识与微观探析、证据推理与模型认知的学科素养。
根据高考命题的特点和规律,复习时要注意以下几个方面:(1)烃的含氧衍生物的官能团有哪些;(2)烃的含氧衍生物典型代表物的性质有哪些,怎样检验;(3)烃的含氧衍生物的同分异构体的书写规律是怎样的;(4)烃的含氧衍生物之间是怎样相互转化的。
考点一:醇、酚、醚(基础性考点)(一)从官能团角度认识醇、酚、醚1.官能团与物质类别醇→(醇)羟基(—OH)酚→(酚)羟基(—OH)醚→醚键【微点拨】醇与酚的区别醇是羟基与饱和碳原子相连而酚是羟基与苯环(或其他芳环)上的碳原子直接相连。

考点烃的含氧衍生物一、醇类1.醇类(1)定义:羟基与烃基或苯环侧链上的碳原子相连形成的化合物称为醇。
(2)醇的分类注意啦:饱和一元醇的通式是C n H2n+1OH,饱和一元醚的通式为C n H2n+2O,所以碳原子数相同的饱和一元醇和饱和一元醚互为同分异构体,如丁醇和乙醚互为同分异构体。
碳原子数相同的芳香醇及酚互为同分异构体。
(3)醇的物理性质和化学性质物理性质递变规律密度一元脂肪醇的密度一般小于1g·cm-3直链饱和一元醇的沸点随着分子中碳原子数的递增而升高沸点醇分子间存在氢键,所以相对分子质量相近的醇和烷烃相比,醇的沸点高于烷烃水溶性低级脂肪醇易溶于水,饱和一元醇的溶解度随着分子中碳原子数的递增而逐渐减小化学性质由于醇类都以羟基为官能团,所以醇类的化学性质与乙醇相似,即能与活泼金属反应,能发生酯化反应、消去反应、取代反应、氧化反应等。
注意啦:在二元醇或多元醇的分子中,两个或两个以上的羟基结合在同一个碳原子上时,物质不能稳定存在(如:→)。
在写二元醇或多元醇的同分异构体时,要避免这种情况。
(4)重要的醇的用途①甲醇:有毒,饮用约10 mL就能使人双目失明。
工业酒精中含甲醇,甲醇是重要的化工原料和车用燃料。
②乙二醇和丙三醇:都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。
乙二醇还用作汽车防冻液,丙三醇用于配制化妆品。
2.脂肪醇、芳香醇、酚和芳香醚的比较类别脂肪醇芳香醇酚芳香醚实例CH3CH2OH C6H5CH2OH C6H5OH C6H5OCH3官能团—OH—OH—OH—O—结构特点—OH与链烃基相连—OH与芳香烃侧链相连—OH与苯环直接相连氧原子连接2个烃基主要化学性质①与钠反应②取代反应③脱水反应④氧化反应⑤酯化反应等①弱酸性②取代反应③显色反应④加成反应等______特性红热铜丝插入醇中有刺激性气味(生成醛或酮)与FeCl3溶液反应显紫色______二、酚1.酚的概念和结构特征羟基与苯环直接相连而形成的化合物称为酚。
![[精品]2019高考化学第1章(化学计量在实验中的应用—物质的量)第1节(含解析)](https://uimg.taocdn.com/1c835b319b6648d7c1c746ad.webp)
第一章化学计量在实验中的应用——物质的量李仕才第一节物质的量气体摩尔体积考点一物质的量摩尔质量1.物质的量及其单位(1)定义:表示含有一定数目微观粒子的集合体的物理量。
符号为n。
2.阿伏加德罗常数(1)定义:0.012_kg_12C所含的原子数为阿伏加德罗常数,其数值约为6.02×1023,单位为mol-1,符号为N A。
(2)计算公式:物质的量n 、阿伏加德罗常数N A 与粒子数N 之间的关系为N A =Nn 。
3.摩尔质量(1)含义:单位物质的量的物质所具有的质量。
(2)符号M ,单位为g·mol -1或g/mol ,表达式M =m n。
(3)数值:Mg 的摩尔质量是24_g·mol -1,KCl 的摩尔质量是74.5_g·mol -1,SO 2的摩尔质量是64_g·m ol -1,CO 2-3的摩尔质量是60_g·mol -1。
由此可知:以g·mol -1为单位时,任何粒子的摩尔质量在数值上都等于该粒子的相对原子质量或相对分子质量。
判断正误(正确的打“√”,错误的打“×”)1.1 mol CaCO 3与1 mol KHCO 3的质量相同,含有阳离子的数目也相同。
( √ ) 2.2 mol HCl 的摩尔质量是1 mol HCl 的摩尔质量的2倍。
( × ) 3.1 mol 任何物质都含有6.02×1023个分子。
( × ) 4.1 mol 水中含有2 mol 氢和1 mol 氧。
( × ) 5.NaOH 的摩尔质量为40 g 。
( × )6.1 mol O 2的质量与它的相对分子质量相等。
( × ) 7.1 mol OH -的质量为17 g·mol -1。
( × )8.氖气的摩尔质量(单位g·mol -1)在数值上等于它的相对原子质量。


烃的含氧衍生物【原卷】一、选择题1.某化学兴趣小组对教材中乙醇氧化及产物检验的实验进行了改进和创新,其改进实验装置如图所示,按图组装好仪器,装好试剂。
下列有关改进实验的叙述不正确的是A.点燃酒精灯,轻轻推动注射器活塞即可实现乙醇氧化及部分产物的检验B.铜粉黑红变化有关反应为:2Cu+O2△2CuO、C2H5OH+CuO△CH3CHO+Cu+H2O C.硫酸铜粉末变蓝,说明乙醇氧化反应生成了水D.在盛有新制氢氧化铜悬浊液的试管中能看到砖红色沉淀2.泛酸又称为维生素B5,在人体内参与糖、油脂、蛋白质的代谢过程,具有抗脂质过氧化作用,其结构为,下列有关该化合物的说法不正确的是A.该物质可发生水解反应,水解产物均能发生缩聚反应B.1mol该物质与足量 NaOH 溶液反应,最多可消耗 2molNaOHC.该物质在铜、银等催化剂存在下可以被氧气氧化生成醛基和酮羰基D.该物质在浓硫酸、Al2O3或 P2O5等催化剂作用下可发生脱水反应,生成碳碳双键3.已知有机物(a)(b)(c),下列说法正确的是A.a、b、c均可与金属钠反应放出H2B.a、b、c三种物质可用紫色石蕊试液鉴别C.1mola与1molCH3OH在一定条件下反应可生成1molbD.除去b中少量a时,可先加NaOH溶液再分液4.利用有机物X、Y合成广谱抗菌药物M的反应表示如图。
下列说法不正确...的是()A.X分子与强酸、强碱均能发生反应B.Y分子与丙烯酸分子互为同系物C.X和Y均能使酸性高锰酸钾溶液褪色D.X、Y合成M的反应类型为取代反应5.科研人员提出CeO2催化合成DMC需经历三步反应,示意图如图:下列说法正确的是()A.DMC与过量NaOH溶液反应生成CO32-和甲醇B.CeO2可有效提高反应物的平衡转化率C.①、②、③中均有O—H的断裂D.生成DMC总反应的原子利用率为100%6.氯乙酸(CH2ClCOOH)是重要的分析试剂和有机合成中间体。

高考化学方程式大全(非常完全版)一、无机反应方程式1. ↑+=+22222H NaOH O H Na↑+=+22222H KOH O H K 2. ↑+=+2222422O NaOH O H O Na 3. 232222222O CO Na CO O Na +=+4. 氢氧化钠和碳酸钠在溶液中反应的离子方程式OH -+HCO 3-=CO 32-+H 2O5. 氯气溶于水(新制的氯水中含Cl 2,HClO,H 2O,H +,Cl -,ClO -,OH -)HClO HCl O H Cl +=+226. O H NaCl NaClO NaOH Cl 222++=+7. 次氯酸见光分解(强氧化剂,杀菌消毒,漂白剂)222O HCl HClO +光照8. HClO CaCO O H CO ClO Ca 23222+↓=++)( 9. ↑++∆+22222)(4Cl O H MnCl MnO HCl 浓 10.222422O HF O H F +=+HClO HCl O H Cl +=+22 HBrO HBr O H Br +=+2211.↑+=++22232222H NaAlO O H NaOH AlO H NaAlO NaOH O Al 223222+=+O H NaAlO NaOH OH Al 2232+=+)(12.双氧水分解:22222022O H MnO O H +13.32222SO O SO ∆−−→←+催化剂14.O H SO CuSO SO H Cu 2244222+↑++△(浓) 15.O H SO CO △SO H C 22242222+↑+↑+(浓)16.O H SO SO H S 2242232+↑+△(浓) 17.↑++CO Si C SiO 222高温18.322NH 2H N 催化剂高温高压−−−→←+19.NO O N 222放电+ 20.2222NO O NO =+21.NO HNO O H NO +=+3222322.O H NO O NH 2236454+−−→−+∆催化剂23.用浓盐酸检验氨气(白烟生成):Cl NH HCl NH 43=+ 24.O H SO Na NH NaOH SO NH 2423424222++↑+△)( 25.O H NaNO NH NaOH NO NH 23334++↑+△ 26.O H O NO HNO 2223244++↑光或热27.O H NO NO Cu HNO Cu 22233224+↑+=+)((浓) 28.O H NO NO Cu HNO Cu 223342383+↑+=+)((稀) 29.O H NO CO HNO C 222324)(4+↑+↑=+浓 30.FeCl 3+3KSCN 3KCl+Fe(SCN)331.盐类水解: 32.CH 3COO -+H 2OCH 3COOH +OH --23CO +H 2O HCO 3-+ OH-HCO 3-+H 2O H 2CO 3+OH - NH 4+ + H 2ONH 3·H 2O + H + Fe 3++3H 2O Fe (OH )3+3H +33.铝热反应:Fe O Al O Fe Al 223232++高温Mn O Al O Al 323Mn 4322++高温34.C MgO CO Mg ++222点燃35.424323342326SO NH OH Al O H NH SO Al )()()(+↓=⋅+ 36.NaAlO 2+HCl+H 2O=Al(OH)3↓+NaClNaAlO 2+CO 2+H 2O=Al(OH)3↓+NaHCO 337.高温下铁与水反应:2432443H O Fe O H Fe ++高温(气)38.NaCl OH Fe NaOH FeCl 3333+↓=+)(39.3222424)()(OH Fe O H O OH Fe =++ 40.3222Cl 2FeCl Cl Fe =+ 41.233Cl 2FeCl Fe Fe =+42.氯化铁溶液中加入铜粉:2232Cl 2CuCl FeCl Cu Fe +=+ 43.金属的冶炼:232323CO Fe CO O Fe ++高温CO C O ++Cu Cu 高温↑↑+−−→−23234O Al O Al 通电熔融44.铜锌原电池:正极:2H ++2e -=H 2↑负极:Zn-2e -=Zn 2+45.钢铁的吸氧腐蚀:正极:O 2 + 4e - + 2H 2O == 4OH -负极:Fe -2e -==Fe 2+46.Fe(OH)3胶体的制备:Cl OH Fe FeCl H 3O H 3323++(胶体))(加热 47.电解CuCl 2溶液: 阳极2Cl --2e -=Cl 2↑阴极Cu 2+ +2e - = Cu总反应 CuCl 2 电解Cu+Cl 2↑48.铜的电解精炼:阳极Cu -2e - = Cu 2+阴极Cu 2++2e - = Cu49.电镀铜:阳极Cu -2e - = Cu 2+阴极Cu 2++2e - = Cu50.电解饱和食盐水:阳极2Cl --2e -=Cl 2↑阴极2H ++2e -=H 2↑总反应2NaCl+2H 2O=H 2↑+Cl 2↑+2NaOH51.黄铁矿的燃烧:4FeS 2+11O 2高温 2Fe 2O 3+8SO 2 52.氨水吸收少量的SO 2:2NH 3+H 20+SO 2=(NH 4)2SO 3 53.CO H C O H ++22高温↑二、有机化学反应方程式1. O H CH CH OH CH CH 222C17023+↑=−−→−--。

有机计算一、有机物分子式与结构式求法M =22.4ρ(标况) M =DM1 (同温、同压))M =m(总)/n(总) → 摩尔质量 → 相对分子质量 M =M1a1+M2a2+…根据化学方程式和元素守恒 → 分子式 →结构式碳氢氧元素的质量碳氢氧元素的质量比 → 原子个数比 → 实验式 碳氢氧元素的质量分数 燃烧产物的物质的量例1:有机物A 含碳54.5%、氢9.10%、氧36.4%(质量分数),在标准状况下,蒸气密度是1.96g •L-1,它易溶于水,其水溶液与新制的氢氧化铜混合,加热到沸腾,有红色沉淀生成。
有机物B 含碳60%、氢13.33%、氧26.67%(质量分数),蒸气密度是氢气的30倍,它能发生酯化反应。
则下列各组中,A 、B 的结构简式正确的是A .CH3CHO CH3CH2CH2OHB .CH3CH2CHO CH3COOHC .CH3CHO CH3COOHD .CH3CHO CH3CH(OH)CH3 答案:A 、D 分析:MA=1.96 g •L-1 × 22.4L •mol-1=44 g •mol-11molA 中 含C=(44g × 54.5%)/12 g •mol-1=2mol 含H=(44g × 9.10%)/1g •mol-1=4mol 含O=(44g × 36.4%)/16 g •mol-1=1mol ∴分子式为C2H4O MB=2 g •mol -1 × 30=60 g •mol-11molB 中 含C=(60g × 60%)/12 g •mol-1=3mol 含H=(60g × 13.33%)/1g •mol-1=8mol 含O=(60g × 26.67%)/16g •mol-1=1mol ∴分子式为C3H8O二、有机物燃烧的有关计算熟练掌握有机物燃烧通式的书写: 1、烃的燃烧: (1)烃燃烧的通式(2)各类烃燃烧的通式:(根据各类烃通式,具体写出)2、烃的含氧衍生物的燃烧:3、卤代烃的燃烧:一般生成二氧化碳、水和卤化氢。
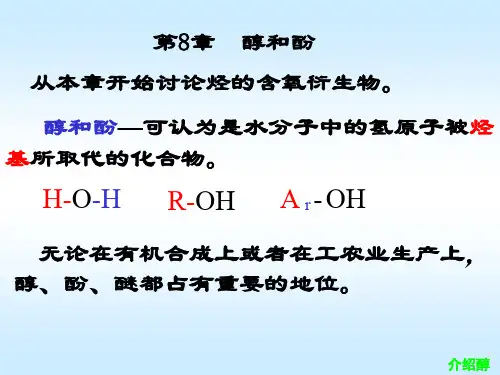
学习必备欢迎下载醇酚一、认识醇和酚羟基与相连的化合物叫做醇;羟基与直接相连形成的化合物叫做酚。
二、醇的性质和应用1.醇的分类(1)根据醇分子中羟基的多少,可以将醇分为饱和一元醇的分子通式:(2)根据醇分子中羟基所连碳原子上氢原子数目的不同,可以分为2.醇的命名(系统命名法)一元醇的命名:选择含有羟基的最长碳链作为主链,把支链看作取代基,从离羟基最近的一端开始编号,按照主链所含的碳原子数目称为“某醇” ,羟基在 1 位的醇,可省去羟基的位次。
多元醇的命名:要选取含有尽可能多的带羟基的碳链作为主链,羟基的数目写在醇字的前面。
用二、三、四等数字表明3.醇的物理性质(1)状态: C1-C4是低级一元醇,是无色流动液体,比水轻。
C5-C11为油状液体,C12以上高级一元醇是无色的蜡状固体。
甲醇、乙醇、丙醇都带有酒味,丁醇开始到十一醇有不愉快的气味,二元醇和多元醇都具有甜味,故乙二醇有时称为甘醇(Glycol )。
甲醇有毒,饮用10 毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
(2)沸点:醇的沸点比含同数碳原子的烷烃、卤代烷。
且随着碳原子数的增多而。
(3)溶解度:低级的醇能溶于水,分子量增加溶解度就降低。
含有三个以下碳原子的一元醇,可以和水混溶。
4.乙醇的结构分子式: C2H6O结构式:结构简式: CH3CH2OH5.乙醇的性质(1)取代反应A .与金属钠反应化学方程式:化学键断裂位置:对比实验:乙醇和 Na 反应现象:水和钠反应现象:乙醚和钠反应:无明显现象结论:①②B.与 HX 反应化学方程式:断键位置:实验(教材P68 页)现象:实验注意:烧杯中加入自来水的作用:C.乙醇的分子间脱水化学方程式:化学键断裂位置:〖思考〗甲醇和乙醇的混合物与浓硫酸共热生成醚的种类分别为D .酯化反应温度计必须伸入化学方程式:断键位置:(2)消去反应化学方程式:断键位置:实验装置: ( 如图 )注:乙醇的消去反应和卤代烃的消去反应类似,都属于β-消去,即羟基的β碳原子上必须有 H 原子才能发生该反应(3)氧化反应A .燃烧点燃CH 3CH 2OH + 3O2C x H y O z+O2[ 思考 ]某饱和一元醇与氧气的混合气体,经点燃后恰好完全燃烧,反应后混合气体的密度比反应前减小了1/5,求此醇的化学式(气体体积在105℃时测定)B.催化氧化化学方程式:断键位置:说明:醇的催化氧化是羟基上的H 与α- H 脱去[ 思考 ] 下列饱和一元醇能否发生催化氧化,若能发生,写出产物的结构简式CH3OH CH 3CH3 C CH2CH CH3CH3 C OH CH 3CH3(CH2)5CH2OH CH 3A B C结论:伯醇催化氧化变成仲醇催化氧化变成叔醇C.与强氧化剂反应乙醇能使酸性KMnO 4溶液褪色三、其它常见的醇(1)甲醇结构简式:物理性质:甲醇俗称木精,能与水任意比互溶,有毒,饮用10 毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
考前必备的化学方程式无机化学反应式2、2Na+2H2O=2NaOH+H2↑★ 2K+2H2O=2KOH+H2↑3、2Na2O2+2H2O=4NaOH+O2↑4、2Na2O2+2CO2=2Na2CO3+O27、氢氧化钠和碳酸氢钠在溶液中反应的离子方程式为:OH- +HCO3- =CO32- +H2O12、氯气溶于水(新制氯水中含Cl2.HClO.H2O .H+ .Cl - .ClO - .OH-):Cl2+H2O=HCl+HClO★ Cl2+2NaOH=NaCl+NaClO+H2O13:2↑14、Ca(ClO)2+CO2+H2O=CaCO3+2HClO15、MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O17、2F2+2H2O=4HF+O2Cl2+H2O=HCl+HClOBr2+H2O=HBr+HBrO19、2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al2O3+2NaOH=2NaAlO2+H2OAl(OH)323、H2O2的分解: 2H2O2O+O2↑*H2S与2S+SO2=3S+2H2O25、2SO2+O327、Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O↑+2SO2↑+2H2O28、C+2H2SO4(浓)CO2303334、N2+O2NO+O2=2NO235、3NO2+H2O=2HNO3+NO45、4NH3 +5O24NO+6H2O47、用浓盐酸检验氨气(白烟生成): NH3+HCl=NH4Cl48、(NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2O49、NH43+NH3↑+H2O50、4HNO2↑+O2↑+2H2O51、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2OC+4HNO3(浓)=CO2↑+4NO2↑+2H2O52、FeCl3354、盐类水解: CH3COO- +H23COOH+OH-CO32- +H23-+OH-HCO3- +H22CO3+OH-NH4+ +H23‧H2O+H+Fe3+ +3H3+3H+58、铝热反应: 2Al+Fe2O2O32O359、2Mg+CO↓+2(NH4)2SO461、Al2(SO4)3+6NH3·H2O=2Al(OH)363、NaAlO2+HCl+H2O=Al(OH)3↓ +NaCl ;NaAlO2+CO2+H2O=Al(OH)3↓ +NaHCO364、高温下铁与水反应:3Fe+4H2O(3O4+4H2 67、FeCl3+3NaOH=Fe(OH)3↓+3NaCl69、4Fe(OH)2+O2+2H2O=4Fe(OH)370、2FeCl2+Cl2=2FeCl371、2FeCl3+Fe=3FeCl2723+Cu=2FeCl2+CuCl273、金属的冶炼:Fe2O32↑74、铜锌原电池:正极:2H++2e- =H2↑负极:Zn-2e- =Zn2+75、钢铁的吸氧腐蚀:正极:O2+4e- +2H2O=4OH-负极:Fe-2e- =Fe2+76、Fe(OH)3胶体的制取:FeCl3 +3H2O Fe(OH)3(胶体)+3HCl77、电解CuCl2溶液:阳极:2Cl- -2e- =Cl2↑阴极:Cu2++2e-总反应:CuCl2↑78、铜的电解精炼:阳极:Cu-2e- =Cu2+阴极:Cu2++2e- =Cu79、电镀铜:阳极:Cu-2e- =Cu2+阴极:Cu2++2e- =Cu80、电解饱和食盐水:阳极:2Cl- +2e-=Cl2↑阴极:2H+ +2e- =H2总反应:22↑+2NaOH+Cl2↑81、黄铁矿的燃烧: 4FeS2 +11O2O3+8SO2822: SO2+2NH3 +H2O=(NH4)2SO383、C+H22有机化学反应式:46、CH2 =CH2 + Br2BrCH2Br7、CH2 =CH2 + H2O 3CH2OH8911、CH ≡ CH + BrCHBr2212141516、17、1819、20、2CH 3CH 23CH 2ONa+ H 2↑21、232526、272829、CH 3CHO +2Ag(NH 3)22O+2Ag ↓+3NH 3+CH 3COONH 430、乙醛与新制氢氧化铜悬浊液反应:Cu2++2OH -= Cu(OH)2↓312O3233COOH +CH 3CH 2OH351、 2、3、 卤(氟、氯、溴、碘)原子:-X4、(醇、酚)羟基:-OH5、醛基:-CHO6、羧基:-COOH 二、有机反应类型:取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
《烃的含氧衍生物》化学性质及方程式
一、醇
1、置换反应:
乙醇与金属钠反应:
2、氧化反应:
(1)饱和一元醇的燃烧:
(2)乙醇的催化氧化:
*(3)被强氧化剂(酸性高锰酸钾、酸性重铬酸钾)氧化
3、取代反应:
(1)乙醇和乙酸的酯化反应:
(2)乙醇的分子间脱水成醚:
(3)乙醇与浓氢溴酸的反应:
4、消去反应:
乙醇消去成乙烯:
二、酚
1、苯酚的弱酸性:
(1)苯酚与烧碱反应:
(2)苯酚钠与盐酸反应:
(3)苯酚钠溶液中通入CO2:
*(3)与活泼金属发生置换反应:
2、苯酚的取代反应(与浓溴水反应产生白色沉
淀):
3、苯酚的氧化反应:
(1)苯酚的燃烧:
*(2)空气中氧化变色:
*(3)被强氧化剂氧化:
):
*4、苯酚的加成反应(与H
2
):
*5、苯酚的显色反应(与FeCl
3
三、醛
1、氧化反应:
(1)饱和一元醛的燃烧:
(2)乙醛的银镜反应:
的反应:
(3)乙醛与新制Cu(OH)
2
(4)乙醛催化氧化生成乙酸:
(5)甲醛的银镜反应:
的反应:
(6)甲醛与新制Cu(OH)
2
*(7)被强氧化剂(酸性高锰酸钾、溴水等)氧化
加成):
2、还原反应(与H
2
四、羧酸
1、羧酸的酸性:
*(1)使石蕊变红:
(2)与碱中和:
(3)与活泼金属发生置换反应:
(4)与碱性氧化物反应:
(5)与弱酸盐反应:
2、酯化反应:
*3、甲酸的特殊性:既有羧基,又有醛基。
五、酯
酯的水解(取代)反应
1、酸性条件下的水解:
2、碱性条件下的水解(皂化反应):
《烃的含氧衍生物》化学性质及方程式 一、醇
1、置换反应: 乙醇与金属钠反应: 2CH 3CH 2
OH + 2Na 2CH 3CH 2ONa + H 2↑
2、氧化反应:
(1)饱和一元醇的燃烧: 2C n H 2n+2O + 3nO 2
2nCO 2 + 2(n+1)H 2O
(2)乙醇的催化氧化:
2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O
*(3)被强氧化剂(酸性高锰酸钾、酸性重铬酸钾)氧化 3、取代反应:
(1)乙醇和乙酸的酯化反应:
CH 3COOH + CH 3CH 2OH
3COOC 2H 5 + H 2O
(2)乙醇的分子间脱水成醚:
2CH 3CH 2OH CH 3CH 2—O —CH 2CH 3+ H 2O
(3)乙醇与浓氢溴酸的反应: CH 3CH 2OH +HBr →CH 3CH 2Br + H 2O 4、消去反应: 乙醇消去成乙烯:
浓硫酸 △
Cu △ 浓H 2
SO 4
140℃
CH 3CH 2OH CH 2=CH 2 ↑+H 2O
二、酚
1、苯酚的弱酸性: (1)苯酚与烧碱反应: (2)苯酚钠与盐酸反应:
(3)苯酚钠溶液中通入CO 2:
*(3)与活泼金属发生置换反应:
2、苯酚的取代反应(与浓溴水反应产生白色沉淀):(苯酚的定性检验和定量测定方法)
3、苯酚的氧化反应:
OH
+ NaOH
ONa + H 2O
OH 2 + 2Na
ONa 2 + H 2
+ HCl
OH + NaCl
ONa + CO 2 + H 2OH + NaHCO 3
ONa OH
+ 3 Br 2
OH
Br Br
+ 3 HBr
(1)苯酚的燃烧:
C 6H 6O + 7O 2 → 6C O 2 + 3H 2O
*(2)空气中氧化变色: *(3)被强氧化剂氧化: *4、 苯酚的加成反应(与H 2):
*5、 苯酚的显色反应(与FeCl 3):
*6、 苯酚的其他反应
(1) 苯酚和碳酸钠溶液反应
(2)苯酚的硝化反应
(3) 苯酚的缩聚反应(酚醛树脂)
n + n + n H 2
O
2
OH
H O
H n
OH
+ 3 HNO + 3 H 2O
OH
NO 2O 2N 2浓硫酸
苦味酸
OH
FeCl 3溶液
紫色,易溶于水的物质
OH
OH
+ 3 H 2
环己醇
OH + Na 2CO 3
ONa + NaHCO 3
(4)苯酚的酯化反应
三、醛
1、氧化反应:
(1)饱和一元醛的燃烧: C n H 2n O +(1.5n-1)O 2 —→ nCO 2 + nH 2O
(2)乙醛的银镜反应:
③ CH 3CHO + 2 [Ag(NH 3)2]+
3COO - + NH 4+3 + H 2O
(3)乙醛与新制Cu(OH)2的反应: (4)乙醛催化氧化生成乙酸:
(5
(6)甲醛与新制Cu(OH)2的反应: *(7)被强氧化剂(酸性高锰酸钾、溴水等)氧化
OH
+ CH 3
COOH + H 2
O OOCCH 3
2 CH 3CHO + O 3COOH
① Ag + + NH 3·H 2O AgOH + NH 4+
② AgOH + 2 NH 3·H 2O [Ag(NH 3)2]+ + OH - + 2 H 2
O
HCHO + 4 Cu(OH)
2 CO 2 + 2 Cu 2O + 5 H 2O CH 3CHO + 2 Cu(OH)23COOH + Cu 2O + 2 H 2O Cu 2+ + 2 OH - Cu(OH)2
HCHO + 4 [Ag(NH 3)2]+4)2CO 33 + 2 H 2O
2、还原反应(与H 2加成):
3、乙醛的制备方法
乙醇氧化法
乙烯氧化法
乙炔水化法
四、羧酸
1、羧酸的酸性: *(1)使石蕊变红: (2)与碱中和:
CH 3COOH + NaOH == CH 3COONa + H 2O 2CH 3COOH + Cu(OH)2 == (CH 3COO)2Cu + 2H 2O
(3)与活泼金属发生置换反应:
2CH 3COOH +2Na → 2 CH 3COONa + H 2↑
(4)与碱性氧化物反应:
2CH 3COOH + CuO== (CH 3COO)2Cu + H 2O
CH 3CHO + H 2
3CH 2OH
2 CH 3CH 2OH + O
23CHO + 2 H 2O
+ H 2
3CHO
HC CH 2 + O 2 2 CH 3CHO 加热 加压
H 2C CH 2催化剂
(5)与弱酸盐反应:
CH 3COOH + NaHCO 3 == CH 3COONa + H 2O+CO 2↑
2、酯化反应:
CH 3COOH + CH 3CH 2OH
3COOC 2
H 5 + H 2O
*3、甲酸的特殊性:既有羧基,又有醛基。
(1)甲酸钠与银氨溶液反应
HCOONa +2Ag(NH 3)2OH
NH 4OCOONa +2Ag ↓+3NH 3↑+H 2O
(2)甲酸钠与新制氢氧化铜反应
HCOONa+2Cu(OH)2+ NaOH Na 2CO 3+Cu 2O ↓+3H 2O
五、酯
酯的水解(取代)反应 1、酸性条件下的水解:
CH 3COOC 2H 5 + H 2O CH 3COOH + CH 3CH 2OH
2、碱性条件下的水解(皂化反应):
CH 3COOC 2H 5 + NaOH ==== CH 3COONa + CH 3CH 2OH
浓硫酸 △。