工艺用水纯化水检验
- 格式:ppt
- 大小:442.50 KB
- 文档页数:20


工艺纯化水验证确认方案1. 概述1.1我公司的制水系统由机械过滤器、活性碳过滤器、软化过滤器、反渗透装置、精密过滤器、紫外线灭菌器、微孔过滤器、纯化水箱及不锈钢输水管道等组成,生产能力为1T/h。
1.2 工艺流程图城市自来水→增压泵→机械过滤器→活性炭过滤器→软化过滤器→精密过滤器→一级反渗透泵→一级反渗透膜→→纯化水箱→紫外线灭菌器→纯化水泵→终端微孔过滤器→纯化水使用点EDI超滤→注射用水使用点1.3用途纯化水主要用于器具、工作服、纯化水箱、洁净室、工作台面的清洗及挤出过程的冷却水和配制消毒液,注射用水主要用于末道精洗、试剂配制等。
2. 确认目的为确认我公司工艺用水系统能正常运行, 其生产工艺符合设计要求,设备各项性能指标稳定,不发生漂移,保证能生产出质量合格、稳定的工艺用水,特制订本确认方案,对工艺用水系统进行确认。
确认过程应严格按照本方案规定的内容进行,若因特殊原因确需变更时,应报管理者代表批准。
3. 确认范围本确认方案适用于我公司工艺用水系统的确认。
3.1检查确认本系统设计方案是否符合规定要求。
3.2根据生产要求,确认水处理设备和管道系统安装是否合理,检查仪表校验的情况及操作、维修规程的编写情况。
3.3在所有的水处理设备均开动的情况下,检测系统操作参数,检查确认系统是否能达到设计要求及工艺要求,并预先测试水质(理化指标和微生物指标)。
3.4系统按照设计要求正常运行后,进行周期取样测试水质是否符合中国药典年版规定标准(理化指标和微生物指标)。
4. 确认计划与人员职责公司成立专门确认工作小组,负责该确认项目确认方案的起草、实施、组织与协调,负责确认结果记录与评定,负责完成确认报告。
4.1 确认计划:工艺用水系统计划确认结束。
4.2 确认工作小组人员职责。

医疗器械工艺用水检查指南工艺用水是许多医疗器械产品生产过程中不可缺少的,而其制备、检测、储存等影响工艺用水质量的过程,也直接或间接的影响着医疗器械产品的质量。
医疗器械行业中所使用的工艺用水更由于医疗器械产品本身及其生产工艺的特性而具有一些自身的特点。
本检查要点指南旨在帮助医疗器械监管人员增强对医疗器械工艺用水相关过程的认知和把握,指导医疗器械监管人员对医疗器械生产企业工艺用水控制水平的监督检查工作。
同时,为医疗器械生产企业在工艺用水环节的管理要求提供参考.当国家相关法规、标准、检查要求、制备方法发生变化时,应重新讨论以确保本指南持续符合要求。
一、适用范围本指南可作为药品监督管理局组织、实施的《医疗器械生产企业许可证》核发、变更、换证等现场检查、医疗器械质量管理体系考核、医疗器械生产质量管理规范检查、医疗器械生产监督检查等各项涉及工艺用水检查的参考资料.二、检查要点及流程以下检查要点的表述主要分为对现场情况和文件资料的检查两部分,但在实际检查过程中应特别注意现场查看、询问、记录的情况与企业的规定、文件、记录的符合性。
(一)现场观察企业工艺用水制水设备及制备环境对于以下的检查内容,检查人员应进行适当的记录。
1。
询问制水设备的生产厂家名称;2.询问制水人员制备的工艺用水种类(纯化水或/和注射用水或/和实验室分析用水等);3.询问制水人员工艺用水的制备方法和流程;4。
现场查看制水设备的材质和结构组成;5.现场查看制水设备设置的采水监测点,出水点至少应设置在进入纯化水储罐前、在线消毒设备前后、进入注射用水储罐前(如涉及)、各个涉及使用工艺用水的功能间使用点以及总进水点、总回水点;6。
现场查看制水设备的状态标识(正常、维护、停用);7。
现场查看洁净区(室)内工艺用水输送管道的布局情况,使用工艺用水的功能间是否均设置了出水点;8。
现场查看制水设备的输送管道的水种和流向标识,分别使用多种工艺用水时,输水管道上应明示工艺用水种类以及流向;9。

目的:建立工艺用水取样标准操作规程,规范工艺用水的取样操作。
范围:适用于饮用水、纯化水、注射用水的取样。
职责:取样员、水站操作工。
质量管理部经理监督本规程的实施。
规程:1 质量保证室接到工艺用水请检单后,发出取样指令并将取样证及请检单交取样员。
2 取样员准备取样容器,通常为具塞的广口瓶,容量为500~1000ml,用于微生物检测的样品,所用瓶子及塞子于取样前必须经高压蒸气湿热灭菌;用于理化检测的样品,所用瓶子及塞子于取样前必须清洁、干燥。
取微生物检测用的样品时,应带消毒用酒精棉球。
3 取样点及取样频次3.1 饮用水:一般在进制水站前总管处每年送市(区)卫生防疫部门全面检测一次,每月自检部分项目一次,每周自检pH值一次。
3.2 纯化水:各个使用点出水口每月取样全检一次,贮罐总送水口、回水口每周全面检测一次,每2小时检测一次酸碱度和电导率。
4. 取样步骤:4.1 取微生物检测用的样品时,用消毒用酒精棉球擦拭手指,擦拭无菌瓶外壁和取水点水龙头。
4.2 取样时,先将取水点开关完全打开,排水2~3分钟,以排去管道内的贮水后再取样。
4.3 打开瓶塞(瓶塞不得碰到其它东西和手掌),将瓶口对准水龙头水流,使水直接落入瓶内(瓶内水面与塞底部要有一定空隙,80%左右,检验时可充分振摇混匀),接够检验3倍量后,移开取样瓶,立即盖紧瓶塞,关上水龙头。
取样瓶贴上取样标签。
同一取水点、同一时间取水样时,用作微生物检测的水样必须先于用作理化检测水样取样,以免被污染。
6. 水样必须在取样后2小时内进行微生物检测,否则须将样品冷藏,并在18小时内进行检测。
7. 取样容器的洗涤7.1 用饮用水冲洗,放入盛有洗涤剂水溶液浸泡30分钟。
7.2 刷洗数次,用饮用水冲洗至无泡沫。
7.3 用纯化水荡洗三遍,晾干。
7.4 需用于微生物检测的取样容器,干燥后,置121℃温度下灭菌30分钟,备用。

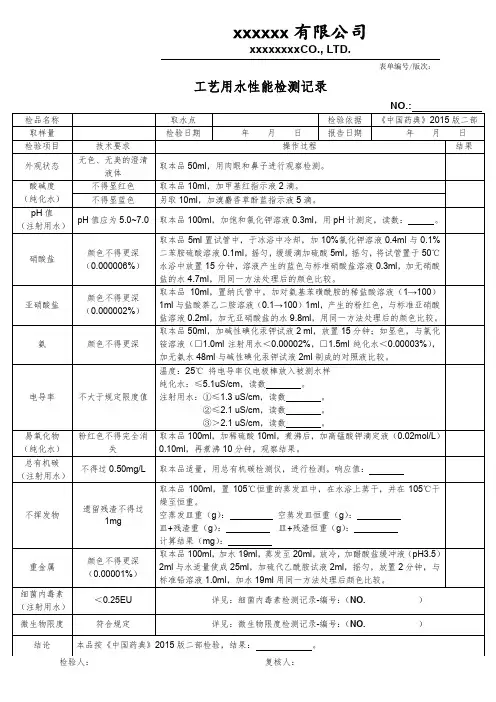

广西医疗器械有限公司 SC-SMP-022-00工艺用水监测管理规定第 5 页 共5页工艺用水监测管理规定1、目的:建立对工艺用水(饮用水、纯化水)的质量控制监测项目、抽查频率及监测标准操作程序。
2、范围:适用于本厂工艺用水的水质标准、水质监护的管理。
3、责任:质量部检验员。
4、内容:4.1工艺用水系统监控工作由质监科负责。
化验室定期对各种用水进行全项检测并出具检验报告书。
4.2取样点:制水点出口、用水点出口、贮水罐出口。
4.3取样检验时间和频次:4.3.1节假日或停产一段时间后,开工之前应取样检验,符合规定后,方可使用。
4.3.2发生异常情况或出现不符合规定的情况,应增加取样检验的频次。
4.3.3一般正常生产情况下,饮用水每年委托防疫站或自来水公司全检一次;纯化水每2小时监测部分项目一次,每周全检一次。
具体监控指标、检测频率和取样点见下表:水质类别 质量监控项目检测频率 取样点 检测人员 饮用水1次/年纯化水水源水、厂总进水口 当地卫生防疫站 纯化水性状、酸碱度、导电率1次/每日送水点、回水点制水操作工或质监员 全项1次/周制水点、回水点化验员4.4检验员应严格按各用水点水质的质量标准,取样进行监测。
4.5 纯化水检验检查项目所需试剂试液及试药配制方法贮藏方法检查步骤检查结果所需仪器设备及玻璃用具备注酸碱度甲基红指示液(甲基红、氢氧化钠、蒸馏水)取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4ml使溶解,再加水稀释至200ml,即得。
置棕色指示剂瓶中取本品10ml,加甲基红指示液2滴不得显红色天平、10ml移液管、量筒、烧杯、棕色指示剂瓶、试管1、0.05mol/L氢氧化钠溶液的配制:取氢氧化钠2g,加水1000ml,搅拌使溶解,即得。
2、甲基红指示液的变色范围为:pH4.2~ pH6.3(红→黄)3、溴麝香草酚蓝指示液的变色范围为:pH6.0~pH7.6(黄→蓝)溴麝香草酚蓝指示液(溴麝香草酚蓝、氢氧化钠、蒸馏水)取溴麝香草酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.2ml使溶解,再加水稀释至200ml,即得。


纯化水检测标准纯化水是一种经过多种处理工艺去除杂质和离子的水,其纯度高,无菌无毒,广泛应用于医药、化工、实验室等领域。
为了确保纯化水的质量,需要对其进行严格的检测。
本文将介绍纯化水的检测标准,以便相关人员了解如何进行有效的检测和监控。
首先,纯化水的外观检测是非常重要的。
正常的纯化水应该是透明无色的,如有混浊或有色现象,可能是受到了外界污染或水质发生了变化。
因此,外观检测可以直观地了解纯化水的质量情况,是最基本的检测手段之一。
其次,纯化水的电导率检测也是必不可少的。
电导率是衡量水中溶解离子含量的重要指标,一般来说,纯化水的电导率应该非常低,如果电导率超出一定范围,说明水中可能存在着溶解物质,需要进行进一步的分析和处理。
此外,纯化水的微生物检测也是非常重要的。
微生物是指细菌、真菌、藻类等微小生物体,在水中存在的微生物可能会对人体健康造成威胁,因此需要对纯化水中的微生物进行检测,确保水质符合相关卫生标准。
另外,纯化水的溶解氧检测也是必不可少的。
溶解氧是水中重要的氧化还原指标,对于水中生物的生存和生长起着重要的作用。
因此,对纯化水中溶解氧的含量进行检测,可以了解水质的新鲜程度和氧化还原性能。
最后,纯化水的重金属离子检测也是必要的。
重金属离子是水中的有害物质之一,如果超出一定的浓度,可能会对人体造成危害。
因此,对纯化水中重金属离子的含量进行检测,可以及时发现并处理水质问题,确保水质安全。
综上所述,纯化水的检测标准包括外观检测、电导率检测、微生物检测、溶解氧检测和重金属离子检测等多个方面,通过对这些指标的检测,可以全面了解纯化水的质量情况,及时发现并解决水质问题,确保纯化水的质量符合相关标准和要求。


1目的明确工艺用水的分类、用途,建立工艺用水质量监测的频次、检验项目、取样点的设置及异常情况的处理,保证工艺用水质量和产品质量,避免工艺用水对药品造成污染。
2范围适用于工厂工艺用水(包括饮用水、纯化水和注射用水)的质量管理。
3责任纯水制备人员、质检部、品保部、设备部对本规程的实施负责。
4内容4.1定义:药品生产过程中使用的水称为工艺用水。
本公司工艺用水包括生活饮用水、纯化水、注射用水。
4.1.1生活饮用水:指经净化、消毒的自来水。
4.1.2纯化水:以符合GB5749-2006生活饮用水卫生标准的自来水为水源,经蒸馏或离子交换或反渗透等处理制得的水。
本公司采用的是二级反渗透装置制备的纯化水。
4.1.3注射用水4.2工艺用水的水质要求与用途见下表4.3水质监控4.3.1对工艺用水的水质要定期检查,由QC负责人指定专门人员进行工艺用水取样和检测,一旦发现异常情况,应立即报告品质保障部和生产部,及时纠偏,确保生产用水符合既定的质量标准。
4.3.2生活饮用水的质量监控说明: 1.生活饮用水由质量检验部每一个月按照公司的《生活饮用水质量标准》全检一次。
2.生活饮用水每半年由品质保障部取样送疾病预防控制中心全检一次。
4.3.3纯化水的质量监控说明:电导率为在线检测,岗位人员应每两个小时观察并记录一次。
4.3.4注射用水的质量监控4.4纠偏措施4.4.1微生物警戒限度和纠偏限度a)警戒限度:指微生物某一污染水平(一般为纠偏限度的一半),监控结果超过它时,表明制药用水系统有偏离正常运行条件的趋势;b)纠偏限度:指微生物污染的某一限度,监控结果超过此限度时,表明制药用水系统已经偏离正常运行条件,应当采取纠偏措施,使系统回到正常的运行状态。
4.4.2纯化水4.4.2.1微生物项目1)纯化水纠偏限度设为100CFU/ml,警戒限度为50CFU/ml。
2)微生物项目监测结果超过警戒限度,应及时通知工程部门加以注意,必要时可采取一定措施;3)微生物项目监测结果超过纠偏限度a.应立即通知生产部各使用点停止用水,并通知工程部门,工程部应检查纯化水运行记录,分析原因,同时由QC人员进行复检;b.若复检仍不合格,则相应的纯化水不得用于生产,并调查原因,采取相应纠偏措施(必要时对水系统进行消毒),直至合格为止;c.微生物限度超标时,密切注意相关批次产品的微生物检验结果,必要时可扩大取样量以供检验。
工艺用水的制备及验证
一、工艺用水的划分
1.饮用水-工艺用水的“原水”
(1)可以是自来水或深井水
(2)符合国家标准GB5749-2006《生活饮用水卫生标准》
(3)“原水”不能直接用于医疗器械的精洗..
2.纯化水:为“原水”经蒸馏、离子交换、反渗透等或其他适宜的方法制得的符合《中国
药典》规定的水
3.注射用水:为纯化水经蒸馏所得的水,应符合细菌内毒素的试验要求。
注射用水必须
在有效防止内毒素产生的条件下制取、储存及分装。
4.灭菌注射用水:为注射用水按照注射剂生产工艺制备而得,主要用于注射用灭菌粉末
的溶剂或注射液的稀释剂。
二、水中的污染物
⏹可溶性无机物
⏹可溶性有机物
⏹胶质
⏹颗粒
⏹微生物
⏹热源
⏹气体等
⏹根据污染物的不同采取不同的纯化手段
工艺用水系统微生物污染的主要原因。
1目的控制本公司工艺用水的质量,包装纯化水检测程序的规范化、标准化。
2范围本标准适用于本公司的工艺用水检测方法。
3职责法规质量部负责工艺用水水质检验。
4要求及检验方法4.1 性状:性状为澄清、无色的液体。
4.2电导率:4.2.1 要求25℃时电导率,应不大于0.1μS/m。
4.2.2仪器和试剂1) 电导率仪;2) 玻璃烧杯(150ml)。
4.2.3 检验方法取100ml 纯化水,使用带温度补偿功能的电导率仪测试按《电导率仪使用、维护和保养规程》中规定的检测方法进行检测,电导率应0.1μS/m(25℃时) 。
4.3 微生物限度:4.3.1 要求微生物总数不大于50 CFU/ml。
4.3.2 仪器和试剂1) 微生物限度仪;2) 生化培养箱;3) R2A琼脂培养基。
4.3.3取本品不少于lml, 按照微生物限度检查法中的薄膜过滤法处理,采用R2A琼脂培养基,30~35℃培养不少于5天,依法检查(通则1105), lml 供试品中需氧菌总数不得过50 CFU。
R 2 A琼脂培养基处方及制备酵母浸出粉o. 5g蛋白胨0 . 5g酪蛋白水解物0.5g葡萄糖0 . 5g可溶性淀粉0. 5g磷酸氢二钾0 3g无水硫酸镁0.024g丙酮酸钠0.3g琼脂15g纯化水1000ml除葡萄糖、琼脂外,取上述成分,混合,微温溶解,调节pH 值使加热后在25℃的pH 值为7.2± 0.2,加入琼脂,加热溶化后,再加人葡萄糖,摇匀,分装,灭菌。
R2A 琼脂培养基适用性检查试验照非无菌产品微生物限度检查:微生物计数法(通则1105)中“计数培养基适用性检查"的胰酪大豆胨琼脂培养基的适用性检查方法进行,试验菌株为铜绿假单胞菌和枯草芽孢杆菌。
应符合规定。
4.3.3 检验方法4.4易氧化物:4.4.1 仪器和试剂1) 玻璃烧杯(150ml);2) 高锰酸钾滴定液(0.02mol/L): 取高锰酸钾3.2g, 加水1000ml, 煮沸15分钟,密塞,静置2日以上,用垂熔玻璃滤器滤过,摇匀〔标定:取在105℃干燥至恒重的基准草酸钠约0.2g, 精密称定,加新沸过的冷水250ml 与硫酸10ml,搅拌使溶解,自滴定管中迅速加入本液约25ml (边加边振摇,以避免产生沉淀),待褪色后,加热至65℃,继续滴定至溶液显微红色并保持30秒不褪;当滴定终了时,溶液温度不应低于55℃,每1ml 高锰酸钾滴定液(0.02mol/L) 相当于6.70mg的草酸钠。
工艺用水系统管理规程
目的:保证所用工艺用水质量合格。
范围:生产过程中配料、检验等所用的水,包括饮用水、纯化水。
责任者:制水岗位操作工,岗位操作工。
规程:
1.生产中所用一切工艺用水必须是经检验合格的。
2.工艺用水管不得和非生活用水管网直接连接,并避免穿过垃圾堆或毒物污染
区,保证水的流动。
3.生产中用纯化水的检测根据《纯化水系统操作规程》中的相关内容进行。
4.纯化水储存不得超过24小时。
5.节假日或停产三天以上的,开工前必须取样检查,质量合格后才能使用。
6.每天第一次用水前,应安全开启龙头30秒钟弃去存水。
7.生产中根据工艺规程规定,各工序工艺用水规定如下:
7.1非洁净区地面清洁用水为饮用水,生产用器具初次洗用饮用水,消毒后冲洗用水为纯化水,生产器具使用前清洗用水为纯化水,生产中提取用水为纯化水7.2洁净区用清洁用水及生产用水为纯化水。
7.3生产中用于冷却用水统一为饮用水。
7.4清洁剂与消毒剂的配制用水统一为饮用水。
1.目的为规范工艺用水符合国家标准和GMP要求, 建立工艺用水的质量监控制度,保证工艺用水的质量。
2.适用范围本规程适用于公司饮用水、纯化水、注射用水的日常质量监控。
3.职责3.1. 质量管理部QC人员:负责各车间工艺用水的日常取样。
3.2. 质量管理部:负责本文件的起草和审核、负责工艺用水的检验工作。
3.3. 总经理:负责本文件的批准。
4.定义工艺用水:药品生产工艺中使用的水,包括:饮用水、纯化水、注射用水。
5.引用标准5.1. 《生活饮用水卫生标准》GB 5749-20065.2. 《药品生产质量管理规范》2010版6.材料6.1.仪器设备电导率仪、酸度计。
6.2.器材、用具取样检验用玻璃仪器。
6.3.其他相应检测用化学试液7.流程图无8.内容8.1.饮用水监测8.1.1.公司饮用水样的检验资料整理每半年公司在供水水间水罐取饮用水样送当地疾控中心等单位进行一次全面检验。
每月由质量控制部对饮用水进行微生物检验,每季度进行一次常规指标检查,如外观、PH等。
8.2.软化器出水硬度监测8.2.1.监测周期:质量管理部人员每月取样监测一次。
8.2.2.监测标准:硬度应<1.5ppm。
8.3.石英砂出水浊度监测8.3.1.监测周期:质量管理部人员每月取样监测一次。
8.3.2.监测标准:浊度应<1NTU。
8.4.活性炭出水余氯监测8.4.1.监测周期:质量管理部人员每月取样监测一次。
8.4.2.监测标准:余氯应<0.1mg/L。
8.5.纯化水监测8.5.1.监测项目由制水人员负责对纯化水系统出水口、纯化水总送水口、纯化水总回水口共3个取水点取样进行性状、酸碱度、电导率共3项的检验。
8.5.2.监测周期制水间工作人员每日生产用水前、生产用水结束时及生产用水过程中每隔2小时分别进行一次监测。
8.5.3.质量管理部检验系统出水口、总送水口、总回水口、其余纯化水取样点每半月轮流取样全检一次,具体取样频次见表一。
8.5.4.检验方法8.5.4.1.制水间工作人员日常检验执行《制水岗位水质检测SOP》。
1目的控制本公司工艺用水的质量,包装纯化水检测程序的规范化、标准化。
2 范围本标准适用于本公司的工艺用水检测方法。
3 职责法规质量部负责工艺用水水质检验。
4 要求及检验方法4.1 性状:性状为澄清、无色的液体。
4.2电导率:4.2.1 要求25℃时电导率,应不大于0.1μS/m。
4.2.2仪器和试剂1)电导率仪;2)玻璃烧杯(150ml)。
4.2.3 检验方法取100ml纯化水,使用带温度补偿功能的电导率仪测试按《电导率仪使用、维护和保养规程》中规定的检测方法进行检测,电导率应0.1μS/m(25℃时)。
4.3 微生物限度:4.3.1 要求微生物总数不大于50 CFU/ml。
4.3.2 仪器和试剂1)微生物限度仪;2)生化培养箱;3)R2A琼脂培养基。
4.3.3取本品不少于lml,按照微生物限度检查法中的薄膜过滤法处理,采用R2A琼脂培养基,30~35℃培养不少于5天,依法检查(通则1105),lml供试品中需氧菌总数不得过50 CFU。
R 2 A琼脂培养基处方及制备酵母浸出粉o. 5g蛋白胨0. 5g酪蛋白水解物0.5g葡萄糖0. 5g可溶性淀粉0. 5g磷酸氢二钾0_3g无水硫酸镁0. 024g丙酮酸钠0.3g琼脂15g纯化水1000ml除葡萄糖、琼脂外,取上述成分,混合,微温溶解,调节pH值使加热后在25℃的pH 值为7.2± 0.2,加入琼脂,加热溶化后,再加人葡萄糖,摇匀,分装,灭菌。
R2A琼脂培养基适用性检查试验照非无菌产品微生物限度检査:微生物计数法(通则1105)中“计数培养基适用性检查”的胰酪大豆胨琼脂培养基的适用性检査方法进行,试验菌株为铜绿假单胞菌和枯草芽孢杆菌。
应符合规定。
4.3.3 检验方法4.4易氧化物:4.4.1 仪器和试剂1)玻璃烧杯(150ml);2)高锰酸钾滴定液(0. 02mol/L):取高锰酸钾3.2g,加水1000ml,煮沸15分钟,密塞,静置2日以上,用垂熔玻璃滤器滤过,摇匀〔标定:取在105℃干燥至恒重的基准草酸钠约0.2g,精密称定,加新沸过的冷水250ml与硫酸10ml,搅拌使溶解,自滴定管中迅速加入本液约25ml(边加边振摇,以避免产生沉淀),待褪色后,加热至65℃,继续滴定至溶液显微红色并保持30秒不褪;当滴定终了时,溶液温度不应低于55℃,每1ml高锰酸钾滴定液(0. 02mol/L)相当于6.70mg 的草酸钠。