同素异形体同分异构现象共20页
- 格式:ppt
- 大小:791.00 KB
- 文档页数:2




同素异形体同位素同系物同分异构体在化学的世界里,有些概念听上去就像是外星语言,特别是那些叫做同素异形体、同位素、同系物和同分异构体的东西。
乍一听,可能让人觉得有点晕,但其实它们并没有想象中那么复杂,嘿,我们来聊聊这些有趣的小家伙吧。
我们得提到同素异形体。
你知道什么是同素异形体吗?简单来说,就是同一种元素,长得却不一样。
想象一下,碳可以是钻石,闪闪发光,耀眼无比;也可以是石墨,黑乎乎的,像铅笔里的那个东西。
二者都是碳,但它们的形状和性质完全不一样。
钻石可是坚硬得像个小霸王,而石墨就像个温柔的绅士,易于滑动。
生活中,我们常常会碰到这种现象。
就像同一个人,可能在不同的场合中表现出截然不同的个性,难怪大家都说,冰冻三尺非一日之寒嘛!接下来是同位素。
说到同位素,可能会让人联想到科学实验室里的那些神秘试管。
实际上,同位素就是元素的小伙伴,它们有相同的原子序数,但中子数不同。
就像是家里的兄弟姐妹,虽然同父同母,但性格、爱好各有不同。
以氢为例,它有三种同位素:普通氢、重氢和超重氢。
普通氢最常见,重氢那可是水中少见的“贵族”,用在核聚变里,超重氢就更少了,简直是珍稀动物。
听起来是不是很酷?同位素在科学研究和医学上可大有用处,简直是“万金油”啊!再来说说同系物。
这种东西听起来有点高深,其实也很简单。
它们是一类化合物,拥有相似的化学性质,但分子结构不同。
打个比方,像是家里兄弟姐妹的风格,虽然都是同一个爸妈生的,但每个人都有自己的特色。
比如说,乙醇和醇类化合物,都是酒精的一种,但它们的结构和用途各有千秋。
乙醇可以用来喝,醇类则可能在工业上派上用场。
这种多样性真是让人感到惊奇,化学就像是一场无尽的派对,各种化合物齐聚一堂,大家都在各显神通。
我们得聊聊同分异构体。
这可是个非常有趣的概念,同分异构体是指分子式相同,但结构不同的化合物。
就好像两个人都有一样的名字,但性格和兴趣爱好却截然不同。
比如说,丁烷和异丁烷,虽然它们的化学式都是C4H10,但分子结构却大相径庭,性质也不同。

同素异形体和同分异构体的概念嘿,朋友们!今天咱来聊聊化学里特别有意思的两个概念,同素异形体和同分异构体。
先来说说同素异形体吧,这就好比是一群兄弟,都是同一个“妈”生的,也就是同一种元素,但长得却不一样,性格特点也不同。
就像氧气和臭氧,都是氧元素组成的呢。
氧气咱都熟悉呀,咱呼吸可少不了它。
那臭氧呢,有时候在大气层能帮咱挡挡紫外线,可要是在地面浓度高了,还会让人不舒服呢!你说神奇不神奇?这不就像一家人里,有的孩子性格温和,有的孩子却有点小脾气嘛!再讲讲同分异构体,这就好像是同一个菜谱,做出了不同模样、不同口味的菜。
同样的化学式,但是结构不一样,性质也就大不同啦。
就拿戊烷来说吧,它有正戊烷、异戊烷和新戊烷这几种同分异构体呢。
正戊烷就像个规规矩矩的好孩子,比较稳定;而异戊烷呢,就有点调皮捣蛋啦;新戊烷更是特别,像个有个性的小家伙。
这就好比同样是用面粉做面包,有的做成了圆面包,有的做成了长面包,味道和口感还都不一样呢!你想想啊,这世界要是没有同素异形体和同分异构体,那该多单调呀!都是千篇一律的东西,多没意思。
正是有了它们,化学的世界才变得如此丰富多彩,充满了惊喜和奥秘。
就像我们的生活一样,每个人都是独一无二的,虽然可能有着相同的出身或者经历,但最后呈现出来的样子和人生却是各不相同的。
这不就是现实版的同素异形体和同分异构体嘛!而且,这也告诉我们一个道理呀,不要小瞧任何一个看起来普通的东西,说不定它背后有着你意想不到的奇妙之处呢!同素异形体和同分异构体的存在,让我们知道了这个世界充满了无限的可能。
它们就像是隐藏在化学世界里的宝藏,等待着我们去挖掘,去发现。
我们可以通过研究它们,更好地理解物质的本质和变化规律。
这多有趣呀!所以呀,我们要保持一颗好奇的心,去探索这些神奇的概念,去感受化学的魅力。
说不定,在这个过程中,我们还能发现更多意想不到的惊喜呢!难道不是吗?反正我是这么觉得的,你们呢?。

同分异构体同位素同素异形体一、同分异构体1.1 定义同分异构体是指分子式相同、结构不同的化合物。
它们具有相同的分子式,但其原子排列或立体构型有所差异。
1.2 特点•同分异构体具有相同的分子式,但其物理性质和化学性质有所不同。
•它们的存在引起了化学反应速率、平衡常数等方面的变化。
1.3 举例说明同分异构体的典型例子是丙酮和乙醇,它们的分子式都是C3H6O,但它们的结构不同。
丙酮是一个含有酮基的化合物,而乙醇是一个含有羟基的化合物。
二、同位素2.1 定义同位素是指具有相同原子序数(即核电荷数)Z的原子,但核子数A不同的元素。
2.2 特点•同位素具有相同的化学性质,但物理性质有所不同。
•它们在核反应、放射性衰变和同位素标记等方面具有广泛的应用。
2.3 举例说明同位素的典型例子是氢的三种同位素:氢-1H、氘-2H和氚-3H。
它们的原子序数都是1,但核子数分别为1、2和3,所以它们的质量数不同。
三、同素异形体3.1 定义同素异形体是指分子式相同、立体结构不同的化合物。
它们具有相同的分子式,但空间构型不同。
3.2 特点•同素异形体的物理性质和化学性质可能有所不同。
•它们的存在导致了药物活性、生物学效应等方面的变化。
3.3 举例说明同素异形体的典型例子是葡萄糖和果糖,它们的分子式都是C6H12O6,但它们的立体结构不同。
葡萄糖是一种左旋的异构体,而果糖是一种右旋的异构体。
四、同分异构体、同位素和同素异形体的联系与区别4.1 联系同分异构体、同位素和同素异形体都是在化学分子中出现的现象,它们都与原子的排列或结构有关,导致了不同的性质和效应。
它们在化学领域的研究和应用中起着重要的作用。
4.2 区别•同分异构体和同素异形体的区别在于它们的结构不同,同分异构体的结构差异在于原子排列或立体构型的不同,而同素异形体的结构差异在于空间构型的不同。
•同位素与同分异构体、同素异形体的区别在于核子数的不同,同位素具有相同的原子序数,但核子数不同。



张浩祥对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
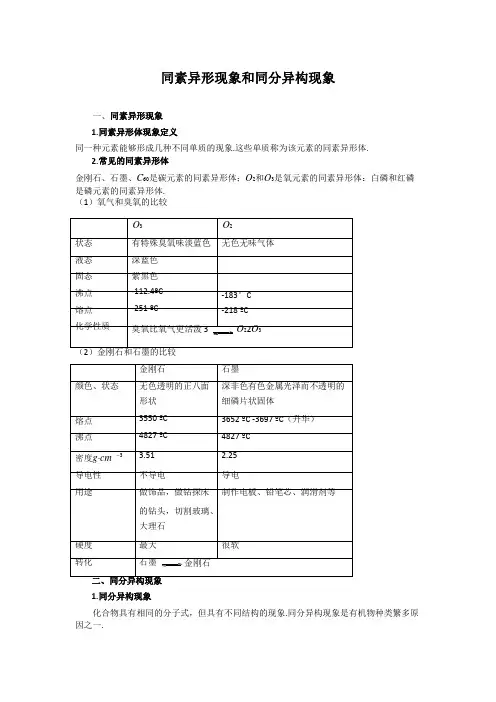
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:同位素:质子数相同,中子数不同的原子(核素)对象原子同素异形体:由同一种元素组成的不同单质。
对象单质同系物; 结构相似,分子组成相差一个或若干个CH2基团的物质对象化合物同分异构体: 分子式相同,结构不同的化合物对象化合物说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如:O2和O3 。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
结构相似不一定是完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链,但二者仍为同系物。
(2)通式相同,但通式相同不一定是同系物。