盐酸标准滴定溶液的配置
- 格式:docx
- 大小:13.50 KB
- 文档页数:1


盐酸标准滴定溶液的制备盐酸标准滴定溶液是化学实验中常用的一种溶液,通常用于测定碱度或酸度。
正确制备盐酸标准滴定溶液对于化学实验的准确性至关重要。
下面将介绍盐酸标准滴定溶液的制备方法及注意事项。
首先,准备所需的材料和仪器。
制备盐酸标准滴定溶液需要盐酸、去离子水、酚酞指示剂、烧杯、容量瓶、滴定管等。
其次,按照一定的比例将盐酸和去离子水混合。
一般情况下,盐酸的浓度为0.1mol/L,因此可以根据需要调整盐酸和去离子水的比例,使得最终溶液的浓度符合实验要求。
然后,加入酚酞指示剂。
酚酞是一种常用的指示剂,可以在酸碱滴定实验中显示颜色变化,便于判断滴定终点。
将适量的酚酞溶解于盐酸溶液中,搅拌均匀即可。
接下来,使用容量瓶进行稀释。
将混合好的盐酸溶液倒入容量瓶中,加入适量的去离子水,并轻轻摇匀。
在稀释的过程中,要注意瓶口不要沾上溶液,以免影响浓度的准确性。
最后,进行滴定实验验证。
将制备好的盐酸标准滴定溶液用于实验中,观察滴定终点的颜色变化,记录所需的滴定量,验证溶液的准确性和稳定性。
在制备盐酸标准滴定溶液的过程中,需要注意以下几点:1. 严格按照比例混合盐酸和去离子水,确保溶液浓度的准确性;2. 在稀释过程中,要轻轻摇匀,避免溶液溅出或者瓶口沾上溶液;3. 使用酚酞指示剂时,要控制加入的量,避免过量影响实验结果;4. 制备好的盐酸标准滴定溶液要密封保存,避免受到外界杂质的污染。
总之,制备盐酸标准滴定溶液是一项重要的实验操作,需要严格按照步骤进行,确保溶液的准确性和稳定性。
只有正确制备的盐酸标准滴定溶液才能保证实验结果的准确性,为化学实验的顺利进行提供保障。

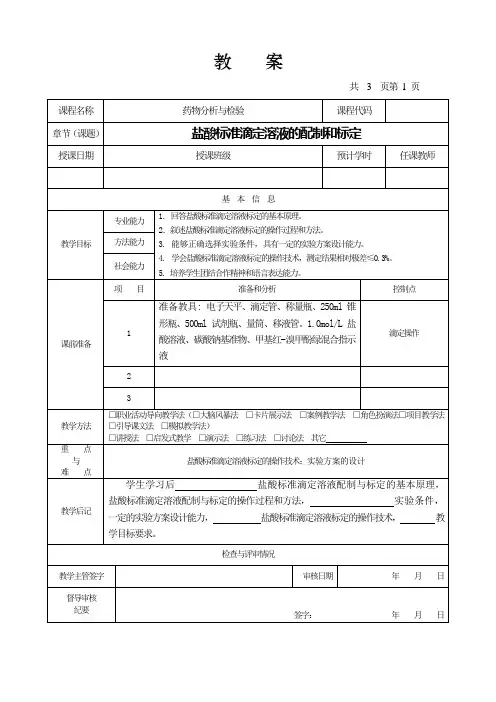
实验五盐酸标准溶液的配置及标定一、实验目的1、掌握酸式滴定管的使用和操作方法2、学会酸碱溶液浓度的标定方法3、学会使用电子天平差量法称重二、实验原理滴定反应Na2CO3+2HCl→2NaCl+CO2+H2O106g 2molW(g) (c∙V/1000)molc(HCl)=(2W×1000)/(106×V)=(1000W)/(53V)基准物-硼砂(Na2B4O7∙10H2O),Na2CO3指示剂-甲基橙终点:黄色→红色三、仪器及试剂HCl标准溶液,无水碳酸钠,甲基橙,酸式滴定管,烧杯,锥形瓶,电子天平。
四、实验步骤1、计算碳酸钠的称量范围2、用差量法准确称取称量范围的无水碳酸钠于锥形瓶中。
3、在锥形瓶中加入30ml蒸馏水,在温水中加热,摇动使其完全溶解,并滴加2-3滴甲基橙。
4、用50ml的酸式滴定管装入标准盐酸,调节好刻度,记下初读数后,左手控制玻璃赛,右手摇动锥形瓶使锥形瓶中液体作圆周运动,控制好滴速,当黄色变为橙色时显示滴定终点,停止滴定。
取下滴定管正确读数,并记录刻度值。
读数结果保留小数点后两位。
5、分别称取称量范围的碳酸钠于洁净的锥形瓶中,按照上述方法重复两次。
五、数据记录与处理六、结果与讨论实验注意事项:1、计算Na2CO3的称量范围。
Na2CO3+2HCl→2NaCl+CO2+H2O106g 2molW(g) (0.2×(20~30)/1000)molW=0.2120~0.31802、用差量法准确称取0.2~0.3g Na2CO3于锥形瓶中⑴将锥形瓶用自来水冲洗,再用蒸馏水淋洗三遍。
⑵称量瓶的取放要用纸条,不能用手直接拿。
⑶用差量法称一份在称量范围内的Na2CO3于锥形瓶中。
⑷不能有Na2CO3洒在锥形瓶外。
⑸记录数据(四位有效数字)。
3、配置Na2CO3溶液⑴在锥形瓶中加入30ml纯水。
⑵在温水浴中加热使之完全溶解。
4、酸式滴定管的准备⑴检查玻璃塞是否配套,有无橡皮套。

盐酸标准溶液的配制和标定一、目的要求掌握减量法准确称取基准物的方法。
掌握滴定操作并学会正确判断滴定终点的方法。
学会配制和标定盐酸标准溶液的方法。
二、实验原理由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。
标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:Na2CO3+2HCI===2NaCl+H2O+CO2滴定至反应完全时,溶液pH3.89通常选用溴甲酚绿-甲基红混合液或甲基橙作指示剂。
三、试剂1.浓盐酸(密度1.19g/mL)2.甲基橙指示剂四、实验步骤1.0.1mol·L-1HCl溶液的配制用量筒量取浓盐酸9mL,倒入预先盛有适量水的试剂瓶中,加水稀释至1000mL,摇匀,贴上标签。
2.盐酸溶液浓度的标定用减量法准确称取约0.15—0.2g在270~300℃干燥至恒量的基准无水碳酸钠,置于250mL锥形瓶,加50mL水使之溶解,再加甲基橙指示剂1—2滴,用配制好的HCl溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
若用甲基橙做指示剂,则终点颜色变化为:由黄色变为橙色。
由Na2CO3的重量及实际消耗的HCl溶液的体积,计算HCl溶液的准确浓度。
实验流程五、数据记录与处理编号实验项目倾出前(称量瓶+基准物)质量倾出后(称量瓶+基准物)质量取出基准物的质量HCl溶液终读数六、注意事项干燥至恒重的无水碳酸钠有吸湿性,因此在标定中精密称取基准无水碳酸钠时,宜采用“减量法”称取,并应迅速将称量瓶加盖密闭。
在滴定过程中产生的二氧化碳,使终点变色不够敏锐。
因此,在溶液滴定进行至临近终点时,应将溶液加热煮沸,以除去二氧化碳,待冷至室温后,再继续滴定。
七、思考题1、作为标定的基准物质应具备哪些条件?2、欲溶解Na2CO3基准物质时,加水50mL应以量筒量取还是用移液管吸取?为什么?3、本实验中所使用的称量瓶、烧杯、锥形瓶是否必须都烘干?为什么?参考文献:张龙、潘亚芬《化学分析技术》邢文卫、李炜《分析化学实验》。

盐酸标准滴定溶液盐酸标准滴定溶液是化学实验中常用的一种试剂,用于测定溶液中含量未知的碱溶液的浓度。
在实验室中,我们经常需要进行盐酸标准滴定溶液的配制和使用。
下面将详细介绍盐酸标准滴定溶液的配制方法和使用注意事项。
首先,我们需要准备一定质量分数的盐酸溶液和酚酞指示剂。
盐酸溶液的质量分数一般为0.1mol/L,而酚酞指示剂是一种常用的酸碱指示剂,呈无色,在酸性溶液中呈粉红色。
接下来,我们来介绍盐酸标准滴定溶液的配制方法。
首先,我们需要称取一定质量分数的盐酸溶液,然后将其定容至标定容器所示刻度线。
在配制盐酸标准滴定溶液的过程中,需要注意使用精密天平进行称取,以确保溶液的准确浓度。
在定容的过程中,要确保溶液充分混合,以保证溶液浓度的均匀性。
完成盐酸标准滴定溶液的配制后,接下来我们将介绍盐酸标准滴定溶液的使用注意事项。
在进行滴定实验时,首先需要将待测溶液置于滴定烧杯中,然后加入数滴酚酞指示剂。
接下来,使用标定瓶中的盐酸标准溶液滴定待测溶液,直至溶液由无色变为粉红色。
在滴定的过程中,需要缓慢滴加盐酸标准溶液,并且要不断搅拌待测溶液,以保证反应的充分进行。
在滴定结束后,我们需要记录下滴定所使用的盐酸标准溶液的体积,然后根据滴定反应的化学方程式,计算出待测溶液中碱的浓度。
在进行计算时,需要注意滴定反应的摩尔比例关系,以确保计算结果的准确性。
总之,盐酸标准滴定溶液的配制和使用是化学实验中常见的操作。
通过本文的介绍,相信大家对盐酸标准滴定溶液的配制和使用有了更加清晰的认识。
在进行实验操作时,需要严格按照操作规程进行,并注意安全操作,以保证实验的顺利进行和实验结果的准确性。
希望本文对大家有所帮助,谢谢阅读!。

盐酸标准溶液的配制
盐酸标准溶液是化学实验室中常用的一种溶液,通常用于酸碱滴定、pH值调节等实验中。
正确的配制盐酸标准溶液对于实验结果的准确性至关重要。
本文将介绍盐酸标准溶液的配制方法及注意事项,希望能帮助到需要的读者。
首先,配制盐酸标准溶液需要准备好一定浓度的盐酸溶液和蒸馏水。
在实验室中,通常会购买到浓度为37%的盐酸溶液,需要根据实际需要将其稀释至所需浓度。
在进行稀释时,需要注意安全,避免盐酸溶液溅到皮肤或衣物上,同时也要避免吸入其蒸汽。
其次,根据所需浓度计算出所需的盐酸溶液和蒸馏水的体积比例。
以配制
1mol/L的盐酸标准溶液为例,假设需要配制100mL的溶液,而购买到的盐酸溶液浓度为37%,则可以通过以下计算得到所需的体积比例,V1 × C1 = V2 × C2,其中V1为盐酸溶液的体积,C1为盐酸溶液的浓度,V2为蒸馏水的体积,C2为所需盐酸标准溶液的浓度。
通过这个计算,可以得出所需的盐酸溶液和蒸馏水的体积比例,然后按照比例将盐酸溶液和蒸馏水加入容器中。
在实际操作中,需要注意以下几点,首先,选择合适的容器进行配制,避免因为溶液的挥发而造成浓度的变化;其次,在加入盐酸溶液和蒸馏水时,需要充分混合,可以轻轻摇晃容器或使用磁力搅拌器进行搅拌;最后,在配制完成后,需要用PH试纸或PH计对溶液的PH值进行检测,确保其达到所需的标准。
总之,正确的盐酸标准溶液的配制方法对于化学实验的准确性和可靠性至关重要。
在进行配制时,需要严格按照所需浓度计算出的盐酸溶液和蒸馏水的体积比例进行操作,并且在操作过程中注意安全,避免溶液的溅洒和吸入。
希望本文介绍的配制方法能够对实验工作者有所帮助。

盐酸标准溶液配制方法
盐酸标准溶液的配制方法如下:
1. 准备所需的化学品和玻璃器皿,包括盐酸(浓度大于95%)、蒸馏水、容量瓶、烧杯、滴定管等。
2. 根据需要的浓度计算所需的盐酸和蒸馏水的体积,计算公式为:(C1V1) + (C2V2) = C3V3,其中C1为盐酸浓度,V1为盐酸体积,C2为蒸馏水浓度(一般为0),V2为蒸馏水体积,C3为所需标准溶液浓度,V3为所需标准溶液体积。
3. 使用滴定管将准确的盐酸体积加入烧杯中。
4. 将加入的盐酸转移至容量瓶中,再用蒸馏水冲洗烧杯,将冲洗液一并转移至容量瓶中,并使液位接近容量瓶刻度线。
5. 用蒸馏水慢慢加至刻度线上,用塞子塞紧容量瓶口并彻底摇匀,使溶液充分混合。
6. 若溶液出现气泡,可以静置一段时间,直至气泡完全消失。
7. 检查溶液体积是否准确,如果超过刻度线,则可使用滴管加入适量的蒸馏水,直至液面接近容量瓶刻度线。
8. 将容量瓶口擦干并标记标准溶液的浓度和配制日期。
注:在配制盐酸标准溶液时,需注意安全操作,避免接触皮肤
和呼吸到蒸气。
同时,需严格按照所需浓度和配制方法进行操作,确保溶液的准确度和稳定性。

盐酸标准滴定溶液的配制所需的仪器、材料与试剂:
1、分析天平、酸式滴管、锥形瓶、量筒、吸量管、试剂瓶、烧杯和电炉子。
2、试剂:浓盐酸(分析纯)。
无水碳酸钠(基准物质),甲基橙。
配置步骤:
1、配制:用量筒取浓盐酸4.5ml,加水稀释至500mL混匀,倒入试剂瓶中,密塞。
2、标定:递减质量称量法在分析天平上称取在270~300℃干燥至恒重的基准物无水碳酸钠1.0~1.2g于烧杯中,加入适量的水溶解。
然后定量地转入250mL容量瓶中,用水稀释至刻度,摇匀。
用移液管取碳酸钠溶液25mL,加甲基橙指示剂1-2滴,用HCl溶液滴定至溶液由黄色刚变为橙色,即可得出盐酸标准溶液。
记下所消耗HCl的体积。
平行测定三份,计算盐酸溶液的浓度。

盐酸标准溶液的配制与标定一、背景分析市售盐酸为无色透明的HCl水溶液,HCl含量为36%~38%(W/W),相对密度约为1.18g/cm³。
由于浓盐酸易挥发出HCl气体。
若直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。
标定盐酸的基准物质常用碳酸钠和硼砂等,本实训采用无水碳酸钠为基准物质,以甲基红-溴甲酚绿混合指示剂指示终点。
溴甲酚绿-甲基红指示剂的变色范围为:PH5.0-5.2(绿色变为暗紫色)。
无水碳酸钠作基准物质的优点易提纯,价格便宜。
缺点是碳酸钠摩尔质量较小,具有吸湿性。
故Na2CO3固体需先在270℃-300℃高温炉中灼烧至恒重,然后置于干燥器中冷却后备用。
用待标定的盐酸溶液滴定至溶液由绿色变为暗红色后煮沸2 min,冷却后继续滴定至溶液再呈暗红色即为终点。
根据Na2CO3的质量和所消耗的HCl体积,可以计算出HCl的准确浓度。
反应本身由于产生H2CO3会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此,接近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。
二、实训原理(实质是酸碱中和反应)2HCl + Na2CO3→ 2NaCl + H2O + CO2三、实训仪器和药品仪器:分析天平,量筒,称量瓶,25mL酸式滴定管,250mL锥形瓶。
药品:①无水Na2CO3基准试剂:先置于270℃-300℃高温炉中灼烧至恒重②浓HCl(浓):取4.2ml浓盐酸加水稀释至500ml③甲基红指示剂:溶液1:称取0.1g溴甲酚绿,溶于乙醇(95%),用乙醇(95%)稀释至100ml;溶液2:称取0.2g甲基红,溶于乙醇(95%),用乙醇(95% )稀释至100ml;30ml溶液1和10ml溶液2,混匀即可。
四、实训步骤①准确称取3份0.2g无水碳酸钠于锥形瓶中,加入50ml蒸馏水溶解②向锥形瓶中加入溴甲酚绿-甲基红混合指示剂③用盐酸滴定,使颜色从绿色变为暗(紫)红色④煮沸(2min)冷却,继续滴定盐酸,使颜色变为暗紫色,记下所消耗的标准溶液盐酸的体积。

盐酸标准溶液的配制步骤及配比原则盐酸标准溶液是化学实验中常用的一种溶液,用于测量其他物质的浓度或者进行酸碱中和反应等。
正确配制盐酸标准溶液可以确保实验结果的准确性和可靠性。
本文将介绍盐酸标准溶液的配制步骤及配比原则,以帮助读者正确配制盐酸标准溶液。
一、盐酸标准溶液的配制步骤1. 准备实验器材:玻璃容量瓶、滴定管、磁力搅拌器等。
2. 准备化学品:优质的盐酸溶液、去离子水等。
3. 标定滴定管:用去离子水反复洗净滴定管,然后用少量盐酸溶液进行标定。
记录标定滴定管的容量。
4. 称量溶液:根据所需盐酸标准溶液的浓度和体积,准确称取一定质量的盐酸溶液。
5. 配制溶液:将称取的盐酸溶液转移至容量瓶中,加入适量的去离子水,摇匀使溶液均匀混合。
6. 校准溶液:用已知浓度的标准溶液进行校准,调整盐酸标准溶液的浓度,直至满足实验要求。
7. 测定浓度:利用盐酸标准溶液与待测溶液进行滴定反应,根据滴定结果计算待测溶液的浓度。
二、盐酸标准溶液的配比原则1. 合理选择浓度:根据实验要求选择盐酸标准溶液的浓度,通常情况下,盐酸标准溶液的浓度范围在0.1-1mol/L之间。
2. 计算所需质量:根据所需盐酸标准溶液的浓度和体积,使用摩尔浓度计算公式计算出所需盐酸的质量。
3. 配合去离子水:通过添加适量的去离子水,将盐酸溶液稀释至所需浓度。
在配比过程中,要注意搅拌均匀,以确保溶液的均匀混合。
4. 校准浓度:根据实际需求,可以通过滴定法和已知浓度的标准溶液进行校准,以调整盐酸标准溶液的浓度。
5. 定期检验:配制好的盐酸标准溶液应定期进行检验,确认其浓度是否满足实验要求,如有需要,及时进行校准。
在配制盐酸标准溶液时,需要特别注意安全操作。
盐酸具有刺激性和腐蚀性,操作时应佩戴防护手套和眼镜,避免直接接触皮肤和眼睛。
配制过程中,要保持实验器材的清洁,避免杂质的加入,影响溶液的准确性。
总结起来,盐酸标准溶液的配制步骤包括准备实验器材、化学品,标定滴定管,称量溶液,配制溶液,校准溶液和测定浓度等。
盐酸标准滴定溶液配置与标定的不确定度评定1 测量及不确定度评定对象盐酸标准滴定溶液,依据:GB/T 601—2002 2 测量方法的描述2.1 配置吸取9mL 盐酸溶于1000mL 水中摇匀。
2.2 标定称取0.2g 于270℃~300℃箱式电阻炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50mL 水中,加10滴溴甲酚率-甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸两分钟,冷却后继续滴定至溶液再呈暗红色。
同时做空白试验。
2.3 计算MV V m c )(100021-⨯=c ——盐酸标准滴定溶液浓度(mol/L ); m ——无水碳酸钠的质量的准确数值(g ); 1V ——盐酸溶液体积的数值(mL );2V ——空白试验盐酸溶液体积的数值(mL );M——无水碳酸钠的摩尔质量的数值(g/mol )[994.52)21(32=CO Na M ]。
3 不确定度来源分析与数学模型的建立3.1 不确定度来源分析w r m 1w f m f 2w fc 11V f 12V f21V f 22V f(1V -2V ) 3.2 建立数学模型r V V V V w w m f Mf f V f f V f f w f m c ⨯⨯⨯-⨯⨯⨯⨯⨯⨯⨯=)(10002122112122113.3 注解3.3.1 工作基准试剂质量分数范围(1w f )、工作基准试剂质量分数数值的标准不确定度(2w f )对工作基准试剂质量分数的数值(w )分别引入的标准不确定度分量为)1(w u 、)2(w u ;3.3.2 天平校准(m f )对工作基准试剂的质量的准确数值(m )引入的标准不确定度分量为)(m u ;3.3.3 无水碳酸钠实际消耗盐酸溶液体积的数值(1V -2V )引入的标准不确定度分量为)(21V V u -;3.3.3.1滴定管检定(11V f )、温度波动(21V f )对盐酸溶液体积的数值(1V )分别引入的标准不确定度分量为)1(1V u 、)2(1V u ;3.3.3.2 滴定管检定(12V f )、温度波动(22V f )对空白试验盐酸溶液体积的数值(2V )分别引入的标准不确定度分量为)1(2V u 、)2(2V u ;3.3.4 人员操作的重复性(称量重复性、滴定管读数重复性、滴定终点判断重复性)、工作基准试剂及盐酸标准溶液的不均匀性对标定结果(c )引入的标准不确定度分量为)(r u ;4 不确定度分量的量化4.1 工作基准试剂质量分数的数值(w )的相对不确定度分量)(w u rel 工作基准试剂质量分数标注范围:99.95%~100.05%, 由计算公式得:%029.03%05.0)1(===k a w u (按均匀分布3=k )由于工作基准试剂质量分数数值的标准不确定度未标注,所以)2(w u 不作考虑 所以:%029.0)1()(==w u w u工作基准试剂质量分数数值为100%,所以,4109.2%100%029.0)()(-⨯===ww u w u rel4.2 工作基准试剂的质量数值(m )的相对不确定度分量)(m u rel天平计量证书标明其称量时,天平偏载的最大允差为0.8mg ,假定为矩形分布,换算成标准不确定度为:mg m u 46.038.0)(==所以称取0.2g 无水碳酸钠引入的相对标准不确定度为:3103.22.000046.0)()(-⨯===gg mm u m u rel4.3 无水碳酸钠实际消耗盐酸溶液体积的数值(1V -2V )的相对标准不确定度分量为)(21V V u rel -4.3.1 盐酸溶液体积的数值(1V )的标准不确定度分量为)(1V u 4.3.1.1 滴定管检定(11V f )引入的标准不确定度分量为)1(1V u检定证书标明B 级50ml 滴定管其容量允差为0.10ml ,假定为矩形分布,换算成标准不确定度为:ml V u 058.0310.0)1(1==4.3.1.2 温度波动(21V f )引入的标准不确定度分量为)2(1V u实验温度控制在(202±)℃,水的体积膨胀系数为4101.2-⨯℃-1,因此产生的体积变化为)(102.4)101.22(44ml V V --⨯±=⨯⨯⨯±,假定温度变化为矩形分布,则ml ml V u 0092.0309.38102.4)2(41=⨯⨯=-将上述不确定度合成:mlV u V u V u 059.00092.0058.0)2()1()(2212121=+=+=4.3.2 空白试验盐酸溶液体积的数值(2V )的标准不确定度分量为)(2V u 4.3.2.1 滴定管检定(12V f )引入的标准不确定度分量为)1(2V u检定证书标明B 级50ml 滴定管其容量允差为0.10ml ,假定为矩形分布,换算成标准不确定度为:ml V u 058.0310.0)1(2==4.3.2.2 温度波动(22V f )引入的标准不确定度分量为)2(2V u实验温度控制在(202±)℃,水的体积膨胀系数为4101.2-⨯℃-1,因此产生的体积变化为)(102.4)101.22(44ml V V --⨯±=⨯⨯⨯±,假定温度变化为矩形分布,则ml ml V u 4421012.0305.0102.4)2(--⨯=⨯⨯=将上述不确定度合成:ml V u V u V u 058.0)1012.0(058.0)2()1()(24222222=⨯+=+=-mlV u V u V V u 083.0058.0059.0)()()(22221221=+=+=-3212121102.2)05.009.38(083.0)()(-⨯=-=--=-mlml V V V V u V V u rel4.5 结果重复性的相对标准不确定度分量)(r u rel八平行测定结果相对标准不确定度为:45108.1/099810.0/108.)()(--⨯=⨯==Lmol Lmol cr u r u rel 15 合成标准不确定度的计算标定过程中的相对标准不确定分量将相对标准不确定度分量进行合成:)()()()()(221222r u V V u m u w u c u rel rel rel rel rel +-++=()382222102.3108.122239.2--⨯=⨯+++=八平行测定结果平均值为0.099810(mol/L ),则合成标准不确定度为:)/(00032.0102.3099810.0)()(3L mol c u c c u rel =⨯⨯=⋅=-6 包含因子及扩展不确定度的计算95%置信水平下取包含因子2=k ,将合成标准不确定度乘以包含因子计算得到测量结果的扩展不确定度为:)0006(mol/L .000032.02)(=⨯==c ku U7 测量结果及其不确定度表述盐酸标准滴定溶液浓度:()2,/0006.00.09981=±k L mol。
广东石油化工学院实验报告班级:生物技术08-2 学号:实验者:成绩:_______________________________________________________________ ________________实验一盐酸标准溶液的配制及标定一、目的要求1.练习溶液的配制和滴定的准备工作,训练滴定操作,进一步掌握滴定操作。
2.学会用基准物质标定盐酸浓度的方法。
3.了解强酸弱碱盐滴定过程中 pH 的变化。
4.熟悉指示剂的变色观察,掌握终点的控制。
二、实验原理市售盐酸为无色透明的HCl水溶液,HCl含量为36%~38%(W/W),相对密度约为1.18。
由于浓盐酸易挥发出HCl气体,若直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。
标定盐酸的基准物质常用碳酸钠和硼砂等,本实验采用无水碳酸钠为基准物质,以甲基红-溴甲酚绿混合指示剂指示终点,无水碳酸钠作基准物质的优点是容易提纯,价格便宜。
缺点是碳酸钠摩尔质量较小,具有吸湿性。
因此Na2CO3固体需先在270℃~300℃高温炉中灼烧至恒重,然后置于干燥器中冷却后备用。
计量点时溶液的 pH为3.89,用待标定的盐酸溶液滴定至溶液由绿色变为暗红色后煮沸2 min,冷却后继续滴定至溶液再呈暗红色即为终点。
根据Na2CO3的质量和所消耗的 HCl 体积,可以计算出HCl的准确浓度。
用Na2CO3标定时反应为:2HCl + Na2CO3→ 2NaCl + H2O + CO2↑反应本身由于产生H2CO3会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此,接近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。
三、实验用品分析天平(感量0.01mg/分度),量筒,称量瓶,25mL酸式滴定管,250mL 锥形瓶。
工作基准试剂无水Na2CO3:先置于270℃~300℃高温炉中灼烧至恒重后,保存于干燥器中。
浓HCl(浓或0.1mol/L),溴甲酚绿(3.8-5.4)一甲基红(4.4-6.2)指示液(变色点pH=5.1):溶液Ⅰ: 称取0.1 g 溴甲酚绿,溶于乙醇(95%),用乙醇(95%)稀释至100m L;溶液Ⅱ; 称取0.2 g 甲基红,溶于乙醇(95%),用乙醇(95% )稀释至100m L;取 30 m L溶液I, 10m L溶液Ⅱ,混匀。
盐酸标准滴定溶液盐酸标准滴定溶液是化学实验中常用的一种溶液,它通常用于测定其他溶液中含有的碱或者其他物质的含量。
在实验室中,我们经常会遇到需要使用盐酸标准滴定溶液的情况,因此了解其制备和使用方法是非常重要的。
首先,我们需要准备一定浓度的盐酸溶液,然后使用标准的氢氧化钠溶液进行滴定。
在进行滴定的过程中,我们需要注意溶液的浓度、滴定管的使用方法以及滴定终点的判断。
接下来,我将详细介绍盐酸标准滴定溶液的制备和使用方法。
制备盐酸标准滴定溶液的第一步是准备一定浓度的盐酸溶液。
我们可以根据需要制备不同浓度的盐酸溶液,一般来说,我们可以通过稀释浓盐酸来得到所需浓度的盐酸溶液。
在制备盐酸溶液的过程中,需要注意安全,避免溅洒和吸入有害气体。
接下来,我们需要使用标准的氢氧化钠溶液对盐酸溶液进行滴定。
在进行滴定之前,我们需要准备好滴定管、酚酞指示剂和烧杯等实验器材。
首先,将盐酸溶液倒入烧杯中,加入几滴酚酞指示剂,然后使用标准的氢氧化钠溶液进行滴定。
在滴定的过程中,需要缓慢滴加氢氧化钠溶液,并且不断搅拌溶液,直到出现颜色变化。
滴定终点的判断是盐酸标准滴定溶液使用过程中需要特别注意的一个环节。
通常情况下,滴定终点可以通过颜色变化来判断,当溶液从无色变为粉红色时,即为滴定终点。
在接近滴定终点时,需要减缓滴液的速度,以免过度滴定,影响结果的准确性。
总的来说,盐酸标准滴定溶液的制备和使用方法并不复杂,但需要我们在实验操作中严格按照标准程序进行,并且注意安全。
只有在正确使用的情况下,我们才能得到准确的实验结果,为化学实验的顺利进行提供保障。
在实际的实验操作中,我们还需要根据具体的实验要求和条件来进行调整和改进。
因此,对于盐酸标准滴定溶液的制备和使用方法,我们需要不断实践和总结经验,以便在实验中能够熟练掌握并灵活运用。
总的来说,盐酸标准滴定溶液在化学实验中具有重要的应用价值,了解其制备和使用方法对于我们进行化学实验具有重要意义。
希望通过本文的介绍,能够帮助大家更好地理解盐酸标准滴定溶液的相关知识,为化学实验的顺利开展提供帮助。
原理
由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。
标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:
Na2CO3 +2HCl 2NaCl +CO2 +H2O
滴定至反应完全时,溶液pH为3.89,通常选用溴甲酚绿-甲基红混合液作指示剂。
二、试剂
1.浓盐酸(密度1.19)
2.溴甲酚绿-甲基红混合液指示剂:量取30mL溴甲酚绿乙醇溶液(2g/L),加入20mL甲基红乙醇溶液(1g/L),混匀。
盐酸标准滴定液的浓度C(NaOH)1mol L工作基准试剂无水碳酸钠的质量1.9m/g
盐酸标准滴定液的浓度[ C(HCl)],数值以摩尔每升(mol/L)表示,按式(2)计算
C(HCl)=100m/[v1-v2]M
式中:m-----无水碳酸钠的质量的准确数值,单位为克(g);
V1---盐酸溶液的体积的数值,单位是毫升(mL);
V2---空白试验盐酸溶液的体积的数值,单位是毫升(mL);
M--- 水碳酸钠的摩尔质量的数值,单位为克没摩尔(g/mol)[M(1/2Na2C2O3)=52.994]。
四、注意事项
干燥至恒重的无水碳酸钠有吸湿性,因此在标定中精密称取基准无水碳酸钠时,宜采用“减量法”称取,并应迅速将称量瓶加盖密闭。
在滴定过程中产生的二氧化碳,使终点变色不够敏锐。
因此,在溶液滴定进行至临近终点时,应将溶液加热煮沸,以除去二氧化碳,待冷至室温后,再继续滴定。
盐酸标准溶液的配制和标定一、目的要求掌握减量法准确称取基准物的方法。
掌握滴定操作并学会正确判断滴定终点的方法。
学会配制和标定盐酸标准溶液的方法。
二、实验原理由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。
标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:Na2CO3+2HCI===2NaCl+H2O+CO2滴定至反应完全时,溶液通常选用溴甲酚绿-甲基红混合液或甲基橙作指示剂。
三、试剂1.浓盐酸(密度mL)2.甲基橙指示剂四、实验步骤溶液的配制用量筒量取浓盐酸9mL,倒入预先盛有适量水的试剂瓶中,加水稀释至1000mL,摇匀,贴上标签。
2.盐酸溶液浓度的标定用减量法准确称取约—在270~300℃干燥至恒量的基准无水碳酸钠,置于250mL锥形瓶,加50mL水使之溶解,再加甲基橙指示剂1—2滴,用配制好的HCl溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
若用甲基橙做指示剂,则终点颜色变化为:由黄色变为橙色。
由Na2CO3的重量及实际消耗的HCl溶液的体积,计算HCl溶液的准确浓度。
实验流程五、数据记录与处理编号 实验项目倾出前(称量瓶+基准物)质量 倾出后(称量瓶+基准物)质量取出基准物的质量HCl 溶液 终读数 HCl 溶液 初读数 消耗HCl 溶液体积 HCl 溶液的浓度HCl 溶液的平均浓度相对平均偏差六、注意事项干燥至恒重的无水碳酸钠有吸湿性,因此在标定中精密称取基准无水碳酸钠时,宜采用“减量法”称取,并应迅速将称量瓶加盖密闭。
在滴定过程中产生的二氧化碳,使终点变色不够敏锐。
因此,在溶液滴定进行至临近终点时,应将溶液加热煮沸,以除去二氧化碳,待冷至室温后,再继续滴定。
盐酸标准滴定溶液
4.2.1 配制
按表3的规定量取盐酸,注人1 000 mL 水中,摇匀。
表 3
盐酸浓度[c(HCI)]/(mol/L) 盐酸的体积(ml.)
1
90 0.5
45 0.1 9
4.2.2 标定
按表4的规定称取于270ºC~300ºC 高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50 ml.水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2 min ,冷却后继续滴定至溶液再呈暗红色。
同时做空白试验。
盐酸标准滴定溶液的浓度c
(HCI)],数值以摩尔每升(mol/L)表示,按式(2)计算:
C(HCI)= 1000m / (V 1一V 2 )M (2)
式中:
m-一无水碳酸钠的质量的准确数值,单位为克((g) ;
V 1 - 盐酸溶液的体积的数值,单位为毫升(ml) ;
V 2一一空白试验盐酸溶液的体积的数值,单位为毫升(ml)
M 一一无水碳酸钠的摩尔质量的数值,M(0.5Na 2 CO 3)=52. 9941
盐酸标液的浓度c(HCI)]/(mol/L) 无水碳酸钠的质量g 1 1.9 0.5 0.95 0.1 0.2。