2015潍城二模化学试题及答案
- 格式:doc
- 大小:1.02 MB
- 文档页数:10

理科综合相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56Cu 64 Zn 65 Ba 137一、选择题(本题包括13道小题,每小题5分,共65分。
每小题只有一个选项符合题意)7.下列实验操作,现象和结论均正确的是8.X、Y、Z、W是原子序数依次增大的四种短周期元素,X的最高价氧化物对应的水化物的化学式为H2XO3,Y的最外层电子数是电子层数的3倍,Z是地壳中含量最高的金属元素,W的一种核素的质量数为28,中子数为14.下列说法正确的是A.原子半径由大到小的顺序是Z>W>Y>XB.元素的非金属性W>Y>XC.Z2Y3、WX分别是离子化合物、共价化合物D.X、Z、W的最高价氧化物都是酸性氧化物9.下列实验过程中,始终看不到明显变化的是A.向10mL0.1mol·L-1FeI2溶液中缓缓通入标准状况下11.2mL Cl2B.向AlCl3溶液中滴加Na2S溶液SO-离子的溶液中通入NO2C.向含有Na+、Fe2+、Cl、24D.向5mL 0.1 mol·L-1NaOH溶液中,逐滴加入1mL0.1 mol·L-1AlCl3溶液,边滴加边振荡10.下列各表述与下图所示一致的是A.图1表示某吸热反应t1时刻升高温度时,正逆反应速率的变化B.图2表示某放热反应过程的能量变化,若使用催化剂,a点会降低C.图3表示向含等物质的量的NaOH、Na2CO3混合溶液中滴加0.1 mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系D.图4表示Cl2通入H2SO3溶液中pH的变化11.右图表示M的结构简式,下列有关M的说法正确的是A.M可以发生加成、加聚、水解、酯化等反应B.1 mol M最多可以与3 mol NaOH反应C.M苯环上的一氯取代物有两种不同结构D.1 molM最多可以与5 mol H2发生加成反应12.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池、盐桥中装有饱和K2SO4溶液。

2015-2016学年度???学校9月月考卷1.化学与生活息息相关,下列说法错误的是A.乙烯可作为水果的催熟剂B.地沟油经过处理,可用来制造肥皂C.漂白粉长期暴露在空气中会变质失效D.丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体【答案】D【解析】试题分析:A.乙烯是植物生长调节剂,可作为水果的催熟剂,正确。
B.地沟油的成分属于油脂,经过处理,可用来与强碱发生皂化反应制造肥皂,正确。
C.漂白粉有效成分是次氯酸钙,会与空气中的水、CO2发生反应变为碳酸钙和次氯酸,因此长期暴露在空气中会变质失效,正确。
D.丙烷(C3H8)没有同分异构体,而乙醇(C2H5OH)存在同分异构体CH3OCH3,错误。
考点:考查化学在生活、生成的作用、物质的保存及物质结构的知识。
2.X、Y、Z、R、W是短周期主族元素,X原子的最外层电子数是其次外层的2倍,Y是地壳中含量最高的元素,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X 原子与Z原子的核外电子数之和,W与Y属于同一主族。
下列叙述正确的是A.Y、Z、R元素简单离子的半径依次增大B.含有Y、Z、R三种元素的化合物最多只有2种C.元素W和R最高价氧化物对应水化物的酸性后者强D.Y与Z形成的两种化合物中的化学键类型和阴阳离子个数比均相同【答案】C【解析】试题分析:X原子的最外层电子数是其次外层的2倍,则X是C元素;Y是地壳中含量最高的元素Y是O元素;Z元素的化合物的焰色反应呈黄色,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R是Cl元素;W与Y属于同一主族,则W是S元素。
A.离子核外电子层数越多。
离子半径就越大。
当离子的核外电子层数相同时,离子的核电荷数越大。
离子半径就越小。
所以Y、Z、R元素简单离子的半径大小关系是:R>Y>Z,错误。
B.含有Y、Z、R三种元素的化合物有NaClO、NaClO2、NaClO3、NaClO4等,多于2种,错误。
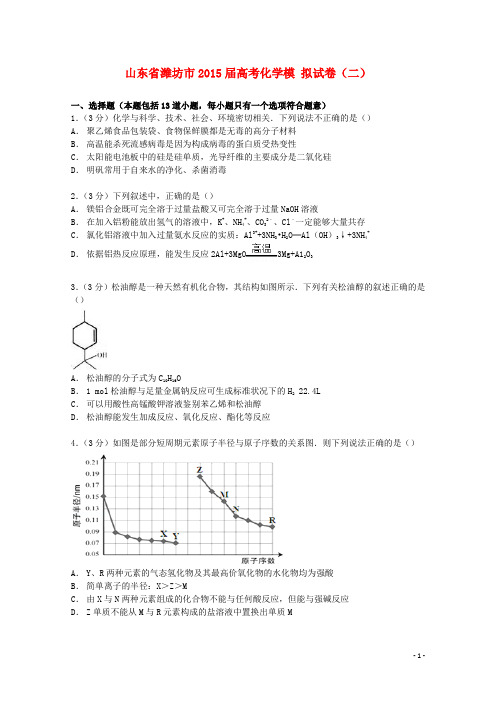
山东省潍坊市2015届高考化学模拟试卷(二)一、选择题(本题包括13道小题,每小题只有一个选项符合题意)1.(3分)化学与科学、技术、社会、环境密切相关.下列说法不正确的是()A.聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子材料B.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性C.太阳能电池板中的硅是硅单质,光导纤维的主要成分是二氧化硅D.明矾常用于自来水的净化、杀菌消毒2.(3分)下列叙述中,正确的是()A.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液B.在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32﹣、Cl﹣一定能够大量共存C.氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O═Al(OH)3↓+3NH4+D.依据铝热反应原理,能发生反应2Al+3MgO3Mg+A12O33.(3分)松油醇是一种天然有机化合物,其结构如图所示.下列有关松油醇的叙述正确的是()A.松油醇的分子式为C10H16OB.1 mol松油醇与足量金属钠反应可生成标准状况下的H2 22.4LC.可以用酸性高锰酸钾溶液鉴别苯乙烯和松油醇D.松油醇能发生加成反应、氧化反应、酯化等反应4.(3分)如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是()A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸B.简单离子的半径:X>Z>MC.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应D.Z单质不能从M与R元素构成的盐溶液中置换出单质M5.(3分)不久前,某海军航空站安装了一台250kW的MCFC型燃料电池.该电池可同时供应电和水蒸气,其工作温度为600~700℃,所用燃料为H2,电解质为熔融的K2CO3.已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO32﹣﹣2e﹣═H2O+CO2,则下列推断正确的是()A.正极反应为4OH﹣═O2+2H2O+4e﹣B.放电时CO32﹣向负极移动C.电池供应1 mol水蒸气,转移电子4 molD.氢氧燃料电池的H2和O2都贮存于电池中6.(3分)比较MnO2和CuO对H2O2分解反应的催化能力大小的实验中若催化剂的质量均控制在0.1g,6%的H2O2溶液均取5mL,可选择的实验装置是()A.B.C.D.7.(3分)常温下,用0.1000mol•L﹣1NaOH溶液分别滴定20.00mL0.1000mol•L﹣1盐酸和20.00mL 0.1000mol•L﹣1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是()A.滴定盐酸的曲线是图乙B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(X﹣)C.达到B、E状态时,反应消耗的,n(CH3COOH)>n(HCl)D.当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(X ﹣)>c(Na+)>c(H+)>c(OH﹣)二、解答题(共3小题,满分53分)8.(16分)由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如图1:(1)操作Ⅱ的名称是.(2)可循环利用的物质(填化学式).(3)反应②的产物中,氧化产物与还原产物的物质的量之比是.(4)反应②中“酸化”时不能选择下列酸中的(填字母序号)A.稀盐酸 B.稀硫酸 C.稀醋酸(5)电解猛酸钾溶液也可以得到高锰酸钾,其阴极反应式为:2H2O+2e﹣=2OH﹣+H2↑如图2,b 作极,电解池的阳极反应式是;若电解过程中收集到2.24L H2(标准状况),则得到高锰酸钾克.(提示:阴离子放电顺序Mn2﹣4>OH﹣)9.(17分)H2O2、NH3都是用途广泛的工业产品.I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照以下方案完成实验.实验编号反应物催化剂①10mL2%H2O2溶液无②10mL5%H2O2溶液无③10mL5%H2O2溶液1mL0.1mol•L﹣1FeCl3溶液④10mL5%H2O2溶液+少量HCl溶液1mL0.1mol•L﹣1FeCl3溶液⑤10mL5%H2O2溶液+少量NaOH溶液1mL0.1mol•L﹣1FeCl3溶液(1)实验①和②的目的是.(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图1能够得出的实验结论是.(3)加入0.1g MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.反应速率变化的原因是,则H2O2的初始物质的量浓度为(保留两位有效数字).Ⅱ.(1)工业上用N2和H2合成氨.已知:N2(g)+3H2(g)⇌2NH3(g)△H=﹣a kJ•mol﹣12H2O(1)⇌2H2(g)+O2(g)△H=+b kJ•mol﹣1则NH3被O2氧化为N2和H2O的热化学方程式为.(2)NH3能被H2O2氧化生成无毒气体和水.①此反应可设计原电池,在碱性条件下负极的电极反应方程式为.②利用上述原电池,用惰性电极电解l00mL 0.5mol•L﹣1的CuSO4溶液,电解反应的离子方程式为.10.已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业.(1)已知25℃时,几种常见弱酸的K a如下表所示:电解质H2C2O4CH3COOH HCN H2CO3电离常数(mol•L﹣1)K1=5.6×10﹣2K2=5.4×10﹣3 K1=1.7×10﹣5 K2=6.2×10﹣10K1=4.2×10﹣7K2=5.6×10﹣11①25℃时,浓度均为0.1mol•L﹣1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是.中和等体积、等pH的HCOOH和HCN消耗NaOH的量(填“前者大”“后者大”或“相等”).②下列关于0.1mol•L‑1NaHC2O4溶液的说法正确的是.a.HC2O4﹣的电离程度大于水解程度,溶液显酸性b.HC2O4﹣的水解程度大于电离程度程度,溶液显碱性c.溶液中c(Na+)+c(H+)=c(HC2O4﹣)+c(OH﹣)+c(C2O42﹣)d.溶液中c(H+)=c(OH﹣)+c(C2O42﹣)﹣c(H2C2O4)(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的K sp=5.6×10﹣12,下列说法不正确的是.A.在t℃时,MgC2O4的K sp=8.1×10﹣5(mol•L﹣1).B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点C.图中a点对应的是MgC2O4的不饱和溶液D.在t℃时,MgC2O4(s)+2OH﹣(aq)⇌Mg(OH)2(s)+C2O42﹣(aq)平衡常数K=K sp/K sp(MgC2O4)(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:①从环保角度考虑,该套实验装置的明显缺陷是.②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃(填“A”或“E”)处的酒精灯.③若实验过程中观察到B中白色无水CuSO4变成蓝色,.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为.草酸亚铁晶体分解的化学方程式为.三、【化学--化学与技术】(共1小题,满分12分)11.(12分)氨在工业上有很多重要应用,合成氨的流程示意图如下:回答下列问题:(1)设备A中含有电加热器、触煤和热交换器,设备A的名称,其中发生的化学反应方程式为;原料氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式:;(2)设备B的名称,其中m和n是两个通水口,入水口是(填“m”或“n”).不宜从相反方向通水的原因;(3)设备C的作用是.四、【化学--物质结构与性质】(共1小题,满分0分)12.(1)AlN的晶体结构与单晶硅相似,在AlN晶体中,每个Al原子与个N原子相连,与N 元素同主族的元素As位于元素周期表的第四周期,其基态原子的核外电子排布式为.(2)A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.①当n=2时,AB2属于分子(填“极性”或“非极性”).②若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是(用元素符号表示)(3)CaO晶胞如右图所示其中Ca2+的配位数为,CaO晶体和NaCl晶体的离子排布方式相同,CaO晶体的熔点高于NaCl晶体的熔点的主要原因是.五、【化学--有机化学基础】(共1小题,满分0分)13.A是一种重要的化工原料,已知A是一种卤代烃相对分子质量为92.5,其核磁共振氢谱中只有一个峰,C是一种高分子化合物,M是一种六元环状酯,转化关系如图所示,回答下列问题:(1)A的分子式为;A→B的反应类型;(2)有机物D的结构式为. M的结构简式为.(3)写出下列反应的化学方程式:B→C:;E→F:.(4)写出满足下列条件的H的同分异构体d的结构简式.①属于酯类②能发生银镜反应;③能与金属钠反应放出气体;④核磁共振氢谱有三个峰,且峰面积比为6:1:1.山东省潍坊市2015届高考化学模拟试卷(二)参考答案与试题解析一、选择题(本题包括13道小题,每小题只有一个选项符合题意)1.(3分)化学与科学、技术、社会、环境密切相关.下列说法不正确的是()A.聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子材料B.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性C.太阳能电池板中的硅是硅单质,光导纤维的主要成分是二氧化硅D.明矾常用于自来水的净化、杀菌消毒考点:常见的生活环境的污染及治理;硅和二氧化硅;镁、铝的重要化合物;合成材料.分析:A.聚乙烯是无毒的高分子化合物;B.蛋白质在加热条件下可发生变性;C.Si可做为半导体,二氧化硅是光导纤维的主要成分;D.明矾具有净水作用,不具有杀菌消毒作用.解答:解:A.聚乙烯是无毒的高分子化合物,可制作食品包装袋、食物保鲜膜,故A正确;B.加热可使蛋白质变性而失去活性,故B正确;C.太阳能电池板的原料是硅单质,光导纤维的主要成分是二氧化硅,故C正确;D.明矾净水时,铝离子发生水解反应,生成氢氧化铝具有净水作用,发生了化学及物理变化,氢氧化铝不具有氧化性,不能杀菌消毒,故D错误.故选D.点评:本题考查聚乙烯、蛋白质的变性、材料、明矾净水等,为2015届高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.2.(3分)下列叙述中,正确的是()A.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液B.在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32﹣、Cl﹣一定能够大量共存C.氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O═Al(OH)3↓+3NH4+D.依据铝热反应原理,能发生反应2Al+3MgO3Mg+A12O3考点:铝的化学性质;镁、铝的重要化合物.分析:A.Mg和NaOH不反应;B.加入铝粉能生成气体的溶液呈强碱性或酸性,但必须是弱氧化性酸;C.氢氧化铝易溶于强碱但难溶于弱碱;D.镁的活泼性大于Al.解答:解:A.镁和铝都易和HCl反应生成氯化物和氢气,但Mg不能和NaOH反应,铝能和氢氧化钠反应,所以镁铝合金不能完全溶于NaOH溶液中,故A错误;B.加入铝粉能生成气体的溶液呈强碱性或酸性,但必须是弱氧化性酸,酸性条件下不能大量存在碳酸根离子,碱性条件下不能存在大量铵根离子,故B错误;C.氢氧化铝易溶于强碱但难溶于弱碱,氨水是弱碱溶液,所以氢氧化铝不溶于氨水,氯化铝和一水合氨反应离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C正确;D.镁的活泼性大于Al,所以不能采用铝热反应冶炼Mg,要采用电解氯化镁方法冶炼镁,故D 错误;故选C.点评:本题考查镁、铝及其化合物的性质,涉及两性氢氧化物的性质、金属冶炼、离子共存、铝的性质等知识点,明确元素化合物知识是解本题关键,C选项是实验室制取氢氧化铝的反应原理,易错选项是B.3.(3分)松油醇是一种天然有机化合物,其结构如图所示.下列有关松油醇的叙述正确的是()A.松油醇的分子式为C10H16OB.1 mol松油醇与足量金属钠反应可生成标准状况下的H2 22.4LC.可以用酸性高锰酸钾溶液鉴别苯乙烯和松油醇D.松油醇能发生加成反应、氧化反应、酯化等反应考点:有机物的结构和性质.分析:由结构简式可知,该物质的分子式为C10H18O,含C=C及﹣OH,结合烯烃和醇的性质来解答.解答:解:A.松油醇的分子式为C10H18O,故A错误;B.只含有1个羟基,则1 mol松油醇与足量金属钠反应可生成标准状况下的H2 11.2L,故B 错误;C.含有碳碳双键,可被酸性高锰酸钾氧化,不能鉴别,故C错误;D.含C=C,能发生加成、氧化反应,含﹣OH,能酯化反应,故D正确,故选D.点评:本题考查有机物的结构与性质,为2015届高考常见题型,注意把握官能团和性质的关系,熟悉醇、烯烃的性质即可解答,题目难度不大.4.(3分)如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是()A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸B.简单离子的半径:X>Z>MC.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应D.Z单质不能从M与R元素构成的盐溶液中置换出单质M考点:原子结构与元素周期律的关系.专题:元素周期律与元素周期表专题.分析:由图可知,为第二周期和第三周期元素的原子半径的变化,根据原子序数关系可知X 为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素,结合对应物质的性质解答该题.解答:解:由图可知,为第二周期和第三周期元素的原子半径的变化,根据原子序数关系可知X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素,A.F元素没有最高价含氧酸,故A错误;B.O2﹣、Na+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径O2﹣>Na+>Al3+,故B正确;C.二氧化硅能与氢氟酸反应生成四氟化硅与水,故C错误;D.Na与氯化铝溶液反应,首先钠与水反应生成氢氧化钠与氢气,氢氧化钠再与氯化铝反应,不能置换出Al单质,故D正确,故选BD.点评:本题考查原子结构与元素周期律,难度不大,注意根据原子半径的递变规律判断元素的种类为解答该题的关键.5.(3分)不久前,某海军航空站安装了一台250kW的MCFC型燃料电池.该电池可同时供应电和水蒸气,其工作温度为600~700℃,所用燃料为H2,电解质为熔融的K2CO3.已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO32﹣﹣2e﹣═H2O+CO2,则下列推断正确的是()A.正极反应为4OH﹣═O2+2H2O+4e﹣B.放电时CO32﹣向负极移动C.电池供应1 mol水蒸气,转移电子4 molD.氢氧燃料电池的H2和O2都贮存于电池中考点:原电池和电解池的工作原理.分析:A、燃料电池中,正极发生的是氧气的得电子的反应过程;B、电池放电时,阴离子向负极移动;C、生成1mol水转移2mol电子;D、氢氧燃料电池的燃料不需要贮存于电池中.解答:解:A、燃料电池中,正极发生的是氧气得电子的反应过程,电极反应为:O2+2CO2+4e 2﹣,故A错误;﹣→2CO3B、电池放电时,阴离子向负极移动,则CO32﹣向负极移动,故B正确;C、已知该电池的总反应为2H2+O2═2H2O,则生成1mol水转移2mol电子,故C错误;D、氢氧燃料电池的燃料不需要贮存于电池中,可以边反应边加,故D错误.故选B.点评:本题是一道有关燃料电池的工作原理的综合题目,要求学生熟悉原电池原理,把握正负极的判断方法和电极方程式的书写方法,具备分析和解决问题的能力,题目难度中等.6.(3分)比较MnO2和CuO对H2O2分解反应的催化能力大小的实验中若催化剂的质量均控制在0.1g,6%的H2O2溶液均取5mL,可选择的实验装置是()A.B.C.D.考点:浓度、温度、催化剂对化学反应速率的影响.专题:化学反应速率专题.分析:A、B两装置中使用的长颈漏斗没有形成液封,无法收集气体;根据双氧水分解反应的化学方程式进行粗略计算可知,2mL6%的H2O2溶液完全分解产生的氧气在标准状况下的体积约为98.8mL,据此进行判断.解答:解:6%的H2O2溶液均取5mL,双氧水的密度大于1g/mL,按照1g/mL计算,双氧水的物质的量为:≈0.0088mol,生成氧气在标况下的体积约为:0.0088mol××22.4L/mol≈0.0986L=98.6mL,A.装置中长颈漏斗没有形成液封,生成的氧气会从长颈漏斗中逸出,无法收集气体,且量筒规格太小,故A错误;B.生成的气体会从长颈漏斗逸出,无法收集气体,故B错误;C.该装置中收集装置为10mL量筒,10mL的量筒规格太小,无法完成实验,故C错误;D.该选项中发生装置和收集装置都比较合理,能够完成实验,故D正确;故选D.点评:本题考查催化剂对双氧水分解实验探究装置的选择有关判断,该题是中等难度的试题,既有定性分析,也有定量计算,有利于培养学生的综合实验能力,激发学生的学习求知欲,高学生的应试能力和学习积极性.7.(3分)常温下,用0.1000mol•L﹣1NaOH溶液分别滴定20.00mL0.1000mol•L﹣1盐酸和20.00mL 0.1000mol•L﹣1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是()A.滴定盐酸的曲线是图乙B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(X﹣)C.达到B、E状态时,反应消耗的,n(CH3COOH)>n(HCl)D.当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(X ﹣)>c(Na+)>c(H+)>c(OH﹣)考点:酸碱混合时的定性判断及有关ph的计算.专题:电离平衡与溶液的pH专题.分析:A.醋酸是弱电解质、HCl是强电解质,物质的量浓度相等的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,则pH醋酸>盐酸;B.中性溶液中存在c(H+)=c(OH﹣),根据电荷守恒判断c(Na+)、c(X﹣)大小;C.两种酸的物质的量浓度相等,其体积相等时物质的量相等;D.当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸.解答:解:A.醋酸是弱电解质、HCl是强电解质,物质的量浓度相等的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,则pH醋酸>盐酸,根据图象知,甲是滴定盐酸、乙是滴定醋酸,故A错误;B.中性溶液中存在c(H+)=c(OH﹣),根据电荷守恒得c(Na+)=c(X﹣),故B正确;C.两种酸的物质的量浓度相等,其体积相等时物质的量相等,所以n(CH3COOH)=n(HCl),故C错误;D.当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A﹣)>c(H+)>c(Na+)>c(OH﹣),故D错误,故D错误;故选B.点评:本题考查酸碱混合溶液定性判断,为高频考点,侧重考查弱电解质电离及溶液离子浓度大小比较,易错选项是D,注意利用溶液中的溶质及其量的多少判断.二、解答题(共3小题,满分53分)8.(16分)由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如图1:(1)操作Ⅱ的名称是过滤.(2)可循环利用的物质MnO2(填化学式).(3)反应②的产物中,氧化产物与还原产物的物质的量之比是2:1.(4)反应②中“酸化”时不能选择下列酸中的A(填字母序号)A.稀盐酸 B.稀硫酸 C.稀醋酸(5)电解猛酸钾溶液也可以得到高锰酸钾,其阴极反应式为:2H2O+2e﹣=2OH﹣+H2↑如图2,b 作负极,电解池的阳极反应式是MnO42﹣﹣e﹣=MnO4﹣;若电解过程中收集到2.24L H2(标准状况),则得到高锰酸钾31.6克.(提示:阴离子放电顺序Mn2﹣4>OH﹣)考点:制备实验方案的设计;电解原理.专题:实验设计题.分析:由流程可知,第一步,KOH和KClO3与MnO2反应,得到K2MnO4,从而可以写出反应方程式为6KOH+3MnO2+KClO3=3K2MnO4+KCl+3H2O,然后加入水溶解分离可溶性物质,得到K2MnO4和KCl;第二步,将滤液酸化,得到高锰酸钾和二氧化锰,为一歧化反应,锰从+6变为+7和+4;反应方程式为3MnO42﹣+4H+=2MnO4﹣+MnO2+2H2O,通过过滤分离MnO2和高锰酸钾溶液,最终得到产品,整个过程中MnO2可以循环利用.(1)操作Ⅱ是固体和液体分离,利用过滤操作分离;(2)流程中参与反应过程,最后又重新生成的物质可以循环使用;(3)反应②3MnO42﹣+4H+=2MnO4﹣+MnO2+2H2O,依据元素化合价变化分析,氧化产物是元素化合价升高的产物,元素化合价降低的产物为还原产物;(4)因锰酸根和高锰酸根均具有强氧化性,不能使用盐酸酸化;(5)由电流流向可知a为正极,铁为活性电极,这里没有参与反应,做阴极故与负极相连,阳极发生氧化反应,锰酸根失电子生成高锰酸根,根据电子得失守恒可以进行相关计算.解答:解:由流程可知,第一步,KOH和KClO3与MnO2反应,得到K2MnO4,从而可以写出反应方程式为6KOH+3MnO2+KClO3=3K2MnO4+KCl+3H2O,然后加入水溶解分离可溶性物质,得到K2MnO4和KCl;第二步,将滤液酸化,得到高锰酸钾和二氧化锰,为一歧化反应,锰从+6变为+7和+4;反应方程式为3MnO42﹣+4H+=2MnO4﹣+MnO2+2H2O,通过过滤分离MnO2和高锰酸钾溶液,最终得到产品,整个过程中MnO2可以循环利用.(1)操作Ⅱ是固体和液体分离,利用过滤操作分离,所以操作Ⅱ的名称是过滤,故答案为:过滤;(2)流程中参与反应过程,最后又重新生成的物质可以循环使用,流程中KOH和KClO3与MnO2反应,将滤液酸化,得到高锰酸钾和二氧化锰,整个过程中MnO2可以循环利用,故答案为:MnO2;(3)反应②为:3MnO42﹣+4H+=2MnO4﹣+MnO2+2H2O,反应中锰元素化合价从+6变为+7和+4;得到氧化产物为MnO4﹣,还原产物为MnO2,物质的量之比为2:1;故答案为:2:1;(4)因锰酸根和高锰酸根均具有强氧化性,盐酸中氯离子具有还原性,能被氧化,不能使用盐酸酸化,故答案为:A;(5)装置图中的电流方向可知,铁为活性电极,这里没有参与反应,做阴极故与负极相连,b做负极,a为正极,石墨电极为阳极发生氧化反应,锰酸根失电子生成高锰酸根,电极反应为:MnO42﹣﹣e﹣=MnO4﹣;根据电子得失守恒可以进行相关计算,若电解过程中收集到2.24L H2(标准状况),物质的量==0.1mol,电极反应为:2H++2e﹣=H2↑,结合电子守恒可知:2MnO4﹣~2e﹣~H2,2 10.2mol 0.1mol得到高锰酸钾质量=0.2mol×158g/mol=31.6g;故答案为:负;MnO42﹣﹣e﹣=MnO4﹣;31.6.点评:本题考查了物质制备流程分析判断,电解原理的分析应用,物质性质的理解应用和实验基本操作的掌握,工艺流程题解题的关键是要搞清楚加入什么物质,发生什么反应,如何分离等,通过分析,我们要能够将一个工艺的流程转化为物质的流程,题目难度中等.9.(17分)H2O2、NH3都是用途广泛的工业产品.I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照以下方案完成实验.实验编号反应物催化剂①10mL2%H2O2溶液无②10mL5%H2O2溶液无③10mL5%H2O2溶液1mL0.1mol•L﹣1FeCl3溶液④10mL5%H2O2溶液+少量HCl溶液1mL0.1mol•L﹣1FeCl3溶液⑤10mL5%H2O2溶液+少量NaOH溶液1mL0.1mo l•L﹣1FeCl3溶液(1)实验①和②的目的是探究浓度对反应速率的影响.(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图1能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.(3)加入0.1g MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.反应速率变化的原因是H2O2溶液的浓度逐渐减小,则H2O2的初始物质的量浓度为0.11mol/L(保留两位有效数字).Ⅱ.(1)工业上用N2和H2合成氨.已知:N2(g)+3H2(g)⇌2NH3(g)△H=﹣a kJ•mol﹣12H2O(1)⇌2H2(g)+O2(g)△H=+b kJ•mol﹣1则NH3被O2氧化为N2和H2O的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(1)△H=(2a ﹣3b)kJ•mol﹣1.(2)NH3能被H2O2氧化生成无毒气体和水.①此反应可设计原电池,在碱性条件下负极的电极反应方程式为2NH3+6OH﹣﹣6e﹣=N2+6H2O.②利用上述原电池,用惰性电极电解l00mL 0.5mol•L﹣1的CuSO4溶液,电解反应的离子方程式为2Cu2++2H2O2Cu↓+O2↑+4H+.考点:探究影响化学反应速率的因素;设计原电池.分析:I.(1)为了便于比较,应在相同的条件下利用一个变量来比较,实验①和②的浓度不同;(2)由图可知,⑤的反应速率最大,④的反应速率最小;(3)由图可知,相同时间内生成氧气越来越少,则反应速率越来越慢,与浓度有关;结合2H2O22H2O+O2↑及c=计算;II(1)①N2(g)+3H2(g)═2NH3(g)△H=﹣a kJ•mol﹣1②2H2O(1)═2H2(g)+O2(g)△H=+b kJ•mol﹣1结合盖斯定律可知②×3+①×2得到:2N2(g)+6H2O (1)=4NH3(g)+3O2(g),以此计算△H;(2)①负极是氨气失电子生成氮气;②阳极反应式为2H2O﹣4e﹣=4H++O2↑,阴极反应式为Cu2++2e﹣=Cu,总的反应式为2CuSO4+2H2O2Cu↓+O2↑+2H2SO4.解答:解:I.(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响,故答案为:探究浓度对反应速率的影响;(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知均存在催化剂,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率;(3)由图可知,相同时间内生成氧气越来越少,则反应速率越来越慢,可知反应速率变化的原因是H2O2溶液的浓度逐渐减小;n(O2)==0.0027mol,则c(H2O2)==≈0.11mol/L,故答案为:H2O2溶液的浓度逐渐减小;0.11mol/L;II.(1)①N2(g)+3H2(g)═2NH3(g)△H=﹣a kJ•mol﹣1②2H2O(1)═2H2(g)+O2(g)△H=+b kJ•mol﹣1由盖斯定律可知②×3+①×2得到:2N2(g)+6H2O (1)=4NH3(g)+3O2(g)△H=﹣(2a﹣3b)kJ•mol﹣1 ;则NH3被O2氧化为N2和H2O的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O (1)△H=(2a﹣3b)kJ•mol﹣1 ;故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O (1)△H=(2a﹣3b)kJ•mol﹣1 ;(2)①电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+6OH﹣﹣6e﹣=N2+6H2O,故答案为:2NH3+6OH﹣﹣6e﹣=N2+6H2O;①用惰性电极电解l00mL 0.5mol•L﹣1的CuSO4溶液,电解反应的离子方程式为2Cu2++2H2O2Cu↓+O2↑+4H+,故答案为:2Cu2++2H2O2Cu↓+O2↑+4H+.点评:本题考查较综合,涉及反应速率的影响因素、电解原理及应用、盖斯定律计算反应热等,综合性较强,注重高频考点的考查,把握反应原理为解答的关键,题目难度中等.10.已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业.(1)已知25℃时,几种常见弱酸的K a如下表所示:电解质H2C2O4CH3COOH HCN H2CO3电离常数(mol•L﹣1)K1=5.6×10﹣2K2=5.4×10﹣3 K1=1.7×10﹣5 K2=6.2×10﹣10K1=4.2×10﹣7K2=5.6×10﹣11①25℃时,浓度均为0.1mol•L﹣1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是Na2CO3>NaCN>CH3COONa>Na2C2O4.中和等体积、等pH的HCOOH和HCN消耗NaOH的量后者大(填“前者大”“后者大”或“相等”).②下列关于0.1mol•L‑1NaHC2O4溶液的说法正确的是ad.a.HC2O4﹣的电离程度大于水解程度,溶液显酸性b.HC2O4﹣的水解程度大于电离程度程度,溶液显碱性c.溶液中c(Na+)+c(H+)=c(HC2O4﹣)+c(OH﹣)+c(C2O42﹣)d.溶液中c(H+)=c(OH﹣)+c(C2O42﹣)﹣c(H2C2O4)(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的K sp=5.6×10﹣12,下列说法不正确的是BD.A.在t℃时,MgC2O4的K sp=8.1×10﹣5(mol•L﹣1).B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点C.图中a点对应的是MgC2O4的不饱和溶液D.在t℃时,MgC2O4(s)+2OH﹣(aq)⇌Mg(OH)2(s)+C2O42﹣(aq)平衡常数K=K sp/K sp(MgC2O4)(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:①从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置.②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃A(填“A”或“E”)处的酒精灯.。

山东省潍坊市中考化学二模试卷姓名:________ 班级:________ 成绩:________一、选择题 (共20题;共40分)1. (2分) (2018九上·定州期中) 生活中的下列现象属于化学变化的是()A . 矿石粉碎B . 冰雪融化C . 酒精燃烧D . 汽油挥发【考点】2. (2分) (2015八上·丹东期末) 在地壳中含量最多的元素是()A . OB . SiC . AlD . Fe【考点】3. (2分) (2020九上·朝阳期末) 化学与生活息息相关,下列说法错误的是()A . 家用电器着火,立即用水浇灭B . 炒菜时油锅着火,应立即盖上锅盖C . “钻木取火”的原理是通过摩擦生热使温度达到木材着火点D . 燃气灶火焰出现黄色,锅底出现黑色时,可增大灶具进风口【考点】4. (2分) (2017九上·兴义期中) 地球是我们赖以生存的美丽家园,我们每一个人都应该珍惜、爱护、保护她.下列人类的生产和生活活动会给地球造成影响的是()①工业“三废”的任意排放;②提倡使用农家肥、合理使用农药、化肥;③合理使用化石燃料、减少硫、氮氧化物的排放;④提倡栽花种草、植树造林、增大绿地面积;⑤回收废旧电池和塑料制品垃圾;⑥立法立规严禁焚烧秸杆和露天焚烧垃圾;⑦提倡使用清洁能源、大力发展风能、水能、太阳能;⑧生活污水随意排放.A . ①②③④B . ①⑧C . ②③④⑤⑥⑦D . ⑤⑥⑦⑧【考点】5. (2分)少数同学在饮食上有偏食、挑食的坏习惯.医学专家建议青少年应该多吃绿色蔬菜、粗粮等食物以维持营养平衡.蔬菜相对于其他食物来说,其中含相对丰富的营养物质是()A . 维生素B . 淀粉C . 油脂D . 蛋白质【考点】6. (2分)(2017·北塔模拟) NH4Cl、(NH4)2SO4、NH4NO3、尿素都是白色固体,也是重要的氮肥。
下列物质能将尿素从这四种化肥中鉴别出来的是()A . 稀盐酸B . 水C . 熟石灰D . 氯化钠【考点】7. (2分) (2015九上·旬阳期中) 下列各图中“○”和“●”分别表示两种质子数不同的原子,其中能表示由两种单质组成的混合物的图是()A .B .C .D .【考点】8. (2分) (2019九上·孝南期中) 下列化学用语中对数字“3”的意义的描述正确的是()①Fe3+②3C60③ ④A . 表示分子个数的是②B . 表示离子所带电荷数的是③C . 表示核外电子数的是④D . 表示元素化合价的是①【考点】9. (2分)下列符号表示正确的是A . 2个氮分子:2NB . 2个碳酸根离子:2CO32-C . 氧化铝元素的化合价:D . 4个氢原子:2H2【考点】10. (2分)(2012·梧州) 尿素〔CO(NH2)2〕能促使农作物的茎、叶生长茂盛,叶色浓绿.尿素属于()A . 氮肥B . 钾肥C . 磷肥D . 复合肥料【考点】11. (2分)(2016·江西模拟) 下列紧急情况的处理方法正确的是()A . 高楼着火,直接从五楼跳下B . 煤气泄漏,立即开灯检查C . 图书着火用二氧化碳灭火器扑灭D . 稀硫酸溅到皮肤上,立即用大量的水冲洗,再涂上稀氢氧化钠溶液【考点】12. (2分)钯元素在元素周期表中的信息如右图所示,下列说法错误的是()A . 钯元素的原子序数为46B . 钯元素的相对原子质量为106.4C . 钯元素属于非金属元素D . 钯元素符号为Pd【考点】13. (2分)下列实验操作正确是()A . 熄灭酒精灯B . 塞紧橡皮塞C . 测定溶液的pHD . 将固体粉末装入试管【考点】14. (2分)取一滤纸条,等间距10滴紫色石蕊试液,然后装入玻璃管中(如图所示),两端管口同时放入分别蘸有浓氨水和浓盐酸的棉球,几秒后观察到图示现象.下列说法不正确的是()A . 氨水的pH大于7B . 酸、碱能使酸碱指示剂显示不同颜色C . 氨分子和氯化氢分子在不断运动D . 所有分子的运动速率都相等【考点】15. (2分)某同学用托盘天平称量固体物质时,误将砝码放在左盘,被称量物放在了右盘.结果读出固体质量为4.3克(1克以下用游码).固体物质的实际质量为()A . 4.3克B . 4.6克C . 4克D . 3.7克【考点】16. (2分)验证氧气、二氧化碳、一氧化碳的下列操作方法中,错误的是()A . 用带火星木条检验氧气B . 用澄清石灰水检验二氧化碳C . 用紫色石蕊试液检验二氧化碳D . 用氧化铜和澄清石灰水检验一氧化碳【考点】17. (2分)(2018·洪湖模拟) 要将一瓶接近饱和的石灰水变成饱和溶液,小明选择了如下方法,其中可行的是()①加入CaO;②加入Ca(OH)2 ;③升高温度;④降低温度A . ②③B . ②④C . ①②④D . ①②③【考点】18. (2分)下列4个图象能正确反映对应变化关系的是()A B C D向一定量NaOH溶液中加水向一定量不饱和KNO3溶液中逐渐加入KNO3固体向一定量澄清石灰水中加入Na2CO3溶液向等质量的Mg、MgO中加入稀盐酸A . AB . BC . CD . D【考点】19. (2分) (2018九上·鄂城期末) 某气体由H2、CO2、CO、CH4中的两种组成,为确定其成分进行了如下的实验:(1)将气体通过澄清的石灰水,未出现浑浊现象(2)将气体通过灼热的氧化铜,有红色的固体生成(3)将气体点燃后通入澄清的石灰水,有现浑浊现象。

2015年中考二模理化综合 化学试题可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 P 31 S 32Cl 35.5 K 39 Ca 40 Fe 56 Cu 64 Zn 65 Ag 108 Ba 137一、单项选择题(本大题包括11小题,每小题2分,共22分。
只有一个选项最符合题目的要求)1.成语是中华民族智慧的结晶。
以下成语所描述的变化中涉及化学变化的是A .火上浇油B .木已成舟C .聚沙成塔D . 滴水成冰2. 建设美丽泉城,优化生活环境。
下列做法中,不符合...这一主题的是A .爱护花草树木B .随意排放废水C .分类回收垃圾D .绿色低碳出行3. 化学是一门以实验为基础的科学,许多化学重大发现和研究成果都是通过实验得到的。
下列实验操作中,符合操作规范的是A .在实验室用100ml 量筒准确量取8.5ml 盐酸B .测定溶液的pH 时,将试纸插入待测液中C .稀释浓硫酸时,将水倒入盛浓硫酸的烧杯中D .点燃氢气前,一定要先检验氢气的纯度4.“关爱生命,拥抱健康”是永恒的主题。
下列做法不利于...人体健康的是 A. 干冰可用作制冷剂 B. 用甲醛溶液浸泡海产品,以防其变质C. 焙制糕点时加入小苏打作发酵粉D. 向易变质食品的包装袋中充入氮气5.根据右图提供的信息进行判断,下列说法中,错误..的是 A .该粒子核外有18个电子 B .该粒子属于非金属元素C .该粒子是带正电的阳离子D .该粒子核外有三个电子层6.形成化学观念是化学学习的任务之.下列说法中,错误的...是 A .pH=0的溶液一定是中性溶液 B .元素周期表中原子序数等于该元素原子核内的质子数C .化学变化的过程中常会伴随能量变化D .复分解反应前后各元素的化合价均未发生变化7.为了减少温室气体排放,人们积极寻找不含碳元素的燃料。
经研究发现NH 3燃烧的产物没有污染,且释放大量能量,有一定应用前景。

2014-2015学年第二学期九年级第二次模拟测试化学试卷(满分:100分;时间:100分钟)2015.5 可能用到的相对原子质量:C-12 H-1 O-16 Fe-56 Cu-64 Ca-40 Na-23N-14 S-32 Mg-24 Zn-65 Cl-35.5第Ⅰ卷(选择题,共40分)一、选择题(本题共15小题,每小题只有一个选项符合题意,每小题2分,共30分)1.能源问题、环境问题成为全国两会代表们关注的焦点之一,尤其是全国很多地区出现了严重的雾霾天气,给人们的生产、生活和健康带来了严重的影响。
下列有关说法错误的是( )A.计入空气污染指数的指标包括PM2.5微颗粒物B.禁止私家车出行,改乘公交车或骑自行车等C.减少化石燃料的使用,尽可能多地开发利用太阳能、风能、地热等D.废旧电池不能随意丢弃,应统一回收集中处理,以减少污染,同时可以回收金属资源2.下列发生化学变化的是( )A.将石油进行分馏B.用海水晒盐C.切割大理石作建筑材料D.用乙醇汽油作燃料驱动汽车5.建立宏观与微观的联系是化学特有的思维方式。
下列对于宏观现象的微观解释中,错误的是()A.水通直流电分解,是因为水分子被破坏,形成新的分子B.“酒香不怕巷子深”,说明了分子在不断运动C.20mL水与20mL酒精混合后体积小于40mL,是因为水分子的体积减少D.一氧化碳和二氧化碳具有不同的化学性质,是因为构成它们的分子不同6.核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生氙、锶等原子及一些粒子和射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电。
锶元素在元素周期表中显示的信息和粒子结构示意图如图所示。
以下表述中正确的是( )A.图2、图3都属于锶元素321B .图3所表示粒子的化学符号是Sr C .锶原子的中子数为38D .锶原子的相对原子质量是87.62g7.扑灭用电设备发生的火灾,来不及切断电源时,可用装有液态四氯化碳的“灭火弹”, 灭火时,液态四氯化碳迅速转化为气态并覆盖在火焰上。
2015年山东省潍坊市奎文区中考化学二模试卷一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意)1.(2分)下列物质的用途与其物理性质有关的是()A.用生石灰作某些食品的干燥剂B.白炽灯泡里涂上红磷作脱氧剂C.用稀硫酸除铁锈D.用钨作灯泡中的灯丝2.(2分)请根据所学化学知识,判断下列叙述中正确的是()A.太阳能电池是化学能转变为电能的一种装置B.当室内发生火灾时,应迅速开启门窗通风C.香烟的过滤嘴可滤出一些有害物质,故吸烟对人体无害D.用食醋可除去热水瓶内的水垢3.(2分)下列属于我国塑料包装制品回收标志的是()A.B.C.D.4.(2分)物质都是由微粒构成的,下列物质由分子构成的是()A.干冰B.碳酸钠C.金刚石D.铜5.(2分)如图所示的实验操作中,正确的是()A.细铁丝燃烧B.稀释浓硫酸C.倾倒液体D.点燃酒精灯6.(2分)用“”和“”表示不同元素的原子,下列微观示意图能表示化合物的是()A.B.C.D.7.(2分)下列实验现象的描述正确的是()A.蜡烛在空气中燃烧生成二氧化碳和水B.硫在空气中燃烧,发出明亮的蓝紫色火焰C.红磷在空气中燃烧产生大量白色烟雾D.铁丝在氧气中燃烧,火星四射,生成黑色固体,放出大量的热8.(2分)国家质检局公布目前在某些饮用水中含有高浓度的致癌物﹣﹣溴酸盐,是矿泉水或山泉水等天然水源在经过臭氧消毒后生成的副产品.如图是溴(Br)原子的结构示意图,下列说法正确的是()A.图中所涉及的元素为第三周期的元素B.溴元素的化学性质与氯元素的化学性质相同C.溴离子的符号为Br﹣D.溴化镁的化学式为MgBr9.(2分)下列各组物质的化学名称、俗名、化学式三者相符的是()A.氢氧化钠纯碱NaOHB.氢氧化钙消石灰Ca(OH)2C.硫酸铜胆矾CuSO4D.乙醇酒精CH3COOH10.(2分)下列有关金属和合金的说法,错误的是()A.金属大多呈银白色且有良好的导电性和延展性B.合金的很多性能与组成它们的纯金属不同C.青铜器表面的绿色物质主要成分是【Cu2(OH)2CO3】,可推测铜生锈是铜与水、氧气共同作用的结果D.铝在空气中表面生成致密的氧化铝薄膜,使铝具有很好的抗腐蚀性能二、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意11.(2分)下列各组物质的溶液,不另加试剂无法一一鉴别的是()A.NaOH HCl CuSO4MgSO4B.Na2CO3K2SO4BaCl2HClC.KNO3HCl CaCl2NaOHD.NH4NO3H2SO4NaOH MgCl212.(2分)下列实验方案中,不能达到实验目的是()A.A B.B C.C D.D13.(2分)绿茶中的单宁酸具有抑制血压上升、清热解毒、抗癌等功效,其化学式为C76H52O46,下列说法不正确的是()A.单宁酸由碳、氢、氧三种元素组成,属于有机物B.一个单宁酸分子由76个碳原子、52个氢原子和46个氧原子构成C.单宁酸中碳元素的质量分数是53.6%D.一个单宁酸分子中含26个氢分子14.(2分)如图所示,在等臂杠杆的两端各系一只等质量等体积的铁球,这时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,下列说法正确的是()A.左边烧杯中溶液质量减少B.右边烧杯中溶液的质量增加C.杠杆仍保持平衡D.杠杆向右倾斜15.(2分)密闭容器内含有4种物质,在一定条件下充分反应测得反应前后各物质的质量如下表所示:已知A与C的相对分子质量之比为197:158,下列推理正确的是()物质A B C D 反应前的质量/g19.78.731.60.4反应后的质量/g待测17.40 3.6 A.A、B是反应物,C、D是生成物B.反应过程中,B与D变化的质量之比为87:43C.反应后密闭容器中A的质量为19.7gD.反应中A与C的化学计量数之比为1:216.(2分)下列类推正确的是()A.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐B.置换反应一定有单质生成,所以有单质生成的反应一定是置换反应C.燃烧一般都伴随发光、放热现象,所以有发光、放热的现象就是燃烧D.根据溶解度曲线图,判断从溶液中获得晶体的方法17.(2分)某无色混合气体可能由CH4、H2、CO、CO2和HCl中的某几种气体组成。
2014学年第二学期期中质量检测初三化学试卷(理化完卷时间100分钟,满分150分) 2015年4月可能用到的相对原子质量:H-1; C-12; O-16;Na-23;Cl-35.5; 六、选择题(每小题只有一个正确选项,共20分) 27.有化学变化发生的是A .铁杵磨成针B .积土成山C .火烧赤壁D .凿壁偷光 28.属于纯净物的是A .煤B .石油C . 石灰水D .干冰 29.属于酸性氧化物的是A .H 2CO 3B .P 2O 5C .O 2D .NaCl 30.物质的俗名与化学式相对应正确的是A .胆矾—CuSO 4B .纯碱—NaOHC .烧碱—Na 2CO 3D .熟石灰—Ca(OH)2 31.氯化铵(NH 4Cl )中氮元素的化合价是A .+3B .﹣3C .﹣5D .+5 32.古代“银针验毒”的原理是:4Ag+2H 2S+O 2→2X+2H 2O ,X 的化学式为 A .AgS B .Ag 2O C .Ag 2S D .Ag 2O 2 33.有关氧元素单质的说法错误的是A .O 2能供给呼吸B .O 2和O 3互称为氧元素的同素异形体C .O 2与O 3的相互转化是物理变化D .O 3中氧元素是以游离态存在的 34.化学方程式书写正确的是A .Cu+FeSO 4→Fe+ CuSO 4B .Fe + H 2SO 4 → FeSO 4 + H 2↑C .Fe + 2AgCl →2Ag + FeCl 2D .4Fe + 3O 2−−−→点燃2Fe 2O 3 35.属于复分解反应的是A .2H 2 + O 2 −−→−点燃 2H 2O B .CO+CuO −−→−加热Cu+CO 2 C .2 KClO 3 −−→−加热2KCl + 3O 2↑ D .Mg(OH)2+ H 2SO 4−→− MgSO 4 + 2H 2O 36.高炉炼铁的原理:3CO + Fe 2O 3−−→−高温2Fe +3CO 2,其中发生氧化反应的物质是 A .CO B .Fe 2O 3 C .Fe D .CO 2 37.关于水的说法错误的是A .水是一种常见的溶剂B .明矾可促进水中悬浮杂质的沉降C .过滤能除去天然水中所有的杂质D .自来水生产中通入Cl 2起到杀菌消毒作用 38.下列物质溶于水能形成溶液的是A .牛奶B .植物油C .食盐D .碳酸钙粉末 39.有关物质燃烧的描述错误的是 A .镁条在空气中燃烧发出耀眼白光B .硫在氧气中燃烧火焰呈蓝紫色C .纯净的氢气在空气中可以安静地燃烧,火焰呈淡蓝色D .铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 40.可用于鉴别稀硫酸和稀盐酸的是A .AgNO 3溶液B .紫色石蕊试液C .Na 2CO 3溶液D .BaCl 2溶液41.已知表示不同元素的原子,两物质发生化学反应的微观示意图如下则有关说法正确的是A .反应物中共有4种原子B .该反应属于置换反应C .该反应可能是CH 4+Cl 2→CH 3Cl+HClD .该反应中涉及了3种物质 42. 常温下,在两个各盛有100mL 水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,并恢复到原温度,结果如下图所示。
山东省潍坊市2015年高考化学二模试卷一、选择题(每小题5分,每小题只有一个选项符合题意)2.(5分)(2015•潍坊二模)X、Y、Z、W是原子序数依次增大的四种短周期元素,X的最高价氧化物对应的水化物的化学式为H2XO3,Y的最外层电子数是电子层数的3倍,Z是地壳中含量最高的金属元素,W的一种核素的质量数为28,中子数为14.下列说法正确的是6.(5分)(2015•潍坊二模)某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如图原电池,盐桥中装有饱和溶液.下列说法正确的是()2)子的水解程度会增大,所以8.(17分)(2015•潍坊二模)碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:2CO(g)+2NO(g)⇌2CO2(g)+N2(g)△H=﹣748kJ•mol﹣12CO(g)+O2(g)═2CO2(g)△H2=﹣565kJ•mol﹣1(1)在一定条件下N2和O2会转化为NO气体,写出反应的热化学方程式N2(g)+O2(g)═2NO(g)△H=+183KJ/mol.(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO 和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v (NO)=7.5×10﹣3mol•L﹣1•min﹣1,则平衡后n(CO)=0.25mol,关于该平衡的下列说法正确的是bce.a.增大压强,平衡一定向右移动b.其它条件不变,升高温度,化学反应速率一定增大c.其它条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大d.向平衡后的容器中再充人0.2mol NO和0.1mol CO,化学平衡常数增大e.达到平衡后v正(NO)=2v逆(N2)(3)其它条件相同,tmin时不同温度下测得NO的转化率如图所示.A点的反应速率v正>v逆(填“>”“<”或“=“),A、B两点反应的平衡常数较大的是A(填“A”或“B“).(4)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,试分析原因:NO2﹣水解显碱性,对铵根离子水解起到促进作用.0.1mol•L﹣1NH4NO3溶液中离子浓度由大到小的顺序是c(NO3)>c(NH4)>c(H+)>c(OH﹣),常温下NO2﹣水解反应的平衡常数Kh= 1.4×1011mol•L1(保留两位有效数字).(已知的电离常数Ka=7.1×10﹣4mol•L﹣1,NH3•H2O的电离常数=1.7×10﹣5mol•L﹣1.Kh=Kh=×=(1)共生工程可以促进化学工业的发展,并改善环境.①下列有关环境问题的说法错误的是b(填序号字母).a.空气中SO2浓度过高会加重呼吸系统和心脑血管疾病b.SO2、NOx、CO2的大量排放都会造成酸雨c.氮的氧化物和碳氢化合物大量排放可能引发光化学烟雾d.“静电除尘”、“燃煤固硫”、“低碳经济”都能改善空气质量②发电厂产生的SO2尾气中的可直接用氨水吸收,变废为宝.若用15L 2.0mol•L﹣1氨水充分吸收4480L含10%的SO2硫酸尾气(气体体积已折算成标准状况).充分反应后吸收液中的溶质为(NH4)2SO3和NH4HSO3.③利用发电厂产生的SO2制成以水为电解质的SO2质子交换膜燃料电池,该电池电动势为1.06V.电池工作时负极反应式为SO2+2H2O﹣2e﹣=SO42﹣+4H+.(2)将发电厂产生的SO2通入含有Na2S、Na2CO3的废液中可制得Na2S2O3•5H2O,过程中的现象是:通了一段时间后,产生气体并析出沉淀,沉淀量逐渐增多;沉淀量逐渐减少并形成清液;停止通SO2,过滤后母液经蒸发浓缩,冷却得Na2S2O•5H2O晶体(提示:S+SO32 2﹣).上述过程中析出沉淀时发生的氧化还原反应的化学方程式为:﹣=S2O32H2S+SO2=3S↓+2H2O.调节废液中Na2S和Na2CO3的物质的量之比为2:1,时可以恰好完全反应生成Na2S2O3.5H2O.=应用.(1)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl﹣和SO42﹣等杂质,提纯工艺线路如图1:碳酸钠的饱和溶液在不同温度下析出的溶质如图2所示请回答下列问题:①试剂A 是 氢氧化钠溶液 ,“母液”中除了含有Na +、CO 32﹣、OH ﹣离子外,还含有 Cl ﹣、SO 42﹣ 等离子,过滤要“趁热”的目的是 提高Na 2CO 3•10H 20晶体的含量 .②检验试剂级Na 2CO 3中Cl ﹣和SO 42﹣是否除尽,选用的试剂及加入的先后次序是 c (填序号).a .HCl 、BaCl 2、AgNO 3b .AgNO 3、HNO 3、Ba (NO 3)2c .HNO 3、Ba (NO 3)2、AgNO 3d .AgNO 3、HCl 、BaCl 2(2)“侯氏制碱法”的原理:NaCl+NH 3+CO 2+H 2O ═NaHCO 3↓+NH 4Cl图3是某兴趣小组在实验室中模拟“侯氏制碱法”制取所用到的主要装置. 请回答下列问题:①各仪器口的链接顺序为a 接 e , f 接 d , c 接b ,实验时先向饱和NaCl 溶液中通人较多的,再通人足量的CO 2,其原因是 a (填写序号字母).a .使CO 2更易被吸收b .NH 3比CO 2更易制取c .CO 2的密度比NH 3大②将生成的NaHCO 3晶体从混合物中分离出来需要的玻璃仪器是 烧杯、玻璃棒、漏斗 . ③该兴趣小组用图4比较C 、N 、Si 三种元素的非金属性强弱,B 中的试剂是 饱和碳酸氢钠溶液 ,能说明碳的非金属性比硅强的实验现象是 C 中生成白色胶状物 .(H 2SiO 3是11.(12分)(2015•潍坊二模)氢、碳、氮都是重要的非金属元素,它们单质及其化合物在科学研究和工业生产中有重要的应用.(1)下列微粒基态的电子排布中未成对电子数最多的是d(填序号)a.O、b.N c.Cu d.Cr e.C(2)含氮配合物W的结构如图1所示(配位键未标出方向),请在结构图中用“→”标出W中所存在的所有配位键的方向.(3)C、H元素形成的某有机化合物分子中共有16个电子,该分子中σ键与π键的个数比为5:1;该有机化合物在一定条件下形成的聚合物中C原子采取sp3杂化.(4)N和Cu元素形成的化合物的晶胞结构如图2所示,则该化合物的化学式为Cu3N.该化合物的相对分子质量为M,N A为阿伏加德罗常数.若该晶胞的边长为a pm,则该晶体的密度是g.pm﹣3.子指向含有空轨道的原子,该配合物中配位键为,故答案为:;==故答案为:.。
2015潍城二模化学试题注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
全卷满分为100分,考试时间为90分钟。
2.答题前务必将将试题密封线内及答题卡上面的项目填涂清楚。
3.所有答案必须涂、填写在答题卡上相应位置,答在本试卷上一律无效。
可能用到的相对原子质量: H 12 C 12 O 16 Na 23 Cl 35.5 Fe 56第Ⅰ卷(选择题共40分)一、选择题 (本题包括20小题,每小题2分,共40分。
每小题只有一个选项符合题意)1.下列变化中,属于化学变化的是A.干冰升华 B.白磷自燃 C.试管破碎 D.海水晒盐2.豆类、动物肝脏中含有丰富的铁和锌,这里的“铁”、“锌”是指A.原子B.分子C.元素D.单质3. 2014年青奥会的吉祥物“砳砳”以雨花石为创意原型.雨花石的主要成分SiO2属于A.氧化物B.酸C.碱D.盐..D5. 下列化肥属于复合肥料的是A.氯化钾B.硝酸钾 C.氨水(NH3·H2O) D.碳酸氢铵6. 下列物质在氧气中燃烧,火星四射,生成黑色固体的是A.木炭B.镁条C.红磷D.铁丝7.下列实验操作中错误的是A.蒸发结晶B.稀释浓硫酸C.滴管用后不洗插回原瓶D.用力塞紧橡皮塞8.纪录片《穹顶之下》再次引起人们对大气环境的强烈关注.下列燃料中最环保的是A.石油B.煤C.氢气D.天然气9.下列关于生产、生活和能源中的化学知识不正确的是A.右图是“节能减排”中的节能标志B.安装煤炭“固硫”装置,可降低酸雨发生率C.推广农作物的生物防治技术,减少农药的使用D.加快化石燃料的开采与使用10.如下图所示,实验室模拟粉尘爆炸试验。
连接好装置,在小塑料瓶中放入下列干燥的粉末,点燃蜡烛,快速鼓入大量的空气,肯定观察不到爆炸现象的是A.镁粉B.面粉C.煤粉D.大理石粉11. 化学知识在生产和生活中有着重要的应用,下列说法中不正确的是A.鼓励使用太阳能、风能等清洁能源能减少PM2.5的污染B.明矾可使水中悬浮小颗粒快速沉降,也可用于自来水的消毒杀菌C.发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔D.纯碱也叫苏打,可用于清洗厨房用具的油污12.下图分别是铝元素、氯元素的原子结构示意图。
2015潍城二模化学试题注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
全卷满分为100分,考试时间为90分钟。
2.答题前务必将将试题密封线内及答题卡上面的项目填涂清楚。
3.所有答案必须涂、填写在答题卡上相应位置,答在本试卷上一律无效。
可能用到的相对原子质量: H 12 C 12 O 16 Na 23 Cl 35.5 Fe 56第Ⅰ卷(选择题共40分)一、选择题 (本题包括20小题,每小题2分,共40分。
每小题只有一个选项符合题意)1.下列变化中,属于化学变化的是A.干冰升华 B.白磷自燃 C.试管破碎 D.海水晒盐2.豆类、动物肝脏中含有丰富的铁和锌,这里的“铁”、“锌”是指A.原子B.分子C.元素D.单质3. 2014年青奥会的吉祥物“砳砳”以雨花石为创意原型.雨花石的主要成分SiO2属于A.氧化物B.酸C.碱D.盐..D5. 下列化肥属于复合肥料的是A.氯化钾B.硝酸钾 C.氨水(NH3·H2O) D.碳酸氢铵6. 下列物质在氧气中燃烧,火星四射,生成黑色固体的是A.木炭B.镁条C.红磷D.铁丝7.下列实验操作中错误的是A.蒸发结晶B.稀释浓硫酸C.滴管用后不洗插回原瓶D.用力塞紧橡皮塞8.纪录片《穹顶之下》再次引起人们对大气环境的强烈关注.下列燃料中最环保的是A.石油B.煤C.氢气D.天然气9.下列关于生产、生活和能源中的化学知识不正确的是A.右图是“节能减排”中的节能标志B.安装煤炭“固硫”装置,可降低酸雨发生率C.推广农作物的生物防治技术,减少农药的使用D.加快化石燃料的开采与使用10.如下图所示,实验室模拟粉尘爆炸试验。
连接好装置,在小塑料瓶中放入下列干燥的粉末,点燃蜡烛,快速鼓入大量的空气,肯定观察不到爆炸现象的是A.镁粉B.面粉C.煤粉D.大理石粉11. 化学知识在生产和生活中有着重要的应用,下列说法中不正确的是A.鼓励使用太阳能、风能等清洁能源能减少PM2.5的污染B.明矾可使水中悬浮小颗粒快速沉降,也可用于自来水的消毒杀菌C.发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔D.纯碱也叫苏打,可用于清洗厨房用具的油污12.下图分别是铝元素、氯元素的原子结构示意图。
下列叙述正确的是A.铝原子第一电子层有3个电子B.氯原子核内有17个质子C.氯原子在化学反应中容易失去电子D.铝原子核带13个单位负电荷13.下列化学用语表示离子的是-④⑤2Mg+①H2O2②Ar ③SO24A.①②B.③④C.②④D.③⑤14. 镁铝合金质优体轻,又不易锈蚀,被大量用于航空工业、造船工业、日用化工等领域。
下列关于镁铝合金性质的叙述中,正确的是A.此合金的熔点比镁和铝的熔点都高B.此合金能全部溶解于稀盐酸中C.此合金属于镁和铝的化合物D.此合金的硬度比镁和铝的硬度都小15. 金属R与稀硫酸反应的化学方程式为R+H2SO4=RSO4+H2↑,下列说法错误的是A.该反应是置换反应B.金属R可能是镁C.反应过程中溶液的酸性不变D.该反应前后R的化合价发生了改变16. 盐场晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,它们的溶解度曲线如图所示。
下列说法正确的是A.MgSO4的溶解度始终随温度的升高而减小B.t1℃时,KCl和MgSO4两溶液所含溶质的质量一定相等C.t2℃时,100g MgCl2的饱和溶液中含有ag MgCl2D.将t2℃时的MgSO4饱和溶液降温到t1℃,溶液的变化是:饱和→不饱和→饱和17用如图所示装置进行实验,实验现象对应的结论正确的是18. 下列图像能正确反映其对应操作中各量变化关系的是①②③④A.①向稀盐酸中不断加水B. ②等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应C.③向一定温度下的饱和氢氧化钙溶液中加入氧化钙固体D.④分别向等质量的铝和铁中加入溶质质量分数相同的稀盐酸至过量19. 下列变化不能一步实现的是A.CO2→CO B.Fe2O3→FeCl2C.Cu→Cu(NO3)2 D.Na2CO3→NaNO320. 为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是第Ⅱ卷(非选择题60分)注意:必须用黑色钢笔、签字笔答题,答案写到答题卷的指定位置。
二、本题包括4小题(共34分)21.(9分)化学是造福人类的科学,请用所学过的化学知识解答下列问题。
(1)打开汽水瓶盖时,汽水会自动喷出来,这说明气体在水中的溶解度与_______有关。
喝了汽水以后,常常会打嗝,这说明气体的溶解度还与_______有关。
(2)吸烟有害健康。
香烟烟气中含有几百种对人体有害的物质,如尼古丁、焦油、一氧化碳等,其中与血红蛋白结合能力强的有毒气体是_______。
(3)化肥的使用大幅度提高了粮食产量。
如(NH4)2SO4是一种肥(填“氮”、“磷”或“钾”),(NH4)2SO4属于(填“酸、碱、盐”)。
(4)防毒面具中使用活性炭,这是利用了活性炭的作用。
(5)“双吸剂”主要成分是还原铁粉,可延长食品保质期,因为铁粉可与H2O和反应。
将完全变质的“双吸剂”放入盐酸中,写出反应的化学方程式。
22.(8分)不同类别的物质间存在着一定的关系,如下图几个图所示。
(“—”表示相连的两种物质能发生反应,“→”表示某种物质可转化为另一种物质。
)(1)碳酸钠溶液、氢氧化钠溶液和稀盐酸之间的变化关系Array如右图所示,回答下列问题:①乙物质是。
②写出“乙→丙”的化学方式。
(2)下图能体现某些物质间变化关系的是。
(填字母序号)A B(3)若上述A图中的金属是Fe,则该图中的氧化物的化学式为_____________,请写出该金属转化为氧化物的反应的化学方程式____________________________。
23.(8分)铁、铝、铜及其化合物在生产、生活中有着广泛的应用。
请回答下列问题:(1)氢氧化铝是医用的胃酸中和剂的一种。
用化学方程式表示其作用机理是。
(2)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是(填字母序号)。
(3)铁在潮湿的环境下易生锈,铜表面也容易生成绿色铜绿,铜锈的主要成分是碱式碳酸铜,化学式为[Cu2(OH)2CO3],其组成元素有_________种。
向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色溶液,从蓝色溶液中回收铜的过程如下:①操作a的名称是_________。
②证明B过量方法是_____________________________________________。
③蓝色溶液加入过量铁粉发生反应的化学方程式为___________________。
24.(9分)电石是一种重要的化工原料,极易与水反应:CaC2+2H2O=Ca(OH)2+X↑。
(1)将电石长期露置于空气中,会发生下列变化:水灰浆→残渣电石(CaC)−−→题干中电石与水反应后所得的气体X的化学式是_______,残渣中的主要成分是Ca(OH)2和_______(写名称)。
(2)工业上利用电石制备某化工原料的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):①向CaCl2溶液中通人NH3、CO2两种气体,生成CaCO3的化学方程式为_______。
②流程中溶液A可循环使用,溶液A中的主要成分的化学式是_______。
③实验室中对过滤所得的固体进行洗涤在_______中进行,加洗涤剂时以浸没固体的量为宜。
(3)检验沉淀洗涤干净的方法:取最后一次洗涤液少量置于试管中滴加试剂硝酸银溶液,若观察到_______,则证明洗涤干净。
(4)电石应该_______保存。
三、本题包括2小题(共18分)A B C D E F G 【碱石灰是氢氧化钠和氧化钙的混合物】(1) 写出图中标有字母的仪器的名称:a为____ ___。
(2)分别写出实验室用A装置制取氧气和二氧化碳的化学反应方程式、。
(3) 氨气是一种无色、有刺激性气味的气体,极易溶于水,氨水显碱性。
实验室用加热氯化铵和熟石灰两种固体的混合物来制取氨气,实验室制取、干燥、收集氨气的装置应分别选用(填序号)、、。
26.煤、石油和天然气等化石燃料是目前人类使用的最主要燃料,也是重要的化工原料。
(1)石油中主要含有_______(填写元素符号)两种元素;天然气的主要成分是_______(填写化学式)。
(2) 工业上,煤炭燃烧前进行粉碎的目的是_______。
(3)煤隔绝空气加强热得到的焦炭是冶铁的重要原料。
为了测定某赤铁矿中氧化铁的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不与水发生反应)。
方案I 取8.00 g赤铁矿粉,加入足量稀硫酸,完全反应后过滤,得到1.60 g滤渣。
则赤铁矿粉中氧化铁的质量分数为_______。
方案Ⅱ如下图所示,取8.00 g赤铁矿粉与过量的焦炭粉混合后加强热,充分反应。
测得氢氧化钠溶液反应前后质量增加了1.32 g。
如果产生的二氧化碳被氢氧化钠溶液完全吸收,根据所学反应3C+2Fe2O3△4Fe+3CO2↑计算,赤铁矿粉中氧化铁的质量分数为_______。
浓硫酸碱石灰【实验反思】方案Ⅱ中硬质玻璃管内原有的空气对实验结果有影响,这会导致测出的氧化铁的质量分数_______(填“偏大”“偏小”或“不变”)。
【实验分析】方案I测出的氧化铁的质量分数明显大于方案Ⅱ测出的结果,可能的原因是_______(写出一种即可)。
四、本题包括1小题(共8分)27. 实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液的溶质质量分数,在烧杯中配制了8g 10%的氢氧化钠溶液,然后往烧杯中滴加该盐酸,反应过程中溶液的pH与滴入盐酸的质量关系如下图所示。
请回答下列问题:(1)配制8 g 10%的氢氧化钠溶液,需要水的质量为_______g。
(2)计算该盐酸的溶质质量分数(写出计算过程)。
(3)当滴入4g盐酸时,烧杯内溶液中钠元素的质量为_______g。
2015潍城二模化学试题21.(化学方程式每个2分,其余每空1分,共9分)(1)气压 温度 (2)一氧化碳 (3)氮 盐 (4)吸附 (5)氧气 Fe 2O 3+6HCl=2FeCl 3+3H 2O 22.(8分)(1)①NaOH(或Na 2CO 3) (1分)②2NaOH+CO 2=Na 2CO 3+H 2O[Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH](2分) (2)ABC (2分)(3)Fe 3O 4(或Fe 2O 3)(1分) 3Fe+O 2点燃===Fe 3O 4(2分)23.(8分)(1)Al(OH)3+3HCl=AlCl 3+3H 2O (2分) (2)B (2分) (3)①过滤(1分)②取滤液少量于试管中,向试管中加入少量锌粒,有气体产生,则证明B 过量(1分) ③Fe+H 2SO 4=FeSO 4+Cu (1分) Fe+CuSO 4=FeSO 4+Cu (1分) 24.(9分)(1)C 2H 2 (1分) 碳酸钙(1分)(2)①CaCl 2+2NH 3+CO 2+H 2O =CaCO 3↓+2NH 4Cl (2分) ②NH 4Cl (2分) ③过滤器(1分) (3)无明显现象(1分) (4)密封(1分)25.(化学方程式每个2分,其余每空1分,共8分) (1)长颈漏斗(2)2H 2O 22MnO ===2H 2O+O 2↑ CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑ (3)B D G26.(10分)(1)C 、H(1分) CH 4 (1分) (2)增大煤与空气(或氧气)的接触面积(1分) (3)方案I 80%(2分) 方案Ⅱ 40%(2分) 【实验反思】偏大(1分)【实验分析】方案Ⅱ生成的二氧化碳与过量的碳反应生成一氧化碳,不能被氢氧化钠溶液吸收(或生成的二氧化碳不能全部被氢氧化钠溶液吸收)(答案合理即可)(2分)27.(8分)解:(1)7.2g …………………………………………………… (2分)(2)设盐酸中溶质的质量为 xNaOH + HCl = NaCl + H 2O …………(1分) 40 36.58g ×10% x ……………………………………………(1分)xg %1085.3640⨯= x=0.73g ………………………………(1分)该盐酸的溶质质量分数:%1001073.0⨯gg=7.3%…………(1分) (3)0.46g ……………………………………………………(2分)。