同素异形体与同分异构体(新)PPT课件
- 格式:ppt
- 大小:1.28 MB
- 文档页数:12




同分异构体同位素同素异形体同分异构体同分异构体指的是化学式相同、结构不同的分子。
它们具有相同的分子式,但它们的原子排列方式不同,因此具有不同的物理和化学性质。
例如,乙醇和甲基乙醇都是C2H6O,但它们的结构不同,因此具有不同的物理和化学性质。
1.分类根据其结构特点可将其分为以下几类:(1)顺反异构体:顺反异构体是指在空间中两个取代基围绕单个碳原子旋转所形成的异构体。
其中一种顺式异构体中两个取代基在空间中位于相邻位置,而另一种反式异构体中两个取代基位于相对位置。
(2)立体异构体:立体异构体是由于原子或取代基之间在空间中的排列方式而形成的。
例如,光学异构体就是一种立体异构体。
(3)环状异构体:环状异构体是由于分子内部存在环状结构而形成的。
同分异构体在生命科学、医药等领域具有广泛应用。
例如,在制药过程中,需要制备纯度高、活性好、副作用小的药物,而同分异构体的存在可能会影响药物的效果和安全性。
因此,对于药物的研究和开发,需要对同分异构体进行深入研究。
同位素同位素指的是具有相同的原子序数但质量数不同的原子。
例如,氢原子有三种同位素:氢-1、氘-2和氚-3。
它们具有相同数量的质子(即原子序数),但其中氘和氚还具有中子,因此它们质量数不同。
1.分类根据其质量数可将其分为以下几类:(1)放射性同位素:放射性同位素是指具有不稳定核的同位素。
这些核会通过放射性衰变释放出能量并转变为其他元素。
(2)稳定同位素:稳定同位素是指具有稳定核的同位素。
这些核不会通过放射性衰变转变为其他元素。
在生命科学、医药等领域中,同位素广泛应用于标记、追踪、诊断等方面。
例如,在医学影像学中,利用放射性同位素可以制备出各种显像剂,并通过显像技术观察人体内部的生理和病理变化。
此外,同位素还可以用于追踪生物分子在体内的代谢过程,进而加深对生物分子功能的认识。
同素异形体同素异形体指的是由于原子或取代基之间在空间中的排列方式而形成的同位素分子。
例如,氨基酸中存在两种同素异构体:L-型和D-型。



同系物和同分异构体同素异形体同位素
1.同素异形体:同一种元素形成的多种单质互为同素异形体。
例如金刚石和石墨是碳的同素异形体。
2.同位素:同位素同属于某一化学元素,针对原子来说的,其原子具有相同数目的电子,原子核也具有相同数目的质子,但却有不同数目的中子。
例如氕、氘和氚。
3.同分异构体是有机物的分子式相同但是分子结构不同。
4.同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
如:甲烷、乙烷、丙烷互称为同系物,它们都属于烷烃。


同位素的表示符号
同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
同位素的表示是在该元素符号的左上角注明质量数,例如碳14,一般用14C而不用C14。
自然界中许多元素都有同位素。
同位素有的是天然存在的,有的是人工制造的,有的有放射性,有的没有放射性.
同一元素的同位素虽然质量数不同,但他们的化学性质基本相同(如:化学反应和离子的形成),物理性质有差异[主要表现在质量上(如:熔点和沸点)]。
自然界中,各种同位素的原子个数百分比一定。
同位素是指具有相同核电荷但不同原子质量的原子(核素)称为同位素。
在19世纪末先发现了放射性同位素,随后又发现了天然存在的稳定同位素,并测定了同位素的丰度。
大多数天然元素都存在几种稳定的同位素。
同种元素的各种同位素质量不同,但化学性质几乎相同。
同素异形体,是相同元素组成,不同形态的单质。
如碳元素就有金钢石、石墨、无定形碳等同素异形体.同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似。
同分异构体:
化学上,同分异构体是一种有相同化学式,有同样的化学键而有不同的原子排列的化合物.简单地说,化合物具有相同分子式,但具有不同结构的现象,叫做同分异构现象;具有相同分子式而结构不同的化合物互为同分异构体。
很多同分异构体有相似的性质。
但具有同一化学通式的有机化合物不一定是同系物。
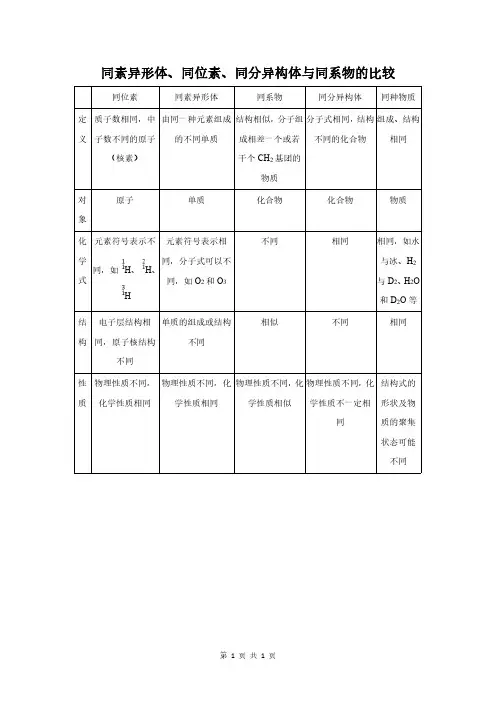
同素异形体、同位素、同分异构体与同系物的比较同位素同素异形体同系物同分异构体同种物质
定义质子数相同,中
子数不同的原子
(核素)
由同一种元素组成
的不同单质
结构相似,分子组
成相差一个或若
干个CH2基团的
物质
分子式相同,结构
不同的化合物
组成、结构
相同
对
象
原子单质化合物化合物物质
化学式元素符号表示不
同,如H、H、
H
元素符号表示相
同,分子式可以不
同,如O2和O3
不同相同相同,如水
与冰、H2
与D2、H2O
和D2O等
结构
电子层结构相
同,原子核结构
不同
单质的组成或结构
不同
相似不同相同
性质物理性质不同,
化学性质相同
物理性质不同,化
学性质相同
物理性质不同,化
学性质相似
物理性质不同,化
学性质不一定相
同
结构式的
形状及物
质的聚集
状态可能
不同
第1页共1页。

同位素、同素异形体、同系物、同分异构体同位素、同素异形体、同系物、同分异构体这四个概念都带有一个同字。
分别对应同一元素的不同原子、同一元素形成的不同单质、组成结构和性质相似的有机物、分子组成相同但结构不同的物质。
对于同一种物质本文没有列入讨论。
同位素是指质子数相同而中子数不同的同一种元素的不同原子互称为同位素。
把具有一定数目的质子和一定数目的中子的一种原子叫做核素。
同位指核素的质子数相同,在周期表中占有相同的位置。
同位素中又有放射性同位素,化学书籍所列相对原子质量多数含有小数就是大都存在同位素的缘故。
相对于同位素,还有人提出同量素概念,是指质子数和中子数都不同但质量数相同的核素。
高考要求是理解同位素概念,看懂并会写核素表示式,计算元素相对原子质量。
由于这个知识点题目相对容易,仅在第一年课标卷即2007年第9题出现,难度系数0.89,所以以后再也没有出现。
同素异形体在初中九年级教材叙述为由同种元素形成的不同单质。
大体可分为三类:物质中原子的排列不同,按照高中讲解是连接方式不同,如金刚石和石墨;分子中的原子个数不同,氧气和臭氧;连接方式和分子中原子个数都不同,如红磷和白磷。
中学阶段理解同素异形体存在于第ⅣA碳、ⅤA磷、ⅥA氧的理由。
这样才有助于记忆且同时理解其性质。
硅元素原子核外电子有3层,半径大,原子之间另一种键合时彼此键合能力弱,这既是含硅化合物远不及碳的原因,也是其同素异形体不易存在的理由。
同理由于氮原子之间可以以氮氮三键结合成为稳定的氮气分子,因此也是极难成为其他形式的单质。
至于氧的同素异形体可以与碳相类比,当然高考题中曾经以信息介绍硫的同素异形体S8,笔者意见作为特例记忆合适。
至于卤族,由于其最外层7个电子,以共用一对电子成为稳定结构,当然不必形成其他形式结合的同素异形体,还有Ⅰ、Ⅱ为金属元素,可认为没有其他形式的单质,ⅢA族的铝也是金属。
这样理解记忆即可。
同素异形体物理性质和化学性质均有不同,其中物理性质差别较为明显,如熔、沸点和气味明显不同;化学性质也有不同,如石墨较金刚石稳定,臭氧比氧气氧化性强,白磷在空气中可以自燃。