有机物的通式和表达方法—肖再兵
- 格式:ppt
- 大小:245.57 KB
- 文档页数:14

有机物通式有机物通式什么是有机物?有机物是指含碳元素的化合物,它们通常与氢、氧、氮、硫和磷等元素结合。
有机物是生命的基础,也是我们日常生活中许多化学物质的来源。
有机物的结构特点由于碳原子具有四个价电子,因此它可以与其他原子形成共价键,从而形成分子链或环。
这种特殊性质使得碳原子能够形成各种复杂的分子结构,从而产生了数百万种不同的有机化合物。
有机物通式为了方便表示和记忆大量的有机化合物,人们发明了一种简单而实用的表示方法——有机物通式。
通式是一种用来表示某一类化合物分子结构的简略公式。
例如,甲烷(CH4)和乙烷(C2H6)都属于烷烃类化合物,它们共同具有一个通式:CnH2n+2。
这个通式表明,在任何一个烷烃分子中,碳原子数目为n,氢原子数目为2n+2。
下面介绍几种常见的有机物通式:1. 烷基:CnH2n+1烷基是一种由一个碳原子和三个氢原子组成的基团,通常表示为CH3。
烷基可以与其他基团结合形成各种有机化合物。
例如,乙烷(C2H6)中含有两个烷基。
2. 烯基:CnH2n烯基是一种由两个碳原子和两个氢原子组成的基团,通常表示为CH2=CH。
烯基具有双键结构,因此它们比相同数目的烷基更容易发生反应。
例如,乙烯(C2H4)中含有一个烯基。
3. 炔基:CnHn炔基是一种由两个碳原子和一个或多个氢原子组成的基团,通常表示为C≡CH。
炔基具有三键结构,因此它们比相同数目的烯基更容易发生反应。
例如,乙炔(C2H2)中含有一个炔基。
4. 苯环:C6H5苯环是一种由六个碳原子和六个氢原子组成的芳香环结构,通常表示为Ph或C6H5。
苯环是许多重要化合物的核心结构之一,例如苯(C6H6)、甲苯(C6H5CH3)和苯乙烯(C6H5CH=CH2)等。
总结有机物通式是一种简单而实用的表示方法,它能够帮助人们理解和记忆大量的有机化合物。
不同类型的有机物具有不同的通式,例如烷基、烯基、炔基和苯环等。
通过学习有机物通式,我们可以更好地理解和应用有机化学知识。

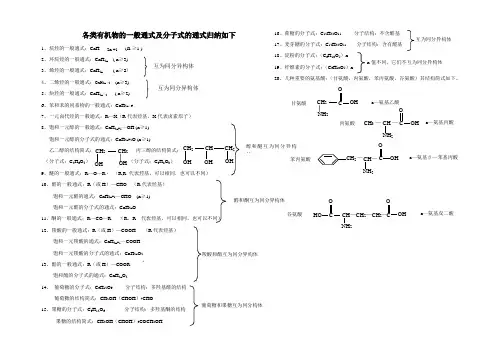
第三章有机化合物绝大多数含碳旳化合物称为有机化合物,简称有机物。
(CO、CO2、碳酸、碳酸盐、金属碳化物和氰化物等少数化合物除外)由于它们旳构成和性质跟无机化合物相似,因而历来把它们作为无机化合物。
一、烃1、烃旳定义:仅含碳和氢两种元素旳有机物称为碳氢化合物,也称为烃。
2、烃旳分类:饱和烃→烷烃(如:甲烷)脂肪烃(链状)烃不饱和烃→烯烃(如:乙烯)芳香烃(具有苯环)(如:苯)3、甲烷、乙烯和苯旳性质比较:有机物烷烃烯烃苯及其同系物通式C n H2n+2C n H2n——代表物甲烷(CH4) 乙烯(C2H4) 苯(C6H6) 构造简式CH4 CH2=CH2或官能团碳碳双键构造特点C-C单键,链状,饱和烃碳碳双键,链状,不饱和烃一种介于单键和双键之间旳独特旳键,环状空间构造正四周体六原子共平面平面正六边形物理性质无色无味旳气体,比空气轻,难溶于水无色稍有气味旳气体,比空气略轻,难溶于水无色有特殊气味旳液体,比水轻,难溶于水,有毒用途优良燃料,化工原料石化工业原料,植物生长调节剂,催熟剂溶剂,化工原料有机物主要化学性质烷烃:(甲烷)①氧化反映(燃烧)CH4+2O2 CO2+2H2O(淡蓝色火焰,无黑烟)②取代反映(注意光是反映条件,产物有5种) CH4 + Cl2 CH3Cl+HClCH3Cl +Cl2 CH2Cl2+HClCH2Cl2+Cl2 CHCl3+HClCHCl3+Cl2 CCl4+HCl在光照条件下甲烷还可以跟溴蒸气(纯卤素)发生取代反映甲烷不能使酸性KMnO4溶液、溴水或溴旳四氯化碳溶液褪色。
烯烃(乙烯)①氧化反映(1)燃烧C2H4+3O2 2CO2+2H2O(火焰明亮,有黑烟)(2)被酸性KMnO4溶液氧化,能使酸性KMnO4溶液褪色。
②加成反映CH2=CH2+Br2 CH2Br-CH2Br(能使溴水或溴旳四氯化碳溶液褪色)在一定条件下,乙烯还可以与H2、Cl2、HCl、H2O等发生加成反映(氯乙烷)③加聚反映光照光照光照光照点燃点燃乙烯能使酸性KMnO4溶液、溴水或溴旳四氯化碳溶液褪色。


.... . . ....... . 高中化学有机物知识点总结一 、 重 要 的 物 理 性 质1 . 有 机 物 的 溶 解 性( 1 ) 难 溶 于 水 的 有 : 各 类 烃 、 酯 、 绝 大 多 数 高 聚 物 、 高 级 的 ( 指 分 子 中 碳 原 子 数 目 较 多 的 , 下 同 ) 醇 、 醛 、 羧 酸 等 。
( 2 ) 易 溶 于 水 的 有 : 低 级 的 [ 一 般 指 N ( C ) ≤ 4 ] 醇 、 醛 、 羧 酸 及 盐 、 氨 基 酸 及 盐 、 单 糖 、 二 糖 。
( 3 ) 具 有 特 殊 溶 解 性 的 :① 乙 醇 是 一 种 很 好 的 溶 剂 , 既 能 溶 解 许 多 无 机 物 , 又 能 溶 解 许 多 有 机 物 。
② 乙 酸 乙 酯 在 饱 和 碳 酸 钠 溶 液 中 更 加 难 溶 , 同 时 饱 和 碳 酸 钠 溶 液 还 能 通 过 反 应 吸 收 挥 发 出 的 乙 酸 , 溶 解 吸 收 挥 发 出的 乙 醇 , 便 于 闻 到 乙 酸 乙 酯 的 香 味 。
③ 有 的 淀 粉 、 蛋 白 质 可 溶 于 水 形 成 胶.体.。
蛋 白 质 在 浓 轻 金 属 盐 ( 包 括 铵 盐 ) 溶 液 中 溶 解 度 减 小 , 会 析 出 ( 即 盐 析 ,皂 化 反 应 中 也 有 此 操 作 ) 。
④ 线 型 和 部 分 支 链 型 高 聚 物 可 溶 于 某 些 有 机 溶 剂 , 而 体 型 则 难 溶 于 有 机 溶 剂 。
⑤ 氢 氧 化 铜 悬 浊 液 可 溶 于 多 羟 基 化 合 物 的 溶 液 中 , 如 甘 油 、 葡 萄 糖 溶 液 等 , 形 成 绛 蓝 色 溶 液 。
2 . 有 机 物 的 密 度小 于 水 的 密 度 , 且 与 水 ( 溶 液 ) 分 层 的 有 : 各 类 烃 、 酯 ( 包 括 油 脂 ) 3 . 有 机 物 的 状 态 [ 常 温 常 压 ( 1 个 大 气 压 、 2 0 ℃ 左 右 ) ] ( 1 ) 气 态 :① 烃 类 : 一 般 N ( C ) ≤ 4 的 各 类 烃 注 意 : 新 戊 烷 [ C ( C H 3 ) 4 ] 亦 为 气 态② 衍 生 物 类 :一.氯.甲.烷.(.C .H .3 C l , 沸 点 为 - 24 . 2℃ ) 甲.醛.(.H .C .H .O .,.沸.点.为.-.2.1.℃.).( 2 ) 液 态 : 一 般 N ( C ) 在 5 ~ 1 6 的 烃 及 绝 大 多 数 低 级 衍 生 物 。
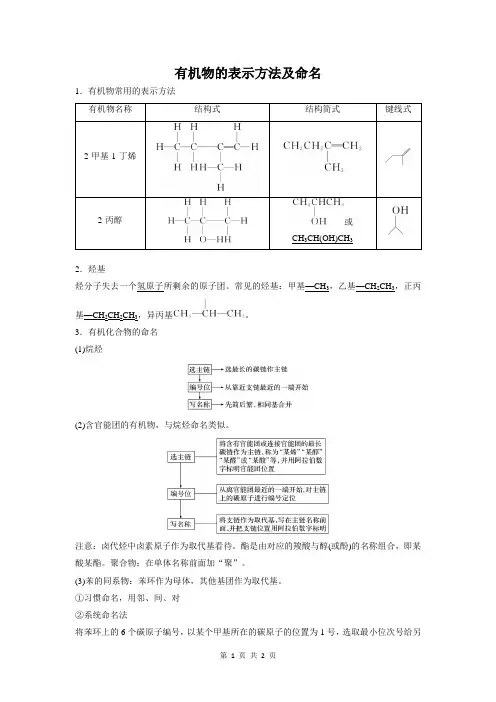
有机物的表示方法及命名1.有机物常用的表示方法
有机物名称结构式
结构简式键线式
2-甲基-1-丁烯
2-丙醇或
CH3CH(OH)CH3
2.烃基
烃分子失去一个氢原子所剩余的原子团。
常见的烃基:甲基—CH3,乙基—CH2CH3,正丙
基—CH2CH2CH3,异丙基。
3.有机化合物的命名
(1)烷烃
(2)含官能团的有机物,与烷烃命名类似。
注意:卤代烃中卤素原子作为取代基看待。
酯是由对应的羧酸与醇(或酚)的名称组合,即某酸某酯。
聚合物:在单体名称前面加“聚”。
(3)苯的同系物:苯环作为母体,其他基团作为取代基。
①习惯命名,用邻、间、对
②系统命名法
将苯环上的6个碳原子编号,以某个甲基所在的碳原子的位置为1号,选取最小位次号给另
一甲基编号。

有机物分子式确定的作者:肖锦文来源:《知识窗·教师版》2010年第05期人教版高中化学教材(必须加选修)第二册第七章第三节《有机物分子式和结构式的确定》中,教材通过对三个例题的解答来讲述有机物分子式的确定方法,每题各用一法:例1是实验式法,例2是直求法,例3是通式法。
笔者认为教材如此编排无可厚非,但我们在学习本节内容时要灵活运用教材、挖掘教材,运用一题多解的方法,全面系统地掌握有机物分子式的确定方法。
例1:实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。
又测得该化合物的相对分子质量是30,求该化合物的分子式。
解法一(实验式法):由C、H质量比→C、H原子个数比→实验式(即最简式)分子式(解答过程如教材,略)解法二(直求法):N(c)=■=■=2同理N(H)=■=■=6∴分子式为C2H6,实验式为CH3解法三(商余法):■=2 (6)∴A的分子式为为C2H6,实验式为CH3解法四(通式法):因为A为烃但不知为何种烃,故可令A的分子式为CxHy,依题意知:12x+y=30■=■→x=2y=6例2:2.3g某有机物A完全燃烧后,生成0.1molCO2和2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式。
【分析】根据A的燃烧产物是CO2和H2O,可知A中一定含C、H元素,可能还有O元素,故要确定A的分子式,首先要确定A中是否含O元素,如何确定呢?一般是运用燃烧前后C、H、O的守恒,方法如下:法一(C、H守恒):A中,m(C)=n(C)·m(C)=n(CO2)·m(C)=0.1mol×12g/mol=1.2g,m(H)=m(H2O) ·w(C)=2.7g×■=0.3g∵m(C)+m(H)=1.2g+0.3g=1.5g∴A中含O元素且m(O)=2.3-1.5=0.8g(此过程与教材解答方法类同)法二(O守恒):根据质量守恒定律,参加反应的O2的质量为:m(CO2)+m(H2O)-m(A)=0.1×44+2.7-2.3=4.8g,即n(O2)反应=■=0.15mol又∵0.1molCO2中含O原子:0.1×2=0.2mol,2.7g水中含O原子■=0.15mol∴燃烧产物中n(O)总=0.2mol+0.15mol=0.35mol>参加反应的O2中的n(O)=0.15mol×2=0.3mol∴A中含O元素且2.3gA中含O原子:0.35-0.3=0.05(mol)通过上述解答,易知2.3gA中m(C)=1.2g,m(H)=0.3g,m(O)=0.8g同时,根据题意也易求mr(A)=29×1.6=46,我们就能顺利求得A的分子式,方法又有:法一(直求法):N(C)=■=■=2,同理求N(H)、N(O)(过程如教材所解)。


有机化合物的所有结构通式嘿,朋友!想象一下这样一个场景,你走进一间充满了化学仪器和瓶瓶罐罐的实验室,里面有一位戴着厚厚眼镜、神情专注的科学家正在对着一堆资料和实验数据眉头紧锁。
这位科学家正在研究的,就是有机化合物的所有结构通式。
说起有机化合物,那可真是一个庞大而又神奇的家族。
就像我们人类社会一样,有机化合物也有着各种各样的“成员”,它们都有着自己独特的“性格”和“特点”。
你知道吗?有机化合物的结构通式就像是它们的“身份证”。
比如,烷烃的通式是 CₙH₂ₙ₊₂,想象一下这就像是烷烃们的统一制服,不管是甲烷、乙烷还是更长链的烷烃,都得按照这个规则来“穿衣打扮”。
烯烃呢,通式是 CₙH₂ₙ。
这就好像是烯烃家族的独特标志,让它们在有机化合物的“大家庭聚会”中一下子就能被认出来。
再来说说醇类,醇类的通式是 CₙH₂ₙ₊₁OH。
这就好比醇类成员们手上拿着的独特“名片”,凭着这张“名片”,它们在有机世界里畅通无阻。
那这些结构通式是怎么来的呢?这可不是随便拍拍脑袋就想出来的。
那是经过无数科学家们夜以继日的实验、观察和思考才总结出来的。
你可能会问,搞清楚这些结构通式有啥用呢?这用处可大了去啦!就好比你要去一个陌生的城市旅游,得先有一张地图才能不迷路吧?这些结构通式就是化学世界里的“地图”,让我们能更好地理解和研究有机化合物的性质和反应。
比如说,通过知道某种有机化合物的结构通式,我们就能预测它可能会和哪些物质发生反应,反应的条件是什么。
这就像是提前知道了一场比赛的规则和对手的特点,我们就能更好地准备,赢得比赛。
而且啊,这些结构通式还能帮助我们开发新的有机材料、合成新的药物。
没有它们,我们的生活可能会变得大不一样呢!想象一下,如果没有对有机化合物结构通式的深入研究,我们可能就没有那些让农作物茁壮成长的农药,没有那些能治疗各种疾病的神奇药物,甚至连我们穿的衣服、用的塑料制品都可能不复存在。
所以说,有机化合物的结构通式可不是什么枯燥无聊的东西,它们是打开有机化学世界大门的钥匙,是推动科技进步和改善我们生活的重要工具。

高中有机化学重要规律及应用总结一、有机物的通式规律随C原子个数的递增,找出其中的“重复单元”从而得出通式。
烷烃:重复单元为“CH2”,n个CH2,再加2个H,即CnH2n+2烯烃:在烷烃的基础出少2个H,即Cn H2n环烷:去掉烷两端的H,形成一个环,即Cn H2n炔烃:在烷烃的基础出少4个H,相当于形成2个双键,即Cn H2n-2苯环:相当于已烷去掉6个H,形成三个C=C双键,再去掉2H形成个环,因此苯的同系物为Cn H2n-6,苯的同系数物也为CnH2n-6如下各种烃的通式找法:二、烃中C、H的百分含量烃的通式为Cn H2n±X,因此,n趋近于无穷大量,极值均为CnH2n.即:烷烃越大,含C数越高,含氢量越低;烯烃不变;炔烃或芳烃,含C数越多,含C量越少,含H越高,极值均为烯。
即:含碳规律:小烷<大烷<烯<大炔<小炔;含H反之同理。
CH4:C%=75% H%=25C2H4: C%=85.7 H%=14.3%C2H2: C%=92.3 H%=7.7% 各种烃的n增大的C%趋近于烯CH2三、不饱和度计算及应用不饱和度:即与烷烃(饱和烃)相比的缺H对数。
由于O是2价元素,形成两个键,-O-可插入链中,不影响不饱和度;卤素形成一个键,-X认为是代替的一个H,因此有卤素原子按H计算;由于N原子形成三键-N=,因此有N原子时,相当于插入时代入一个H,因此有N时应加一个H,同时注意-NO2有一双键。
不饱和度的分子式计算如下:有机物结构与不饱和度关系:Ω=0,烷烃;Ω=1,双键(包括C=C、C=0、C=N-)或单环Ω=2,说明分子中有两个双键或一个三键;或一个双键和一个环;或两个环;其余类推Ω≥4,一般认为是苯环。
当然也可是双键、环、三键等组合。
说明:立体环状烷不饱和度Ω=所有立体环数-1.四、有机物燃烧耗氧通式为1、摩耗氧量:Cx Hy→(x+y/4)O2CX HYOZ→(x+y/4-z/2)O2CX HYClZ→[x+(y-z)/4]O2,保证Cl先生成HClCX HYSZ→[x+y/4+z]O2,此时视S生成SO22.烃单位质量耗氧量:由于C(12克)→CO2→1mol O24H(4克)→2H2O→1mol O2因此,单位质量耗氧情况为含H越高,耗氧越多。

各类有机物的通式、及主要化学性质烷烃CnH2n+2 仅含C—C键与卤素等发生取代反应、热分解、不与高锰酸钾、溴水、强酸强碱反应烯烃CnH2n 含C==C键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应、加聚反应炔烃CnH2n-2 含C≡C键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应苯(芳香烃)CnH2n-6与卤素等发生取代反应、与氢气等发生加成反应(甲苯、乙苯等苯的同系物可以与高锰酸钾发生氧化反应)卤代烃:CnH2n+1X 醇:CnH2n+1OH或CnH2n+2O 苯酚:遇到FeCl3溶液显紫色醛:CnH2nO 羧酸:CnH2nO2 酯:CnH2nO2有机反应类型:取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
加成反应:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合的反应。
聚合反应:一种单体通过不饱和键相互加成而形成高分子化合物的反应。
加聚反应:一种或多种单体通过不饱和键相互加成而形成高分子化合物的反应。
消去反应:从一个分子脱去一个小分子(如水.卤化氢),因而生成不饱和化合物的反应。
氧化反应:有机物得氧或去氢的反应。
还原反应:有机物加氢或去氧的反应。
酯化反应:醇和酸起作用生成酯和水的反应。
水解反应:化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、糖等)甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
有机化学必考内容课题1有机物的分类一、按骨架分类链状化合物:分子中原子之间的连接呈链状1. 有机化合物脂环化合物:分子中含有碳环的有机物环状化合物芳香化合物:分子中含有苯环的有机物2. 烃的分类链状烃(链烃):分子中碳和碳之间的连接呈链状(1)烃山」脂环烃:分子中含有碳环的烃环状烃(环烃)芳香烃:分子中含有苯环的烃(2)链烃的分类饱和链烃-------- 烷烃链烃不饱和链烃烯烃:分子中含有碳碳双键的链烃炔烃:分子中含有碳碳叁键的链烃、按官能团分类1•官能团:反映一类有机化合物共同特性的原子或原子团。
2•有机物主要类别、官能团、通式官能团通式烷烃烯烃炔烃芳香烃卤代烃醇酚醚醛酮羧酸酯典例导悟1•下列有机化合物的分类不正确的是A B C Dc'ICIUOH 苯的同系物芳香族化合物不饱和烃醇2. 下列对有机化合物的分类结果正确的是A •乙烯、苯、环己烷都属于脂肪烃B •苯、环戊烷、环己烷同属于芳香烃C.乙烯、乙炔同属于烯烃 D . 同属于环烷烃3. S诱抗素的分子结构如图,下列关于该分子说法正确的是A •含有碳碳双键、羟基、羰基、羧基B •含有苯环、羟基、羰基、羧基C .含有羟基、羰基、羧基、酯基D .含有碳碳双键、苯环、羟基、羰基4. 观察下列有机物的分子结构,将其所含官能团的名称填写到相应的横线上。
课题2有机物的结构(1) 饱和碳原子:在烃分子中仅以(2) 不饱和碳原子:在烃分子中以 (3) 手性碳原子:在有机物分子中与 3•有机物结构的表示方法成键的碳原子。
如烷烃和环烷烃中的碳原子。
或 _______ 成键的碳原子。
如烯烃或炔烃。
个不同的原子或原子团相连的碳原子。
有机物名称结构式结构简式键线式丙烯乙醇乙酸4.有机物的通式(1 )烷烃:C n H 2n+2(2)其它有机物:每引入一个碳碳双键或碳氧双键,则减去 引入一个碳环,则减去个氢。
一、有机物的结构特点 1碳原子的成键特点 成键数目(1)碳原子总是形成 (2) 氮原子、磷原子总是形成 (3) 氧原子、硫原子总是形成(4) 氢原子、卤原子总是形成 成键种类:碳原子形成成 _______________ ;氢原子、 连接方式:碳原子形成2.碳原子的成键方式 个键个键(一N02除外)。
有机物燃烧通式有机物燃烧通式是有机物在空气中燃烧的一般反应方程式,描述了有机物燃烧过程中发生的主要化学变化。
一般来说,有机物燃烧的主要过程是燃烧反应,生成二氧化碳和水。
燃烧是一种氧化反应,有机物在氧气的作用下产生热量和光线,并最终转化为二氧化碳和水。
有机物燃烧的通式可以表示为:有机物 + 氧气→ 二氧化碳 + 水 + 能量在这个通式中,有机物代表任何一种有机化合物,氧气代表空气中的氧气成分,二氧化碳和水是有机物燃烧产物,能量表示在燃烧过程中释放出的热能或光能。
有机物燃烧的过程是一种复杂的化学反应,其中包括了多个中间步骤和产物。
燃烧的整个过程可以分为三个阶段:燃烧起炉、燃烧燃尽和烟雾形成。
在燃烧起炉阶段,有机物首先需要被加热至点燃温度,点燃的火焰会提供能量给使有机物分子裂解成自由基,同时和氧气发生反应。
这个阶段的反应可以用以下反应来表示:有机物 + 热量→ 自由基在燃烧燃尽阶段,有机物的自由基和氧气分子发生反应,形成新的分子,并释放出大量的能量。
这个阶段的反应可以用以下反应来表示:自由基 + 氧气→ 燃烧产物 + 能量最后,在烟雾形成阶段,燃烧过程中形成的产物中的一部分会通过其他化学反应进一步分解或重新组合,最终形成烟雾。
这个阶段的反应可以用以下反应来表示:燃烧产物 + 其他反应物→ 烟雾有机物燃烧的通式还可以根据具体的化学式来具体表示。
例如,甲烷(CH4)的燃烧通式可以写为:CH4 + 2O2 → CO2 + 2H2O + 能量这个通式表示了甲烷分子与氧气分子发生反应,生成二氧化碳和水,并释放出能量。
有机物燃烧通式的相关知识对于理解和预测有机物燃烧过程具有重要意义。
通过了解有机物燃烧的基本原理,可以更好地控制和利用燃烧过程,减少有害气体的排放,提高能源利用效率,保护环境。
高中化学:写有机物通式的几种常用方法一、等差法题目给出了同一类物质的结构简式,在组成上看构成了等差数列。
在求通式时关键是通过相邻两物质结构简式的比较,找出系差,再根据等差数列的通项公式求出这一类物质的通式,教材中所涉及有机物的通式大多数可以用此方法求得。
例1:有一系列有机物按以下顺序排列:①该系列有机物的组成通式是_____________,第25个物质的分子式为____________。
②该系列有机物含碳的质量分数最大值为______________。
解析:①观察结构简式,发现上述有机物构成等差数列,系差为“”,首项为,根据等差数列通项公式可知,第n个有机物的分子式为。
当时,该有机物的分子式为。
②该系列有机物含碳的质量分数:根据极限法可知:二、等比法与等差法一样,题目也给出了一类特殊结构的烷烃,从分子式的组成来看,氢原子数构成了等比数列,解题时关键是比较相邻两物质的结构简式,找出公比,再根据等比数列通项公式求出这一类物质氢原子的通式,再根据烷烃的通式求出碳原子的通式,从而得出该类烷烃的通式。
例2:只有一种一卤代物的烷烃,其分子结构有“球形A”和“椭圆形B”两类,它们的组成有一定的规律。
A类以甲烷()为起始物,然后将甲烷分子中所有氢原子用甲基取代得,再将中的所有氢原子用甲基取代得,再将中的所有氢原子用甲基取代得,如此循环得一系列物质;B类以乙烷()为起始物,按同样规律循环也得一系列物质。
①写出碳原子数在10以内,只有一种一卤代物的烷烃的结构简式:_____________;②A类物质的通式是___________;B类物质的通式是___________。
③A类物质与B类物质之间是否存在同分异构体?___________(填“有”或“无”)为什么?___________解析:依题意,A类:【】【】【】……;B类:【】【】【】【】……。
①一卤代物只有一种结构,则结构中所有氢原子等效,且碳原子数在10以内,这样的烷烃有。