有机物完全燃烧的通式
- 格式:doc
- 大小:41.00 KB
- 文档页数:4

高中化学各类有机物的通式各类有机物的通式、及主要化学性质烷烃CnH2n+2 仅含C—C键与卤素等发生取代反应、热分解、不与高锰酸钾、溴水、强酸强碱反应烯烃CnH2n 含C==C键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应、加聚反应炔烃CnH2n-2 含C≡C键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应苯(芳香烃)CnH2n-6与卤素等发生取代反应、与氢气等发生加成反应(甲苯、乙苯等苯的同系物可以与高锰酸钾发生氧化反应)卤代烃:CnH2n+1X 醇:CnH2n+1OH或CnH2n+2O 苯酚:遇到FeCl3溶液显紫色醛:CnH2nO 羧酸:CnH2nO2 酯:CnH2nO2 有机反应类型:取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
加成反应:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合的反应。
聚合反应:一种单体通过不饱和键相互加成而形成高分子化合物的反应。
加聚反应:一种或多种单体通过不饱和键相互加成而形成高分子化合物的反应。
消去反应:从一个分子脱去一个小分子(如水.卤化氢),因而生成不饱和化合物的反应。
氧化反应:有机物得氧或去氢的反应。
还原反应:有机物加氢或去氧的反应。
酯化反应:醇和酸起作用生成酯和水的反应。
水解反应:化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、糖等)CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。

烃类完全燃烧的计算规律高中有机化学的学习中,经常涉及烃类完全燃烧的计算的题目。
如何解决这一类题目,既是难点,也是重点内容之一。
为了使同学们熟练解题,系统掌握基础知识,现将有关规律总结如下,供大家参考。
一、烃类完全燃烧的通式CxHy + (x+y/4)O2→xCO2 + (y/2)H2O二、烃类完全燃烧前后体积(分子总数)的变化规律1、同温同压下,1体积烃类完全燃烧,当生成的水为气态时(温度高于100℃)△V = V前– V后= 1 + x + y/4 – x – y/2 =1 – y/4当△V ? 0时, V前? V后,则燃烧前后气体的体积减小,此时y ? 4当△V?0时, V前?V后,则燃烧前后气体的体积减小,此时y ?4当△V =0时, V前= V后,则燃烧前后气体的体积减小,此时y = 4可见,当温度高于100℃时,燃烧前后的体积的变化与碳原子数无关,与氢原子数有关。
例如:150℃时,CH4、C2H4完全燃烧前后的体积不变(即分子数不变),而C2H2燃烧前后的体积变小,C2H6等氢原子数大于4的烃燃烧前后的体积变大。
对于混合气体,求氢原子的平均原子数,亦可适用。
练习1:120℃时,下列气体物质(或混合物)各 a mol,在氧气中完全燃烧,燃烧前后体积不变的有(),燃烧前的体积大于燃烧后的体积的有(),燃烧前的体积小于燃烧后的体积的有()。
A、C2H2B、C2H4与C2H2C、C2H2与C3H6(1:1)D、C3H8与CH4(1:1)E、C2H4与C3H4答案:(C、E); (A、B); (D)2、同温同压下,1体积烃类完全燃烧,当生成的水为液态时(温度低于100℃)。
△V = V前– V后= 1 + x + y/4 – x =1 + y/4则必然△V ? 0, V前? V后,则燃烧前后气体的体积一定减小,这取决于氢原子数,氢原子数越多,体积减少的越多。
例如:在50℃时,1mol的C2H6燃烧前后气体体积减少要比1mol的C2H4体积减少的多。


有机物完全燃烧的通式:烃: CxHy+(x+y/4)O2→xCO2+(y/2)H2O烃的衍生物:C x H y O z+(x+ y/4-z/2)O2→xCO2+(y/2)H2O题型一:有机物的质量一定时:1、烃类物质(C xHy)完全燃烧的耗氧量与成正比。
2、有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中含碳或氢的质量分数一定;若混合物总质量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O的物质的量保持不变,则混合物中各组分含碳或氢的质量分数相同。
3、燃烧时耗氧量相同,则两者的关系为:⑴同分异构体或⑵最简式相同。
例1 下列各组有机物完全燃烧时耗氧量不相同的是A、50g乙醇和50 g甲醚B、100 g乙炔和100 g苯ﻫC、200 g甲醛和200g乙酸D、100 g甲烷和100 g 乙烷解析:A中的乙醇和甲醚互为同分异构体,B、C中两组物质的最简式相同,所以答案为D。
例2下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是A、甲烷、辛醛B、乙炔、苯乙烯C、甲醛、甲酸甲酯D、苯、甲苯解析:混合物总质量一定,不论按什么比例混合,完全燃烧后生成CO2的质量保持不变,要求混合物中各组分含碳的质量分数相同。
B、C中的两组物质的最简式相同,碳的质量分数相同,A中碳的质量分数也相同,所以答案为D。
例3分别取等质量的甲烷和A(某饱和一元醇)、B(某饱和一元醛)、C(某稠环芳香烃含氧衍生物),若它们完全燃烧,分别生成了物质的量相同的CO2。
则:⑴A的分子式为_______;B的分子式为_______,C的分子式为_________(C的分子式有多种可能,只写分子量最小的一种)。
⑵写出符合上述要求时,CH4和A、B、C的分子组成必须满足的条件是__________(以n表示碳原子数,m表示氧原子数,只写通式)。
解析:A、B、C中的碳的质量分数与甲烷中相同,⑴中A、B的分子式只要结合醇、醛的通式就可以求出答案。

燃烧的化学方程燃烧是一种常见的化学反应,通过氧气与其他物质的反应产生能量和生成新的物质。
在这篇文章中,我们将深入探讨燃烧的化学方程,并讨论其在日常生活和工业中的应用。
首先,让我们了解一下燃烧的基本概念。
燃烧通常是指物质与氧气发生快速氧化反应的现象。
要发生燃烧,物质必须具备三个要素:可燃物质,氧气和能使反应发生的燃烧温度。
燃烧的化学方程式可以用来描述燃烧过程中原料和产物之间的化学变化。
对于有机化合物燃烧来说,它们通常包含碳、氢和氧元素。
当一个有机物在氧气的存在下完全燃烧时,产生的主要产物是二氧化碳和水。
例如,让我们考虑丙烷完全燃烧的化学方程式:C3H8 + 5O2 -> 3CO2 + 4H2O在这个方程中,“C3H8”代表丙烷分子,而“O2”代表氧气分子。
箭头“->”表示反应的进行方向,而反应物和产物之间的数字表示了各自的化学计量比。
方程的左边是丙烷和氧气,右边则是二氧化碳和水。
该反应的化学计量比是基于化合物分子的相对组成,它质量比已经被实验确定。
这意味着,一个丙烷分子和五个氧气分子在反应中完全消耗,产生三个二氧化碳分子和四个水分子。
这个方程还告诉我们燃烧是一个放热反应,释放出大量的能量。
燃烧时放出的能量来自于化学键的断裂和形成,化学键的形成释放能量,而斩断化学键则需要吸收能量。
燃烧的化学方程还可以被用来计算燃烧反应中的能量变化。
燃烧反应的能量变化也称为焓变,可以使用标准焓变来计算。
标准焓变是指在标准温度(通常为298K)和标准压力下,从基态的单质元素形成一个摩尔化合物所释放或吸收的能量。
利用燃烧的化学方程和标准焓变,我们可以计算出燃烧反应的热效应。
这在实践中非常重要,因为它可以帮助我们估计燃料的热值(产生的能量)以及燃烧过程中产生的废气的成分。
除了在实验室中研究和计算方程式外,燃烧的化学方程还有许多实际应用。
在日常生活中,我们常常使用燃料燃烧来供应能量,如煮饭、取暖和驱动车辆。
不同燃料的化学方程不同,因此它们产生的热值也有所不同。

烷烃在空气中燃烧通式烷烃是一类只含有碳和氢的有机化合物,它们是石油和天然气等化石燃料的主要组成部分。
烷烃在空气中燃烧是我们日常生活中不可避免的化学反应之一,也是现代工业生产中不可缺少的过程,如汽车引擎的工作就需要烷烃的燃烧来提供动力。
本文将详细探讨烷烃在空气中燃烧的通式及其主要反应过程。
烷烃可以表示为CnH(2n+2),其中n表示烷烃中碳原子的数量。
例如,甲烷(CH4)是一种最简单的烷烃,分子式为CH4。
其他常见的烷烃还包括乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)等。
烷烃在空气中燃烧的通式为:烷烃 + 氧气→ 二氧化碳 + 水 + 热能其中,烷烃和氧气为反应底物,二氧化碳和水为反应产物,热能为反应放出的能量。
烷烃在空气中燃烧的反应是一种氧化还原反应。
在这个过程中,烷烃中碳原子和氢原子与氧分子进行反应,生成二氧化碳和水,同时放出大量的热能。
这个反应的主要反应过程可以由以下两个步骤组成:第一步:烷烃与氧气反应生成一氧化碳和水CnH(2n+2) + n/2 O2 → nCO + (n+1) H2O在此反应中,烷烃和氧气发生双方向反应,产生一氧化碳和水。
而由于一氧化碳的毒性及易燃性,这一步反应可以被看作是有害的,并且是不完全的。
第二步:一氧化碳继续氧化为二氧化碳2CO + O2 → 2CO2在此反应中,产生的一氧化碳和氧气发生反应,生成二氧化碳,是一个放出大量热能的反应,协助推动反应的进行。
总的反应式可以写为:CnH(2n+2) + (n+1/2) O2 → n CO2 + (n+1) H2O + 热能通过烷烃在空气中燃烧的通式,我们可以看出这种反应的原理和其中的反应过程。
这个过程将烷烃和氧气进行反应,放出大量的热能,产生二氧化碳和水,是一种重要的化学反应过程,同时也是工业生产和人类日常生活中不可避免的化学作用之一。

烷烃通式:CxH2x+2(x大于等于1)
烯烃通式:CxH2x(x大于等于2)
环烷烃通式:CxH2x(x大于等于3)
炔烃通式:CxH2x-2(x大于等于2)
苯及苯的同系物通式:CxH2x-6(x大于等于6)
一元羧酸通式:CxH2x+1COOH(x大于等于0)
一元醇通式:CxH2x+1OH(x大于等于0)
一元醛通式:CxH2x+1CHO(x大于等于0)
烃类燃烧通式:CxHy + (x+y/4)O2 ——→xCO2 + (y/2)H2O
烃的含氧衍生物燃烧通式:
CxHyOz + (x+y/4-z/2)O2 ——→xCO2 + (y/2)H2O
烃的通性:密度小于水,不溶于水,易溶于有机溶剂,可燃,碳原子数小于等于4的烃是气体,同一类烃随着碳原子数的增加熔点、沸点增加。
烷烃性质:与卤素发生取代,生成卤代烃和卤化氢。
烯烃性质:能使酸性高锰酸钾溶液褪色(烯烃被氧化生成二氧化碳和水);能使溴水褪色(发生加成反应生成溴代烃);
炔烃性质:与烯烃类似。
苯的性质:与溴发生取代;与浓硝酸在浓硫酸催化下加热硝化成硝基苯;与浓硫酸共热磺化成苯磺酸。
羧酸性质:与醇在浓硫酸催化下加热发生酯化;酸性;
醇的性质:氧化生成醛;酯化;浓硫酸催化下加热分解成烯烃和水,或分子间脱水生成醚
醛的性质:氧化生成羧酸;与银铵溶液共热发生银镜反应;与新制氢氧化铜反应生成砖红色沉淀;
卤代烃性质:与氢氧化钠水溶液共热发生水解生成卤化钠和醇;与氢氧化钠的醇溶液共热发生分解生成烯烃和卤化钠。

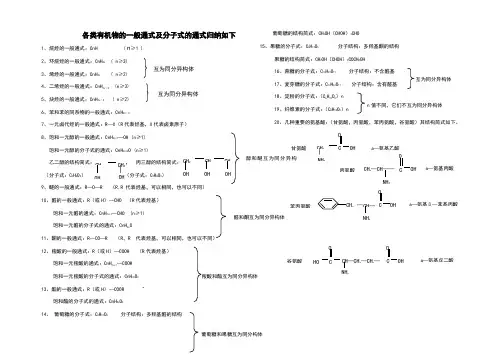
各类有机物的一般通式及分子式的通式归纳如下1、烷烃的一般通式:CnH ( ≥1 )2、环烷烃的一般通式:CnH 2n ( n ≥3)3、烯烃的一般通式:CnH 2n ( n≥2)4、二烯烃的一般通式:CnH 2n -2 (n ≥3)5、炔烃的一般通式:CnH 2n -2 ( n ≥2)6、苯和苯的同系物的一般通式:CnH 2n -67、一元卤代烃的一般通式:R —X (R 代表烃基,X 代表卤素原子) 8、饱和一元醇的一般通式:CnH 2n+1—OH (n ≥1) 饱和一元醇的分子式的通式:CnH 2n+2O (n ≥1)乙二醇的结构简式: , 丙三醇的结构简式: (分子式:C 2H 6O 2) (分子式:C 3H 8O 3)9、醚的一般通式:R —O —R (R,R 代表烃基,可以相同,也可以不同) 10、醛的一般通式:R (或H )—CHO (R 代表烃基)饱和一元醛的通式:CnH 2n+1—CHO (n ≥1) 饱和一元醛的分子式的通式:CnH 2n O11、酮的一般通式:R —CO —R (R ,R代表烃基,可以相同,也可以不同) 12、羧酸的一般通式:R (或H )—COOH (R代表烃基)饱和一元羧酸的通式:CnH 2n+1—COOH 饱和一元羧酸的分子式的通式:CnH 2n O 2 13、酯的一般通式:R (或H )—COOR饱和酯的分子式的通式:CnH 2n O 214、 葡萄糖的分子式:C 6H 12O 6 分子结构:多羟基醛的结构葡萄糖的结构简式:CH 2OH (CHOH )4CHO15、果糖的分子式:C 6H 12O 6 分子结构:多羟基酮的结构果糖的结构简式:CH 2OH (CHOH )3COCH 2OH16、蔗糖的分子式:C 12H 22O 11分子结构:不含醛基 17、麦芽糖的分子式:C 12H 22O 11 分子结构:含有醛基18、淀粉的分子式:(C 6H 10O 5)n 19、纤维素的分子式:(C 6H 10O 5)n20、几种重要的氨基酸:(甘氨酸,丙氨酸,苯丙氨酸,谷氨酸)其结构简式如下。

苯的同系物燃烧通式苯是一种重要的有机化合物,它的同系物的燃烧通式是C6H6+9O2=6CO2+3H2O。
下面就苯及其同系物燃烧通式进行详细介绍。
苯是一种无色液体,它的分子式为C6H80.1℃,闪点为-11℃。
它具有强烈的苯味,是一种易燃液体,可以与氧气发生可燃性反应。
苯的燃烧通式为C6H6+9O2=6CO2+3H2O,即1个苯分子可以与9个氧分子反应,生成6个二氧化碳分子和3个水分子。
苯的同系物也具有易燃性,也可以与氧发生可燃性反应。
苯的同系物有甲苯、乙苯、丙苯、丁苯等,其燃烧通式也都可以用C6H6+9O2=6CO2+3H2O表示,即1个苯分子可以与9个氧分子反应,生成6个二氧化碳分子和3个水分子。
苯的燃烧可以分为三个步骤,即预燃烧、燃烧本身和后燃烧。
预燃烧是指苯分子被氧分子所氧化,反应产物是苯的氧化物,燃烧本身则是苯的氧化物与氧发生反应,生成二氧化碳和水;而后燃烧是指苯分子在燃烧过程中可被进一步氧化,生成碳酸酯类物质。
苯的燃烧产物的特性与燃烧的温度有关,当温度较低时,产物主要为CO2和H2O;而当温度较高时,产物还会包括一些有机物,如碳酸酯等。
苯及其同系物燃烧的反应通常是一个完全燃烧反应,其燃烧通式为C6H6+9O2=6CO2+3H2O,即1个苯分子可以与9个氧分子反应,生成6个二氧化碳分子和3个水分子。
苯的燃烧产物的特性与燃烧的温度有关,温度较低时,产物主要为CO2和H2O;而温度较高时,产物还会包括一些有机物,如碳酸酯等。
综上所述,苯及其同系物的燃烧通式都是C6H6+9O2=6CO2+3H2O,即1个苯分子可以与9个氧分子反应,生成6个二氧化碳分子和3个水分子。
苯的燃烧产物的特性与燃烧的温度有关,当温度较低时,产物主要为CO2和H2O;而当温度较高时,产物还会包括一些有机物,如碳酸酯等。

有机物完全燃烧的通式:
烃:C x H y+(x+y/4)O2→xCO2+(y/2)H2O
烃的衍生物:C x H y O z+(x+y/4-z/2)O2→x CO2+(y/2)H2O
题型一:有机物的质量一定时:
1、烃类物质(C x H y)完全燃烧的耗氧量与成正比。
2、有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中含碳或氢的质量分数一定;若混合物总质量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O 的物质的量保持不变,则混合物中各组分含碳或氢的质量分数相同。
3、燃烧时耗氧量相同,则两者的关系为:⑴同分异构体或⑵最简式相同。
例1 下列各组有机物完全燃烧时耗氧量不相同的是
A、50 g乙醇和50 g甲醚
B、100 g乙炔和100 g苯
C、200 g甲醛和200 g乙酸
D、100 g甲烷和100 g乙烷
解析:A中的乙醇和甲醚互为同分异构体,B、C中两组物质的最简式相同,所以答案为D。
例2下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是
A、甲烷、辛醛
B、乙炔、苯乙烯
C、甲醛、甲酸甲酯
D、苯、甲苯
解析:混合物总质量一定,不论按什么比例混合,完全燃烧后生成CO2的质量保持不变,要求混合物中各组分含碳的质量分数相同。
B、C中的两组物质的最简式相同,碳的质量分数相同,A中碳的质量分数也相同,所以答案为D。
例3分别取等质量的甲烷和A(某饱和一元醇)、B(某饱和一元醛)、C(某稠环芳香烃含氧衍生物),若它们完全燃烧,分别生成了物质的量相同的CO2 .则:
⑴A的分子式为_______;B的分子式为_______,C的分子式为_________(C的分子式有多种可能,只写分子量最小的一种)。
⑵写出符合上述要求时,CH4和A、B、C的分子组成必须满足的条件是__________(以n表示碳原子数,m表示氧原子数,只写通式)。
解析:A、B、C中的碳的质量分数与甲烷中相同,⑴中A、B的分子式只要结合醇、醛的通式就可以求出答案。
稠环芳香烃中最简单的是萘,通过增加氧原子维持含碳的质量分数不变可推出C .⑵的通式推导抓住每少16个氢原子增加一个氧原子即可。
答案:(1)A、C9H20O B、C8H16O C、C10H8O2
(2)C n H4n-16m O m
题型二:有机物的物质的量一定时:
1、比较判断耗氧量的方法步聚:①若属于烃类物质,根据分子中碳、氢原子
个数越多,耗氧量越多直接比较;若碳、氢原子数都不同且一多一少,则可以按1个碳
原子与4个氢原子的耗氧量相当转换成碳或氢原子个数相同后再进行比较即可。
②若属于烃的含氧衍生物,先将分子中的氧原子结合氢或碳改写成H2O或CO2的形式,即将含氧衍生物改写为C x H y·(H2O)n或C x H y·(CO2)m或C x H y·(H2O)n·(CO2)m形式,再按
①比较C x H y的耗氧量。
2、有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中碳原子或氢原子的个数一定;若混合物总物质的量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O的量保持不变,则混合物中各组分中碳或氢原子的个数相同。
例4相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是
A、C3H4和C2H6
B、C3H6和C3H8O
C、C3H6O2和C3H8O
D、C3H8O和C4H6O2
解析:A中C3H4的耗氧量相当于C2H8,B、C、D中的C3H8O可改写为
C3H6·(H2O),C中的C3H6O2可改为C3H2·(H2O)2,D中的C4H6O2可改为C3H6·(CO2),显然答案为B、D。
例5 1 mol C x H y(烃)完全燃烧需要5 mol O2,则X与Y之和可能是
A、X+Y=5
B、X+Y=7
C、
X+Y=11D、X+Y=9
解析:根据烃燃烧通式可知,1 mol C x H y的耗氧量为,讨论易知,当x=3,y=8时合理,答案为C。
例6 有机物A、B只可能烃或烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数) ( )
A、8n
B、14n
C、
18n D、44n
解析: A中的一个碳原子被B中的四个氢原子代替,A和B的分子量相差8的倍数,即答案A. 如果A和B的分子组成相差若干个H2O或CO2 ,耗氧量也不变,即分别对应答案C和D。
题型三:一定量的有机物完全燃烧,生成的CO2和消耗的O2的物质的量之比一定时:
1、生成的CO2的物质的量小于消耗的O2的物质的量的情况
例7某有机物的蒸气完全燃烧时,需要三倍于其体积的O2,产生二倍于其体积的CO2,则该有机物可能是(体积在同温同压下测定)
A、C2H4
B、C2H5OH
C、
CH3CHO D、CH3COOH
解析:产生的CO2与耗氧量的体积比为2:3,设该有机物为1 mol,则含2 mol 的C原子,完全燃烧时只能消耗2 mol的氧气,剩余的1 mol氧气必须由氢原子消耗,所以氢原子为4 mol,即该有机物可以是A,从耗氧量相当的原则可知B也正确。
答案为A、B。
2、生成的CO2的物质的量等于消耗的O2的物质的量的情况
符合通式C n·(H2O)m。