无机化学第四版(北师大)课后推断题附答案
- 格式:doc
- 大小:48.50 KB
- 文档页数:4


精心整理第十一章电化学基础11-1用氧化数法配平下列方程式(1)KClO 3→KClO 4+KCl(2)Ca 5(PO 4)3F+C+SiO 2→CaSiO3+CaF 2+P 4+CO(3)NaNO 2+NH 4Cl →N 2+NaCl+H 2O(4)K 2Cr 2O 7+FeSO 4+H 2SO 4→Cr 2(SO 4)3+Fe 2(SO 4)3+K 2SO 4+H 2O(5)CsCl+Ca →CaCl 2+Cs解:(((((11-2(1(2(3(4(5解:(2(3(4(511-3.用半反应法(离子-电子法)配平下列方程式(1)K 2Cr 2O 7+H 2S+H 2SO 4——K 2SO 4+Cr 2(SO 4)3+H 2O(2)MnO 42-+H 2O 2———O 2+Mn 2+(酸性溶液)(3)Zn+NO 3-+OH -——NH 3+Zn (OH )42-(4)Cr (OH )4-+H 2O 2——CrO 42-(5)Hg+NO 3-+H +——Hg 22++NO解:(1)K 2Cr 2O 7+3H 2S+4H 2SO 4==K 2SO 4+Cr 2(SO 4)3+7H 2O+3S(2)MnO 42-+2H 2O 2+4H +==2O 2+Mn 2++4H 2O(3)Zn+NO 3-+3H 2O+OH -==NH 3+Zn (OH )42-(4)2Cr(OH)4-+3H2O2+2OH==-2CrO42-+8H2O(5)6Hg+2NO3-+8H+==3Hg22++2NO+4H2O11-4将下列反应设计成原电池,用标准电极电势判断标准态下电池的正极和负极,电子传递的方向,正极和负极的电极反应,电池的电动势,写出电池符号.(1)Zn+2Ag+=Zn2++2Ag(2)2Fe3++Fe=3Fe2+(3)Zn+2H+=Zn2++H2(4)H2+Cl2=2HCl(5)3I2+6KOH=KIO3+5KI+3H2O11-5写出下列各对半反应组成的原电池的电池反应、电池符号,并计算标准电动势。

精心整理第十一章电化学基础11-1用氧化数法配平下列方程式(1)KClO 3→KClO 4+KCl(2)Ca 5(PO 4)3F+C+SiO 2→CaSiO3+CaF 2+P 4+CO(3)NaNO 2+NH 4Cl →N 2+NaCl+H 2O(4)K 2Cr 2O 7+FeSO 4+H 2SO 4→Cr 2(SO 4)3+Fe 2(SO 4)3+K 2SO 4+H 2O(5)CsCl+Ca →CaCl 2+Cs解:(((((11-2(1(2(3(4(5解:(2(3(4(511-3.用半反应法(离子-电子法)配平下列方程式(1)K 2Cr 2O 7+H 2S+H 2SO 4——K 2SO 4+Cr 2(SO 4)3+H 2O(2)MnO 42-+H 2O 2———O 2+Mn 2+(酸性溶液)(3)Zn+NO 3-+OH -——NH 3+Zn (OH )42-(4)Cr (OH )4-+H 2O 2——CrO 42-(5)Hg+NO 3-+H +——Hg 22++NO解:(1)K 2Cr 2O 7+3H 2S+4H 2SO 4==K 2SO 4+Cr 2(SO 4)3+7H 2O+3S(2)MnO 42-+2H 2O 2+4H +==2O 2+Mn 2++4H 2O(3)Zn+NO 3-+3H 2O+OH -==NH 3+Zn (OH )42-(4)2Cr(OH)4-+3H2O2+2OH==-2CrO42-+8H2O(5)6Hg+2NO3-+8H+==3Hg22++2NO+4H2O11-4将下列反应设计成原电池,用标准电极电势判断标准态下电池的正极和负极,电子传递的方向,正极和负极的电极反应,电池的电动势,写出电池符号.(1)Zn+2Ag+=Zn2++2Ag(2)2Fe3++Fe=3Fe2+(3)Zn+2H+=Zn2++H2(4)H2+Cl2=2HCl(5)3I2+6KOH=KIO3+5KI+3H2O11-5写出下列各对半反应组成的原电池的电池反应、电池符号,并计算标准电动势。

第九章 酸碱平衡9-1 以下哪些物种是酸碱质子理论的酸,哪些是碱,哪些具有酸碱两性?请分别写出它们的共轭碱或酸。
SO -24, S-2, H 2PO -4, NH 3, HSO -4, [Al(H 2O)5OH]+2, CO -23, NH +4, H 2S, H 2O,OH -,H 3O +, HS -, HPO -24。
解: 质子酸 — 共轭碱H 2PO -4 — HPO -24 HSO -4 — SO -24 [Al(H 2O)5OH]+2—[Al(H 2O)4(OH)2]+NH +4 —NH 3 H 2S — HS -H 2O — OH -H 3O +— H 2O HS -— S-2 HPO -24 — PO -34质子碱 — 共轭酸SO -24 — HSO -4 S-2 — HS -NH 3 — NH +4 HSO -4— H 2SO 4[Al(H 2O)5OH]+2—[Al(H 2O)6]+3 CO -23 — HCO -3 H 2O — H 3O +OH -— H 2O HS -— H 2S HPO -24 — H 2PO -4酸碱两性:H 2PO -4, HSO -4, [Al(H 2O)5OH]+2, H 2O , HS -, HPO -24。
9-2 为什么pH=7并不总表明水溶液是中性的。
解: 因为水的解离是一个明显的吸热过程,因此水的离子积是温度的函数,只有在常温下K w =1.0×1014-,即[H +]=[OH -]=1.0×107-,所以pH =7,其他温度下则不然。
9-3 本章表示电解质及其电离产物的浓度有两种,一种如c(HAc)、c(NH +4),另一种如[HAc],[NH +4]等,它们的意义有何不同?什么情况下电离平衡常数的表达式中可以用诸如c(HAc)、c(NH +4)等代替诸如[HAc],[NH +4]等?有的书上没有诸如c(HAc)、c(NH +4)这样的浓度符号,遇到浓度时一律用诸如[HAc],[ NH +4]等来表示,这样做有可能出现什么混乱?解:c(HAc)、c(NH +4)用来表示初始状态的浓度,而[HAc],[ NH +4]用来表示平衡状态下的浓度。

北师⼤《⽆机化学》第四版习题答案第五章化学热⼒学基础5-1从⼿册中查出常⽤试剂浓硫酸、浓盐酸、浓硝酸、浓氨⽔的密度和质量分数计算它们的(体积)物质的量浓度和质量摩尔浓度。
解:经查阅:p(HCl)=1.19g/mlw(HCl)=37.23%p(H2SO4)=1.83g/mlw(H2SO4)=98%p(HNO3)=1.42g/mlw(HNO3)=69.80%p(NH3.H2O)=0.9g/mlw(NH3.H2O)=26%由公式c=pw/M可得:c(HCl)=12mol·L–1c(H2SO4)=18.3mol·L–1c(HNO3)=15.7mol·L–1c(NH3.H2O)=13.8mol·L–1设1㎏⽔中含溶质nmol,则由w=m/(m+1000)(m为溶质质量)可得:m(HCl)=16.2mol/㎏m(H2SO4)=500mol/㎏m(HNO3)=36.69mol/㎏m(NH3.H2O)=20.67mol/㎏5-2从⼿册查出常温下的饱和⽔蒸⽓压,计算当时相对湿度为40%时,⽔蒸⽓压多⼤。
解:在298K下,P(饱和⽔蒸⽓压)=3.167Kpa,P(不饱和)/P (饱和)=40%,则P(不饱和)/P(饱和)=40%×P(饱和)=0.4×3.167=1.2668Kpa 答:⽔蒸⽓压为1.2668Kpa.5-3化学实验中经常⽤蒸馏⽔冲洗已⽤⾃来⽔洗净的烧杯。
设洗净烧杯内残留“⽔”为1mL,试计算,⽤30mL蒸馏⽔洗1次和2次,烧杯中残留的“⾃来⽔的浓度”分别多⼤?解:再⽤⾃来⽔洗之后,烧杯中⾃来⽔为1ml之后,加⼊30ml 蒸馏⽔,⼀共为31ml⽔,⾃来⽔占1/31,倒掉后⼜倒1ml,故⾃来⽔浓度为1/31。
若第⼀次加⼊的蒸馏⽔倒掉之后,1ml中含1/31ml的⾃来⽔;再加⼊30ml蒸馏⽔,⼀共为31ml⽔,⾃来⽔占1/312=1/963所以倒掉后⾃来⽔占1/312=1/9635-4计算15℃,97kPa下15g氯⽓的体积。
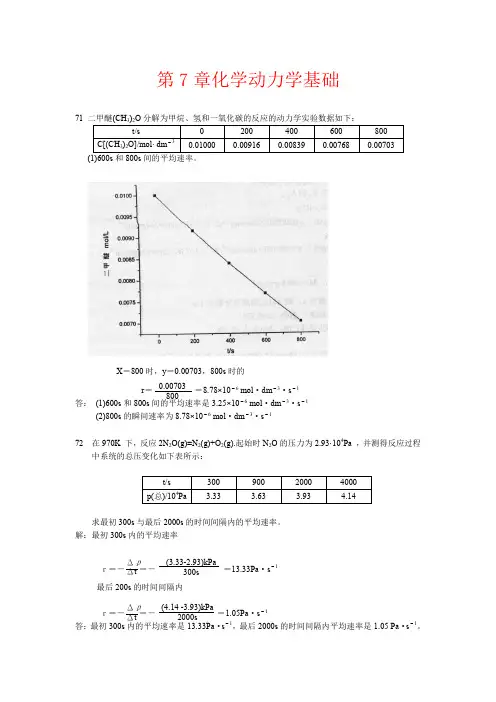
第7章化学动力学基础71(1)600s 和800s 间的平均速率。
X =800时,y =0.00703,800s 时的r ==8.78×10-6 mol ·dm -3·s -1答: (1)600s 和800s 间的平均速率是3.25×10-6 mol ·dm -3·s -1(2)800s 的瞬间速率为8.78×10-6 mol ·dm -3·s -172 在970K 下,反应2N 2O(g)=N 2(g)+O 2(g).起始时N 2O 的压力为2.93·104Pa ,并测得反应过程中系统的总压变化如下表所示:求最初300s 与最后2000s 的时间间隔内的平均速率。
解:最初300s 内的平均速率r=-=-=13.33Pa ·s -1 最后200s 的时间间隔内r=-=-=1.05Pa ·s -1答:最初300s 内的平均速率是13.33Pa ·s -1,最后2000s 的时间间隔内平均速率是1.05 Pa ·s -1。
0.00703800ΔpΔt (3.33-2.93)kPa300sΔp Δt (4.14 -3.93)kPa 2000s7.3在600K 下反应(1)求该反应的表观速率方程. (2)计算速率常数.(3)预计c 0(NO)=0.015mol∙ dm -3,c 0(O 2)=0.025 mol∙ dm -3的初速率.解:(1)由实验数据可见,O 2的浓度增加一倍,反应速率就增加一倍;NO 的浓度增加3倍,反应速率就增大为原来的9倍.可见该反应的速率与O 2的浓度的一次方呈正比,与NO 浓度的平方呈正比。
故有,r=kc 2(NO)c(O 2)(2)由表中的数据可见,任取一组数据来计算速率常数k ,计算结果不会有差别:3-3132612-3-30020.2510d m 2.510d m ()()(0.01d m )(0.01d m )rm o l s k m o l s c N O c O m o l m o l ----⨯⋅⋅===⨯⋅⋅⋅⋅ (3) 3200022.510()()r c NO c O =⨯3261-32-3-312.510dm (0.015dm )0.025dm 0.014dm mol s mol mol mol s---=⨯⋅⋅⨯⋅⨯⋅=⋅⋅答:(1)该反应的表观速率方程是r=kc 2(NO)c(O 2);(2)速率常数为32612.510dm mols --⨯⋅⋅(3) c 0(NO)=0.015mol∙ dm -3,c 0(O 2)=0.025 mol∙ dm -3的初速率时的初速率为-310.014 dm mol s -⋅⋅ 17.4 N 2O (l)求分解反应的反应级数。


无机化学_第四版_北师大版_课后答案(补充:1-11章)_khdaw第一章原子结构与元素周期系1-14Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
答:∵E=190kJ/mol∴每个分子解离所需要的能量为190×10-3/6.02×1023=3.156×10-19(J)所需吸收光子能量为E=hν=3.156×10-19J∴λ=c/ν=c·h/E=3×108×6.63×10-34/3.156×10-19=6.3×10-7(m)=630(nm)ν=4.76×10141-19氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?答:氢原子莱曼系的跃迁吸收光子的波数公式为ǔ=1/λ=R H·(1/12-1/n2)已知波长λ=103nm=1.03×10-7m∴1/1.03×10-7=R H·(1/12-1/n2),R H=1.09677×10-7∴n=2.95≈3∴相应于氢原子电子从n=1的轨道向n=3的轨道跃迁的过程,即从K 层→M层轨道的跃迁1-21当电子的速度达到光速的20.0%时,该电子的德布罗意波长多大?当锂原子(质量7.02amu)以相同速度飞行时,其德布罗意波长多大?答:对电子,λ=h/mv=6.63×10-34×(9.11×10-31×3×108×20%)-1=1.21×10-11m=12.1(pm)对锂原子,其m=7.02×1.660×10-24×10-3=1.165×10-26(kg)∴λ=h/mv=6.63×10-34×(1.165×10-26×3×108×20%)-1 =9.48×10-16m=9.48×10-4(pm)1-23处于K、L、M层的电子最大可能数目各为多少?答:处于K层,即n=1,而每个能层能容纳的最大电子数目为2n2∴第K层:2×12=2(个)第L层:2×22=8(个)第M层:2×32=18(个)1-24以下哪些符号是错误的?(a)6s(b)1p(c)4d(d)2d(e)3p(f)3f答:(a)6s对;(b)1p错(因为n=1,则l只能是0,即s);(c)4d对;(d)2d错(因为n=2,则l可能是0,1,即s,p轨道);(e)3p对;(f)3f错(因为n=3,则l可能是0,1,3即s,p,d轨道)。

(a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4XeF 平面四边形 2XeF 直线形3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。
8、解: 2XeF 直线形 4XeF 平面四边形 6XeF 八面体 4XeOF 四方锥 4ClF 三角锥13-9用化学方程式表达下列化合物的合成方法(包括反应条件): (a) XeF 2 (b) XeF 6 (c) XeO 39、解: )()()(21.0,4002g XeF g F g Xe MPaC −−−−→−+︒ )()(3)(66,3002g XeF g F g Xe MPa C −−−−→−+︒ HF XeO O H XeF 63326+=+13-10 完成下列反应方程式: (1) XeF 2 + H 2O → (2) XeF 4 + H 2O → (3) XeF 6 + H 2O → (4) XeF 2 + H 2 → (5) XeF 4 + Hg → (6) XeF 4 + Xe → 10、解:2424224263262324222222226312232632212XeF Xe XeF HgF Xe XeF Hg HF Xe H XeF HF XeOF O H XeF HF XeO O H XeF HFO Xe XeO O H XeF OH F O Xe OH XeF =++=++=++=++=++++=++++=+--14-5 三氟化氮NF 3(沸点-129℃)不显Lewis 碱性,而相对分子质量较低的化合物NH 3 (沸点-33℃)却是个人所共知的Lewis 碱。
(a )说明它们挥发性差别如此之大的原因;(b )说明它们碱性不同的原因。
5、解:(1)NH 3有较高的沸点,是因为它分子间存在氢键。
(2)NF 3分子中,F 原子半径较大,由于空间位阻作用,使它很难再配合Lewis 酸。

精心整理第八章水溶液8-1现需1200克80%(质量分数)的酒精作溶剂。
实验室存有浓度为70%的回收酒精和95%的酒精,应各取多少进行配置?解:令用浓度为70%的酒精X 克,95%的酒精Y 克。
(70%X+95%Y )/(X+Y )=80%①X+Y =1200②由①②得,X =720Y =4808-2(1(2(3(4解:(1所以c (2(3)(4)同理c(NH 3)=)()(233O H n NH n +=18/)28100()17/28(-+×100%=29.17% 8-3如何将25克NaCl 配制成质量分数为0.25的食盐水溶液?解:令加水X 克,依题意得0.25=25/(25+X),所以X =75克所以加水75克,使25克NaCl 配成25%的食盐水。
8-4现有100.00mLNa 2CrO 4饱和溶液119.40g ,将它蒸干后得固体23.88g ,试计算:(1)Na 2CrO 4溶解度;(2)溶质的质量分数;(3)溶液的物质的量浓度;(4)Na2CrO4的摩尔分数。
解:(1)令Na2CrO4溶解度为S所以S/(S+100)=23.88g/119.40g 所以S=25g(2)ω(Na2CrO4)=23.88g/119.40g×100%=20%(3)M(Na2CrO4)=162g/mol;molgg3)/162/(88.23--1(4)8-5在-1H2SO4g/100g (H2O8-6纯甲解:m8-7解:由解得:8-8⑴胰岛素的摩尔质量;⑵溶液蒸气压下降Δp(已知在25℃时水的饱和蒸气压为3.17kPa)。
解:(1)C=Π/RT=4.34KP a/8.314P a·L·mol-1×(273+25)K=0.00175mol·L-1摩尔质量=0.101g/0.00175mol·L-1×0.01L=5771.43g/mol(2)△P=P B*×X A=3170P a×n1/(n1+n2)≈3170P a×n1/n2=3170P a×(0.101g/5771.43g/mol)×(18g/mol)/(10×1g)=0.0998P a8-9烟草的有害成分尼古丁的实验式为C5H7N,今有496mg尼古丁溶于10.0g水中,所得溶液在101kPa下的沸点为100.17°C,求尼古丁的相对分子质量。
![北师大无机化学习题解答]_《无机化学》(第四版,吴国庆,高等教育出版社)习题答案](https://uimg.taocdn.com/7c4cbdf00b4c2e3f5627631c.webp)
第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
目录第16章............................................................................................ - 2 -第22章............................................................................................ - 2 -第23章............................................................................................ - 2 -第16章1.有一种无色气体A,能使热的CuO还原,并逸出一种相当稳定得到气体B,将A通过加热的金属钠能生成一种固体C,并逸出一种可燃性气体D。
A能与Cl2分步反应。
最后得到一种易爆的液体E。
指出A、B、C、D和E各为何物?并写出各过程的反应方程式。
第22章1.有一黑色固体化合物A,它不溶于水、稀醋酸和氢氧化钠,却易溶于热盐酸中,生成一中绿色溶液B。
如溶液B与铜丝一起煮沸,逐渐变棕黑色得到溶液C。
溶液C若用大量水稀释,生成白色沉淀D。
D可溶于氨溶液中,生成无色溶液E。
E若暴露于空气中,则迅速变成蓝色溶液F。
在溶液F中加入KCN时,蓝色消失,生成溶液G。
往溶液G中加入锌粉,则生成红棕色沉淀H。
H不溶于稀的酸和碱,可溶于热硝酸生成蓝色溶液I。
往溶液I中慢慢加入NaOH溶液生成蓝色胶状沉淀J。
将J过滤、取出。
然后强热,又生成原来化合物A。
试判断上述个字母所代表的物质,并写出相应的各化学反应方程式。
第23章1.铬的某化合物A是橙红色溶于水的固体,将A用浓HCl处理产生黄绿色刺激性气体B和生成暗绿色溶液C。
在C中加入KOH溶液,先生成灰蓝色沉淀D,继续加入过量的KOH溶液则沉淀消失,变成绿色的溶液E。
在E中加入H2O2加热则生成黄色溶液F,F用稀酸酸化,又变为原来的化合物A 的溶液。
第19章金属通论19-1举例说明哪些金属能从(1)冷水,(2)热水,(3)水蒸气,(4)酸,(5)碱中置换出氢气,写出有关的反应式并说明反应条件。
1、解:2Na + 2H2O = 2NaOH+ H2↑Mg+ 2H2O= Mg(OH)2↓ + H2↑3Fe + 4H2O = Fe3O4 + 4H2↑Zn + 2HCl = ZnCl2 + H2↑2Al + 2OH- + 6H2O = 2[Al(OH)4]-19-2 已知在 973K 时,2CO + O2 = 2CO2 ; △r Gθ= -398 kJ.mol-12Ni + O2 = 2NiO; △r Gθ=-314 kJ.mol-1试计算该温度下CO + NiO = Ni +CO2的△r Gθ值,并对照图19-1说明在该温度下能否用CO 还原NiO制取Ni 。
2、解: 2CO + O2 = 2CO (1)2Ni + O2 = 2NiO (2)CO + NiO = Ni + CO2 (3)(3) =2)2()1(-∆rGθ =2) 314(398---= -42kJ•mol-1CO的自由能比NiO的低,∆rGθ< 0 故可以使用CO还原NiO 制取Ni19-3下图是几种金属硫化物的埃林汉姆图。
(1)请解释图中各条线形状变化的意义;(2)据图,若从硫化物中提取金属,适宜的还原剂和温度条件各如何?(1)1/2C + S = 1/2 CS2(2)Hg + S = HgS(3)2/3 Bi +S = 1/3 Bi2S3(4)H2 +S = H2S(5)Pb +S = PbS3、解:线1中,随着温度的升高,刚开始时吉布斯自由能呈上升趋势,但当温度达到一定值后,随着温度的升高,吉布斯自由能反呈下降趋势。
斜率发生了变化,是因为温度升高,发生了相变,出现了熵增,因而∆rGθ下降。
线2线3相似,起始随温度的升高,∆rGθ增加,达到一定温度后,随着温度的增加,∆rGθ增加的速度更快,斜率加大,出现了熵增。
第一章原子结构与元素周期系1-14Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
答:∵E=190kJ/mol∴每个分子解离所需要的能量为190×10-3/6.02×1023=3.156×10-19(J)所需吸收光子能量为E=hν=3.156×10-19J∴λ=c/ν=c·h/E=3×108×6.63×10-34/3.156×10-19=6.3×10-7(m)=630(nm)ν=4.76×10141-19氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?答:氢原子莱曼系的跃迁吸收光子的波数公式为ǔ=1/λ=R H·(1/12-1/n2)已知波长λ=103nm=1.03×10-7m∴1/1.03×10-7=R H·(1/12-1/n2),R H=1.09677×10-7∴n=2.95≈3∴相应于氢原子电子从n=1的轨道向n=3的轨道跃迁的过程,即从K 层→M层轨道的跃迁1-21当电子的速度达到光速的20.0%时,该电子的德布罗意波长多大?当锂原子(质量7.02amu)以相同速度飞行时,其德布罗意波长多大?答:对电子,λ=h/mv=6.63×10-34×(9.11×10-31×3×108×20%)-1=1.21×10-11m=12.1(pm)对锂原子,其m=7.02×1.660×10-24×10-3=1.165×10-26(kg)∴λ=h/mv=6.63×10-34×(1.165×10-26×3×108×20%)-1=9.48×10-16m=9.48×10-4(pm)1-23处于K、L、M层的电子最大可能数目各为多少?答:处于K层,即n=1,而每个能层能容纳的最大电子数目为2n2∴第K层:2×12=2(个)第L层:2×22=8(个)第M层:2×32=18(个)1-24以下哪些符号是错误的?(a)6s(b)1p(c)4d(d)2d(e)3p(f)3f答:(a)6s对;(b)1p错(因为n=1,则l只能是0,即s);(c)4d对;(d)2d错(因为n=2,则l可能是0,1,即s,p轨道);(e)3p对;(f)3f错(因为n=3,则l可能是0,1,3即s,p,d轨道)。
北师大《无机化学》第四版习题答案10第十章沉淀溶解平衡10-1 (1)解:P b i2(s)=p b2+(aq)+2I-(aq)设溶解度为S.则:k sp(I2) =S×(2S)2=4S3=4×(1.29×10-3)3=8.6×10-9(2)解:溶解度S=2.91×10-3/253=1.15×10-5BaCrO4(s)=Ba2++CrO42-(BaCrO4)=S2 =(1.15×10-5)2 =1.32×10-1010-2 .(1) Zn(OH)2(s)=Zn2++2OH-K sp (Zn(OH)2)=S×(2S)2=4S3=4.12×10-17S*=2.18×10-6=2.17×10-4g/L(2) 解:P b (s)=P b2++2F-K sp(PbF2(s))=S*×(2S*)2=4S3=7.12×10-7S*=2.61 mol/L=6.39 g/L10-3 (1) 解:设AgIO3溶解度为S1, 设Ag2CrO4溶解度为S2, 则:AgIO3(s)=Ag++ IO3-K sp(AgIO3)=S1× S1=S12S1=( K sp(AgIO3)) 1/2=(9.2×10-9) 1/2=9.59×10-5 mol/L.Ag2CrO4(s)=2Ag ++ CrO42—K sp(Ag2CrO4)=(2S2) S2=4S23S2=( K sp(Ag2CrO4)/4) 1/3=(1.12×10-12/4) 1/3=6.54×10-5 mol/L(2)解:设AgIO3溶解度为S1, 设Ag2CrO4溶解度为S2, 则:AgIO3(s)=Ag++ IO3-S1 S1S1+0.01S1K sp(AgIO3)=(S1+0.01)×S1=0.01×S12=9.2×10-9Ag2CrO4(s)=2Ag ++ CrO4—2S2 S22S2+0.01S2K sp(Ag2CrO4)=(2S2+0.01)×S2=0.01×S22=1.12×10-12S2=1.12×10-8 mol/L∴S1>S2AgIO3在0.01 mol*L-1的AgIO3溶液中的溶解度大10-4(1)解:沉淀Ca2+:[SO42-]1=K sp(CaSO4)/ [Ca2+]=7.1×10-5/0.01=7.1×10--3沉淀Ba2+:[SO42-]2=K sp(BaSO4)/ [Ba2+]=1.07×10-10/0.01=1.07×10-8=1.07×10-10/0.01/7.1×10-5/0.01=1.5×10--8mol/L﹤1×10-5用Na2 SO4作沉淀剂能将Ca2+与Ba2+分离(2) 解:n(SO42-)=100×10-3 ×0.01=1×10-3 mol/L∴ m(Na2 SO4) =142×1×10-3=0.142(g)∴加入0.142 g Na2 SO4才能达到BaSO4完全沉淀的要求10-5解:C(MgCl2) =10×0.1/20=0.05 mol/L C(NH3.H2O) =10×0.01/20=0.005∴C(Mg2+)=0.05 mol/L∝C(NH3)/K b=0.005/1.774×10-5=281﹤500 [OH-]=1.774×10-5+(3.147×10-10+3.548×10-10)=2.89×10-4 mol/LJ =C(Mg2+)×C(OH-)2=0.05×(2.89×10-4)2 =4.81×10-9﹥K sp(Mg(OH)2)=5.61×10-12∴有Mg(OH)2沉淀生成10-6解:沉淀Fe3+[OH-]=( K sp(Fe(OH)3)/ [Fe3+])1/3=(2.64×10-39/0.05) 1/3=3.75×10-13 mol/L沉淀Fe2+[OH-]=( K sp(Fe(OH)2)/ [Fe2+])1/2=(4.87×10-17/0.05) 1/2=3.12×10-8 mol/L当Fe 3+沉淀完全时,[Fe 3+]=10-5 mol ·L -1[OH -]完全=(2.64×10-39/10-5)1/3=6.42×10-12 mol ·L-1∴pH 完全=14-12+0.8=2.8 ∴pH 开始=14-8+0.5=6.5 ∴pH 的范围为2.8~6.510-7在10mL 0.201-⋅L mol 溶液中加入10mL 含的0.010氨水溶含多少克CLNH 4才不至于生成()2OH Mn 沉淀?[]1210.0-+⋅=L mol Mn[]5310*8.1*10*10*01.0--=OH =410*42.0-离子积Q=[][]22-+OH Mn =1010*8.1-()[]13210*06.2-=OH Mn K spθQ >>SPk有沉淀生成要使不析出沉淀,应加抑制3NH 电离。
第六章化学平衡常数6.1写出下列各反应的标准平衡常数表达式和实验平衡常数表达式:(1)2SO 2(g)+O 2(g)=2SO 3(g)(2)NH 4HCO(s)=NH 3(g)+CO 2(g)+H 2O(g)(3)CaCO 3(s)=CO 2(g)+CaO(S)(4)AgO=2Ag(s)+l/2O 2(g)(5)CO 2(g)=CO 2(aq)(6)Cl 2(g)+H 2O(l)=H +(aq)+Cl -(aq)+HClO(aq)(7)HCN(aq)=H +(aq)+CN -(aq)(8)Ag 2CrO 4(s)=2Ag +(aq)+CrO 42-(aq)(9)BaSO 4(s)+CO 32--(aq)=CaCO 3(s)+SO 42-(aq)(10)Fe 2+(aq)+1/4O 2(g)+2H +(aq)=Fe 3+(aq)+H 2O(l)解:(1)K ()()()2223/SO SO O p p p p p p θθθ⎡⎤⎡⎤⎡⎤=⋅⎢⎢⎢⎥⎢⎥⎢⎥⎢⎥⎣⎦⎣⎦⎣⎦排版注意:请将符号Θ改为θ下同。
()2222()()/p SO SO O K p p p =⋅(2)K322()()()NH CO H O p p p p p pθθθ=⋅⋅322()()()p NH CO H O K p p p =⋅⋅(3)K2()CO p p θ=2()p CO K p =(4)K 21/2()O p p θ⎡⎤=⎢⎥⎣⎦2()p O K p =(5)K 22()()/CO CO c p c pθθ=22()()/CO CO K c p =(6)K 2()()()/ClH Cl HClO c c p c c c c p θθθθ+-=⋅⋅2()()()/HClO Cl H Cl K c c c p +-=⋅⋅(7)K ()()()/CN H HCN c c cc c c θθθ-+⎡⎤=⋅⎢⎥⎢⎥⎣⎦()()()/c HCN H CN K c c c +-=⋅(8)K 242()()CrO Ag c c c c θθ-+⎡⎤=⋅⎢⎥⎢⎥⎣⎦242()()c Ag CrO K c c +-=⋅(9)K2234()()/CO SO c c c cθθ--=2243()()/c SO CO K c c --=(10)K32221/2()()()()/O Fe Fe H c c c p c c p c θθθθ+++⎡⎤⎡⎤=⋅⋅⎢⎥⎢⎥⎢⎥⎣⎦⎣⎦K实验3221/22()()()()/O Fe Fe H c c p c +++=⋅⋅评注:除非固体为混合物而且活度系数不等于1,在化学平衡中又会发生变化,否则在平衡常数表达式中没有固体。
目录
第16章............................................................................................ - 2 -第22章............................................................................................ - 2 -第23章............................................................................................ - 2 -
第16章
1.有一种无色气体A,能使热的CuO还原,并逸出一种相当稳定得到气体B,
将A通过加热的金属钠能生成一种固体C,并逸出一种可燃性气体D。
A能与Cl2分步反应。
最后得到一种易爆的液体E。
指出A、B、C、D和E各为何物?并写出各过程的反应方程式。
第22章
1.有一黑色固体化合物A,它不溶于水、稀醋酸和氢氧化钠,却易溶于热盐酸
中,生成一中绿色溶液B。
如溶液B与铜丝一起煮沸,逐渐变棕黑色得到溶液C。
溶液C若用大量水稀释,生成白色沉淀D。
D可溶于氨溶液中,生成无色溶液E。
E若暴露于空气中,则迅速变成蓝色溶液F。
在溶液F中加入KCN时,蓝色消失,生成溶液G。
往溶液G中加入锌粉,则生成红棕色沉淀H。
H不溶于稀的酸和碱,可溶于热硝酸生成蓝色溶液I。
往溶液I中慢慢加入NaOH溶液生成蓝色胶状沉淀J。
将J过滤、取出。
然后强热,又生成原来化合物A。
试判断上述个字母所代表的物质,并写出相应的各化学反应方程式。
第23章
1.铬的某化合物A是橙红色溶于水的固体,将A用浓HCl处理产生黄绿色刺
激性气体B和生成暗绿色溶液C。
在C中加入KOH溶液,先生成灰蓝色沉淀D,继续加入过量的KOH溶液则沉淀消失,变成绿色的溶液E。
在E中加入H2O2加热则生成黄色溶液F,F用稀酸酸化,又变为原来的化合物A 的溶液。
问A,B,C,D,E,F各是什么物质,写出每步变化的反应方程式。
2.有一锰的化合物,它是不溶于水且很稳定的黑色粉末状物质A,该物质与浓
硫酸反应得到淡红色溶液B,且有无色气体C放出。
向B溶液中加入强碱得到白色沉淀D。
此沉淀易被空气氧化成棕色E。
若将A与KOH、KClO3一起混合熔融可得一绿色物质F,将F溶于水并通入CO2,则溶液变成紫色G,且又析出A。
试问A,B,C,D,E,F,G各为何物,并写出相应的方程式。
3.金属M溶于稀HCl生成MCl2,其磁矩为5.0B.M.。
在无氧条件下,MCl2与
NaOH作用产生白色沉淀A,A接触空气逐渐变成红棕色沉淀B,灼烧时,B变成红棕色粉末C。
C经不完全还原,生成黑色的磁性物质D。
B溶于稀HCl生成溶液E。
E能使KI溶液氧化出I2,若出加入KI前加入NaF,则不会析出I2。
若向B的浓NaOH悬浮液中通入氯气,可得紫红色溶液F,加入BaCl2时就析出红棕色固体G。
G是一种很强的氧化剂。
试确认M及由A到G所代表的化合物,写出反应方程式,画出各物质之间相互转化的相关图。
第16章
A.NH 3,
B.N 2,
C.NaNH 2,
D.H 2,
E.NCl 3
①2NH 3+3CuO=3Cu+N 2+3H 2O
②2NH 3+2Na=2NaNH 2+H 2
③NH 3+3Cl 2=NCl 3+3HCl
第22章
A.CuO ,
B.CuCl 2,
C.[CuCl 2]-,
D.CuCl ,
E.Cu(NH 3)2+,
F.Cu(NH 3)22+,G .[Cu(CN)4]3-,H.Cu ,I.Cu(NO 3)2,J.Cu(OH)2
①22CuO 2HCl =CuCl H O ++△
②CuCl 2+Cu+2Cl -=2[CuCl 2]-
③2[CuCl 2]-=CuCl ↓+2Cl -
④CuCl+2NH 3= Cu(NH 3)2++ Cl -
⑤4Cu(NH 3)2++O 2+8NH 3+2H 2O=4Cu(NH 3)22++4OH -
⑥2Cu(NH 3)22++10CN -=2[Cu(CN)4]3-+(CN)2↑+4NH 3↑
⑦2[Cu(CN)4]3-+Zn=[Zn(CN)4]2-+2Cu+4CN -
⑧3Cu+8HNO 3=3Cu(NO 3)2+2NO ↑+4H 2O
⑨Cu(NO 3)2+2NaOH=Cu(OH)2↓+2NaNO 3
⑩()22=CuO O C OH +H u △
第23章
1.A.K 2Cr 2O 7,B.Cl 2,C.CrCl 3,D.Cr(OH)3,E.KCrO 2,F.K 2CrO 4 ①K 2Cr 2O 7+14HCl(浓)=2KCl+2CrCl 3+3Cl 2↑
②CrCl 3+3KOH=Cr(OH)3↓+3KCl
③Cr(OH)3+KOH=KCrO 2+2H 2O
④2KCrO 2+3H 2O 2+2KOH=2K 2CrO 4+4H 2O
⑤2K 2CrO 4+H 2SO 4=K 2Cr 2O 7+Na 2SO 4+H 2O
2.A.MnO 2,B.MnSO 4,C.O 2,D.Mn(OH)2,E.MnO(OH)2,F.K 2MnO 4,G .KMnO 4 ①2MnO 2+2H 2SO 4(浓)=2MnSO 4+2H 2O+O 2↑
②MnSO 4+2OH -=Mn(OH)2↓+SO 42-
③3Mn(OH)2+O 2=2MnO(OH)2
④232423MnO 6KOH KClO =3K MnO +KCl+3H O ++△
⑤3K 2MnO 4+2CO 2=2KMnO 4+MnO 2+2K 2CO 3
3.A.Fe(OH)2,B.Fe(OH)3,C.Fe 2O 3,D.Fe 3O 4,E.FeCl 3+FeCl 2,F.Na 2FeO 4,G .BaFeO 4,M.Fe
①Fe+2HCl=FeCl 2+H 2↑
②FeCl 2+2NaOH=Fe(OH)2↓+2NaCl
③2Fe(OH)2+O 2+2H 2O=2Fe(OH)3
④32322Fe(OH)=Fe O +3H O △
⑤233423Fe O +CO =2Fe O +CO 高温
⑥Fe 3O 4+8HCl=2FeCl 3+FeCl 2+4H 2O
⑦FeCl3+KI=FeCl2+I2+KCl
⑧FeCl3+6NaF=3NaCl+3Na[FeF6]
⑨2Fe(OH)3+10NaOH+3Cl2=6NaCl+2Na2FeO4+8H2O ⑩Na2FeO4+BaC l2=BaFeO4↓+2NaCl。