2、第一类定位基--邻对位定位基
电子效应: 一般为推电子基团; 活化基团(推电子基团,使苯环电子云 密度增大,亲电反应易于进行)。
- +
H3C
理论解释: 共价键理论的解释:
+
受推电子基的影响,邻对位d-,亲电试剂 易于进攻;间位d+,亲电试剂难于进攻。
2、第一类定位基--邻对位定位基
+
较稳定
X X X X X
+
E H
X
E H
X H E
E H
X H E
E H
X H E
E H
较稳定
+
E
H
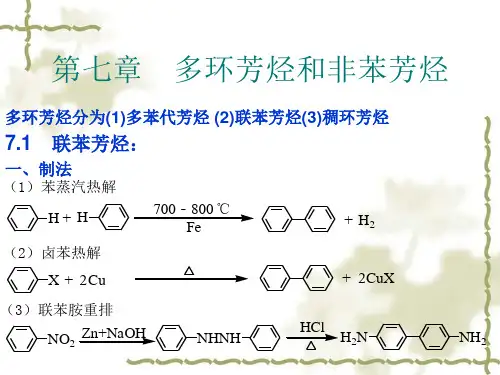
5、小结:各类取代基性能特性表
性能 邻对位定位基 间位定位基
强度
最强
强
中
弱
弱
强
最强
取 代 基
O-
NR2, NHR, OCOR, NH2, NHCOR OH, OR
F, NHCHO, Cl、Br、I, C6H5, CH2Cl, CR3, CH=CHCOOH, CH3 CH=CHNO2
+
Cl H 2C Cl
Cl2, hv
1、卤代反应
实验:甲苯的溴代
2、硝化反应nitration
+ HNO3 H2SO4 50~60oC NO2 + H2O
浓硝酸、浓硫酸的混合物常称为“混酸”。
2、硝化反应
反应机理:
2H2SO4 + HONO2
O2N H
NO2+ + H3O+ + 2HSO4硝酰正离子
CH CH 2
C CH
2-甲基-3-苯基戊烷