胰蛋白酶的分离纯化
- 格式:pptx
- 大小:1008.84 KB
- 文档页数:4





酶分离纯化过程中的问题以及进行酶活力等测定的意义班级:生物技术133 组别:第六组姓名:董冰夏学号:2013013906酶的分离纯化一般包括三个基本步骤:即抽提、纯化、结晶或制剂。
首先将所需的酶从原料中引入溶液,此时不可避免地夹带着一些杂质,然后再将此酶从溶液中选择性地分离出来,或者从此溶液中选择性地除去杂质,然后制成纯化的酶制剂。
酶的来源多为生物细胞。
生物细胞内产生的总的酶量虽然是很高的,但每一种酶的含量却很低,如胰脏中期消化作用的水解酶种类很多,但各种酶的含量却差别很大。
因此,在提取某一种酶时,首先应当根据需要,选择含此酶最丰富的材料,如胰脏是提取胰蛋白酶、胰凝乳蛋白酶、淀粉酶和脂酶的好材料。
由于从动物内脏或植物果实中提取酶制剂受到原料的限制,如不能综合利用,成本又很大。
目前工业上大多采用培养微生物的方法来获得大量的酶制剂。
从微生物中来生产酶制剂的优点有很多,既不受气候地理条件限制,而且动植物体内酶大都可以在微生物中找到,微生物繁殖快,产酶量又丰富,还可以通过选育菌种来提高产量,用廉价原料可以大量生产。
生物细胞产生的酶有两类:一类由细胞内产生后分泌到细胞外进行作用的酶,称为细胞外酶。
这类酶大都是水解酶,如酶法生产葡萄糖所用的两种淀粉酶,就是由枯草杆菌和根酶发酵过程中分泌的。
这类酶一般含量较高,容易得到;另一类酶在细胞内产生后并不分泌到细胞外,而在细胞内起催化作用,称为细胞内酶,如柠檬酸、肌苷酸、味精的发酵生产所进行的一系列化学反应,就是在多种酶催化下在细胞内进行的,在类酶在细胞内往往与细胞结构结合,有一定的分布区域,催化的反应具有一定的顺序性,使许多反应能有条不紊地进行。
由于在生物组织中,除了我们所需要的某一种酶之外,往往还有许多其它酶和一般蛋白质以及其他杂质,因此为制取某酶制剂时,必须经过分纯化的手续。
因为酶是具有催化活性的蛋白质,蛋白质很容易变性,所以在酶的提纯过程中应避免用强酸强碱,保持在较低的温度下操作。



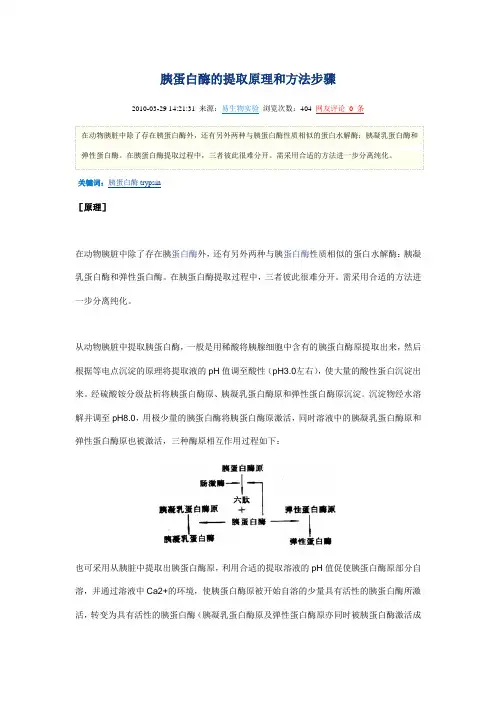
胰蛋白酶的提取原理和方法步骤2010-03-29 14:21:31 来源:易生物实验浏览次数:404 网友评论0 条在动物胰脏中除了存在胰蛋白酶外,还有另外两种与胰蛋白酶性质相似的蛋白水解酶:胰凝乳蛋白酶和弹性蛋白酶。
在胰蛋白酶提取过程中,三者彼此很难分开。
需采用合适的方法进一步分离纯化。
关键词:胰蛋白酶trypsin[原理]在动物胰脏中除了存在胰蛋白酶外,还有另外两种与胰蛋白酶性质相似的蛋白水解酶:胰凝乳蛋白酶和弹性蛋白酶。
在胰蛋白酶提取过程中,三者彼此很难分开。
需采用合适的方法进一步分离纯化。
从动物胰脏中提取胰蛋白酶,一般是用稀酸将胰腺细胞中含有的胰蛋白酶原提取出来,然后根据等电点沉淀的原理将提取液的pH值调至酸性(pH3.0左右),使大量的酸性蛋白沉淀出来。
经硫酸铵分级盐析将胰蛋白酶原、胰凝乳蛋白酶原和弹性蛋白酶原沉淀。
沉淀物经水溶解并调至pH8.0,用极少量的胰蛋白酶将胰蛋白酶原激活,同时溶液中的胰凝乳蛋白酶原和弹性蛋白酶原也被激活,三种酶原相互作用过程如下:也可采用从胰脏中提取出胰蛋白酶原,利用合适的提取溶液的pH值促使胰蛋白酶原部分自溶,并通过溶液中Ca2+的环境,使胰蛋白酶原被开始自溶的少量具有活性的胰蛋白酶所激活,转变为具有活性的胰蛋白酶(胰凝乳蛋白酶原及弹性蛋白酶原亦同时被胰蛋白酶激活成有活性的酶)。
激活后的酶溶液再进一步分离纯化。
[试剂和器材]1、试剂(1)pH2.5~3.0乙酸化的水溶液(2)10%(体积分数)乙酸(3)2mol/L硫酸(4)固体硫酸铵(5)无水CaCl2(6)结晶胰蛋白酶(7)25%乙醇溶液(含0.015mol/LHCl 、0.05mol/LCaCl2)(8)95%(体积分数)乙醇(9)5mol/LNaOH(10)丙酮2、器材(1)胰脏(2)组织捣碎机(3)离心机(4)磁力搅拌器(5)透析袋、20目筛网、纱布、水浴锅(6)烧杯、量筒、刻度吸管、试管、玻璃漏斗(7)布氏漏斗、抽滤瓶、温度计、滴管、玻璃搅棒、纱布、pH试纸等[方法和步骤]方法一1、胰蛋白酶原的提取取新鲜胰脏约150g,剥去结缔组织和脂肪,取净重100g,切成碎块,在组织捣碎机中捣碎,并加入2倍体积预冷的pH2.5~3.0 乙酸化水溶液,制成匀浆。

胰蛋白酶糜蛋白酶制备方法胰蛋白酶和糜蛋白酶是两种常用的酶制剂,用于消化蛋白质。
它们在医疗、生物工程和食品工业等领域都有广泛的应用。
本文将介绍胰蛋白酶和糜蛋白酶的制备方法。
胰蛋白酶的制备方法:胰蛋白酶是一种消化酶,主要由胰腺分泌。
在制备胰蛋白酶时,主要包括以下几个步骤:1. 提取胰蛋白酶:首先需要从动物的胰腺中提取胰蛋白酶。
一般使用动物胰腺作为原料,如猪胰腺、牛胰腺等。
提取胰蛋白酶的方法通常是将动物胰腺切碎,加入缓冲液中,通过机械或化学方法破坏细胞膜,释放胰蛋白酶。
2. 纯化胰蛋白酶:提取的胰蛋白酶中可能还存在其他酶或杂质,需要进行纯化。
常用的纯化方法包括离心、过滤、吸附和层析等。
通过这些纯化方法,可以去除杂质,得到较纯的胰蛋白酶。
3. 浓缩胰蛋白酶:纯化后的胰蛋白酶可能是稀释的,需要进行浓缩。
常用的浓缩方法有蒸发法、超滤法和冷冻干燥法等。
通过这些方法,可以使胰蛋白酶的浓度提高,方便后续的应用。
4. 活性检测:制备好的胰蛋白酶需要进行活性检测,以确保其具有一定的消化能力。
常用的活性检测方法包括酶活测定、底物降解等。
糜蛋白酶的制备方法:糜蛋白酶是一种能够降解胶原蛋白的酶,主要用于医疗和化妆品等领域。
糜蛋白酶的制备方法主要包括以下几个步骤:1. 选择菌株:从自然环境中选择具有糜蛋白酶产生能力的细菌或真菌菌株。
常见的菌株有放线菌、枯草杆菌等。
2. 培养菌株:将选定的菌株接种于合适的培养基中,并进行培养。
培养条件包括温度、pH值、培养时间和培养方法等。
通过培养,菌株能够产生和分泌糜蛋白酶。
3. 收集糜蛋白酶:培养一定时间后,菌体和培养基中会含有糜蛋白酶。
收集的方法可以采用离心、过滤等方式,将糜蛋白酶从培养基中分离出来。
4. 纯化糜蛋白酶:收集到的糜蛋白酶中可能还有其他酶或杂质,需要进行纯化。
纯化方法可以采用离心、吸附、层析等技术,去除杂质,得到纯净的糜蛋白酶。
5. 活性检测:制备好的糜蛋白酶需要进行活性检测,以确定其降解胶原蛋白的能力。

一、实验目的1. 学习和掌握胰蛋白酶的纯化方法。
2. 了解胰蛋白酶的理化性质和生物学功能。
3. 培养实验操作技能和数据分析能力。
二、实验原理胰蛋白酶是一种广泛存在于胰腺中的丝氨酸蛋白酶,具有水解蛋白质的能力。
本实验采用硫酸铵盐析法对胰蛋白酶进行纯化,该方法具有操作简便、成本低廉、纯度较高等优点。
三、实验材料1. 胰蛋白酶粗品:由动物胰腺提取。
2. 硫酸铵:分析纯。
3. 氯化钠:分析纯。
4. 磷酸盐缓冲液(pH 7.0):0.1 mol/L。
5. 其他试剂:三氯乙酸、硫酸、氢氧化钠等。
四、实验方法1. 胰蛋白酶粗品预处理:将胰蛋白酶粗品溶解于磷酸盐缓冲液(pH 7.0),搅拌使其充分溶解。
2. 盐析:向胰蛋白酶溶液中加入硫酸铵,使其饱和,充分搅拌,室温静置过夜。
3. 沉淀收集:用布氏漏斗抽滤,收集沉淀,并用磷酸盐缓冲液(pH 7.0)洗涤沉淀。
4. 脱盐:将沉淀溶于适量的水,加入适量的三氯乙酸,使蛋白质变性,去除杂质。
5. 纯化:将变性后的蛋白质溶液透析,去除三氯乙酸和硫酸铵。
6. 蛋白质复性:将透析后的蛋白质溶液加入适量的磷酸盐缓冲液(pH7.0),使蛋白质复性。
7. 检测:采用SDS-PAGE方法检测纯化后的胰蛋白酶。
五、实验结果与分析1. 盐析:在胰蛋白酶溶液中加入硫酸铵后,溶液出现白色沉淀,说明胰蛋白酶已经盐析。
2. 沉淀收集:通过抽滤,收集到白色沉淀,表明胰蛋白酶已经沉淀。
3. 脱盐:加入三氯乙酸后,沉淀溶解,表明蛋白质已经变性。
4. 纯化:透析后的蛋白质溶液中,SDS-PAGE电泳结果显示,只有一个明显的条带,说明胰蛋白酶已经纯化。
5. 蛋白质复性:复性后的胰蛋白酶溶液中,SDS-PAGE电泳结果显示,蛋白条带清晰,说明蛋白质已经复性。
六、实验结论本实验采用硫酸铵盐析法对胰蛋白酶进行纯化,成功地将胰蛋白酶从粗品中分离出来,并通过SDS-PAGE电泳检测,证明纯化后的胰蛋白酶具有较高的纯度。
化学生物学论文班级:2009级化学生物学班姓名:学号:胰蛋白酶的研究及应用摘要:以胰蛋白酶为例研究酶的结构与功能。
酶学知识来源于生产与生活实践。
我们祖先很早就会制酱和酿酒。
西方国家于1810年发现酵母可将糖转化为酒精;1833年,Payen及Persoz 从麦芽的水抽提物中用酒精沉淀得到一种热不稳定物,可使淀粉水解成可溶性糖;1878年德国科学家屈内(Kuhne)首先把这类物质称为酶(enzyme,其意“在酵母中”)。
1860年法国科学家巴斯德(Pasteur)认为发酵是酵母细胞生命活动的结果,细胞破裂则失去发酵作用。
1897年,Buchner兄弟首次用不含细胞的酵母提取液实现了发酵,证明发酵是酶作用的化学本质,获得1911年诺贝尔化学奖。
1926年,美国生化学家Sumner第一次从刀豆得到脲酶结晶,并证明是蛋白质。
1930年,Northrop得到胃蛋白酶的结晶(1946年二人共获诺贝尔化学奖)。
1963年测定第一个牛胰RNaseA序列(124aa);1965年揭示卵清溶菌酶的三维结构(129aa)。
酶是由活细胞合成的,对其特异底物起高效催化作用的生物催化剂(biocatalyst)。
已发现的有两类:主要的一类是蛋白质酶(enzyme),生物体内已发现4000多种,数百种酶得到结晶。
美国科学家Cech于1981年在研究原生动物四膜虫的RNA前体加工成熟时发现核酶“ribozyme”,为数不多,主要做用于核酸(1989年的诺贝尔化学奖)。
酶所催化的反应称为酶促反应。
在酶促反应中被催化的物质称为底物,反应的生成物称为产物。
酶所具有的催化能力称为酶活性。
酶作为生物催化剂,具有一般催化剂的共性,如在反应前后酶的质和量不变;只催化热力学允许的化学反应,即自由能由高向低转变的化学反应;不改变反应的平衡点。
但是,酶是生物大分子,又具有与一般催化剂不同的特点。
一、单纯酶和结合酶单纯酶是仅由肽链构成的酶。
如脲酶、一些消化蛋白酶、淀粉酶、脂酶、核糖核酸酶等。
亲和层析法纯化胰蛋白酶一.实验目的1.理解亲和层析法的基本原理,并通过实验能初步掌握制备一种亲和吸附剂的操作方法;2.掌握利用紫外可见分光光度计测定酶活性和抑制酶活性的原理和方法。
二.实验原理亲和层析主要是根据生物分子与其特定的固相化的配基或配体之间具有一定的亲和力而使生物分子得以分离。
这是由一种典型的吸附层析发展而来的分离纯化方法。
许多生物分子都具有能和某些相对应的专一分子可逆地结合的特性。
这种分子之间的结合能力做亲和力。
亲和层析正是利用生物分子间所具有的专一亲和力而设计的层析技术。
所以有人称为“生物专一吸附技术”。
在实际工作中,只要把被识别的分子,称为配基(Ligand),在不损害其生物学功能的条件下共价结合到水不溶性载体或基质上(如Sepharose4B)制成亲和吸附剂,然后装柱。
再把含有要分离纯化的物质的混合液通过这个柱子,这时绝大部分对配基没有亲和力的化合物均顺利地流过层析柱而不滞留,只有与配基互补的化合物被吸附留在柱内。
当所有的杂质从柱上流走后,再改变洗脱条件,使结合在配基上的物质解离下来。
这样,原来混合液中被分离的物质便以高度纯化的形式在洗脱液中出现。
本实验为了纯化胰蛋白酶,采用胰蛋白酶的天然抑制剂—鸡卵粘蛋白作为配基制成亲和吸附剂。
鸡卵粘蛋白是专一性较高的胰蛋白酶抑制剂,对牛和猪的胰蛋白酶有相当强的抑制作用,但不抑制糜蛋白酶。
在pH=7-8的缓冲溶液中卵粘蛋白与胰蛋白酶牢固地结合,而在pH=2-3时,又能被解离下来。
采用鸡卵粘蛋白作成的亲和吸附剂可以从粗提液中通过一次亲和层析直接获得高纯度的胰蛋白酶制品,比用经典分离纯化方法简便得多。
纯化效率可达到10-20倍以上。
三.实验方法步骤1.鸡卵粘蛋白的制备取蛋清60ml,加入等体积的三氯乙酸丙酮溶液(丙酮:三氯乙酸=40:60)后,出现大量白色沉淀,搅匀后室温静置4h以上,待清蛋白完全沉淀,3000rpm 离心10min,弃去沉淀,47ml上清液倒入250ml锥形瓶并用塑料薄膜封好,置于冰箱中冰浴片刻,缓慢加入3倍体积(141ml)的预冷丙酮,搅匀后冰浴4h直到出现沉淀,用真空泵抽去部分上清液,剩余部分的部分沉淀和上清液全部转移至离心管中,以3000rpm下离心15min,弃上清液。
测序级胰蛋白酶生产工艺测序级胰蛋白酶是一种重要的酶制剂,广泛应用于生物医药、食品工业、环境保护等领域。
本文将从生产工艺的角度介绍测序级胰蛋白酶的制备过程。
一、胰蛋白酶的来源与提取胰蛋白酶主要来源于动物胰腺组织,常用的动物包括猪、牛等。
提取胰蛋白酶的方法通常包括以下几个步骤:1. 动物胰腺的收集:选择健康的动物,将其胰腺收集起来。
在收集过程中,要保证胰腺组织的新鲜度,避免组织受到损伤。
2. 组织的粉碎:将收集到的胰腺组织进行粉碎,可以采用机械研磨或者酶解的方法。
粉碎的目的是使胰蛋白酶能够更好地释放出来。
3. 蛋白质的溶解:将粉碎后的胰腺组织加入适量的缓冲液,进行蛋白质的溶解。
常用的缓冲液包括磷酸盐缓冲液、氯化钠溶液等。
4. 蛋白质的分离:通过离心等方法,将溶解后的蛋白质与残渣分离开来。
分离后的蛋白质溶液即为胰蛋白酶的提取液。
二、测序级胰蛋白酶的纯化与精制提取液中的胰蛋白酶通常还存在着其他的蛋白质、杂质等物质,需要进行纯化和精制。
常用的纯化方法包括以下几种:1. 盐析法:利用胰蛋白酶与其他蛋白质在盐浓度不同的条件下溶解性的差异,通过逐渐增加盐浓度来分离纯化胰蛋白酶。
2. 层析法:利用胰蛋白酶与其他蛋白质在固定相上的相互作用差异,通过选择性地吸附、洗脱等步骤,使胰蛋白酶得以纯化。
3. 电泳法:利用胰蛋白酶与其他蛋白质在电场中的迁移速度差异,通过电泳分离来纯化胰蛋白酶。
纯化后的胰蛋白酶还需要进行精制,以获得测序级的制剂。
精制的过程中通常包括以下几个步骤:1. 去除胰蛋白酶中的核酸:利用核酸酶将胰蛋白酶中的核酸降解,从而减少核酸对测序的影响。
2. 去除胰蛋白酶中的蛋白酶抑制剂:胰蛋白酶抑制剂会降低胰蛋白酶的活性,因此需要通过抗蛋白酶抑制剂的方法将其去除。
3. 调节pH值和温度:胰蛋白酶的活性受到pH值和温度的影响,因此需要将其调节到适宜的范围内。
三、测序级胰蛋白酶的质量控制生产测序级胰蛋白酶的过程中需要进行严格的质量控制,以确保最终产品的质量符合要求。
猪胰蛋白酶的提取分离、纯化一、实验目的1. 学习胰蛋白酶的纯化及其结晶的基本方法。
2. 复习用紫外法测定酶酶溶液中蛋白质含量。
3、学习用BAEE法测定蛋白酶活力的测定。
二、实验原理胰蛋白酶是以无活性的酶原形式存在于动物胰脏中,在Ca2+的存在下,被肠激酶或有活性的胰蛋白酶自身激活,从肽链N端赖氨酸和异亮氨酸残基之间的肽键断开,失去一段六肽,分子构象发生一定改变后转变为有活性的胰蛋白酶。
胰蛋白酶原的分子量约为24000,其等电点约为pH8.9,胰蛋白酶的分子量与其酶原接近(23300),其等电点约为pH10.8,最适pH7.6~8.0,在pH=3时最稳定,低于此pH时,胰蛋白酶易变性,在pH>5时易自溶。
Ca2+离子对胰蛋白酶有稳定作用。
重金属离子,有机磷化合物和反应物都能抑制胰蛋白酶的活性,胰脏、卵清和豆类植物的种子中都存在着蛋白酶抑制剂。
最近发现在一些植物的块基(如土豆、白薯、芋头等)中也存在有胰蛋白酶抑制剂。
胰蛋白酶能催化蛋白质的水解,对于由碱性氨基酸(精氨酸、赖氨酸)的羧基与其他氨基酸的氨基所形成的键具有高度的专一性。
此外还能催化由碱性氨基酸和羧基形成的酰胺键或酯键,其高度专一性仍表现为对碱性氨基酸一端的选择。
胰蛋白酶对这些键的敏感性次序为:酯键> 酰胺键> 肽键。
因此可利用含有这些键的酰胺或酯类化合物作为底物来测定胰蛋白酶的活力。
目前常用苯甲酰-L-精氨酸-对硝基苯胺(简称BAPA)和苯甲酰-L-精氨酸-β-萘酰胺(简称BANA)测定酰胺酶活力。
用苯甲酰-L-精氨酸乙酯(简称BAEE)和对甲苯磺酰-L-精氨酸甲酯(简称TAME)测定酯酶活力。
本实验以BAEE为底物,用紫外吸收法测定胰蛋白酶活力。
酶活力单位的规定常因底物及测定方法而异。
从动物胰脏中提取胰蛋白酶时,一般是用稀酸溶液将胰腺细胞中含有的酶原提取出来,然后再根据等电点沉淀的原理,调节pH以沉淀除去大量的酸性杂蛋白以及非蛋白杂质,再以硫酸铵分级盐析将胰蛋白酶原等(包括大量的酸性杂蛋白以及非蛋白杂质,再以硫酸铵分级盐析将胰蛋白酶原等(包括大量糜蛋白酶原和弹性蛋白酶原)沉淀析出。