高考化学第1节认识晶体专题1
- 格式:doc
- 大小:47.00 KB
- 文档页数:7
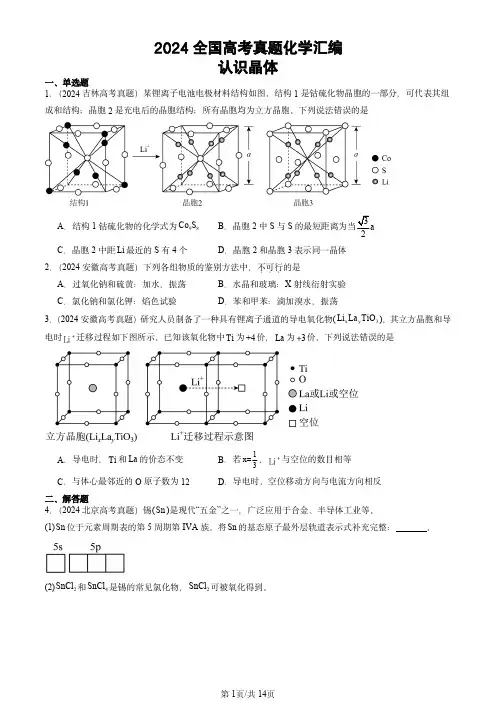
2024全国高考真题化学汇编认识晶体一、单选题1.(2024吉林高考真题)某锂离子电池电极材料结构如图。
结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。
下列说法错误的是A .结构1钴硫化物的化学式为98Co SB .晶胞2中S 与S 的最短距离为当3a 2C .晶胞2中距Li 最近的S 有4个D .晶胞2和晶胞3表示同一晶体2.(2024安徽高考真题)下列各组物质的鉴别方法中,不可行...的是A .过氧化钠和硫黄:加水,振荡B .水晶和玻璃:X 射线衍射实验C .氯化钠和氯化钾:焰色试验D .苯和甲苯:滴加溴水,振荡3.(2024安徽高考真题)研究人员制备了一种具有锂离子通道的导电氧化物(x y 3Li La TiO ),其立方晶胞和导电时+Li 迁移过程如下图所示。
已知该氧化物中Ti 为+4价,La 为3 价。
下列说法错误的是A .导电时,Ti 和La 的价态不变B .若1x=3,+Li 与空位的数目相等C .与体心最邻近的O 原子数为12D .导电时、空位移动方向与电流方向相反二、解答题4.(2024北京高考真题)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第5周期第IVA 族。
将Sn 的基态原子最外层轨道表示式补充完整:。
(2)2SnCl 和4SnCl 是锡的常见氯化物,2SnCl 可被氧化得到。
①2SnCl 分子的VSEPR 模型名称是。
②4SnCl 的Sn Cl —键是由锡的轨道与氯的3p 轨道重叠形成σ键。
(3)白锡和灰锡是单质Sn 的常见同素异形体。
二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn 原子周围与它最近且距离相等的Sn 原子有个。
②若白锡和灰锡的晶胞体积分别为31v nm 和32v nm ,则白锡和灰锡晶体的密度之比是。
(4)单质Sn 的制备:将2SnO 与焦炭充分混合后,于惰性气氛中加热至800C ,由于固体之间反应慢,未明显发生反应。









高考化学第1节认识晶体专题1
2020.03
1,有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫______,其晶体类型是______。
(2)B的氢化物的电子式为______,属______分子。
(极性或非极性)
(3)A和B形成化合物的分子空间构型为______,属______分子(极性或非极性),其晶体类型是______。
俗名______。
(4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)_______________________。
(5)C和D的化合物溶于水后滴入过量KOH,现象是_______________________________,离子方程式_______________________________。
2,下列关于胶体的叙述不正确的是 ( )
A.布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来
B.光线透过胶体时,胶体发生丁达尔现象
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
3,有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸溶胶、As2S3胶体、NaOH溶液。
现将有关实验现象记录如下:(1)电泳:甲液体的阳极周围颜色变浅,阴极周围颜色变深;(2)将一束光通过乙液体,无丁达尔现象;(3)将乙慢慢加入到丙中,先出现浑浊,后液体变清。
则甲为,乙为,丙为,丁为
4,二氧化硅晶体是立体的网状结构,其晶体模型如右图所示。
认真观察晶体模型并回答下列问题:
(1)二氧化硅晶体中最小的环为元环。
(2)每个硅原子为个最小环共有。
(3)每个最小环平均拥有
5,下列过程需要通电后才可以进行的是 ( )
①电离②电解③电镀④电泳⑤电化腐蚀
A.①②③ B.②③④ C.②④⑤ D.全部
6,下列与胶体无关的事实是 ( )
A.明矾用于净水 B.澄清石灰水在空气中放置后变浑浊
C.用FeCl3止血 D.用石膏点豆腐
7,某离子晶体晶胞结构如下图所示,x位于立方体的顶点,
Y位于立方体中心。
试分析:
(1)晶体中每个Y同时吸引着__________个X,每个x同时
吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有
__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹∠XYX的
度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为N A则晶体中两个距离最近的X中心间的距离为__________ 。
8,下面有关离子晶体的叙述中,不正确的是()
A.1mol氯化钠中有N A个NaCl分子
B.氯化钠晶体中,每个Na+周围距离相等的Na+共有12个
C.氯化铯晶体中,每个C S+周围紧邻8个Cl-
D.平均每个NaCl晶胞中有4个Na+、4个Cl-
9,下列的晶体中,化学键种类相同,晶体类型也相同的是()
A.SO2与Si02 B.C02与H20 C.NaCl与HCl D.CCl4与KCl
10,将饱和三氯化铁溶液滴入沸水时,液体变为色,得到的是;反应的离子方程式为;用此分散系进行实验: (1)将其装入U型管内,用石墨做电极,接通直流电源,通电一段时间后发现阴极附近颜色,这表明,这种现象称为。
(2)向其中加入饱和的硫酸铵溶液,发生的现象是;原因是。
(3)向其中逐滴加入过量稀硫酸,现象是;原因是(4)提纯此分散系的方法叫
11,可以用来证明胶体粒子大于溶液中溶质粒子的实验为 ( ) A.丁达尔现象 B.渗析 C.电泳 D.聚沉
12,把淀粉溶于沸水中,制成淀粉胶体。
(1)鉴别溶液和胶体可以利用的方法是。
(2)60℃左右时,在淀粉胶体中加入淀粉酶,充分反应,然后把反应后的全部液体装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。
从半透膜袋里析出的物质是,该操作的名称是。
13,现有甲、乙、丙、丁和Fe(OH)3等五种胶体,按甲和丙、乙和丁、丙和丁、乙和Fe(OH)3胶体两两混合,均出现胶体聚沉现象。
则粒子带负电荷的胶体是()
A.甲和乙 B.丙和乙 C.甲和丁 D.丙和Fe(OH)3胶体
14,下列化学式能真实表示物质分子组成的是
()
A.NaOH B.Si02 C.CsCl D.S03
15,向下列溶液中滴加稀硫酸,生成白色沉淀,继续滴加稀H2SO4沉淀又溶解的是 ( )
A.Na2CO3 B.BaCl2 C.Fe(OH)3胶体 D.NaAlO2
16,下列叙述正确的是 ( )
A.饱和溶液一定是浓溶液 B.不饱和溶液一定是稀溶液
C.同温同溶质的饱和溶液浓度大于不饱和溶液的浓度 D.以上叙述都不正确
17,下列说法中,正确的是()
A.冰融化时,分子中H-O键发生断裂
B.原子晶体中,共价键的键长越短,通常熔点就越高
C.分子晶体中,共价键键能越大,该分子的熔沸点就越高
D.分子晶体中,分子间作用力越大,则分子越稳定
18,关于晶体的下列说法正确的是()
A.只要含有金属阳离子的晶体就一定是离子晶体
B.离子晶体中一定含金属阳离子
C.在共价化合物分子中各原子都形成8电子结构
D.分子晶体的熔点不一定比金属晶体熔点低
答案
1, (1)金刚石;原子晶体
(3)直线型分子;非极性;分子晶体;干冰
(4)3;ⅢA;HClO4>H2CO3>Al(OH)3 (5)先有白色沉淀,滴入过量KOH 时白色沉淀消失。
Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
2, A
3, 甲为Fe(OH)3胶体乙为NaOH溶液丙为硅酸胶体丁为As2S3胶体(1)电泳实验说明胶粒带正电荷,甲为Fe(OH)3胶体;(2)无丁达尔现象只有NaOH溶液;(3)将乙(NaOH溶液)加入到丙中,先出现浑浊,后液体变清,说明是硅酸溶液。
出现混浊是胶体遇电解质溶液的结果,后又变浑浊是两者发生了化学反应
4, 12、12、1
5, B
6, B
7, (1)4 8 XY2(或Y2X) (2)12 (3)109°28' (4)
3
2
A m
N 8, A
9, B
10, 红褐色;Fe(OH)3胶体 Fe+3H2O △
Fe(OH)3+3H+
(1)逐渐变深;Fe(OH)3胶粒带正电荷;电泳
(2)形成红褐色沉淀,电解质电离出的离子中和了胶体粒子所带电荷,使Fe(OH)3胶体聚沉
(3)先出现红褐色沉淀,后沉淀溶解为黄色溶液;电解质使Fe(OH)3胶体聚沉,随着H2SO4的加入,H+与Fe(OH)3发生Fe(OH)3+3H+ = Fe3++3H2O 反应,沉淀溶解。
11, B
12, (1)用可见光照射,观察有无“丁达尔现象”,有就是胶体。
(2)麦芽糖渗析。
因为胶体不能透过半透膜,而小分子可自由通过
13, B
14, D
15, D
16, C
17, B
18, D。