硫磺性质
- 格式:doc
- 大小:148.50 KB
- 文档页数:4

硫磺不溶于水的原因硫磺作为一种常见的物质,具有许多特殊的性质。
其中一个最引人注目的特点就是它不溶于水。
这一现象可以通过物理和化学的角度来解释。
从物理的角度来看,硫磺不溶于水是因为它们之间的相互作用力较弱。
水分子是极性分子,由一个氧原子和两个氢原子组成。
氧原子带有部分负电荷,而氢原子则带有部分正电荷。
这种极性使得水分子能够形成氢键,并形成水的网状结构。
而硫磺分子是非极性分子,由八个硫原子组成,硫原子之间的键非常强大。
这种非极性的硫磺分子与水分子之间的相互作用力较弱,因此硫磺不溶于水。
从化学的角度来看,硫磺不溶于水是因为硫磺与水反应的能力较弱。
水是一种良好的溶剂,具有较强的溶解能力。
然而,硫磺与水反应的化学反应并不容易发生。
硫磺分子中的硫原子之间的键非常强大,因此很难被水分子所破坏。
此外,硫磺分子与水分子之间也没有明显的化学反应。
因此,硫磺不溶于水。
除了不溶于水,硫磺还具有其他一些特殊的性质。
例如,硫磺在常温下是一种黄色的固体,它具有较低的熔点和沸点。
当硫磺受热时,它会迅速融化,并在冷却时形成硫磺的结晶。
这种特殊的物理性质使得硫磺在许多领域得到广泛应用,例如火药、农药、橡胶制造等。
硫磺还具有一种独特的气味。
当硫磺受热时,它会释放出一种刺激性气味。
这种气味不仅对人类具有较强的感知能力,而且对许多动物也具有明显的影响。
这种气味的产生与硫磺分子中的硫原子有关。
硫原子与氧原子结合形成硫氧键,从而形成硫磺分子。
当硫磺受热时,硫氧键会断裂,释放出硫原子并与空气中的氧气反应,形成硫化物。
这种硫化物具有刺激性气味,因此使得硫磺具有独特的气味。
总的来说,硫磺不溶于水是因为硫磺分子与水分子之间的相互作用力较弱,硫磺与水反应的能力较弱。
这种性质使得硫磺在许多领域得到广泛应用,同时也使得硫磺具有独特的气味。
对于我们来说,了解硫磺的这些特性有助于我们更好地理解和应用它。

硫磺(化学、工业产品)硫磺别名硫、胶体硫、硫黄块。
外观为淡黄色脆性结晶或粉末,有特殊臭味。
分子量为32.06,蒸汽压是0.13kPa,闪点为207℃,熔点为119℃,沸点为444.6℃,相对密度(水=1)为2.0。
硫磺不溶于水,微溶于乙醇、醚,易溶于二硫化碳。
作为易燃固体,硫磺主要用于制造染料、农药、火柴、火药、橡胶、人造丝等。
硫磺是无机农药中的一个重要品种。
商品为黄色固体或粉末,有明显气味,能挥发。
硫磺水悬液呈微酸性,不溶于水,与碱反应生成多硫化物。
硫磺燃烧时发出青色火焰,伴随燃烧产生二氧化硫气体。
生产中常把硫磺加工成胶悬剂用于防治病虫害,它对人、畜安全,不易使作物产生药害。
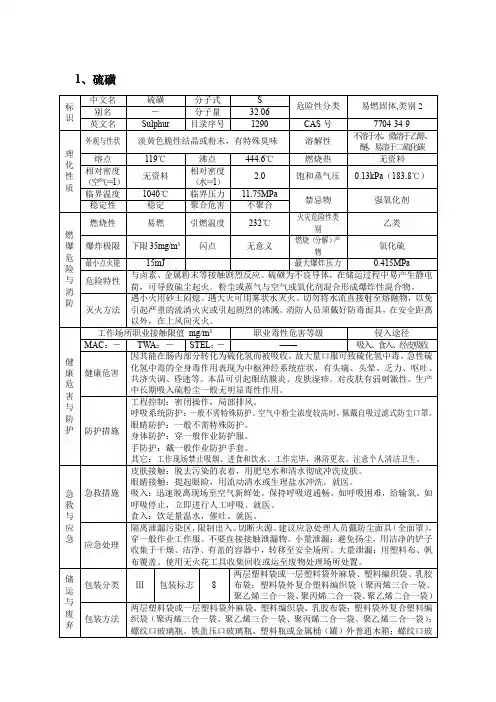
中文名硫磺英文名Sulphur别称硫磺、硫块、粉末硫磺、磺粉、硫磺块、硫磺粉化学式S分子量32.06CAS登录号7704-34-9熔点114 °C沸点445℃水溶性能溶于二硫化碳,不溶于水密度2.36闪点168 °C一、物化性质元素符号S,原子序数16,原子量32.06,外围电子排布3S23p4,位于第三周期第ⅥA族,主要氧化数-2、0、+2、+4、+6。
原子共价半径104皮米,离子半径S-2184皮米,S+630皮米,第一电离能1000kJ/mol,电负性2.5。
单质硫俗称硫磺,块状硫磺为淡黄色块状结晶体,粉末为淡黄色粉末,有特殊臭味,能溶于二硫化碳,不溶于水。
工业硫磺呈黄色或淡黄色,有块状、粉状、粒状或片状等。
有多种同素异形体,斜方硫又叫菱形硫或α-硫,在95.5℃以下最稳定,密度2.1g/cm3,熔点112.8℃,沸点445℃,质脆,不易传热导电;单斜硫又称β-硫,在95.5°以上时稳定,密度1.96g/cm3;弹性硫又称γ-硫是无定形的,不稳定,易转变为α-硫。
斜方硫和单斜硫都是由S8环状分子组成,液态时为链状分子组成,蒸气中有S8、S4、S2 等分子,1000℃以上时蒸气由S2组成。

硫磺燃点全文共四篇示例,供读者参考第一篇示例:硫磺是一种常见的黄色晶体,常见于火山喷发、温泉沉积和硫磺矿床等地方。
它具有特殊的化学性质,包括极高的燃点,被广泛用于各种领域的应用。
硫磺的燃点是指其在加热下开始燃烧的温度。
硫磺具有较高的燃点,通常在190至200摄氏度左右。
这一特性使得硫磺在工业领域具有广泛的应用价值,例如在火药、硫酸、化肥、橡胶和化学品生产等领域。
硫磺的高燃点使其能够在高温下保持稳定状态,并且不易燃烧,有利于在各种工艺过程中的控制和安全操作。
在工业生产中,硫磺的燃点是一个重要的参数,对于生产过程的设计和运行都起着关键作用。
工程师们在设计生产设备和制定生产工艺方案时,通常会考虑到硫磺的燃点,以确保设备运转安全可靠,并且能够高效地利用硫磺的特性。
硫磺的高燃点也意味着它可以作为防火材料来使用。
在建筑工程和交通运输领域,硫磺可以作为阻燃剂添加在材料中,提高其阻燃性能,降低火灾发生的风险。
硫磺还可以用于制造火柴等易燃物品,通过硫磺的高燃点来延缓着火的速度,增加灭火的时间窗口,提高人们逃生的机会。
除了在工业和防火领域的应用外,硫磺的高燃点还有助于其在制药、农业和其他领域的应用。
在医药领域,硫磺可以用作一种药剂,用于治疗皮肤疾病和其他疾病。
在农业领域,硫磺可以用作杀虫剂和杀菌剂,帮助农民保护作物和预防病害。
第二篇示例:硫磺是一种常见的化学元素,化学符号为S,原子序数为16,属于周期表上的第16族,在自然界中以多种形式存在,如硫化物、硫酸盐等。
硫磺具有很高的燃点,是一种非常理想的燃烧物质,被广泛应用于火药、火柴、硫磺火炬等领域。
本文将从硫磺的性质、燃点及应用领域等方面进行详细介绍。
硫磺具有典型的硫黄色,呈现出黄色的晶体状,常温下为固体状态。
硫磺有较强的刺激性气味,熔点为115.21摄氏度,沸点为444.6摄氏度。
硫磺是一种化学性质较为活泼的元素,同氧一样具有典型的还原性,在燃烧过程中会释放出大量的热量和光线。

初中化学第十一十二单元知识点总结第十一单元:硫的化学性质1.硫磺的常见性质-硫磺有黄色晶体或粉末状态;-硫磺是现存的12种元素中颜色最鲜艳的物质之一;-硫磺的密度较低,能在空气中飘扬;-硫磺受热能熔化成黄色液体,冷却成为黄色晶体;-硫磺在室温下不溶于水,但可溶于一些有机溶剂;-硫磺有刺激性气味。
2.硫的元素周期表位置-硫的原子序数是16;-硫属于第16族元素;-硫元素的电子结构为2,8,63.硫磺的制取和性质-硫磺主要由自然界的硫矿物质通过矿石炼制获得;-硫磺受热能燃烧,生成二氧化硫;-硫磺燃烧的生成物二氧化硫是一种有毒气体,能够与水反应生成亚硫酸;-硫磺和许多金属直接反应生成对应的金属硫化物。
4.硫化氢的制取和性质-硫化氢可以由金属和酸反应制取;-硫化氢是一种无色、有刺激性气味的气体;-硫化氢在空气中能够燃烧,并生成二氧化硫和水;-硫化氢能够与酸反应生成对应的盐和水。
5.硫酸的制备和性质-硫酸是一种无色、无味、有刺激性气味的强酸;-硫酸具有很强的腐蚀性,应注意安全使用;-硫酸能与许多金属反应生成对应的盐和氢气;-硫酸能与氢氧化物反应生成对应的盐和水;-硫酸能与碳酸盐反应生成二氧化碳、水和硫酸盐。
第十二单元:氧、氢、水的化学性质1.氧的常见性质-氧是一种无色、无味、无臭的气体;-氧是一种能够燃烧的气体,能够支持其他物质的燃烧;-氧是生命中必需的,用于呼吸和维持生命活动。
2.氧的制备-氧可以通过电解水制备;-氧还可以通过加热金属氧化物或过氧化物制备。
3.氧气的性质-氧能够与许多物质反应,发生氧化反应;-氧能够与大多数金属反应,生成对应的金属氧化物。
4.氢的常见性质-氢是一种无色、无味、无臭的气体;-氢是一种能够燃烧的气体,能够与氧反应生成水。
5.氢气的制备-氢气可以通过金属和酸反应制备;-氢气还可以通过电解水制备;-氢气还可以通过水蒸气和金属反应制备。
6.水的性质-水是一种无色、无味、无臭的液体;-水是一种广泛存在于自然界的物质,人体中也含有大量的水;-水的冰、液态和气态分别是固体、液体和气体状态的水;-水是一种良好的溶剂,可以溶解许多物质;-水是一种重要的化学物质,能够参与许多化学反应。

硫磺硫磺别名硫、胶体硫、硫黄块。
外观为淡黄色脆性结晶或粉末,有特殊臭味。
分子量为32.06,蒸汽压是0.13kPa,闪点为207℃,熔点为119℃,沸点为444.6℃,相对密度(水=1)为2.0。
硫磺不溶于水,微溶于乙醇、醚,易溶于二硫化碳。
作为易燃固体,硫磺主要用于制造染料、农药、火柴、火药、橡胶、人造丝等。
硫磺分类在日常生活和工业硫磺生产中硫磺有很大的作用。
主用于橡胶轮胎、烟花爆竹、农药、化肥、食品工业、花草林木果树、日化助济、工业制品主要分为两大类及食品级硫磺工业级硫磺食品级硫磺:如在食品生产中硫磺有漂白,防腐之作用对玉米淀粉加工必需材料对干果类加工也有很重要的作用工业级硫磺:如电子半导体,塑胶、乳胶、造纸,医药精细化工,工业陶瓷、建材制品辅助材料等工业部门样式分类硫磺粉硫磺块硫磺颗粒硫磺片液体硫磺功效分类解毒杀虫燥湿止痒药药材基原为自然元素类硫黄族矿物自然硫,主要用含硫物质或含硫矿物经炼制升华的结晶体。
炮制生硫磺:去净杂质,砸成小块。
制硫黄:取拣净的硫黄块,与豆腐同煮,至豆腐现黑绿色为度,取出,漂去豆腐,阴干。
(每硫黄10斤,用豆腐20斤)《纲目》:"凡用硫黄,入丸散用须以萝卜剜空,入硫在内,合定,稻糠火煨熟,去其臭气;以紫背浮萍同煮过,消其火毒;以皂荚汤淘之,去其黑浆。
一法:打碎以绢袋盛,用无灰酒煮三伏时用。
又消石能化硫为水,以竹筒盛硫埋马粪中一月,亦成水,名硫黄液。
"采收储藏采挖得自然硫后,加热熔化,除去杂质,或用含硫矿经加工制得。
本品为自然元素类矿物硫族自然硫,采挖后,加热熔化,除去杂质;或用含硫矿物经加工制得。
[原矿物]硫黄 Sulphur形态:斜方晶系。
晶体的锥面发达,偶尔呈厚板状。
常见者为致密块状、钟乳状、被膜状、土状等。
颜色有黄、浅黄、淡绿黄、灰黄、褐色和黑色等。
条痕白色至浅黄色。
晶面具金刚光泽,断口呈脂肪光泽。
半透明。
解理不完全,断口呈贝壳状或参差状。

硫磺回收装置基本知识一、硫磺的性质硫磺是一种浅黄色的晶体,分子式S,分子量32.06,不溶于水,易溶于二硫化碳,熔点112-119℃,沸点444.6℃,自燃点248-266℃,在空气中液硫于150℃接触明火即可燃烧,比重1.92-2.07。
硫磺在加热或冷却时发生如下现象:黄色固体112.8℃熔化成黄色流动液体250℃暗棕色粘稠液体300℃暗棕色易流动液体44.6℃橙黄色气体650℃草黄色气体900℃无色气体。
液体硫磺具有独特的粘温性质:130-160℃粘度小,流动性好;160-190℃,由于S8环链开始破裂,粘度升高;190℃以上链平均长度缩短,粘度又变小。
硫分子中的硫原子数目,随温度不同而异:(1)熔点以下硫分子为S8。
(2)熔点-沸点为S8、S6共存。
(3)沸点时,S2开始出现,700℃时S8为零,750℃时S2最大,S6为零。
二、常用参数说明及计算(一)气风比:气风比:酸性气燃烧炉的进风量与进炉酸性气量的比值。
公式:配风原则:使原料气中的烃类完全燃烧,1/3H2S完全燃烧生成SO2进行配风。
1.酸性气中烃类以烷烃计时所需空气量G=[1/2H2S%+(3n+1)烃%]×G酸×100/21Nm3/h2.酸性气中烃类以烯烃计时所需空气量:G=[1/2H2S%+3n×烃%]×G酸×100/21Nm3/h式中: H2S%为酸性气中H2S含量。
n为烃分子中碳原子数量。
烃%为酸性气中烃的[url=]含量[/url][caihua1]。
G计算所需空气量Nm3/h。
G酸酸性气流量Nm3/h。
(二)H2S的转化率:假设:(1)整个过程气体体积不变。
(2)采样中除去的H2O和S蒸汽量忽略不计。
1.装置的总转化率①式中:(H2S+SO2+COS)%为二转出口分析数据之和。
H2S%为酸性气中H2S含量。
②总硫转化率=1-Q尾(H2S’+ SO2’+ COS’+2 ×CS2’)/Q酸H2S式中: Q酸——酸气流量Q尾——尾气流量H2S——酸气中硫化氢体积含量H2S’——二级反应器出口硫化氢体积含量SO2’——二级反应器出口二氧化硫体积含量CS2’,COS’——二级反应器出口有机硫体积含量③装置总硫回收率=1- K×(H2S’+ SO2’+ COS’+2 ×CS2’+S’)/ H2S式中:K ——体积收缩系数:(1.86×H2S)/(N2’(1+2.38× H2S))N2’——尾气中氮气含量。

硫磺的作用功效与作用硫磺是一种常见的化学元素,其化学符号为S,原子序数为16。
硫磺自古就被广泛应用于人类生活的各个领域,其具有多种作用功效。
下面将详细介绍硫磺的作用功效和应用。
一、硫磺的物理特性与化学性质硫磺是一种黄色的固体物质,无味无臭。
它在常温和大气压下是稳定的,不易被氧化。
硫磺具有较高的熔点和沸点,可以熔化为黄色液体。
在空气中燃烧时,产生蓝色火焰并释放出强烈的烟雾和刺激性的气味。
硫磺具有较强的还原性,能够与许多金属、非金属和有机物发生反应。
硫磺可以与氧气反应生成二氧化硫,也可以与氢气反应生成硫化氢。
此外,硫磺还能与氮气反应生成四硫化二氮等多种硫氮化合物。
这些反应使得硫磺在化学工业中应用广泛。
二、硫磺的作用功效1. 水灵散痛:硫磺具有温热散寒的作用,在中医中被用来治疗一些寒湿病症,如湿疹、痤疮、痢疾等。
硫磺能够温热经络,散寒燥湿,起到杀菌消炎、止痛止痒的作用。
2. 杀菌消毒:硫磺具有较强的杀菌能力,可用于消毒空气和物品表面。
硫磺燃烧时可以产生大量的二氧化硫,这种气体具有强烈的刺激性和杀菌能力。
因此,硫磺被广泛应用于卫生和农业领域,用于消毒病房、畜禽场、蘑菇棚等。
3. 防腐保鲜:硫磺可以抑制食品中的微生物生长,延长食品的保鲜期。
硫磺可以抑制食品中的霉菌和细菌的生长,减少食品腐败和质量变化。
因此,硫磺常被用于制作果脯、蜜饯、腊肠等食品,以延长其保质期。
4. 农业应用:硫磺是一种重要的农业药剂,广泛用于农田和果园。
硫磺具有驱虫、杀菌、防治病害的作用。
它可以杀灭农作物上的细菌、真菌、线虫等病虫害,增加作物的产量和质量。
此外,硫磺还可以改善土壤的酸碱度,促进植物的生长。
5. 化学工业:硫磺在化学工业中具有广泛的应用。
它可以用于制造硫酸、硝酸、硫醇等重要的化工产品。
此外,硫磺还可以作为合成树脂、橡胶和染料的原料,用于生产各种化学制品。
6. 药用价值:硫磺在中医药中有着悠久的应用历史。
它被广泛应用于治疗一些皮肤病,如湿疹、疥疮、头癣等。

硫磺入库管理制度第一章总则为加强对硫磺的入库管理,提高硫磺的安全性和保障性,制定本管理制度。
第二章硫磺的分类与性质1.硫磺是一种黄色的固体,熔点为115.21摄氏度,沸点为444.6摄氏度,易燃易爆,有毒。
2.硫磺主要用途为制造硫酸、化肥、染料等,是一种重要的化工原料。
第三章入库管理机构1.入库管理机构设在硫磺入库的生产企业内,负责制定硫磺入库管理制度,统一管理入库工作。
2.入库管理机构由一名专业负责人负责管理,配备专业的技术人员和安全管理人员。
第四章硫磺的入库程序1.生产企业应按照国家相关法律法规和标准,制定硫磺入库计划,确定入库时间、数量等。
2.入库前,应对所要入库的硫磺进行检测,确保硫磺的质量符合要求。
3.入库时,应按照计划将硫磺送达指定地点,由专业人员进行验收,确保入库的硫磺无误。
4.入库后,应对硫磺进行分类、编号、储存,确保硫磺的安全性和实时性。
第五章硫磺的储存管理1.硫磺的储存应符合相关法律法规和标准,储存场所应干燥通风,防潮防火。
2.硫磺的储存区域应设立专门的硫磺储存库,硫磺使用与其他化学品分开存放,避免混淆。
3.硫磺的储存区域应定期进行消防检查,确保硫磺的安全性。
4.硫磺的储存区域应定期进行清理和检查,防止硫磺的变质和损坏。
第六章硫磺的安全防护1.硫磺在生产和储存过程中应严格采取安全措施,确保硫磺的安全运输和使用。
2.硫磺的运输应使用专业的硫磺运输车辆,避免硫磺泄露和事故发生。
3.硫磺的使用应严格遵守操作规程,避免硫磺接触皮肤和吸入。
4.硫磺的使用场所应配备必要的防护设施,如安全眼镜、呼吸器等。
第七章硫磺的监督管理1.硫磺的入库、储存、使用过程应在入库管理机构的监督下进行,确保硫磺的安全性和保障性。
2.硫磺的安全监督由专业的安全管理人员进行,定期对硫磺的入库、储存、使用情况进行检查。
3.发现硫磺存在安全隐患或问题时,应立即处理,确保硫磺的安全使用。
第八章硫磺的应急处置1.发生硫磺泄漏、火灾等事故时,应立即启动应急预案,采取相应的措施进行处置。
硫磺化学式硫磺(S04,又称黄晶石、黄硫石),是一种分子式为S04的无机化合物,是硫元素最简单的单质形态。
硫在地壳中的含量约为0.006%,在海水中则更少。
硫是一种化学性质活泼的非金属元素,硫具有高度的氧化性,并且还具有还原性,常用于自制杀菌消毒的干粉,也可做燃料及火箭燃料,还用作木料的防腐剂、皮革的鞣料等。
硫磺的主要成分是硫化亚铁,为红色或淡黄色固体。
不溶于水,微溶于酒精和醚,易溶于二硫化碳、四氯化碳、苯和甲烷等。
1S04。
外观与性状:白色粉末,受热后能燃烧,发出黄色火焰。
生产方法:由硫酸和焦炭反应而得。
主要用途:用于冶炼、造船、医药、农药等工业。
1S04。
物理性质:黄色或黄红色结晶固体,无味,易吸湿。
相对密度: 4.4。
熔点: 800 ℃。
沸点: 1390 ℃。
3S04。
化学性质:加热时能强烈分解,放出大量的热,同时产生大量的氧化硫气体,可以阻止温度进一步升高。
加热到900 ℃以上,全部转变为三氧化硫。
3S04。
用途:本品用于工业生产、农药、医药、杀虫剂、火箭燃料和人造丝的漂白剂等。
4S04。
危险性:不燃。
受热分解,放出有毒的氧化硫烟雾。
具有还原性,易燃。
5S04。
急救:吸入:脱离现场至空气新鲜处。
如呼吸困难,给输氧。
就医。
6S04。
皮肤接触:脱去污染的衣着,用大量流动清水冲洗。
就医。
7S04。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
就医。
8S04。
食入:饮足量温水,催吐。
就医。
9S04。
消防人员须佩戴防毒面具、穿全身消防服,在上风向灭火。
灭火剂:雾状水、泡沫、干粉、二氧化碳、砂土。
10S04。
隔离泄漏污染区,限制出入。
建议应急处理人员戴防尘面具(全面罩),穿防毒服。
避免扬尘,小心扫起,置于袋中转移至安全场所。
若大量泄漏,用塑料布、帆布覆盖。
收集回收或运至废物处理场所处置。
11S04。
储存:储存于阴凉、通风的库房。
远离火种、热源。
防止阳光直射。
包装密封。
应与氧化剂、酸类、碱类分开存放,切忌混储。
硫磺简介鉴定特征:一般呈块状、粉末状。
浅黄色,带杂质者灰绿色。
条痕黄白色,脂肪光泽,晶体透明或半透明。
硬度1—2,不完全解理,性脆。
比重 2.05—2.09。
摩擦生负电。
易溶(180摄氏度),燃烧时生淡蓝色火焰,并发出SO2气味。
自然硫主要为火山喷发气体在火山口周围升华而成或经过氧化或与SO2反应而成。
其次为硫化物(如黄铁矿)在地表氧化分解而成。
硫磺主要用于制硫酸,此外用于橡胶、造纸、医药、火柴、农药、漂白剂等工业。
我国台湾、四川、甘肃、青海等省均产硫磺。
世界上著名的产地有意大利、西班牙、美国、日本。
加拿大是世界上最大的硫磺出口国.大部分经温哥华港出口的硫磺被用做制造磷肥的原料。
这些化肥产品则为世界上许多快速发展的国家提高农业生产力作出了巨大的贡献。
除了制造磷肥产品外,硫磺被转化为硫酸和用于生产其它化学和工业产品的比例越来越高。
例如,用于滤取含有金属的岩石,农用化学品的生产,塑料和合成橡胶的生产,纸浆和纸的生产过程,以及普通化学品的生产。
硫磺别名硫、胶体硫、硫黄块。
外观为淡黄色脆性结晶或粉末,有特殊臭味。
分子量为32.06,蒸汽压是0.13kPa,闪点为207℃,熔点为119℃,沸点为444.6℃,相对密度(水=1)为2.0。
硫磺不溶于水,微溶于乙醇、醚,易溶于二硫化碳。
作为易燃固体,硫磺主要用于制造染料、农药、火柴、火药、橡胶、人造丝等。
虽然从毒理学上来说,硫磺属低毒危化品,但其蒸汽及硫磺燃烧后发生的二氧化硫对人体有剧毒。
它与卤素、金属粉末等接触后会发生剧烈反应。
硫磺为不良导体,在储运过程中易产生静电荷,可导致硫尘起火。
粉尘或蒸汽与空气或氧化剂混合后就会形成爆炸性混合物。
硫磺发生事故后,一般会出现吸入、食入、经皮肤吸收等几种情况。
因其能在肠内部分转化为硫化氢而被吸收,故大量口服可导致硫化氢中毒。
急性硫化氢中毒的全身毒作用表现为中枢神经系统症状,有头痛、头晕、乏力、呕吐、昏迷等。
硫磺还可引起眼结膜炎、皮肤湿疹。
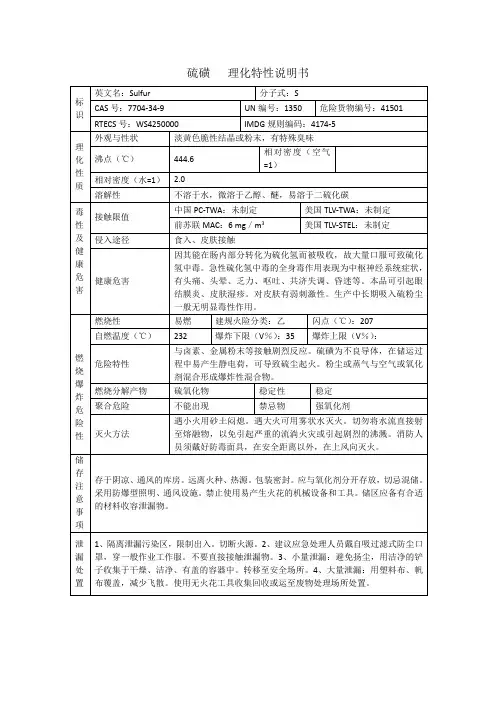
硫酸的主要理化和危险特性标识中文名:硫磺;硫;胶体硫;硫黄块;硫黄粉英文名:sulfur、Cosan、Elosal分子式:S分子量:32.06CAS号:7704-34-9UN编号:1350,2448危险货物编号:41501理化性质外观与性状:淡黄色脆性结晶或粉末,有特殊臭味主要用途:用于制造染料、农药、火柴、火药、橡胶、人造丝、医药等熔点:119℃沸点:444.6℃相对密度(水=1):2.0相对密度(空气=1):无资料饱和蒸汽压(kPa):0.13(183.8℃)溶解性:不溶于水,微溶于乙醇、醚,易溶于二硫化碳临界温度(℃):无资料临界压力(MPa):无资料燃烧热(kj/mol):无意义燃烧爆炸危险性避免接触的条件:接触潮湿空气。
燃烧性:易燃闪点(℃):207自燃温度(℃):无意义爆炸下限(V%):35mg/m3爆炸上限(V%):无资料燃烧(分解)产物:氧化硫稳定性:稳定聚合危害:不聚合禁忌物:强氧化剂危险特性与卤素、金属粉末等接触剧烈反应。
硫磺为不良导体,在储运过程中易产生静电荷,可导致硫尘起火。
粉尘或蒸气与空气或氧化剂混合形成爆炸性混合物。
灭火方法:遇小火用砂土闷熄。
遇大火可用雾状水灭火。
切勿将水流直接射至熔融物,以免引起严惩的流淌火灾或引起剧烈的沸溅。
消防人员须戴好防毒面具,在安全距离以外,在上风向灭火。
包装与储运危险性类别:第4.1类易燃固体危险货物包装标志:8包装类别:I储运注意事项:储存于阴凉、通风的库房。
远离火种、热源。
包装密封。
应与氧化剂分开存放,切忌混储。
采用防爆型照明、通风设施。
禁止使用易产生火花的机械设备和工具。
储区应备有合适的材料收容泄漏物。
毒性危害接触限值:中国未制定标准苏联MAC:6mg/m3美国TWA:未制定标准美国STEL:未制定标准侵入途径:吸入、食入、皮肤吸收毒性:属低毒物,但其蒸汽及硫磺燃烧后发生的二氧化硫对人体有剧毒健康危害:因其能在肠内部分转化为硫化氢而被吸收,故大量口服可导致硫化氢中毒。
硫磺药剂特性硫磺是无机农药中的一个重要品种。
商品为黄色固体或粉末,有明显气味,能挥发。
硫磺水悬液呈微酸性,不溶于水,与碱反应生成多硫化物。
硫磺燃烧时发出青色火焰,伴随燃烧产生二氧化硫气体。
用于防治病虫害常把硫磺加工成胶悬剂。
它对人、畜安全,不易使作物产生药害。
主要剂型45%、50%硫磺胶悬剂。
防治对象及使用方法硫磺属多功能药剂,除有杀菌作用外,还能杀螨和杀虫。
用于防治各种作物的白粉病和叶螬等,持效期可达半月左右。
蔬菜使用硫磺胶悬剂主要用于防治瓜类白粉病,如黄瓜、甜瓜(香瓜)、南瓜等,使用时将50%硫磺胶悬剂稀释成200-400倍液喷雾。
每隔10天左右喷洒1次,一般发病轻的用药2次,发病重者用药3次。
硫磺制剂的防治效果与气温关系密切,适宜使用的气温为4-32℃。
早春或晚秋低温季节使用浓度宜高,多喷洒200-300倍液,以保证药效,夏季高温季节使用浓度宜低,多喷洒400-500倍液,以免产生药害。
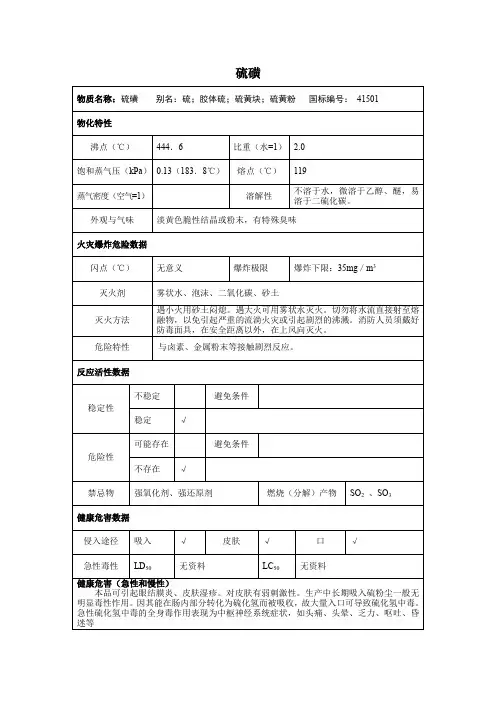
理化性质:硫磺有特殊臭味,不溶于水。
它有好几种同分异构体,如斜方硫、单斜硫、无定形硫等。
密度:斜方硫2.06,单斜硫1.96,液体1.803;熔点119,沸点444.6,闪点207.2(闭式),自燃点232.2,爆炸下限2.3克/米3。
属二级易燃固体。
用途:用于制造硫酸、亚硫酸、硫化物、二硫化碳、火柴、黑色火药、硫化橡胶、药物、杀虫剂等。
硫磺粉防治园林病害有特效硫磺粉是一种酸性化合物,在花草、林木、果树上使用,具有灭菌防腐、调节酸碱性、促进伤口愈合、防治病害的作用,还可供给植株养料,促进生长发育。
1、防止伤流。
容易产生伤流的植物,如无花果、葡萄、榕树、苏铁等的根、枝、叶,修剪后在伤口上涂上硫磺粉,可抑制伤流产生,防止伤口感染腐烂,促进愈合。
2、防治烂根。
君子兰等盆栽花木,因渍水、病害产生烂根、黄叶现象,结合翻盆换土,剪除烂根,在伤口及根上喷撒硫磺粉,可控制烂根,促发新根,迅速恢复生长。
大树出现烂根黄化时,刨开根土,剪切烂根后,在根部撒施硫磺粉,覆盖新鲜无菌土,可防止继续烂根,恢复正常生长。
第一节硫磺
硫磺分天然硫磺和从其它含硫物质中制取的硫磺,这里主要介绍硫磺的物化特性、硫的制取、工业硫磺标准和硫的用处等。
一、硫的物化特性
(一)硫的一般特性
常压下,硫的沸点为444.6℃。
硫的临界常数:
温度: 1040℃体积: 2.48ml/g
密度: 0.43g/ml
硫几乎不溶于水,但少量的溶于汽油、溴化乙烯、甲苯、丙酮等有机溶剂及二硫化碳中。
硫在空气中有升华现象,且随温度升高加快升华速度。
硫具有较强的化学活泼性,于空气中常温下即可发生轻微的氧化现象产生二氧化硫。
硫的燃点:246~266℃。
当硫磺粉尘在空气中的含量达≥35g/m3时,接触到火源能引起爆炸。
最小引燃能量15mJ,最大爆炸压力为27.36×104Pa。
长期在硫磺粉尘环境中工作的人员,必须穿戴好防护用品,否则将引起呼吸系统疾病,经常接触硫的人,也会引起皮炎等症。
在高温条件下,硫同氢、碳、氮等物质发生化学反应,产生H2S、CS2、S2N2等。
硫同金属反应(除金、铂),可直接化合成金属硫化物。
(二)硫的熔点
硫的温度达到熔点时,硫将熔融成具有流动性质的液体硫。
不同结晶系及不同状态的硫熔点略有差异。
具体情况见下表
硫的熔点
(三)硫的粘度
熔融硫的粘度随温度而变化,一般是初熔时的粘度随温度升高而下降,当温度超过159℃后,粘度随温度升高而急剧增大。
当继续提高温度达190℃时;硫的粘度达到极大值(93Pa·s),当温度超过190℃后,粘度又恢复到初时的特征。
当温度升高到250℃以后,由于长链结构的硫分子发生断裂,引起硫的粘度又急剧下降。
在130~160 ℃时粘度最小,利于液硫的输送。
根据硫磺的特性,
为了使之保持较好的流动性,以利于我们生产过程液硫的输送,同时为了降低输送的功率消耗,所以我们熔硫工段的熔硫槽温度一般控制在160℃,粗硫槽、助滤及精硫槽温度一般控制在130~140℃之间,这些控制依据,就是根据硫磺粘度随温度升高而下降,当温度超过159℃后,粘度随温度升高而急剧增大。
二、硫磺标准
(一)工业硫磺
本标准适用于由硫铁矿制得的和天然硫磺、石油炼厂气等回收制得的工业硫磺。
工业硫磺用于制造硫酸、染料和橡胶制品,也用于医药等工业部门。
化学符号:S
原子量:32.06(按1979年国际原子量)
1、工业硫磺成品呈黄色或淡黄色,有块状、粉状、粒状、或片状
2、工业硫磺应符合的要求
具体指标为: %(m/m)
注(1)表中1、3、4、5、6、7项指标均以干基计算。
(2)对于硫铁矿制得的硫磺,一级品的砷含量允许小于或等于0.003%。
(3)表中第8、9项的指标仅用于粉状硫磺。
三,蒸汽温度。