原子的结构和电子构型
- 格式:ppt
- 大小:339.00 KB
- 文档页数:8

电子构型解析电子构型是描述一个原子或离子中电子分布的一种方式。
它对于理解化学中的原子结构、化学键的形成以及物质的性质都具有重要意义。
本文将详细介绍电子构型的概念及其应用。
一、电子构型的概念电子构型是指一个原子或离子中电子的分布方式,它通过表示电子层和亚层的填充情况来描述。
在填充电子时,按照能级从低到高的顺序填充。
电子层由主量子数来表示,亚层由主量子数和轨道类型(s、p、d、f)共同确定。
电子在亚层中的填充原则遵循洪特规则和奥特伯规则。
二、电子构型的表示方法1. 能级表示法:采用数字和字母的组合来表示电子层和亚层,例如1s、2s、2p等。
2. 诺特方式:将电子的数量按照升序排列,用上标表示。
三、电子构型的应用1. 原子结构:电子构型是研究原子结构的基本依据。
通过电子构型可以知道一个原子中的电子分布情况,包括电子层数目、亚层及其填充情况等。
这对于理解原子的性质和行为具有重要意义。
2. 化学键的形成:化学键的形成涉及到原子中的电子重排。
通过电子构型可以判断出原子是否容易失去或获得电子,进而预测化学键的形成方式和性质。
3. 元素周期表:元素周期表是按照元素的电子构型进行排列的。
通过电子构型可以帮助我们理解元素的周期性规律,为化学反应和物质性质提供有用的信息。
结论电子构型是描述原子和离子中电子分布方式的重要概念。
通过电子构型的表示和解析,我们可以更好地理解原子结构、化学键的形成以及元素周期表的排序规律。
在化学研究和应用中,电子构型的理解和应用对于探索物质性质和化学反应具有重要的指导意义。

原子结构表达式
原子结构表达式是一种用于描述原子的结构的表示法。
它由原子的原子序数(即在原子序列中的位置)和电子构型组成。
原子序数表示原子在元素周期表中的位置,是指原子核中的质子数量。
例如,氢原子的原子序数为1,因为它的原子核中有1个质子。
电子构型描述的是原子的电子分布情况。
电子构型可以用简单的符号表示,例如用[He]2s^2来表示氦原子的电子构型。
在这个例子中,[He]表示原子内有两个电子,它们分别在2s和2p轨道上。
因此,氦原子的原子结构表达式为2, [He]2s^2。
好的,那么继续讲原子结构表达式。
当原子内有多个电子时,电子构型中的符号会变得更加复杂。
例如,铜原子的电子构型可以表示为[Ar]3d^10 4s^1。
在这个例子中,[Ar]表示原子内有18个电子,它们分别分布在3d、4s和4p轨道上。
另外,还有一种称为简写电子构型的表示法。
简写电子构型是指只写出原子内有电子的最外层轨道,其他轨道省略。
例如,铜原子的简写电子构型为[Ar]3d^10。

原子的结构和电子构型原子是构成物质的最基本单位,它由质子、中子和电子组成。
质子和中子位于原子的核心,称为原子核,而电子则围绕着原子核旋转。
原子核是原子的中心,由质子和中子组成。
质子带正电荷,质子数决定了元素的原子序数。
中子不带电荷,其数量会影响原子的质量。
电子壳是电子的运动区域,分为n个主量子能级(n=1,2,3...)。
第一主量子能级(K壳)离原子核最近,第二主量子能级(L壳)紧随其后,以此类推。
每个主量子能级可以容纳不同数量的电子。
电子轨道是电子在主量子能级中的运动路径。
每个主量子能级可以含有不同数量的电子轨道,分别以s、p、d和f来表示。
s轨道是最简单的电子轨道,每个s轨道可以容纳最多2个电子。
s轨道有一个球形的分布,出现在所有主量子能级上。
p轨道比s轨道复杂一些,每个p轨道可以容纳最多6个电子。
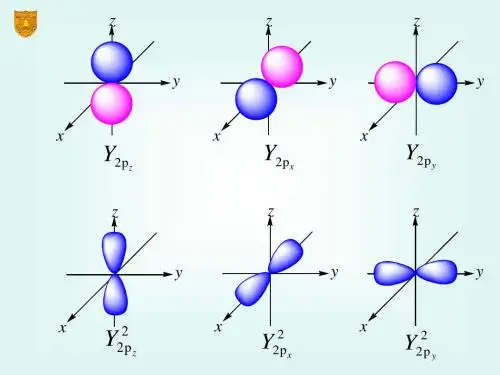
p轨道有三个不同的方向(xyz轴),分别以px、py、pz表示。
d轨道相对更复杂,每个d轨道可以容纳最多10个电子。
d轨道有五个不同的方向,分别以dxy、dyz、dzx、dx2-y2和dz2表示。
f轨道更加复杂,每个f轨道可以容纳最多14个电子。
f轨道有七个不同的方向,分别以fxyz、fx2-y2、fyz2、fzx2、fz3和fx3-y2表示。
当电子填充到原子中时,要遵循一定的顺序。
这一顺序可以通过洪特规则和泡利不相容原理来确定。
洪特规则指出,当电子填充到电子轨道中时,首先填充最低能级的轨道。
泡利不相容原理指出,每个电子轨道上的电子应具有相反的自旋方向。
根据这些规则,我们可以确定原子的电子构型。
以氧(O)原子为例,氧原子有8个电子,因此电子构型为1s22s22p4、这意味着氧原子的电子首先填充到1s轨道中,然后填充到2s轨道中,最后填充到2p轨道中。
电子构型对于理解原子性质和化学反应非常重要。
它可以帮助我们预测原子的化学行为和物理性质,以及解释元素周期表的排列。

电子构型与原子结构的关系探究在化学和物理学中,电子构型是描述原子中电子分布的方式。
它揭示了电子在原子中的能级分布和填充顺序,进而影响了原子的化学性质和反应行为。
电子构型与原子结构之间存在着紧密的关系,本文将探究这一关系的本质。
首先,我们来了解一下原子的基本结构。
原子由质子、中子和电子组成。
质子和中子位于原子核中,而电子则围绕着原子核的轨道上运动。
电子的能级分布和填充顺序决定了原子的电子构型。
原子的电子构型可以通过填充原子轨道来描述。
原子轨道是描述电子可能存在于原子周围的特定区域。
根据量子力学的理论,原子轨道可以分为不同的能级和子能级。
能级是指电子的主要能量水平,而子能级则是能级内的不同能量亚层。
每个子能级可以容纳一定数量的电子。
电子填充原子轨道的顺序遵循一定的规则,即泡利不相容原理、奥克塔规则和洪特规则。
泡利不相容原理指出,每个轨道最多只能容纳两个电子,且这两个电子的自旋方向必须相反。
奥克塔规则指出,在填充轨道时,电子会尽可能地填充到同一能级的不同子能级上,直到所有子能级都被填满。
洪特规则则规定了电子填充顺序,即按照能级从低到高的顺序填充。
电子构型的不同可以解释原子的化学性质和反应行为。
电子构型决定了原子的化学键形成能力和稳定性。
例如,具有完全填充的主能级的原子(如惰性气体)具有高度稳定的构型,不易与其他原子形成化学键。
相反,具有未完全填充的主能级的原子具有较高的反应活性,容易与其他原子形成化学键。
此外,电子构型还影响原子的大小和离子半径。
原子的大小取决于电子云的大小,而电子云的大小又取决于电子的能级和轨道。
一般来说,电子构型中能级较高的原子比能级较低的原子更大。
当原子失去或获得电子形成离子时,电子构型的改变会导致离子半径的变化。
正离子通常比原子更小,因为它们失去了外层电子,而负离子通常比原子更大,因为它们获得了外层电子。
最后,电子构型还可以用于解释原子光谱中的谱线。
原子光谱是通过将原子激发到不同能级并观察其辐射发射或吸收而获得的。

原子结构与电子分布规律原子是物质的基本单位,它通常由质子、中子和电子组成。
质子和中子位于原子核中,而电子则围绕着原子核运动。
原子的结构和电子的分布规律对于解释元素的性质和化学反应机制具有重要意义。
1. 原子结构原子由原子核和围绕核旋转的电子构成。
原子核由带正电荷的质子和质量近似于质子的中子组成。
质子的数量决定了原子的元素类型,电子的数量决定了元素的化学性质。
原子核的直径与原子整体直径之比可理解为一个篮球与篮球场直径之比。
这表明原子的绝大部分空间是空的,核外电子主要存在于一定的能级中。
2. 原子序数和元素周期表原子序数是指一个原子核中的质子数量,通常表示为Z。
元素周期表按照原子序数的增加顺序排列了所有已知元素,并以简洁的方式呈现了元素的化学性质和特征。
周期表的横行称为周期,纵列称为族。
原子序数的增加导致了电子壳层的增加和电子分布规律的变化。
3. 原子的壳层和能级原子的电子分布规律可以通过壳层和子壳层的概念来解释。
壳层是指电子分布的主要能级,由数字和字母表示。
数字表示主能级,字母表示子壳层。
例如,1s表示第一个主能级上的s子能级。
原子的壳层分布规律为2、8、18、32。
第一个壳层最多容纳2个电子,第二个壳层最多容纳8个电子,第三个壳层最多容纳18个电子,以此类推。
根据能级的填充顺序,电子趋向于填充最低能级。
4. 电子的填充顺序和原子稳定性电子的填充顺序遵循通过增加质子数量和原子序数来增加电子数量的规律。
根据塞德伯格填充规则,电子首先填充低能级的壳层。
当一个壳层被填满后,电子开始填充下一个壳层。
例如,氧原子的电子配置为1s2 2s2 2p6,其中1s2是填满的K壳层,2s2和2p6分别是填充的L壳层。
当原子的填充顺序不满足填充规则时,会出现稳定性较低的不稳定原子。
5. 常见的电子分布规律有几个常见的电子分布规律对于理解元素性质和化学反应机制至关重要。
八个电子规律说明了填充到第二能级(L壳层)的最后一个电子是稳定的,因为这种配置类似于惰性气体。


原子的结构和电子构型原子是物质的基本单位,由原子核和围绕核运动的电子组成。
原子核位于原子的中心,由质子和中子组成。
质子带有正电荷,中子不带电荷。
电子带有负电荷,绕着原子核的轨道运动。
原子核的质量主要由质子和中子的质量决定,质子和中子的质量几乎相等。
质子的电荷为+1,中子没有电荷。
原子核的直径约为1/10,000分之1个原子直径。
电子的质量远小于质子和中子,电子的质量约为1/1836个质子质量。
电子的电荷为-1,质子和电子的电荷大小相等但异号。
电子围绕着原子核的轨道运动,根据量子力学理论,电子的位置不能确定,只能确定在一些轨道上的概率分布。
电子轨道是描述电子运动的数学函数,通常用主量子数(n)、角量子数(l)、磁量子数(m)和自旋量子数(s)来表示。
主量子数决定了电子的能级大小,角量子数决定了电子的轨道形状,磁量子数决定了电子在轨道上的位置,自旋量子数决定了电子的自旋方向。
电子的能级和轨道:根据量子力学理论,电子围绕着原子核的轨道可以分为不同的能级,能级越高,电子的能量越大。
第一个能级(n=1)最靠近原子核,能级数依次增加。
每个能级可以容纳的电子数由角量子数决定,第一个能级(n=1)只能容纳最多2个电子,第二个能级(n=2)最多容纳8个电子,以此类推。
每个能级又可以分为不同的子能级,子能级由角量子数决定,角量子数的取值范围为0到n-1、例如,第一个能级(n=1)只有一个子能级(l=0),称为s轨道;第二个能级(n=2)有两个子能级(l=0和l=1),分别称为s轨道和p轨道。
电子的填充原则:根据电子填充原则,电子首先填充低能级的轨道,然后逐渐填充高能级的轨道。
在填充同一个能级的轨道时,按照泡利不相容原理,每个轨道最多只能容纳两个电子,并且这两个电子的自旋方向相反。
根据能级和轨道的填充规律,我们可以推导出元素周期表的结构。
元素周期表是根据元素的原子序数(原子核中质子的数量)和电子构型排列的。
每个元素的电子构型可以通过填充电子的方式来确定,电子构型的不同决定了元素的化学性质和反应能力。

原子结构与电子排布原子结构是指构成原子的基本组成部分,包括原子核和围绕核外部运动的电子。
而电子排布则指的是电子在不同能级和轨道上的分布方式。
本文将从原子结构和电子排布的概念入手,探讨原子结构和电子排布的相关知识。
一、原子结构原子是物质的基本单位,是由带正电荷的原子核和带负电荷的电子组成。
原子核由质子和中子组成,质子带正电荷,中子不带电荷。
电子围绕在原子核的外部轨道上,并带有负电荷。
1. 原子核原子核位于原子的中心,质子和中子组成了原子核。
质子的质量和电荷均为1,中子的质量为1,不带电荷。
原子核的质量主要集中在质子和中子上,电子的质量可忽略不计。
2. 电子电子是负电荷的基本粒子,围绕在原子核的轨道上。
电子的质量很小,在计算原子质量时可以忽略。
每个原子的电子数目是不同的,决定了元素的化学性质。
电子在原子中的分布是不均匀的,分别存在于不同的能级和轨道上。
二、电子排布电子排布是指电子在原子的能级和轨道上的分布方式,遵循一定的规律。
下面将介绍两种常见的电子排布方式:布居数法和能级填充顺序。
1. 布居数法布居数法是指用数字表示每个能级中的电子数目。
第一个能级只能容纳2个电子,第二个和第三个能级可以容纳8个电子,第四个能级可以容纳18个电子。
一个完整的能级是指在前一个能级填充满后才填充下一个能级。
2. 能级填充顺序能级填充顺序是指按照一定的规则填充能级和轨道上的电子。
能级顺序是依次增加的,电子的填充规则遵循“电子优先填充低能级”的原则。
按照能级填充顺序,电子的填充顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s等。
三、电子排布的规律和应用电子排布遵循一定的规律,可以通过电子排布的规律来推测元素的化学性质和反应能力。
以下是几个常见的电子排布规律和应用:1. 阻塞原理根据阻塞原理,填充轨道上的电子时,电子会尽可能地占据不同的轨道。
这意味着在填充3d轨道之前,先填充4s轨道,因为4s轨道的能量较低。
2. 稳定性能级填充顺序决定了某些配置的电子排布比其他配置更稳定。

原子结构原子核与电子构型的关系原子结构、原子核与电子构型的关系原子是构成物质的基本单位,而原子结构的重要组成部分是原子核和电子。
原子核位于原子的中心,而电子则围绕原子核运动。
原子核和电子之间存在着一定的关系,这种关系决定了原子的化学性质和物理性质。
本文将探讨原子结构、原子核与电子构型之间的关系。
一、原子结构的组成原子结构主要由原子核和电子组成。
原子核是由质子和中子组成的,质子带有正电荷,中子不带电荷。
原子核位于原子的中心,占据很小的体积,但质量非常大。
电子是带有负电荷的粒子,围绕着原子核旋转,形成电子云。
二、原子核和元素的关系原子核中的质子数目决定了元素的性质。
每个元素都有一个特定的原子序数,就是其原子核中质子的数目。
例如,氢元素的原子核中只有一个质子,所以它的原子序数为1;氧元素的原子核中有八个质子,所以其原子序数为8。
原子序数不同的元素具有不同的化学性质。
三、原子核和质量数的关系原子核中还包含中子,中子的数目和质子的数目之和称为质量数。
原子的质量主要由原子核的质量决定。
质量数不同的同位素在化学性质上相同,但物理性质可能有所不同。
例如,氢元素有三种同位素,氘(D)、氚(T)和正常氢(H),它们的质量数分别为2、3和1。
四、电子的能级和电子壳层电子围绕原子核运动,其运动轨道被划分为不同的能级,每个能级可以容纳一定数量的电子。
不同的能级由数字表示,能级数字越高,能级越远离原子核,能量也越高。
每个能级又可以进一步分为不同的轨道,称为电子壳层。
在电子壳层中,每个轨道可以容纳一定数量的电子,按顺序填充。
五、电子构型和元素周期表电子的排布遵循一定的规律,即泡利的不相容原理和洪特规则等。
根据这些规律,可以确定每个元素的电子构型。
电子构型描述了一个原子中各个能级和电子壳层的填充情况。
通过电子构型,我们可以推测出元素的化学性质和反应行为。
元素周期表中的元素按照其原子序数排列,并以电子构型的方式展示。
六、原子核与电子构型的关系原子核的质子数目决定了元素的化学性质,而电子构型则决定了元素的电子行为。

n元素原子结构
氮元素(N)是原子序数为7的元素,属于氮族元素。
在原子结构方面,氮原子有如下特点:
1. 电子构型:氮原子的电子构型为1s²2s²2p³,这意味着它有3个外层电子,分别是2s轨道上的2个电子和2p轨道上的3个电子。
2. 价电子:氮原子的价电子构型为2s²2p³,这决定了它在形成化合物时的
化学键类型。
3. 杂化态:在形成化合物时,氮原子可以采取sp²或sp³杂化态,这取决于
它与其它原子的结合方式。
4. 配位数:氮原子的常见配位数是3或4,这取决于它所形成的化合物。
以上信息仅供参考,如需获取更多关于氮元素原子结构的信息,建议查阅化学书籍或咨询化学专家。
九年级原子结构知识点总结原子结构是化学中的基础知识,它涉及到原子的组成以及原子的性质。
本文将对九年级学生必须掌握的原子结构知识点进行总结。
一、基本概念原子是物质的最小单位,由原子核和电子组成。
原子核由质子和中子组成,质子带正电,中子不带电,电子带负电。
原子核位于原子的中心,电子在原子核周围的能层上运动。
二、元素符号和元素符号元素是由相同类型的原子组成的纯物质。
元素符号是表示元素的一两个字母,通常来自元素名称的拉丁文缩写,例如氢的符号是H,氧的符号是O。
三、电子结构原子的电子排列方式称为电子结构。
基本原则是:1. 电子按照能级从低到高的顺序填充。
能级按照K、L、M、N 等字母来表示,K能级最靠近原子核。
2. 每个能级最多容纳固定数量的电子,第一能级最多容纳2个电子,第二能级最多容纳8个电子,第三能级最多容纳18个电子。
3. 原子外层电子数目决定了元素的化学性质。
四、原子序数和质子数原子的质子数等于原子核中质子的数量,也等于元素周期表中元素的原子序数。
例如,氧元素的原子序数为8,质子数也为8。
五、同位素同位素是指具有相同质子数但质量数不同的原子。
同位素具有相似的化学性质,但质量不同。
六、离子离子是具有正电荷或负电荷的原子或原子团。
正离子是电子数目比质子少的原子或原子团,负离子是电子数目比质子多的原子或原子团。
七、原子的平衡状态原子的平衡状态是指原子内外电子数目相等时的状态。
原子通过得电子或失电子来实现平衡。
得电子后的原子形成负离子,失电子后的原子形成正离子。
八、原子的价电子原子外层最活跃的电子称为价电子。
原子通过共享、转移或捐赠价电子来与其他原子形成化学键。
九、同位素的应用同位素在实际应用中具有广泛的用途,例如用于放射治疗、碳-14用于碳定年、同位素示踪等。
十、元素周期表元素周期表将所有已知元素按照原子序数排列并划分成周期和族。
周期数表示原子中能级最高的电子能级,族数表示原子外层电子数。
总结:九年级的原子结构知识点包括基本概念、元素符号、电子结构、原子序数和质子数、同位素、离子、原子的平衡状态、原子的价电子、同位素的应用以及元素周期表。
电子构型与原子结构的关系探究在化学领域中,电子构型和原子结构是两个非常重要的概念。
电子构型描述了一个原子中电子的排布方式,而原子结构则涉及到原子的组成和排列方式。
本文将探究电子构型与原子结构之间的关系,并分析其对化学性质的影响。
首先,我们来了解一下电子构型的概念。
电子构型是指描述一个原子中电子分布的方式,通常用一系列数字和字母表示。
这些数字和字母代表了不同的能级、子能级和轨道。
比如,氧原子的电子构型为1s² 2s² 2p⁴,其中1s²表示1s轨道上有2个电子,2s²表示2s轨道上有2个电子,2p⁴表示2p轨道上有4个电子。
电子构型可以帮助我们了解原子中电子的排布方式,从而推断出原子的化学性质。
那么,电子构型与原子结构之间有何关系呢?电子构型是由原子结构所决定的。
原子结构包括了原子的核、质子、中子和电子的组成和排列方式。
原子的核由质子和中子组成,而电子则围绕核心的轨道上运动。
根据量子力学理论,电子在原子中的能级和轨道是离散的,每个能级和轨道只能容纳一定数量的电子。
因此,原子的电子构型取决于原子结构中能级和轨道的数量和排布方式。
了解了电子构型和原子结构的关系后,我们可以进一步探究电子构型对化学性质的影响。
电子构型决定了原子的化学性质,因为电子是参与化学反应和化学键形成的主要因素之一。
原子中的电子分布方式决定了原子的化学反应活性、化合价和化学键的形成方式。
例如,氧原子的电子构型为1s² 2s² 2p⁴,其中2p轨道上有4个电子。
这意味着氧原子具有6个价电子,可以与其他原子形成共价键。
而氢原子的电子构型为1s¹,只有一个价电子,因此氢原子只能与其他原子形成单一共价键。
此外,电子构型还可以解释元素周期表的排列规律。
根据元素周期表的排列方式,我们可以观察到一些规律性的变化。
例如,周期表中从左到右的横行称为周期,每个周期中原子的电子数逐渐增加。
原子结构与电子排布解析电子构型原子是物质的基本构成单位,由原子核和围绕原子核运动的电子组成。
原子结构的核心概念是电子构型,它描述了电子在原子中的分布方式和能级排布。
本文将解析原子结构、电子排布以及电子构型的相关概念。
一、原子结构原子由质子、中子和电子组成。
质子带正电荷,中子不带电荷,而电子带负电荷。
质子和中子集中在原子核中,而电子在核外的电子壳层中运动。
电子带负电荷,与质子的正电荷相互吸引,维持着原子的稳定结构。
二、电子排布原则电子排布遵循一些基本原则,包括奥克福德定律、泡利不相容原理和洪特规则。
1. 奥克福德定律(Aufbau principle):按照能级逐渐填充电子。
电子首先填充低能量轨道,然后再逐渐填充高能量轨道。
2. 泡利不相容原理(Pauli exclusion principle):每个轨道最多容纳两个电子,且这两个电子的自旋要相反。
自旋指的是电子围绕自身旋转的方向。
3. 洪特规则(Hund's rule):当有多个轨道具有相同能量时,电子尽量分布在不同的轨道中,以使电子自旋相同。
这样可以降低原子能量。
三、电子构型表示方法电子构型表示了原子的电子排布方式。
常见的电子构型表示法有核符号法和分子轨道法。
1. 核符号法:采用元素符号和上标下标的方式表示电子排布。
例如,氧元素的电子构型可表示为1s²2s²2p⁴,其中1s²表示1s轨道上有两个电子,2s²表示2s轨道上有两个电子,2p⁴表示2p轨道上有四个电子。
2. 分子轨道法:采用分子轨道的能级图表示电子排布。
根据电子填充原则,可以逐渐填充分子轨道,形成电子构型。
四、电子构型的应用与重要性电子构型对于理解原子性质、化学反应以及元素周期表有着重要的意义。
1. 元素周期表:元素周期表中的周期和族与电子构型密切相关。
电子构型的变化可以解释为什么元素在周期表中排列有序,以及为何具有相似的化学性质。
2. 原子性质:电子构型对于原子性质的影响非常显著。
原子的电子结构及轨道分布原子的电子结构是指电子在原子中的能级分布和轨道排布的规律。
了解原子的电子结构对于理解原子性质、元素周期表和化学反应等具有重要意义。
本文将对原子的电子结构及轨道分布进行详细论述。
一、原子的电子结构1. 基本概念原子由质子、中子和电子组成。
质子和中子位于原子核中,而电子则以环绕原子核的方式存在。
原子的电子结构由不同能级的电子层组成,能级越靠近原子核,能量越低。
2. 原子模型的演变(这里可以分为几个小节,分别介绍经典原子模型、量子力学模型等)3. 原子的主量子数和次量子数原子的主量子数(n)决定了电子的主要能级和电子层的数量。
主量子数为正整数,其数值越大,电子的能量越高。
原子的次量子数(l)描述了电子的轨道形状。
次量子数的取值范围为0到n-1。
不同的次量子数对应不同的轨道类型,如s轨道、p轨道、d轨道和f轨道。
4. 原子的磁量子数和自旋量子数原子的磁量子数(ml)描述了电子在轨道上的空间分布。
磁量子数的取值范围为-l到l。
原子的自旋量子数(ms)描述了电子的自旋方向。
自旋量子数可以取两个值:+1/2或-1/2。
二、轨道分布图轨道分布图用于表达原子中电子的能级和轨道位置。
轨道分布图常用的表示方式包括原子核符号、能级分层和电子填充规则。
(这里可以列举一些轨道分布图的例子)三、能级填充规则电子在填充轨道时遵循一定的顺序和规则:泡利不相容原理、奥卡规则和洪特规则。
1. 泡利不相容原理泡利不相容原理指出一个轨道最多只能容纳两个自旋方向相反的电子。
2. 奥卡规则奥卡规则规定电子在填充轨道时优先填满能量较低的轨道。
3. 洪特规则洪特规则描述了电子填充顺序,即按照能级的不同,按照一定规律填充轨道。
四、电子排布的例子(这部分可以给出几个具体的原子的电子结构和轨道分布的例子,如氢原子、氦原子等)结论:原子的电子结构及轨道分布是原子性质的重要基础。
通过了解原子的电子结构,我们可以更好地理解元素周期表的特点,以及不同元素之间的化学反应和相互作用。