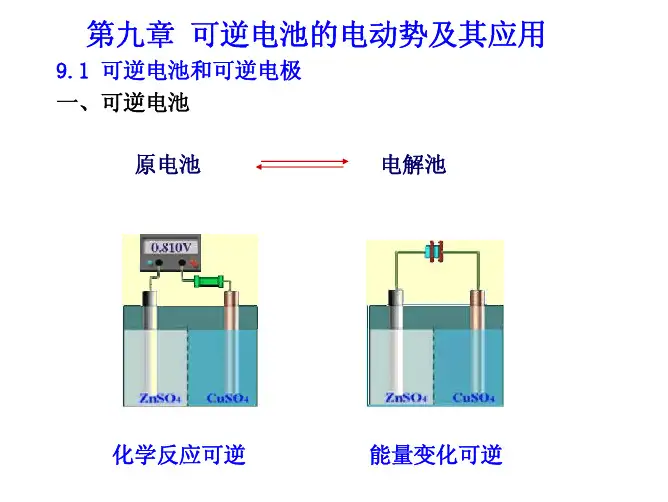
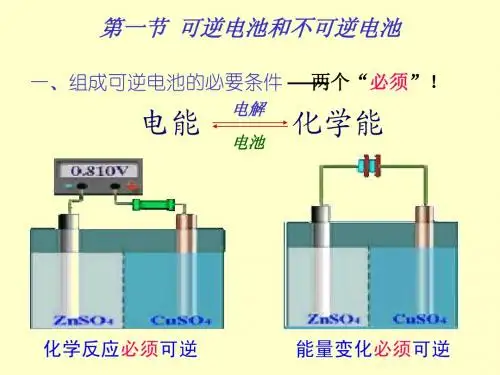
电池的种类及其电动势计算
- 格式:ppt
- 大小:1.61 MB
- 文档页数:56

浓差电池电动势计算
电动势(电势)是描述电荷在同一电位能量中的势能的物理量。
电动势可以使用浓差电池
来测量。
浓差电池是一种带有一定的内阻的恒流源,它由两个温度在相同温度的离子溶液,例如,金属/盐溶液和金属/氨水溶液,制成的双极电池。
其中一个极端比另一个极端浓一些。
要测量电动势,首先要测量电位,然后再测量电流。
用浓差电池来测量电动势时,可以用
一个测量仪器,如多用电表,来测量流过电池的电流和每个极端所受的电压。
由于电位之
差所表示的电动势是电流乘以电压之差,所以用浓差电池测量电动势的方法是,先测量电
流和电压的不同,然后用多用电表计算它们之间的乘积,即电动势。
浓差电池测量电动势的优点是准确性高,并且进行测量的方法稍微复杂,但实现起来简单
便捷,操作简便,耗时短,测量结果较准确,抗干扰能力较强。
总之,浓差电池可以测量电动势,使用这种方法来测量电动势是一个非常准确的方法,在
实际工作中应用较为广泛。

电解池原电池电动势电势计算电解池是一种将化学能转化为电能的装置。
在电解池中,通过电解反应使电流产生,从而把化学能转化为电能,是化学电池中最常用的一种。
电解池的原电池电动势就是在标准状态下,由电解反应引起的电动势,是电解池中化学能转变为电能的能力。
下面是电解池原电池电动势的电势计算方法。
一. 原电池电动势的定义原电池电动势E0是指在标准活化状态下,以纯物质作氧化剂和还原剂,产生1mol电子时,电池中的电势差。
二. 标准电极电势的测定标准电极电势是指在标准条件下,电化学电池中氧化反应和还原反应中电子的转移系数都是1时所测定的电极电势,它是用标准电极强度计测定的。
三. 标准电动势计算公式标准电池电动势的计算公式是:E0cell = E0cathode - E0anode其中,E0cell是标准电池电动势,E0cathode是还原电极的标准电极电势,E0anode是氧化电极的标准电极电势。
对于化学方程式2H+ + 2e− → H2,它的标准电极电势为0V。
对于化学方程式Cu2+ + 2e− → Cu,它的标准电极电势为+0.34V。
因此,铜/铜离子电池的标准电池电动势为:E0cell = E0cathode - E0anode = 0V - (+0.34V) = -0.34V四. 温度影响对于每个化学电池来说,它的电动势都会随着温度的变化而变化。
五. 氧化还原电位氧化还原电位是一种描述氧化还原反应趋势的物理量。
在实际应用中,氧化还原电位的计算、测定与预测是很关键的。
六. 应用范围电解池原电池电动势的电势计算是电化学基础知识之一,它在工业、生物、医学、环保等领域都有着广泛的应用。
对于电解池中的原电池电动势,它的电势计算是非常重要的,只有通过电势计算才能确定电池的电势差,从而实现化学能和电能之间的转化。

标准电动势计算公式电动势是指导体中单位正电荷在外电场作用下所受的力做功时,单位正电荷所获得的能量。
在电路中,电动势是指电源对电荷做功的能力,通常用符号ε表示。
标准电动势是指在标准状态下,电池正负极之间的电动势,通常表示为E°。
在化学反应中,标准电动势是反应进行到标准状况时,单位物质的标准电动势。
下面将介绍标准电动势的计算公式。
对于标准电动势的计算,我们需要了解以下两个概念,标准电动势和标准氧化还原电动势。
标准电动势是指在标准状态下,电池正负极之间的电动势,通常表示为E°;而标准氧化还原电动势是指在标准条件下,一个氧化还原反应中,氧化剂和还原剂之间的电动势,通常表示为E°(red)或E°(ox)。
在化学反应中,标准电动势是反应进行到标准状况时,单位物质的标准电动势。
标准电动势的计算公式如下:E°cell = E°(cathode) E°(anode)。
其中,E°cell表示电池的标准电动势,E°(cathode)表示还原电极的标准电动势,E°(anode)表示氧化电极的标准电动势。
在实际应用中,我们可以根据具体的化学反应来计算标准电动势。
以锌和铜电池为例,其化学反应为:Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)。
根据该反应,我们可以得到还原反应和氧化反应:还原反应,Cu2+(aq) + 2e→ Cu(s) E°(cathode) = 0.34V。
氧化反应,Zn(s) → Zn2+(aq) + 2e E°(anode) = -0.76V。
将以上数值代入标准电动势的计算公式中,即可得到该电池的标准电动势:E°cell = 0.34V (-0.76V) = 1.10V。
通过以上计算,我们可以得知锌和铜电池在标准状态下的电动势为1.10V。
除了上述的计算方法外,我们还可以通过标准电极电势表来获取化学反应的标准电动势。

电池电动势计算公式
电池电动势即电池的有效电势,一般可通过电池内部的电位差来计算
电池电动势,其计算公式为:
电池电动势=电导电压-电池内部的电位差。
电池内部的电位差可以通过电池内各正负极之间的电势差来衡量,其
根据电池各正负电极之间的物理位置和电解液的属性而定,一般可用理想
电池来近似模型求解。
具体而言,电池电动势可以通过以下公式计算:
电池电动势=π-α+λ×(电池正极电势-电池负极电势)。
π为电池内电解液的离子电势,α为电池各正负极之间的熔融电势,λ为电解液的离子迁移率。


电池电势计算公式1. 能斯特方程(电池电势的基本计算公式)- 对于一个任意的氧化还原反应aA + bB⇌ cC + dD,其电池反应的能斯特方程为:E = E^∘-(RT)/(nF)ln Q。
- 其中E为电池的电动势(电池电势),E^∘为标准电池电动势,R为气体常数(R = 8.314 J/(mol· K)),T为反应温度(单位为K),n为反应中转移的电子数,F为法拉第常数(F=96485 C/mol),Q为反应商。
- 对于反应aA + bB⇌ cC + dD,反应商Q=([C]^c[D]^d)/([A]^a[B]^b)(这里的[A]、[B]、[C]、[D]表示各物质的相对浓度或相对压力,对于溶液中的物质用浓度,对于气体用分压)。
2. 标准氢电极与标准电池电动势。
- 在标准状态下(溶液中溶质的浓度为1 mol/L,气体分压为100 kPa,温度通常为298 K),将待测电极与标准氢电极组成原电池,所测得的电池电动势就是该电极的标准电极电势φ^∘。
- 对于一个电池反应,其标准电池电动势E^∘=φ^∘_( + )-φ^∘_( - ),其中φ^∘_( + )为正极的标准电极电势,φ^∘_( - )为负极的标准电极电势。
3. 示例计算。
- 例如,对于反应Zn + Cu^2 + ⇌ Zn^2 + +Cu。
- 首先写出两个半反应:- 负极(氧化反应):Zn→ Zn^2 + +2e^-,φ^∘_Zn^2 + /Zn=- 0.76 V。
- 正极(还原反应):Cu^2 + +2e^-→ Cu,φ^∘_Cu^2 + /Cu= + 0.34 V。
- 则标准电池电动势E^∘=φ^∘_Cu^2 + /Cu-φ^∘_Zn^2 + /Zn=0.34 -(-0.76)=1.10 V。
- 如果要计算非标准状态下的电池电动势E,假设[Zn^2 + ]=0.1 mol/L,[Cu^2 + ]=0.01 mol/L,反应中n = 2,T = 298 K。



电化学电池的电动势计算电化学电池是通过在化学反应中产生电能的设备。
其电动势是衡量电化学反应的能力来产生电能的指标。
本文将介绍电化学电池电动势的计算方法。
一、标准电动势计算电化学电池的标准电动势是在标准状态下测量得到的,通常记作E°。
标准状态指温度为298K(25°C)、压强为1 atm(标准大气压),溶液浓度为1 mol/L(摩尔/升)。
标准电动势的计算方法如下:1. 根据所给电化学反应方程式写出反应式和所有的参与物质。
2. 根据参与物质的氧化还原能力,查找标准电极电势(E°)的参考资料。
电极电势是参与物质相对于标准氢电极的电势,表征了物质的氧化还原能力。
3. 将所有参与物质的标准电极电势相加,并根据反应式的余数系数进行相应的乘法和除法运算。
例如,考虑以下锌-铜电池的反应:Zn(s) + Cu2+(aq) --> Zn2+(aq) + Cu(s)根据参考资料可得到锌的标准电极电势为-0.76V,铜的标准电极电势为0.34V。
在此情况下,反应的标准电动势可以计算为:E° = E°(Cu) - E°(Zn)= 0.34V - (-0.76V)= 1.10V因此,这个锌-铜电池在标准状态下的电动势为1.10V。
二、非标准电动势计算实际情况下,电化学电池通常不处于标准状态。
如果在非标准状态下计算电动势,需要引入一个修正项,称为Nernst方程。
Nernst方程的表达式如下:E = E° - (RT/nF) * ln(Q)其中,E为非标准电动势,E°为标准电动势,R为理想气体常数(8.314 J/(mol·K)),T为温度(K),n为电子转移数(表示反应的电子数),F为法拉第常数(96485 C/mol),ln为自然对数运算,Q为反应物的活度积。
通过Nernst方程,可以计算出非标准状态下的电动势。
需要注意的是,Q的计算方式根据具体电化学反应而不同。
一个电池的电动势是多少?
电池的电动势通常指的是它的电压,也就是产生电流的能力。
电动势的单位是伏特(V),代表电流从正极流向负极的势能差。
在理论上,一个电池的电动势是由许多因素决定的,包括电池
的化学成分、内部结构和外部环境等。
不同类型的电池具有不同的
电动势。
当我们讨论一个电池的电动势时,我们通常指的是它的标称电
动势或额定电动势。
标称电动势是制造商指定的电池额定电压,一
般以直流伏特(VDC)为单位。
常见的电池类型包括碱性电池、锂离子电池和铅酸电池等。
碱
性电池的标称电动势通常为1.5V,锂离子电池的标称电动势通常为3.6V或3.7V,铅酸电池的标称电动势通常为2V。
需要注意的是,电池的实际电动势可能与标称电动势略有不同,这取决于电池的使用情况和衰减程度。
此外,电池的电动势可能随
着使用时间的增长而下降。
总而言之,一个电池的电动势取决于多种因素,并且与电池类型密切相关。
标称电动势提供了电池的额定电压,但实际值可能会有所不同。
电池的标准电动势电池是一种能够将化学能转化为电能的装置,它是现代社会中不可或缺的能源设备。
而电池的标准电动势则是评价电池性能的重要指标之一。
本文将就电池的标准电动势进行详细的介绍和解析。
首先,我们需要了解电池的基本结构和工作原理。
电池通常由正极、负极和电解质组成。
正极和负极之间的化学反应产生电子流,从而产生电能。
而电池的标准电动势是指在标准状态下,即温度为25摄氏度、压强为1大气压、溶液浓度为1摩尔/升时,电池正负极之间的电势差。
标准电动势是电池内部化学反应的结果,是电池性能的重要指标之一。
其次,标准电动势与电池的电压有着密切的关系。
电池的电压是指电池正负极之间的电势差,而标准电动势则是在特定条件下的电池电压。
电池的实际电压会受到温度、压强、溶液浓度等因素的影响,而标准电动势则是在标准条件下的理论值。
因此,标准电动势可以作为评价电池性能优劣的重要参考指标。
另外,标准电动势还可以用来计算电池的电动势变化。
根据奥姆定律,电池的电动势与电池内阻和电流大小有关。
而在实际使用中,电池的电动势会因为内阻和电流的存在而产生变化。
通过标准电动势的数值,可以计算出电池在不同条件下的电动势变化,从而更好地了解电池的性能特点。
此外,标准电动势还可以用来比较不同类型电池的性能。
不同类型的电池由于内部化学反应的不同,其标准电动势也会有所差异。
通过比较不同类型电池的标准电动势,可以更好地了解它们的性能特点,从而选择适合的电池类型。
总之,电池的标准电动势是评价电池性能的重要指标,它可以帮助我们更好地了解电池的性能特点、电压变化和不同类型电池之间的差异。
因此,对于电池制造商和使用者来说,了解和掌握电池的标准电动势是十分重要的。
希望本文对您有所帮助,谢谢阅读!。
原电池的电动势原电池的电动势(emf)是指在电池两极之间产生的电势差。
它是电池的重要参数之一,反映了电池的内部化学反应能力和电子传递能力。
本文将从电池的基本原理、电动势的定义、测量方法以及影响电动势的因素等方面进行阐述。
我们来了解一下电池的基本原理。
电池是一种能够将化学能转化为电能的装置。
它由正极、负极和电解质组成。
正极是电池中的氧化剂,负极是还原剂,而电解质则起到连接正负极的作用。
当电池内部发生化学反应时,正极和负极之间会产生电子流动,形成电流。
接下来,我们来了解一下电动势的定义。
电动势是指电池两极之间的电势差,表示单位正电荷从电池的负极移动到正极时所做的功。
通常用字母E来表示电动势,单位是伏特(V)。
电动势的测量可以通过连接一个理想的伏特计来进行。
在测量过程中,伏特计的内阻应远大于电池的内阻,以保证测量结果的准确性。
将伏特计的正极连接到电池的正极,负极连接到电池的负极,即可读取电池的电动势。
然而,电动势并不是一个固定不变的值,它受到多种因素的影响。
首先,电池的化学反应类型对电动势有很大的影响。
不同类型的电池,如干电池、碱性电池、锂电池等,其内部的化学反应方式不同,因此电动势也会有所差异。
温度对电动势的影响也是不可忽视的。
一般来说,随着温度的升高,电动势会有所下降。
这是因为在高温下,电池内部的化学反应速率增加,但同时也会造成电池的寿命缩短。
电池的使用状态也会对电动势产生影响。
当电池处于放电状态时,电动势会随着时间的推移而逐渐下降。
这是因为随着化学反应的进行,电池内部的化学物质逐渐消耗,导致电动势下降。
电池的存储方式和使用环境也会对电动势产生一定的影响。
比如,长时间不使用的电池可能会出现自放电现象,导致电动势下降。
同时,极端的温度和湿度等环境条件也会影响电池的电动势。
原电池的电动势是电池的重要参数之一,反映了电池的内部化学反应能力和电子传递能力。
电动势的测量可以通过连接一个理想的伏特计来进行。
然而,电动势并不是一个固定不变的值,它受到电池的化学反应类型、温度、使用状态以及存储和使用环境等因素的影响。