北京大学网络教育学院无机化学课程作业4-1
- 格式:xls
- 大小:16.00 KB
- 文档页数:5

第13章氢和稀有气体13-1 氢作为能源,其优点是什么?目前开发中的困难是什么?1、解:氢作为能源,具有以下特点:(1)原料来源于地球上储量丰富的水,因而资源不受限制;(2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境;(4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用13-2按室温和常压下的状态(气态液态固态)将下列化合物分类,哪一种固体可能是电的良导体?BaH2;SiH4;NH3;AsH3;PdH0.9;HI13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。
3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。
13-4试说明稀有气体的熔点、沸点、密度等性质的变化趋势和原因?4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。
这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。
分子量越大,分子间相互作用力越大,熔点沸点越来越高。
密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。
13-5你会选择哪种稀有气体作为:(a)温度最低的液体冷冻剂;(b)电离能最低安全的放电光源;(c)最廉价的惰性气氛。
13-6用价键理论和分子轨道理论解释HeH、HeH+、He2+粒子存在的可能性。
为什么氦没有双原子分子存在?13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型:(a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4X e F 平面四边形 2XeF 直线形3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。

作业1 A型题:1. A.2. [1分] B.略有增大3. 一定温度下难溶电解质有关离子浓度的幂的乘积称为溶度积 [1分] B.饱和溶液中4. 盐效应能使难溶电解质的电离度 [1分] A.增大5. 在H2S饱和溶液中,下列表达式哪个是错误的?Ka1θ、Ka2θ表示H2S一、二级电离常数 [1分] A.[ H+ ] = 2 [ S2- ]6. [1分] A.先产生AgCl沉淀7. 在HAc溶液中加入NaCl,使HAc电离度增大,这种现象称为 [1分] C.盐效应8. 沉淀溶解的条件 [1分] C.9. 可以作为衡量缓冲溶液能力大小的是 [1分] D.缓冲容量10. 下列说法正确的是 [1分] C.同一弱电解质的溶液,浓度小的,电离度大11. A.12. B.4.7513. 一元弱酸强碱盐的水解常数可以表示为 [1分] A.14. [1分] B.15. 对于缓冲能力较大的缓冲溶液,它们的pH值最主要是由下列哪一种因素决定 [1分] A.缓冲(共轭)对之间的电离常数16. H3PO4的三级电离常数分别是Ka1θ、Ka2θ、Ka3θ,总电离平衡常数为Kaθ下列那些表达式是正确的? B.Kaθ =Ka1θ+Ka2θ+Ka3θ17. E.18. [1分] A.使更多的AgCl沉淀19. HAc的电离常数为Kaθ,在HAc溶液中加入NaAc固体,将使 [1分] C.pH值升高20. [1分] A.HAc —NaAC21. [1分] D.1.3%22. 下列溶液哪个是缓冲溶液 [1分] A.23. [1分] B.24. 沉淀完全的标准一般认为是 [1分] A.25. [1分] A.26. [1分] A.8227. [1分] A.9.2528. [1分] B.略有增大29. [1分] C.30. [1分] E.这些都不是31. NaAc固体加到HAc溶液中去,将使HAc的 [1分] D.电离度减小32. 同离子效应能使难溶强电解质的溶液变 [1分] B.减小33. 在HAc溶液中加入固体NaCl,使其溶解,可使 [1分] B.HAc电离度增大34. [1分] A.酸碱反应35. [1分] D.36. [1分] B.37. [1分] C.38. C.离子间的相互牵制39. 在NaHCO3溶液中。

单选题1、已知MnO2(s)=MnO(s) + ½O2(g)的=akJ∙mol-1;Mn(s) + MnO2(s) = 2MnO(s)的=b kJ∙mol-1,则MnO2(s)的标准摩尔生成焓为()kJ∙mol-1(4A.2a – bB.b – 2aC.a – 2bD.a – b我的答案:B得分:4分2、HA起始浓度为c,达解离平衡HA⇌H+ + A−时的解离度为α,则HA的Ka为()(4 分)A.B.C.D.我的答案:A得分:4分3、某可逆反应,当温度由T1升高至T2时,标准平衡常数>,则该反应的等cc6fab934c894e7压反应热()(4 分)A.大于零B.小于零C.等于零D.无法判断我的答案:A得分:4分4、某反应物在一定条件下的平衡转化率为36%,当加入催化剂,而反应条件不变时,其平衡转化率为()(4A.大于36%B.等于36%C.小于36%D.无法确定我的答案:B得分:4分5、反应A(s) + B2+(aq) ⇌A2+(aq) + B(s)在温度T时的标准平衡常数 = 1.0。
若B2+和A2+的浓度分别为0.50mol∙L-1和0.10mol∙L-1,则反应()(4 分)f4b43bbf076042A.正向自发进行B.处于平衡态C.逆向自发进行D.无法判断方向我的答案:A得分:4分6、反应aA(g) + bB(g) ⇌dD(g) + eE(g)达平衡后,在温度不变的情况下,增大压力,平衡向正反应方向移动,由此可知,下列各式中正确的是()(4A.a + b=d + eB.(a + b)>(d + e)C.(a + b)<(d + e)D.a>b,d>e我的答案:B得分:4分7、在某温度下,已知反应½N2(g) + ³⁄2H2(g) ⇌NH3(g)的标准平衡常数为a,该反应若写成2NH3(g) ⇌N2(g) + 3H2(g),则在相同温度下反应的标准平衡常数为()(4 分)A.a/2B.2aC.a2D.(1/a)2我的答案:D得分:4分8、对反应H2(g) + I2(g) ⇌2HI(g),下列措施中将改变标准平衡常数的是()(4 分)A.加更多的H2B.除去一些HIC.使用较小的反应容器D.升高温度我的答案:D得分:4分9、下列说法中正确的是()(4A.放热反应都是自发反应B.ΔrSm为正值的反应都可自发进行C.若化学反应的>0,则此反应不能发生D.若化学反应的ΔrHm和ΔrSm都是正值,当温度升高时,ΔrGm将减小我的答案:D得分:4分10、NaOH固体溶解于水中,溶液变热,则该过程的、、为()(4 分)A.>0,<0,<0B.<0,>0,<0C.>0,>0,>0D.<0,<0,<0我的答案:B得分:4分11、下列反应的标准自由能变等于产物的标准摩尔生成自由能的是()(4967abddfa7c040分)A.H2(g) + ½O2(g) = H2O(l)B.CO(g) + ½O2(g) = CO2(g)C.H2(g) + Cl2(g) = 2HCl(g)D.Ag(s) + ½Br2(g) = AgBr(s)我的答案:A得分:4分12、下列反应中熵增加的是()(4A.水蒸气凝结为水B.酒精挥发C.Ag+(aq) + I−(aq) =AgI(s)D.H2(g) + Cl2(g) =2HCl(g)我的答案:B得分:4分13、在热力学中,焓的定义式为()(4A.DU = Q + WB.H = U + pVC.G = H −TSD.=Qp我的答案:B得分:4分14、某系统经过一系列变化又回到初始状态,则系统的()(4A.Q>W,DU = Q + W,= 0B.Q = 0,W = 0,DU = 0,= 0C.Q = −W,Q + W = 0,= 0D.Q>0,W<0,DU = 0,= 0我的答案:C得分:4分15、某系统由A态到B态,沿途经Ⅰ放热100J,环境对系统做功50J;如果系统由A态沿途径Ⅱ到B态,吸热40J,则其W为()J(4A.−90B.10C.90D.110我的答案:A得分:4分16、下列各组物理量中,均为状态函数的是()(4A.U,H,GB.T,V,QvC.W,Qp,pD.,S,G我的答案:A得分:4分17、维持毛细血管内外水平衡的是()(4A.晶体渗透压B.胶体渗透压C.氯化钠产生的渗透压D.电解质分子产生的渗透压我的答案:B得分:4分18、下列溶液中,使红细胞发生溶血的溶液是()(4A.9.0g∙L-1NaCl溶液B.0.15mol∙L-1CaCl2溶液C.50.0g∙L-1葡萄糖溶液D.5.0g∙L-1NaCl溶液我的答案:D得分:4分19、相同条件下,下列4种水溶液中,凝固点最低的是()(4A.9.0g∙L-1NaCl溶液B.0.20mol∙L-1蔗糖溶液C.50.0g∙L-1葡萄糖溶液D.0.15mol∙L-1CaCl2溶液我的答案:D得分:4分20、等渗溶液应是()(4A.质量浓度相等的溶液B.质量摩尔浓度相等的溶液C.凝固点降低相同的溶液D.物质的量浓度相等的溶液我的答案:C得分:4分21、欲使被半透膜隔开的A、B两种稀溶液之间不发生渗透,应使两溶液的()(4 分)A.物质的量浓度相等B.渗透浓度相等C.质量摩尔浓度相等D.质量浓度相等我的答案:B得分:4分22、已知HAc的Ka = 1.8´10−5,300mL、0.20mol∙L-1HAc溶液,稀释到体积为()时,其解离度增大一倍。

精心整理第十一章电化学基础11-1用氧化数法配平下列方程式(1)KClO 3→KClO 4+KCl(2)Ca 5(PO 4)3F+C+SiO 2→CaSiO3+CaF 2+P 4+CO(3)NaNO 2+NH 4Cl →N 2+NaCl+H 2O(4)K 2Cr 2O 7+FeSO 4+H 2SO 4→Cr 2(SO 4)3+Fe 2(SO 4)3+K 2SO 4+H 2O(5)CsCl+Ca →CaCl 2+Cs解:(((((11-2(1(2(3(4(5解:(2(3(4(511-3.用半反应法(离子-电子法)配平下列方程式(1)K 2Cr 2O 7+H 2S+H 2SO 4——K 2SO 4+Cr 2(SO 4)3+H 2O(2)MnO 42-+H 2O 2———O 2+Mn 2+(酸性溶液)(3)Zn+NO 3-+OH -——NH 3+Zn (OH )42-(4)Cr (OH )4-+H 2O 2——CrO 42-(5)Hg+NO 3-+H +——Hg 22++NO解:(1)K 2Cr 2O 7+3H 2S+4H 2SO 4==K 2SO 4+Cr 2(SO 4)3+7H 2O+3S(2)MnO 42-+2H 2O 2+4H +==2O 2+Mn 2++4H 2O(3)Zn+NO 3-+3H 2O+OH -==NH 3+Zn (OH )42-(4)2Cr(OH)4-+3H2O2+2OH==-2CrO42-+8H2O(5)6Hg+2NO3-+8H+==3Hg22++2NO+4H2O11-4将下列反应设计成原电池,用标准电极电势判断标准态下电池的正极和负极,电子传递的方向,正极和负极的电极反应,电池的电动势,写出电池符号.(1)Zn+2Ag+=Zn2++2Ag(2)2Fe3++Fe=3Fe2+(3)Zn+2H+=Zn2++H2(4)H2+Cl2=2HCl(5)3I2+6KOH=KIO3+5KI+3H2O11-5写出下列各对半反应组成的原电池的电池反应、电池符号,并计算标准电动势。

北京⼤学中⽆机化学答案⽆机化学习题参考答案(II)第⼀章1.4.解:(1)H 2O 22C(2)S 2O 323v C(3)N 2O (NN O ⽅式) v C ∞(4)Hg 2Cl 2h D ∞(5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4d T (8)SClF 54v C (9)反-Pt(NH 3)2Cl 2 2h D(10)PtCl 3(C 2H 4)2v C1.B(CH 3)3和BCl 3相⽐,哪⼀个的Lewis 酸性强,为什么?⼀般来说,CH 3为推电⼦基团,Cl 为吸电⼦基团,因此的Lewis 酸性强。
(BCl 3易⽔解;B(CH 3)3不溶于⽔,在空⽓中易燃)2.BH 3和BF 3都可和(CH 3)2NPF 2⽣成加合物,在⼀种加合物中,B 原⼦和N 相连,另⼀种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3C CH 3NPF F H 3CCH 3NB BH 3F 34. 吸⽔后失效的AlCl 3有什么⽅法可以脱⽔?因为Al 3+是典型的硬酸,与氧的亲合⼒很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等⽓氛下加热脱⽔。
(只能加强热⽣成 Al 2O 3后,⽤⾼温下⽤加C 和Cl 2⽤还原氯化法制备,这就不是脱⽔⽅法了)。
第⼆章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态第四周期(分裂能⼩)第六周期(分裂能⼤)P Ni ClP ClPtCl ClPtCl ClP PPPtrans cis四⾯体构型平⾯四⽅形构型(两种构型)只有⼀种结构(P 代表PPh 3)2.2 解(1)MA 2B 4(2)MA 3B 3M A AB BBB M ABA BBB M ABA ABB M A AA Btrans cis fac(⾯式) mer(经式) D 4h C 2v C 3v C 2v =0 0 0 facmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+Cl NH3ClNH 3ClH3Ntrans cis Co(en)(NH3)2Cl2+NH3NH3ClClClNH3ClNH3ClNH3ClNH3ClClNH3NH3trans(1) trans(2) cis2.4 Co(en)33+Ru(bipy)32+⼿性分⼦D3D3PtCl(dien)+ClNCH2CH2CH2NH2NH2CH2基本上为平⾯分⼦,⽆⼿性2.5 (1) 分别⽤BaCl2溶液滴⼊,有⽩⾊沉液出现的为[Co(NH3)5Br]SO4,或分别加⼊AgNO3溶液,产⽣浅黄⾊沉淀的为[Co(NH3)5SO4]Br。

1. 脂肪酸氧化的最终产物是( B )A)H2O和CO2B)ATP、H2O及CO2C)乙酰CoAD)脂酰CoAE)乙酰CoA、FADH2及NADH2. 酮体包括( D )A)草酰乙酸、β羟丁酸及丙酮B)草酰乙酸、β羟丁酸及丙酮酸C)乙烯乙酸、β羟丁酸及丙酮D)乙酰乙酸、β羟丁酸及丙酮E)乙酰乙酸、β异丁酸及丙酮3. 体内合成脂肪酸、胆固醇时所需的氢来自( D )A)FMNH2B)FADH2C)NADH+H+D)NADPH+H+E)CoQH24. 甘油三酯水解过程的调节酶(限速酶)是( C )A)组织脂肪酶B)甘油二酯脂肪酶C)激素敏感性脂肪酶D)胰脂肪酶E)肝脂酶5. 体内不能合成,必须由食物供应的必需脂肪酸是( C )A)软油酸B)油酸C)亚油酸D)廿碳三烯酸E)软脂酸6. 细胞色素b,c1,c和P450均含辅基( B )A)Cu2+B)铁卟啉C)Mg2+D)原卟啉ⅤE)原卟啉原7. 苹果酸-天冬氨酸穿梭的生理意义是( D )A)将乙酰CoA转移出线粒体B)维持线粒体内外有机酸的平衡C)为三羧酸循环提供足够的草酰乙酸D)将NADH+H+上的H带入线粒体E)将草酰乙酸带入线粒体彻底氧化8. FAD和FMN含有维生素( B )A)Vit B1B)Vit B2C)VitPPD)泛酸E)VitB69. 人体活动主要的直接供能物质是( C )A)葡萄糖B)脂肪酸C)ATPD)GTPE)磷酸肌醇10. 各种细胞色素在呼吸链中的排列顺序是( C )A)aa3→b1→c→c1→O2B)c1→c→b1→aa3→O2C)b→c1→c→aa3→O2D)aa3→b→c1→c→O2E)c→c1→b→aa3→O211. 氰化物和一氧化碳中毒的机理是抑制( D )A)cytbB)NADH脱氢酶C)泛醌D)细胞色素氧化酶E)琥珀酸脱氢酶12. 影响氧化磷酸化的因素不包括( C )A)[ATP]/[ADP]比值B)[ADP]C)[AMP]D)细胞对能量的需求E)甲状腺素13. 人体的营养非必需氨基酸是( C )A)苯丙氨酸B)甲硫氨酸C)谷氨酸D)色氨酸E)苏氨酸14. 肌肉中氨基酸脱氨基作用的主要方式是( A )A)嘌呤核苷酸循环B)谷氨酸氧化脱氨基作用C)转氨基作用D)鸟氨酸循环E)转氨基与谷氨酸氧化脱氨基的联合15. 体内氨储存及运输的主要形式之一是( C )A)谷氨酸B)酪氨酸C)谷氨酰胺D)谷胱甘肽E)天冬酰胺16. 食物蛋白质的互补作用是指( C )A)糖与蛋白质混合食用,提高营养价值B)脂肪与蛋白质混合食用,提高营养价值C)几种蛋白质混合食用,提高营养价值D)糖、脂肪、蛋白质混合食用,提高营养价值E)用糖、脂肪代替蛋白质的营养作用17. 营养充足的婴儿、孕妇、恢复期病人常保持( C )A)氮平衡B)氮负平衡C)氮正平衡D)氮总平衡E)氮不平衡18. 哺乳类动物体内氨的主要去路是 ( B )A)渗入肠道B)在肝中合成尿素C)经肾泌氨随尿排出D)生成谷氨酰胺E)合成非必需氨基酸19. 人体内嘌呤核苷酸分解代谢的主要终产物是( D )A)尿素B)肌酸C)肌酸酐D)尿酸E)β丙氨酸20. 不是嘌呤核苷酸从头合成的原料分子是( C )A)甘氨酸B)天冬氨酸C)谷氨酸D)CO2E)一碳单位21. 嘧啶核苷酸从头合成的特点是( C )A)在5-磷酸核糖上合成碱基B)由FH4提供一碳单位C)先合成氨基甲酰磷酸D)甘氨酸完整地掺入E)谷氨酸提供氮原子22. 嘌呤核苷酸从头合成时首先生成的是( E )A)GMPB)AMPC)ATPD)GTPE)IMP23. 5-氟尿嘧啶的抗癌作用机理是( A )A)抑制胸苷酸的合成B)抑制尿嘧啶的合成C)抑制胸腺嘧啶的合成D)抑制胞嘧啶的合成E)抑制腺嘌呤的合成24. 最直接联系核苷酸合成与糖代谢的物质是( D )A)葡萄糖B)6-磷酸葡萄糖C)1-磷酸葡萄糖D)5-磷酸核糖E)1.6-二磷酸果糖25. 关于酶含量的调节错误的叙述是( B )A)酶含量调节属细胞水平的调节B)酶含量调节属快速调节C)底物常可诱导酶的合成D)产物常阻遏酶的合成E)激素或药物也可诱导某些酶的合成26. 下列关于酶的化学修饰调节的叙述中错误的是( E )A)引起酶蛋白发生共价变化B)使酶活性改变C)有放大效应D)是一种酶促反应E)与酶的变构有关27. cAMP可直接激活( B )A)腺苷酸环化酶B)蛋白激酶AC)磷酸二脂酶D)磷酸化酶E)磷脂酶28. 酮体生成的调节酶(关键酶)是( A )A)HMGCoA合成酶B)HMGCoA还原酶C)HMGCoA裂解酶D)乙酰CoA羧化酶E)柠檬酸裂解酶29. 胆固醇合成的调节酶(关键酶)是( B )A)HMGCoA合成酶B)HMGCoA还原酶C)HMGCoA裂解酶D)乙酰CoA羧化酶E)柠檬酸裂解酶30. 关于糖、脂、氨基酸代谢错误的是( D )A)乙酰CoA是糖、脂、氨基酸分解代谢共同的中间代谢物B)三羧酸循环是糖、脂、氨基酸分解代谢的共同途径C)当摄入糖量超过体内消耗时,多余的糖可转变为脂肪D)当摄入大量脂类物质时,脂类可大量异生为糖E)糖、脂是体内的主要供能物质。

无机化学_第四版_北师大版_课后答案(补充:1-11章)_khdaw第一章原子结构与元素周期系1-14Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
答:∵E=190kJ/mol∴每个分子解离所需要的能量为190×10-3/6.02×1023=3.156×10-19(J)所需吸收光子能量为E=hν=3.156×10-19J∴λ=c/ν=c·h/E=3×108×6.63×10-34/3.156×10-19=6.3×10-7(m)=630(nm)ν=4.76×10141-19氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?答:氢原子莱曼系的跃迁吸收光子的波数公式为ǔ=1/λ=R H·(1/12-1/n2)已知波长λ=103nm=1.03×10-7m∴1/1.03×10-7=R H·(1/12-1/n2),R H=1.09677×10-7∴n=2.95≈3∴相应于氢原子电子从n=1的轨道向n=3的轨道跃迁的过程,即从K 层→M层轨道的跃迁1-21当电子的速度达到光速的20.0%时,该电子的德布罗意波长多大?当锂原子(质量7.02amu)以相同速度飞行时,其德布罗意波长多大?答:对电子,λ=h/mv=6.63×10-34×(9.11×10-31×3×108×20%)-1=1.21×10-11m=12.1(pm)对锂原子,其m=7.02×1.660×10-24×10-3=1.165×10-26(kg)∴λ=h/mv=6.63×10-34×(1.165×10-26×3×108×20%)-1 =9.48×10-16m=9.48×10-4(pm)1-23处于K、L、M层的电子最大可能数目各为多少?答:处于K层,即n=1,而每个能层能容纳的最大电子数目为2n2∴第K层:2×12=2(个)第L层:2×22=8(个)第M层:2×32=18(个)1-24以下哪些符号是错误的?(a)6s(b)1p(c)4d(d)2d(e)3p(f)3f答:(a)6s对;(b)1p错(因为n=1,则l只能是0,即s);(c)4d对;(d)2d错(因为n=2,则l可能是0,1,即s,p轨道);(e)3p对;(f)3f错(因为n=3,则l可能是0,1,3即s,p,d轨道)。
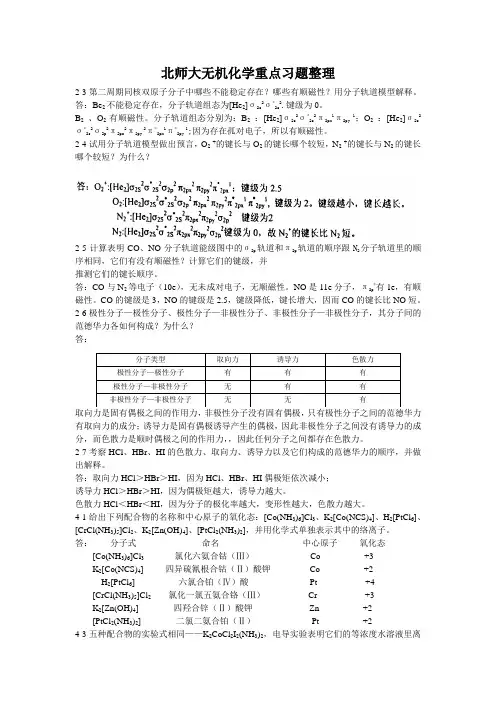
北师大无机化学重点习题整理2-3第二周期同核双原子分子中哪些不能稳定存在?哪些有顺磁性?用分子轨道模型解释。
答:Be2不能稳定存在,分子轨道组态为[He2]σ2s2σ*2s2.键级为0。
B2、O2有顺磁性。
分子轨道组态分别为:B2:[He2]σ2s2σ*2s2π2px1π2py1;O2:[He2]σ2s2σ*2s2σ2p2π2px2π2py2π*2px1π*2py1;因为存在孤对电子,所以有顺磁性。
2-4试用分子轨道模型做出预言,O2+的键长与O2的键长哪个较短,N2+的键长与N2的键长哪个较短?为什么?2-5计算表明CO、NO分子轨道能级图中的σ2p轨道和π2p轨道的顺序跟N2分子轨道里的顺序相同,它们有没有顺磁性?计算它们的键级,并推测它们的键长顺序。
答:CO与N2等电子(10e),无未成对电子,无顺磁性。
NO是11e分子,π2p*有1e,有顺磁性。
CO的键级是3,NO的键级是2.5,键级降低,键长增大,因而CO的键长比NO短。
2-6极性分子—极性分子、极性分子—非极性分子、非极性分子—非极性分子,其分子间的范德华力各如何构成?为什么?答:分子类型取向力诱导力色散力极性分子—极性分子有有有极性分子—非极性分子无有有非极性分子—非极性分子无无有取向力是固有偶极之间的作用力,非极性分子没有固有偶极,只有极性分子之间的范德华力有取向力的成分;诱导力是固有偶极诱导产生的偶极,因此非极性分子之间没有诱导力的成分,而色散力是顺时偶极之间的作用力,,因此任何分子之间都存在色散力。
2-7考察HCl、HBr、HI的色散力、取向力、诱导力以及它们构成的范德华力的顺序,并做出解释。
答:取向力HCl>HBr>HI,因为HCl、HBr、HI偶极矩依次减小;诱导力HCl>HBr>HI,因为偶极矩越大,诱导力越大。
色散力HCl<HBr<HI,因为分子的极化率越大,变形性越大,色散力越大。
4-1给出下列配合物的名称和中心原子的氧化态:[Co(NH3)6]Cl3、K2[Co(NCS)4]、H2[PtCl6]、[CrCl(NH3)5]Cl2、K2[Zn(OH)4]、[PtCl2(NH3)2],并用化学式单独表示其中的络离子。

1. 有一个原电池Pt│Fe3+(1 mol·L-1),Fe2+(1 mol·L-1)‖Ce4+(1 mol·L-1),Ce3+(1 mol·L-1)│Pt,则该A)Ce3+ + Fe3+ ⇔Ce4+ + Fe2+B)Ce4+ + Fe2+ ⇔Ce3+ + Fe3+C)Ce3+ + Fe2+⇔ Ce4+ + FeD)Ce4+ + Fe3+ ⇔Ce3+ + Fe2+2. 关于原电池的下列叙述中错误的是( D )。
A)盐桥中的电解质可以保持两半电池中的电荷平衡B)盐桥用于维持电池反应进行C)盐桥中的电解质不参与电池反应D)电子通过盐桥流动3. 已知φΘ(Cl2/Cl–) = 1.36V,φΘ(Cu2+/Cu) = 0.34V,则反应Cu + Cl2 = Cu2+ + 2Cl– 的标准电池电动势E Θ为(A)-1.02 VB)1.02 VC)1.70 VD)2.38 V 4. 已知Fe3+ + e ⇔Fe2+ 的φΘ = 0.771 V,当此电极的 φ= 0.750 V时,则溶液中必定是( A )。
A)c(Fe3+)/c(Fe2+)<1B)c(Fe3+)<1C)c(Fe2+)/c(Fe3+)<1D)c(Fe2+)<15. 已知φΘ(Sn2+/Sn) = -0.14 V、φΘ(Br2/Br-) = 1.07 V、φΘ(Fe3+/Fe2+) = 0.77 V、φΘ(Cu2+/Cu) = 0.34 V,则A)Br- 和Fe3+B)Fe2+ 和CuC)Cu和Sn2+D)Br2和Cu6. 在298K时,若将铜?锌原电池中Cu2+ 和Zn2+ 的浓度均降为0.10 mol·L-1,则此时原电池的电动势与标准状态时比较(A)无变化B)上升0.48 VC)下降0.48 VD)下降0.24 V7. 下列电对的标准电极电势最大的是( A )。
A)φΘ(Ag+/Ag)B)φΘ(AgCl/Ag)C)φΘ(AgBr/Ag)D)φΘ(AgI/Ag)8. 已知φΘ(Zn2+/Zn) = -0.76 V,φΘ(H+/H2) = 0.00 V,则反应Zn(s) + 2H+(aq) = Zn2+(aq) + H2(g) 的lgK Θ为(A)-25.68B)-12.84C)12.84D)25.689. 下列分子或离子中,可做配体的是( B )。

1. 下列浓度均为0.10 mol·L-1的溶液中,离子强度最大的是( B )。
A)Na2SO4B)Na3PO4C)NH4AcD)ZnSO42. 相同条件下,下列4种水溶液中,凝固点最低的是( D )。
A)9.0 gL-1 NaCl溶液B)0.20 molL-1 蔗糖溶液C)50.0 gL-1 葡萄糖溶液D)0.15 molL-1 CaCl2溶液3. 质量浓度为11.1 gL-1 CaCl2(其相对分子质量为111.0)溶液的渗透浓度是( C )molL-1。
A)0.10B)0.20C)0.30D)0.404. 非电解质稀溶液的蒸气压下降、沸点升高和凝固点降低的数值取决于( D )。
A)溶质的本性B)溶液的温度C)溶液的体积D)溶液的质量摩尔浓度5. 等渗溶液应是( C )。
A)质量浓度相等的两种溶液B)质量摩尔浓度相等的两种溶液C)凝固点降低值相等的两种溶液D)物质的量浓度相等的两种溶液6. 下列溶液中,使红细胞发生溶血的溶液是( D )。
A)9.0 g/LNaCl溶液B)0.15 molL-1 CaCl2溶液C)50.0 g/L葡萄糖溶液D)0.10 molL-1 NaCl 溶液+ 50.0 gL-1葡萄糖溶液7. 维持毛细血管内外水平衡的是( B )。
A)晶体渗透压B)胶体渗透压C)氯化钠产生的渗透压D)电解质分子产生的渗透压8. 聚沉As2S3负溶胶,下列电解质中聚沉能力最强的是( D )。
A)Ca(NO3)2B)K2SO4C)Na3PO4D)AlCl39. 将高分子溶液作为胶体体系来研究,因为它( D )。
A)是多相体系B)热力学不稳定体系C)对电解质很敏感D)粒子大小在胶体范围内10. 蛋白质在等电点时( B )。
A)溶液中正、负离子数相等B)蛋白质分子所带正、负电荷数量相等C)溶液中正、负电荷数相等D)[H+] = [OH-]11. α–球蛋白等电点为4.8,将其置于pH为6.5的缓冲溶液中,α–球蛋白应该是( C )。

1. 含有两个羧基的氨基酸是( c )A)丝氨酸B)酪氨酸C)谷氨酸D)赖氨酸E)苏氨酸2. 维系蛋白质一级结构的化学键是( a )A)肽键B)氢键C)盐键D)疏水键E)范德华力3. 蛋白质分子引起280nm光吸收的最主要成分是( d )A)肽键B)半胱氨酸的-SH基C)精氨酸的胍基D)色氨酸的吲哚环E)组氨酸的咪唑环4. 变性蛋白质的特点是( d )A)粘度下降B)溶解度增加C)颜色反应减弱D)丧失原有的生物学活性E)不易被胃蛋白酶水解5. 蛋白质分子的一级结构是指( d )A)组成蛋白质的氨基酸种类B)组成结合蛋白质的非蛋白质成分C)组成蛋白质的氨基酸组成比例D)组成蛋白质的氨基酸排列顺序E)组成蛋白质的氨基酸侧链基团的相互作用6. 影响蛋白质在液体中溶解的因素是( c )A)蛋白质溶液有分子扩散现象B)蛋白质在溶液中有"布朗运动"C)蛋白质分子表面带有水化膜和同种电荷D)蛋白质溶液的粘度大E)蛋白质分子带有电荷7. Tm值愈高的DNA分子,其碱基组成的特点是( a )A)G+C含量愈高B)A+G含量愈高C)A+C含量愈高D)A+T含量愈高E)T+C含量愈高8. 含稀有碱基较多的核酸分子是( a )A)tRNAB)rRNAC)mRNAD)hnRNAE)DNA9. DNA中碱基对之间的关系是( c )A)A=G,C≡TB)A≡T,G=CC)A=T,G≡CD)A-T,G=CE)A=U,G≡C10. DNA变性时,其理化性质的主要改变是( c )A)溶液粘度升高B)浮力密度升高C)260nm处光吸收增加D)易被蛋白酶降解E)分子量降低11. 组成核酸的基本结构单位是( d )A)嘌呤碱基B)核糖C)核苷D)核苷酸E)嘧啶碱基12. Michaelis-Menten方程式是( c )A)v = ( Km +[S] ) / ( V+[S] )B)v = ( V+[S] ) / ( K m+[S] )C)v = ( V[S] ) / ( Km+[S] )D)v = ( Km + [S] ) / ( V[S] )E)v = ( Km[S] ) / ( V+[S] )13. 反竞争性抑制剂具有的动力学效应是( d )A)Km值升高,V max不变B)Km值降低,V max不变C)Km值不变,V max升高D)Km值和V max均降低E)Km值不变,V max降低14. 酶分子中使底物转变为产物的基团称为( d )A)结合基团B)调节基团C)诱导基团D)催化基团E)变构基团15. 全酶中酶蛋白的最主要功能是( b )A)增强酶蛋白的特异性B)决定反应的特异性C)参与酶促化学反应D)激活底物E)提高酶的活化能16. 辅酶NAD+和NADP+中含有的维生素是( c )A)Vit B1B)Vit B2C)Vit PPD)Vit B6E)Vit B1217. 同工酶的酶蛋白( a )A)催化的化学反应相同B)理化性质相同C)分子结构相同D)免疫学性质相同E)Km值相同18. 糖酵解时,下列代谢物中能生成高能磷酸键使ADP生成ATP的代谢对是( b )A)3-磷酸甘油醛及磷酸果糖B)1,3-二磷酸甘油酸及磷酸烯醇式丙酮酸C)1,6-二磷酸果糖及1,3-二磷酸甘油酸D)α-磷酸甘油酸及6-磷酸葡萄糖E)1-磷酸葡萄糖及磷酸烯醇式丙酮酸19. 剧烈运动时肌肉中葡萄糖酵解的主要产物是( b )A)甘油B)乳酸C)酮体D)丙酮酸E)甘油酸20. 糖异生的概念是( e )A)葡萄糖转变为胆固醇B)葡萄糖转变为脂肪C)葡萄糖转变为核糖D)葡萄糖转变为氨基酸E)非糖物质转变为葡萄糖21. 三羧酸循环中有作用物水平磷酸化的反应是( b )A)琥珀酸 → 延胡索酸B)α-酮戊二酸 → 琥珀酸C)延胡索酸 → 苹果酸D)苹果酸 → 草酰乙酸E)柠檬酸 → α-酮戊二酸22. 糖原合成中葡萄糖的活化形式为( a )A)UDP-葡萄糖B)CDP-葡萄糖C)1-磷酸葡萄糖D)葡萄糖醛酸E)6-磷酸葡萄糖23. 毛发的角蛋白中含量最多的结构是( b )A)β折叠B)α螺旋C)双螺旋D)超螺旋E)三股螺旋24. DNA的二级结构是( c )A)β折叠B)α螺旋C)双螺旋D)超螺旋E)三股螺旋25. 竞争性抑制剂作用是( a )A)占据酶活性中心阻止底物与酶结合B)能与底物结合C)不能与游离酶结合D)酶可以与底物,抑制剂同时结合E)只能与酶-底物复合物结合26. 提供NADPH的代谢途径是( c )A)糖酵解B)糖原分解C)磷酸戊糖途径D)糖异生E)三羧酸循环27. 体内糖、脂、氨基酸分解代谢的最终共同途径是( e )A)糖酵解B)糖原分解C)磷酸戊糖途径D)糖异生E)三羧酸循环28. 提供核酸合成原料的代谢途径是( c )A)糖酵解B)糖原分解C)磷酸戊糖途径D)糖异生E)三羧酸循环29. 糖异生途径的调节酶(关键酶)是( d )A)醛缩酶B)丙酮酸激酶C)磷酸果糖激酶1D)丙酮酸羧化酶E)磷酸甘油酸激酶。
无机化学(第四版)答案第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
A型题:请从备选答案中选取一个最佳答案1. 下列物质中热稳定性最好的是 [1分]A.Ca(HCO3) 2B.CaCO3C.BaCO3D.H2CO3E.MgCO32. 在下列化合物中,氢键表现最强的是 [1分]A.NH3B.H2OC.H2SD.HClE.HBr3. 硝酸分子中有一个π键,可表示为 [1分]A.B.C.D.E.4. 主成分含铁的中药是 [1分]A.芒硝B.朱砂C.赭石D.轻粉E.雄黄5. 下列哪一族离子在中性条件下通入H2S都不生成硫化物沉淀 [1分]A.Fe2+、Mg2+B.Ca2+、Co2+C.Ag+、Pb2+D.Mg2+、Ca2+E.Ag+、Sn2+6. 下列化合物属于两性氧化物的是 [1分]A.Na2OB.Al2O 3C.CO2D.SO3E.CaO7. 在水溶液中易自发歧化的是 [1分]A.Fe2+B.Hg22+C.Cu+D.Hg2+E.Cr3+8. 在MnSO4溶液中滴加NaOH后,在空气中放置可以观察到的现象是 [1分]A.开始为白色胶状沉淀→棕色沉淀B.开始生成白色沉淀→黄色沉淀→棕色沉淀→黑色沉淀C.开始生成白色沉淀→变灰绿色沉淀→棕色沉淀D.黄色沉淀→黑色沉淀E.黑色沉淀→白色沉淀9. 在水溶液中都具有颜色的离子是 [1分]A.Cu2+、Na+、Al3+B.Fe2+、Co2+、Mg2+C.Cr3+、Fe2+、Cu2+D.Mn2+、Zn2+、Cd2+E.AsO43-、MnO4-、Cl-10. 下列硫化物能溶于稀盐酸的是 [1分]A.ZnSB.CuSC.Ag2SD.HgSE.CdS11. 过氧化氢中氧原子是采用何种杂化轨道成键 [1分]A.spB.sp2C.sp3D.dsp2E.sp3d12. 下列各酸中何者为酸性最强的酸 [1分]A.H2SO4B.HClO4C.HBrO4D.HIO4E.HCl13. 下列氢化物中沸点最低的是 [1分]A.HClB.HBrC.HID.HFE.H2O14. 下列哪一种酸能于玻璃反应 [1分]A.H2SO4B.HNO3C.HFD.HClO4E.HCl15. 中药胆矾的主要成分是 [1分]A.CuCl2·H2OB.FeSO4·7H2OC.CuSO4D.Cu(OH)2·CuCO3E.CuSO4·5H2O16. 加入NaOH,得不到氧化物的是 [1分]A.Cu2+B.Ag+C.Hg2+D.Hg22+E.HgCl217. 下列物质中酸性最弱的是 [1分]A.H3PO4B.HClO4C.H3AsO4D.H3AsO3E.HCl18. 下列硫化物能溶于浓盐酸的是 [1分]A.CuSB.Ag2SC.HgSD.CdSE.都不溶19. 在铬(III)盐溶液中加过量碱溶液其存在形式为 [1分]A.Cr(OH)3B.Cr3+C.CrO2-D.CrO42-E.Cr2O 72-20. Pb2+离子的电子构型是 [1分]A.8电子构型B.18电子构型C.18+2电子构型D.9~17电子构型E.2电子构型21. 在酸性溶液中欲将Mn2+氧化为MnO4-,在下列氧化剂中应选择 [1分]A.PbO2B.Cl2C.K2CrO7D.H2O 2E.KClO322. 实验室中配制FeSO4溶液须 [1分]A.加稀H2SO4与铁屑B.加铁屑C.加浓H2SO4D.加浓H2SO4与铁屑E.加稀H2SO423. 单质碘在水中的溶解度很小,但在KI或其它碘化物的溶液中碘的溶解度增大,这是因为 [1分]A.发生了离解反应B.发生了配位反应C.发生了氧化还原反应D.发生了盐效应E.发生了水解反应24. p区元素含氧酸既可做氧化剂,又能做为还原剂的是 [1分]A.HNO3B.H3PO4C.HNO2D.HClO4E.H2HO425. 硝酸钾的热分解产物是 [1分]A.KNO2和O2B.K2O、N2O和O2C.K、N2O和O2D.K、N2O、O2和H2OE.K、N2和H2O26. 硼酸的分子式为H3BO3,所以它是 [1分]A.三元酸B.二元酸C.一元弱酸D.一元强酸E.三元弱酸27. 在K2CrO4溶液中,加入H2SO4,然后再加H2O2。
1、用H3PO4(pKa1= 2.16,pKa2= 7.21,pKa3= 12.32)和NaOH所配成的pH = 7.35的缓冲溶液中,抗碱成分是()(4 分)A.H3PO4B.H2PO4-C.HPO42-D.PO43-我的答案:B得分:4分2、对于一个化学反应,下列说法中正确的是()(4 分)A.越负,反应速率越大B.越负,反应速率越大C.活化能越大,反应速率越大D.活化能越小,反应速率越大我的答案:D得分:4分3、蛋白质发生盐析的主要原因是()(4 分)A.电解质离子强烈的水化作用使大分子去水化B.蛋白质所带的电荷发生了变化C.由于电解质的加入,使大分子溶液处于等电点D.蛋白质上基团的解离情况发生了变化我的答案:A得分:4分4、已知某蛋白的pI = 5.6,欲使该蛋白移向正极,则电泳液的pH应()(4 分)A.<5.6B.=5.6C.>5.6D.无法确定我的答案:C得分:4分5、聚沉As2S3负溶胶,下列电解质中聚沉能力最强的是()(4 分)A.Ca(NO3)2B.K2SO4C.Na3PO4D.AlCl3我的答案:D得分:4分6、溶胶在一定时间内能稳定存在而不聚沉,主要原因是()(4 分)A.溶胶的分散相粒子很小B.溶胶的分散相粒子很大,扩散速度慢C.溶胶的胶粒呈均匀分布,是均相系统D.胶粒带电,相互排斥;胶粒带有水化膜保护,阻止彼此碰撞时聚结沉淀我的答案:D得分:4分7、溶胶的丁铎尔(Tyndall)现象的本质是胶粒对光的()(4 分)A.透射作用B.反射作用C.折射作用D.散射作用我的答案:D得分:4分8、下列关于胶体分散系的描述,正确的是()(4 分)A.分散相粒子的直径小于1nmB.它是多相系统C.分散相粒子的直径在1~100nm之间D.分散介质只能为水我的答案:C得分:4分9、已知HAc的Ka= 1.8´10−5,NH3∙H2O 的Kb=1.8´10−5,则下列水溶液(各相关物质的浓度均为0.10mol∙L-1)中,pH最高的是()(4 分)A.HAc−HCl混合溶液B.NH4Ac溶液C.HAc−NaAc混合溶液D.pH = 5.00的溶液我的答案:B得分:4分10、在1 L下列缓冲溶液中,缓冲容量最大的是()(4 分)A.含0.15mol HAc和0.05mol NaAc B.含0.10mol HAc和0.10mol NaAc C.含0.12mol HAc和0.15mol NaAc D.含0.15mol HAc和0.15mol NaAc 我的答案:D得分:4分。
优秀学习资料 欢迎下载《无机化学》专科辅导资料A 型题:1. NaAc 固体加到HAc 溶液中去,将使HAc 的 D.电离度减小2. 强电解质溶液的表观电离度总是小于100%,原因是 B.正负离子互相吸引3. 一种酸的强弱可用下列哪一种数据来衡量 C.电离常数4. 已知NH 3·H 2O 的θb K= 10—4.75,将0.2 mol ·L —1的NH 3·H 2O 和0.2 mol ·L —1的NH 4Cl 等体积混合,溶液的pH 值为 A .9.25 5. 计算无机多元弱酸的酸度时 D .θ1a K /θ2a K ≥104时,可以按一元弱酸处理 6. 有一难溶电解质AB,在水溶液中达到溶解平衡,设平衡时[A] = X ·mol ·L —1,[B] = Y ·mol ·L —1,则θSP K 可表达为 B .θSP K = X ·Y 7. 在下列分子中元素氧化值为+7的是 D .(NH 4)2S 2O 8 8. 已知:BrO 4— +0.93 BrO 3— +0.54 BrO —+0.54 Br 2 +1.07 Br —能发生歧化反应的是 C .Br 2 9. 电子运动具有波动性B .电子衍射实验可以证实 10.下列各组量子数哪组是正确的 D .n =4 l =3 m =0 m s =+1/211. 中心原子采取sp 2杂化,空间构型为平面三角形的是 C .BF 3 12. 泡里原理(pauli )指的是 B .在同一原子里,不能有四个量子数完全相同的电子13.ψ2的物理意义是D 代表原子在该点(r 、θ、ϕ)出现的概率密度,即单位微体积中电子出现的概率 14.水分子间产生的作用力是哪一种 E. 取向力+色散力+诱导力+氢键 15.当n = 3时,•则该电子层最多可容纳的电子数 B.18个电子 16.在 HAc 溶液中加入 NaCl 固体振荡后 B. 溶液的 pH 值降低17.铁的原子序数是26,Fe(Ⅲ)离子的电子层结构在基态时是下列哪种构型 D. [Ar] ↑ ↑ ↑ ↑ ↑ 18.在下列哪一种物质中,氧的氧化值与水的氧的氧化值不同 D. H 2O 219、在饱和H 2S(θ1a K =1.32×10-7,θ2aK = 7.08×10-15)水溶液中,何者浓度最小 C. S 2-20.难溶物 AgCl 的溶解度为 s (mol·L -1),其 θSP K 等于E. s 2 21.下列配体中,何种配体是螯合剂 D. NH 2CH 2CH 2NH 2 22.实际浓度为0.1 mol·L -1的NaCl 溶液,其有效浓度为0.078 mol·L -1,对此现象最恰当的解释是:C .离子间的相互牵制 23.原电池中负极发生的是A .氧化反应 24.氨分子间产生的作用力是E. 取向力+色散力+诱导力+氢键 25.HAc 溶液中,加少量固体NaAc 后,则B. 溶液酸度下降26.0.1mol·L -1的H 2S(θ1a K =9.1×10-8,θ2a K =1.1×10-12)水溶液中,浓度最大的是:A. H 2S27.温度一定时,决定某弱酸及其盐缓冲溶液pH 值的主要因素是:D.弱酸和其盐的浓度比 28.π键的特征是 D.原子轨道以平行方式重叠,重叠部分通过一个键轴平面,具有镜面反对称29.下列有关分步沉淀叙述中正确的是A.J θ先达到溶度积者先沉淀出来。
1. |y |2表示( C )。
A)电子在核外空间出现的概率
B)波函数的物理意义
C)电子在核外空间出现的概率密度
D)电子在核外运动的轨迹
2. 氢原子的1s电子激发到4s或4p轨道时所需要的能量分别为Es和Ep,它们的关系为( A )
A)Es = Ep
B)Es>Ep
C)Es<Ep
D)无法比较
3. 在多电子原子中,具有下列各组量子数的电子中能量最高的是( A )。
A)3,2,+1,+½
B)3,0,0,−½
C)3,1,0,−½
D)3,1,−1,−½
4. 下列基态原子的电子构型中,正确的是( D )。
A)3d9 4s2
B)3d4 4s2
C)3d6 4s1
D)3d8 4s2
5. 描写基态Ca(Z = 20)原子最外层一个电子运动状态的量子数是( D )。
A)4,1,0,½
B)4,1,1,½
C)4,1,−1,½
D)4,0,0,½
6. 一个核外电子排布式为1s2 2s2 2p6 3s2 3p1 的元素最可能的价态是( C )。
A)+1
B)−1
C)+3
D)−3
7. 某元素基态原子失去3个电子后,角量子数为2的轨道半充满,则该元素的原子序数为( C )。
A)24
B)25
C)26
D)27
8. 已知某元素+3价离子的核外电子排布为1s2 2s2 2p6 3s2 3p6 3d5,该元素在周期表中属于( B )
A)ⅢA族
B)Ⅷ族
C)ⅤB族
D)ⅡA族
9. 某元素基态原子的价层电子构型是3d10 4s2,则该元素在周期表中属于( A )。
A)ds区第ⅡB族
B)s区第ⅡA族
C)ds区第ⅡA族
D)d区第ⅡB族
10. 下列各组元素的原子半径按大小排列,正确的是( C )。
A)F>O>N
B)F>Cl>Br
C)K>Ca>Mg
D)Li>Na>K
11. 下列元素的电负性大小顺序正确的为( A )。
A)C<N<O<F
B)C<O<N<F
C)N<C<O<F
D)N<O<C<F
12. 下列四组元素中,属于人体必需元素的是( B )。
A)Zn、Cu、Mn、Pb
B)Fe、Zn、Cu、Se
C)Zn、Cr、Se、Cd
D)Fe、I、Cu、Hg
13. 下列化合物中,键的极性最小的是( A )。
A)CH4
B)NH3
C)H2O
D)HCl
14. 通过测定AB2型分子的偶极矩,可以判断( A )。
A)分子的空间构型
B)A─B键的键能
C)A─B键的极性
D)分子间的作用力
15. H2O分子的空间构型、中心原子的杂化方式分别为( C )。
A)直线型、sp等性杂化
B)V 形、sp2不等性杂化
C)V 形、sp3不等性杂化
D)V 形、sp3等性杂化
16. 下列分子或离子的立体结构中,正确的是( A )。
A)SO42-为正四面体形
B)SO2为直线型
C)HCN为平面三角形
D)BCl3为三角锥形
17. H2O、H2S、BF3 三种分子的极性大小顺序为( B )。
A)H2S>H2O>BF3
B)H2O>H2S>BF3
C)BF3>H2O>H2S
D)BF3>H2S>H2O
18. 下列离子中几何构型为三角锥形的是( C )。
A)NH4+
B)NO3-
C)ClO3-
D)ClO4-
19. 下列分子中,属于极性分子的是( C )。
A)CO2
B)PCl5
C)PH3
D)C6H6
20. 氮分子中的化学键是( B )。
A)3 个σ 键
B)1 个 σ 键、2 个π键
C)3 个π 键
D)2 个σ键、1 个π键
21. 若键轴为x轴,则下列原子轨道重叠能形成键的是( A )。
A)s–s
B)s–pz
C)py–py
D)px–pz
22. 下列各组分子或离子的键能大小顺序,正确的是( B )。
A)N2+>N2> N2-
B)O2+>O2> O2-
C)H2>O2>N2
D)N2>O2>O2+
23. 下列各组分子间同时存在取向力、诱导力、色散力和氢键的是( C )。
A)苯和CCl4
B)CH3F和C2H4
C)H2O和CH3OH
D)H2O和N2
24. 下列各组物质沸点的高低顺序,正确的是( B )。
A)H2Se>H2S>H2O
B)NH3>AsH3>PH3
C)HI>HBr>HCl>HF
D)CH4>NH3>H2O
25. 在下列含氢化合物中,能形成分子内氢键的是( A )。
A)HNO3
B)对羟基苯甲酸
C)H2SO4
D)CH3CH2OH
)
序数为( C )。
周期表中属于( B )。