测定冰的熔化热-实验报告
- 格式:docx
- 大小:34.44 KB
- 文档页数:4

测定冰的熔化热实验测定冰的熔化热实验【目的和要求】用混合法测定冰的熔化热。
【仪器和器材】量热器(J2251型),学生天平(J0104型),温度计(0-100℃),温水,0℃的冰块约100克,干布,小勺子,镊子,小烧杯2个。
【实验方法】1.将量热器内筒(包括搅拌器)擦干净,用天平称出量热器内筒和用同种材料制成的搅拌器的质量m筒,再查出量热器内筒所用材料的比热[容]C筒。
记下室内温度。
2.在量热器内筒中装入大约100克比室温高10-12℃的温水,用天平称出内筒(包括搅拌器)和水的质量(m筒+M水),减去内筒的质量m筒求得水的质量M水。
3.将内筒放入量热器外筒内的木架上,盖好盖子,并将温度计插好,测出量热器内筒中水的温度t0。
4.取一些正在熔化的碎冰块(0℃),把冰块上的水擦干,然后小心地把它放入量热器内筒中,不要使水溅出。
投冰量应当使最后混合温度大约低于室温10-12℃为好。
5.用搅拌器上下轻轻搅动量热器内筒里的水,待水里的冰块完全熔化。
当水上下部分的温度稳定时,记下温度计所指示的最低温度,即混合温度t。
6.用天平称出量热器内筒、水和冰的总质最(m筒+M水+m 冰),然后算出冰的质量m冰。
将以上实验数据填入上表。
7.根据实验数据,利用(1)式求出冰的熔化热的实验平均值。
【注意事项】1.量热器和外界实际上有热交换,造成实验误差。
实验中使水温在高于室温10-12℃和低于室温10-12℃之间变化,就是为了使它从外界吸热和向外界放热的量大致相等,从而尽量减小因热交换引起的实验误差。
为了控制好水温的变化范围,冰和水的质量比大约为2:15;实验时,不可一次投冰过多。
2.实验前应将大冰块敲碎,加入少许水放入保温瓶中,以确保实验时冰的温度为0℃。
冰在投入量热器前要用毛巾擦干,冰块不可太大否则不利于冰和水的热交换,冰块也不宜太小,过小时,投入前,冰表面已熔为水的部分所占比例过大,也会增大实验误差。
3.冰块放入量热器后,要不停搅拌,以加速冰和水的热交换。

45实验4-4 测定冰的熔解热混合法是热学实验中的一种常用方法,其基本原理可用热平衡方程式来描述,即在一个孤立系统中,一部分物体所吸收的热量等于该系统中其它物体所放出的热量。
本实验用混合法测冰的熔解热,关键是必须保证系统为孤立系统•(即系统与外界环境没有热交换)。
【实验目的】1.掌握用混合法测定冰的熔解热的方法。
2.学习散热修正的一种方法。
【实验器材】量热器、物理天平、温度计、水、冰块、秒表、取冰夹子等。
【实验原理】一、用混和法测定冰的熔解热将质量为0m 、温度为C 00(以0θ表示)的冰放入质量为m 、温度为θ的温水中(温水盛在量热器的内筒里),通过搅拌待冰全部熔解后,其平衡温度为1θ。
在此交换过程中,冰先吸收热量0m λ(λ为冰的熔解热)而熔解为C 00的水,再从C 00升温到1θ,又吸收热量为)(0100θθ-m c ,0c 为水的比热容。
量热器系统(内筒、搅拌器、温度计)与原来的温水放出的热量可表示为(m c 0+11m c +22m c +30m c ))(1θθ-。
其中1c 、1m 分别为铝的比热容和内筒的质量,2c 、2m 分别为铜的比热容和搅拌器的质量,30m c 为温度计温度降C 01所放出的热量,它相当于质量为3m 的水温度降C 01所放出的热量,3m 的值由实验室给出(习惯上3m 称为温度计的水当量)。
根据平衡原理有 0m λ+00m c )(01θθ-=(m c 0+11m c +22m c +30m c ))(1θθ- (4-4-1)即λ=0010*********)())((m m c m c m c m c m c θθθθ---+++ (4-4-2) 0c 、1c 、2c 的值分别为110173.4--⋅⋅=K g J c 、111904.0--⋅⋅=K g J c 、112385.0--⋅⋅=K g J c (它们随温度的变化可忽略不计)。
可以看出,本实验的关键是必须保持系统为孤立系统•,即系统与外界环境没有热交换,热传递有三种方式:①热传导;②热对流;③热辐射。

用混合热量法测定冰的熔化热实验报告一、实验目的:1.正确使用热量器,熟练使用温度计。
2.用混合热量法测定冰的熔解热。
3.进行实验安排和参量选取。
4.学会一种粗略修正散热的方法——抵偿法。
二、实验用具:热量器、数字温度计、电子天平、秒表、干抹布、保温桶、冰以及热水等。
关于实验仪器的说明:1.电子天平使用前,请将电子天平放置于稳固、平坦的台面上,利用四只调整脚,使仪器保持平衡(勿放于摇动或振动台架上)。
注意水平仪内气泡应位于圆圈中央。
使用时应避免将其至于温度变化较大或者空气流动剧烈的场所,如日光直射或冷气机的出风口。
打开电源时,秤盘上请勿防止任何物品。
建议开机预热1~5分钟,以确保测量的精确度。
使用时,称量物品重心须位于称盘的中心点,且称量物不可超出称量范围,以确保准确度。
2.量热器量热器的构造如下图所示。
由铜质内筒、塑料外筒、绝热盖、环形绝热架、橡皮塞和铜质搅拌器组成。
绝热盖上附有中空橡皮塞,用于实验时插入温度计。
搅拌器通过绝热盖上的细孔置于内筒中,试验时上下搅动,使桶内各处温度迅速均匀。
内筒置于外筒内部的环形绝热架上,外筒又用胶木圆盖盖住。
因此,内部空气夹层与外界对流很小。
又因空气是热的不良导体,故外、内筒之间由传导所传递的热量可减到很小。
同时,内筒的外壁电镀得十分光亮,使得它们辐射或吸收热量的本领变得很小。
所以,因辐射而产生的热量传递也可以减至最小。
由上所述,量热器的这种结构,使将热量传递的三种方式:传导、对流及辐射都尽可能地减到最小;因而,他成为量热实验的常用仪器。
使用时,通常是先注入适量的水(约为容量的二分之一到三分之二),并将温度计、搅拌器等通过绝热盖的小孔插入,构成所谓已知热容的系统。
但上述量热器的绝热条件并不十分完善,因此在进行精确的量热实验时还必须据牛顿冷却定律进行散热修正。
三、实验原理:质量为m i,温度为θ0′的冰块与质量为m、温度为θ1的水相混合,冰全部熔化为水后,测得平衡温度为θ2。

冰的熔解热实验报告篇一:冰的熔解热的测定冰的熔解热的测定摘要:用混合法测定冰的熔解热是把冰和一个容量已知的系统混合起来达到热平衡,在与外界没有热交换条件下冰吸收的热量等于系统在实验过程中放出的热量,放出的热量可由温度的改变和热容量计算出来,冰的熔解热可根据条件计算出来。
关键词:冰的比熔解热、吸热、放热、散热修正引言:将一定质量的冰和一定质量的水混合,当混合后的系统达到一定的温度后,冰全部熔解为同温度的水,根据热力学第一定律,冰熔解所吸收的热量与水降温所放出的热量相等.只要测量出系统与外界的换热量、水的质量、冰的质量等,就可以求出冰的熔解热.文中采用混合法测量冰的熔解热,实验中并未考虑系统环境的散热损失.本实验研究方法中采用测量系统中水的质量变化来测量冰的质量。
实验用混合法来测定冰的熔解热,即把待测的系统个已知其热容的系统(和一混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统(或)所放出的热量,全部为(或)所吸收。
因为已知和热容C计算出来的,)。
这样热容的系统在实验过程中所传递的热量是可以由其温度的改变即Q??TC。
因此,待测系统在实验过程中所传递的热量也就知道了。
由此可见,保持系统为孤立系统,是混合量热法所要求的基本实验条件,这要从仪器装置、测量方法及实验操作等各方面去保证。
如果实验过程中与外界的热交换不能忽略,就要做散热或吸热修正。
温度是热学中的一个基本物理量,量热实验中必须测量温度。
一个系统的温度,只有在平衡态时才有意义,因此计温时必须使系统温度达到稳定而均匀。
用温度计的指示值代表系统温度,必须使系统与温度计之间达到热平衡。
1.1实验原理:一定压强下的晶体开始熔解时的温度称为该晶体在此压强下的熔点,质量为1g的某种物质的晶体熔解为相同温度的液体所吸收的热量叫做该晶体的熔解热。
本实验采用混合量热测定冰的熔解热,其基本原理是:把待测系统和一个已知其热容的系统混合起来,并使它们形成一个与外界没有热量交换的孤立系统。

实验9 冰的熔解热的测定(86 95)一、实验目的1. 测量冰的熔解热的大小;2. 理解通过能量守恒原理,利用已知的物理量推导出未知物理量的方法。
二、仪器与试剂仪器:热量计、电磁炉、温度计、量筒、实验室天平等。
试剂:蒸馏水。
三、实验原理1. 熔解同温度下,固体与液体之间存在着平衡。
固体熔解成液态的现象,称为熔点。
温度上升时,固体在熔点以上逐渐变软,直至全部熔化,这时液体在熔点以下下降了一些温度,保持这一温度,不断从熔融体中吸收热量。
当液体全部变成气体时,温度又逐渐上升,直至达到沸点。
同理,升华是晶体或气体直接从固体到气体的过程。
当温度达到升华温度,晶体直接变成气体,吸收升华热。
在升华时,由于没有液态,因此不存在熔融温度。
2. 热量计的原理热量计是一种用来测定物质发生热上变化(如熔化,沸化)所需吸收的热量的仪器。
将物质放在试样室内,通过加热而使试样室内的物质发生热上变化,同时通过减小制冷液流量与增加制热量,维持量热器的恒温。
3. 能量守恒原理根据热力学基本原理可知,自然界中能量的总量不变,即能量守恒原理;根据能量守恒原理,若某物体吸收热量 Q,温度上升ΔT,则可知吸收的热量与温度上升对应。
所吸收的热量可以用以下公式求出,Q=m•C•ΔT,其中,m--物质的质量;C--物质的比热;ΔT--物质的温度变化。
水的熔点是0℃时,在大气压下,由固体变成液体,用2500J/g表示。
可探究冰在熔解时,每克所吸收的热量。
总结:根据能量守恒定律,将冰和蒸馏水放在热量计中进行测量,能得到冰川熔解所需要吸收的热量 Q。
四、实验步骤1. 将热量计 (J2) 的两条前截流管道、现测量管道,同时连接到市电源。
预热50分钟。
2. 计算出冰的密度,称取 5g 冰,记录其重量 w1,放入量热器预热 1h。
3. 取出冰川,丢弃水,同样称取 5g 的干净瓶子,记录 w2,倾倒加热过程中融化的冰川。
4. 将量下出的熔融水加入 5g 的瓶子内,使用电子天平将其重量记录为 w3。

实验名称测定冰的熔解热一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
二、实验目的1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
3、了解一种粗略修正散热的方法——抵偿法。
三、实验原理本实验用混合量热法测定冰的熔解热。
其基本做法如下:把待测系统A和一个已知热容的系统B混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统C(C=A+B).这样A(或B)所放出的热量,全部为B(或A)所吸收。
因为已知热容的系统在实验过程中所传递的热量Q,是可以由其温度的改变△T和热容C计算出来,即Q=C△T,因此待测系统在实验过程中所传递的热量也就知道了。
实验时,量热器装有热水(约高于室温10℃,占内筒容积1/2),然后放入适量冰块,冰溶解后混合系统将达到热平衡。
此过程中,原实验系统放热,设为Q放,冰吸热溶成水,继续吸热使系统达到热平衡温度,设吸收的总热量为Q吸。
因为是孤立系统,则有Q放=Q吸(1)设混合前实验系统的温度为T1,其中热水质量为m1(比热容为c1),内筒的质量为m2(比热容为c2),搅拌器的质量为m3(比热容为c3)。
冰的质量为M(冰的温度和冰的熔点均认为是0℃,设为T0),数字温度计浸入水中的部分放出的热量忽略不计。
设混合后系统达到热平衡的温度为T℃(此时应低于室温10℃左右),冰的溶解热由L表示,根据(1)式有ML+Mc1(T-T0)=(m1c1+m2c2+m3c3)(T1-T)T T'θ JKT 1 T 1'因T r=0℃,所以冰的溶解热为:11223311()()m c m c m c T T L Tc M ++-=-(2)综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。

测定冰的溶解热测定冰的熔解热【实验简介】温度测量和量热技术是热学实验的中最基本问题。
本实验主要学习利⽤量热学的实验⽅法混合法测量冰的熔化热。
量热学是以热⼒学第⼀定律为理论基础的,它所研究的范围就是如何计量物质系统随温度变化、相变、化学反应等吸收和放出的热量。
量热学的常⽤实验⽅法有混合法、稳流法、冷却法、潜热法、电热法等。
本实验应⽤混合发测冰的熔化热,使⽤的基本仪器为量热器。
由于实验过程中量热器不可避免地要参与外界环境的热交换⽽散失对热量,因此,本实验采⽤⽜顿冷却定理克服和消除热量散失对实验的影响,以减⼩实验系统误差。
⼀、实验⽬的:1、理解混合法测量冰的熔解热的原理;2、掌握⽤混合法测定冰的熔解热的⽅法;3、学会修正散热的粗略⽅法。
⼆、实验仪器和⽤具:量热器、数字温度计、电⼦天平、冰柜、恒温⽔浴锅、保温桶、秒表、⼲擦布。
三、实验原理:在⼀定压强下,固体发⽣熔化时的温度称为熔化温度或熔点,单位质量的固态物质在熔点时完全熔化为同温度的液态物质所需要吸收的热量称为熔解热,⽤L 表⽰, 单位为J Kg 或J g 。
1、熔解热的计算若将质量为m ,温度为00C 的冰块置⼊量热器内,与质量为0m ,温度为0t 的⽔相混合,当量热器内系统达到热平衡时温度为1t 。
设量热器内筒和搅拌器的材料相同,两者总质量为1m ,⽐热容为1C 。
若忽略量热器与外界的热交换,根据热平衡原理可知,冰块熔化成⽔并升温吸热与⽔、内筒以及搅拌器的降温放热相等。
即:01001101()()mL mC t m C mC t t +=+- (1)解得冰的熔解热为:001101011()(-)L m C m C t t C t m=+- (2)上式中:)/(18.40C g J C o=为⽔的⽐热容,1m ,1C 为量热器内筒及搅拌器的质量和⽐热容(⼆者同材料),0t 、1t 为冰熔化前后系统处在热平衡时的温度。
01,C C 为已知量,实验中可测出0101,,,,m m m t t 的值,故可以求出冰的熔解热L 的值。

测定冰的熔解热实验报告测定冰的熔解热实验报告引言:熔解热是物质从固态转变为液态所需吸收的热量。
在日常生活中,我们经常接触到冰,因此了解冰的熔解热对于理解物质状态变化和热力学性质具有重要意义。
本实验旨在通过测定冰的熔解热,探索冰的物理特性和热力学过程。
实验原理:冰的熔解是一个吸热过程,当冰从固态转变为液态时,需要吸收一定的热量。
根据热力学原理,冰的熔解热可以通过以下公式计算得出:Q = m × L其中,Q表示熔解热,m表示冰的质量,L表示冰的熔解潜热。
实验步骤:1. 准备实验器材:电子天平、烧杯、温度计、冰块。
2. 使用电子天平称量一定质量的冰块,并记录下冰块的质量m。
3. 将称量好的冰块放入烧杯中。
4. 在烧杯中插入温度计,并记录下初始温度T1。
5. 加热烧杯中的冰块,直到冰完全熔化为止。
期间需不断搅拌以保持温度均匀。
6. 在冰完全熔化后,记录下此时的温度T2。
数据处理:根据实验原理中的公式,可以计算出冰的熔解热Q。
首先,计算冰的质量m,然后根据温度变化ΔT = T2 - T1,再结合水的比热容C,可以计算出吸收的热量Q = m × C × ΔT。
由于水的比热容C已知,所以可以通过实验数据计算出冰的熔解热。
实验结果:根据实验数据和计算公式,我们可以得出冰的熔解热。
以一次实验数据为例,假设冰的质量为50g,初始温度为0°C,冰完全熔化后的温度为10°C。
根据公式,ΔT = 10°C - 0°C = 10°C。
假设水的比热容为4.18 J/(g·°C),则吸收的热量Q = 50g × 4.18 J/(g·°C) × 10°C = 2090 J。
因此,冰的熔解热为2090 J。
讨论与分析:通过多次实验,我们可以得出冰的熔解热的平均值。
在实验中,我们发现冰的熔解过程是一个温度稳定的过程,即使在加热的过程中,温度不会显著上升,直到冰完全熔化为止。
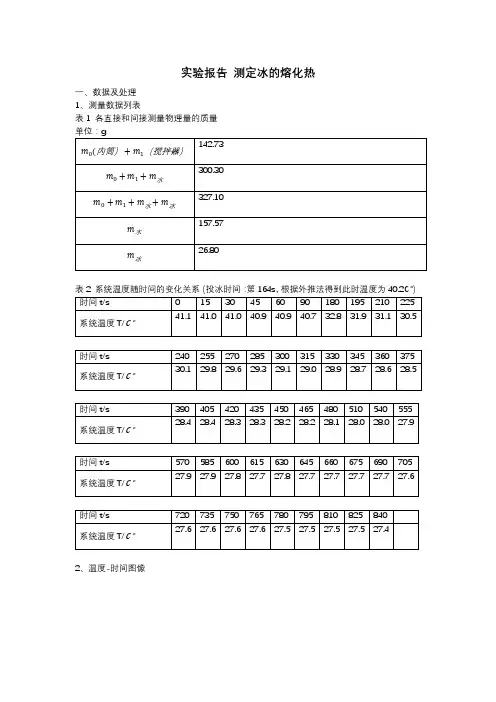
实验报告测定冰的熔化热一、数据及处理1、测量数据列表表1 各直接和间接测量物理量的质量单位:g2、温度-时间图像这次实验当中,我由于冰和水的比例控制不当,导致融化结束后,温度仍未降至室温以下。
在老师的启发下,我在判断反应结束时也使用了类似于“外推法”的处理方法,认为反应结束后温度是线性下降的,在T-t图上做出一条反向延长线,当温度-时间图线刚开始与该直线重合时,认为反应结束。
根据温度-时间图线确定出初温和末温如图(图中两处Y坐标)。
3、计算熔化热根据公式L=1m冰[m水c水+(m0+m1)c Cu](T2−T3)−c水T3+c冰T1(取冰温度T1=-12.8℃)计算得到L=1.87∗105J/kg,与参考值相差较大。
可能的原因是,考虑到实验持续的时间过长,大约15分钟,而由于冰水比例控制不当温度未降至室温以下,对环境放热又没有得到补偿,故计算结果比参考值小很多。
另有两组相比该组更为“正常”的实验数据,只是未记录T-t关系,也一并列表计算如下。
第二组:T1=-14.7℃,T2=38.8℃(由外推法得到),T3=23.4℃计算得到L=3.40∗105J/kg第三组:T1=-13.1℃,T2=37.2℃(由外推法得到),T3=26.9℃计算得到L=3.20∗105J/kg可以看到,后两组实验的数据相互较为接近,且与参考值也较为接近,而都与第一组数据相差不少。
后两组数据的平均值为L=3.30∗105J/kg,与参考值还是比较接近的。
第一组数据可能的误差来源前面已经分析了,当然,也不排除可能有某些数据记录错误导致得到这样的结果。
二、分析与讨论1、主要误差来源是测定冰质量时的误差。
在实验过程中,投冰与搅拌过程都有可能造成水的溅出,或留在外筒、桶盖上,或者水的蒸发导致相同结果。
这使得测定冰和水、内筒的总质量时产生误差。
冰质量在公式中位于分母上,且又较小,故对实验结果有较大影响。
2、试验中会有许多非理想的情况,我们可以尽量通过一些方法去减小这些非理想情况对实验的影响。

混合法测冰的熔化热【实验简介】温度测量和量热技术是热学实验的中最基本问题。
本实验主要学习利用量热学的实验方法混合法测量冰的熔化热。
量热学是以热力学第一定律为理论基础的,它所研究的范围就是如何计量物质系统随温度变化、相变、化学反应等吸收和放出的热量。
量热学的常用实验方法有混合法、稳流法、冷却法、潜热法、电热法等。
本实验应用混合发测冰的熔化热,使用的基本仪器为量热器。
由于实验过程中量热器不可避免地要参与外界环境的热交换而散失对热量,因此,本实验采用牛顿冷却定理克服和消除热量散失对实验的影响,以减小实验系统误差。
【实验目的】1、掌握基本的量热方法——混合法;2、测定冰的熔化热;3、学习消除系统与外界热交换影响量热的方法。
【实验仪器和用具】量热器(BDI-302A型),数字温度计(SN2202或DM-T)或水银温度计(0~50℃,0.1℃)、烧杯、电子天平(YJ6601)、冰柜、或恒温数显水浴锅、保温桶、小量筒(10ml,0.5ml)、电子秒表或机械秒表等。
【实验原理】1、热平衡方程式在一定压强下,固体发生熔化时的温度称为熔化温度或熔点,单位质量的固态物质在熔点时完全熔化为同温度的液态物质所需要吸收的热量称为熔化热,用L表示, 单位为J Kg或J g。
将质量m,温度为0℃的冰块置入量热器内,与质量为m,温度为t的水相混合,设量热器内系统达到热平衡时温度为1t。
若忽略量热器与外界的热交换,根据热平衡原理可知,冰块熔化成水并升温吸热与水和内筒等的降温放热相等。
即:010*******()(-)mL mC t m C m C m C t t+=++(3-1)电子天平图3-5图3-2 量热器图3-3 量热器结构图图3-4 电子天平解得冰的熔化热为:00112201011()(-)-L m C m C m C t t C t m=++ (3-2) 上式中:m 为冰的质量,0m 为量热器内筒中所取温水的质量,00 4.18()C J g C =⋅为水的比热,1m ,1C 为量热器内筒及搅拌器的质量和比热(二者同材料), 22m C 是温度计插入水中部分的热容(对水银温度计22 1.9m C V =,V 数值上等于温度计插入水中体积的毫升数,单位为o J C ; 对数字温度计的22m C 可不计。

冰熔化实验报告篇一:冰熔化实验报告冰熔化实验报告实验目的:观察冰的熔化的过程,知道晶体的熔化特点,是吸热的过程。
实验器材:温度计,铁架台,石棉网,大烧杯,酒精灯,冰,秒表(或手表)实验步骤:1、把装有冰块的大烧杯放在铁架台的石棉网上。
2、把温度计用铁架台上的架子固定,且温度计不接触大烧杯的底和壁。
3、把酒精灯放在石棉网下面。
4、点燃酒精灯开始加热大烧杯。
5、每隔半分钟记录一次温度计的读数。
并记录下来。
6、根据记录的数据,在下表中做温度--时间图线。
实验表格:1实验结论:实验延伸:1.是不是所有物质的熔化都和冰的熔化一样具有相同的情况?2.水凝固成冰的时的温度--时间图线又是怎样的?2篇二:冰熔化实验报告篇一:冰熔化实验报告冰熔化实验报告实验目的:观察冰的熔化的过程,知道晶体的熔化特点,是吸热的过程。
实验器材:温度计,铁架台,石棉网,大烧杯,酒精灯,冰,秒表(或手表)实验步骤:1、把装有冰块的大烧杯放在铁架台的石棉网上。
2、把温度计用铁架台上的架子固定,且温度计不接触大烧杯的底和壁。
3、把酒精灯放在石棉网下面。
4、点燃酒精灯开始加热大烧杯。
5、每隔半分钟记录一次温度计的读数。
并记录下来。
6、根据记录的数据,在下表中做温度--时间图线。
实验表格:1实验结论:实验延伸:1.是不是所有物质的熔化都和冰的熔化一样具有相同的情况?2.水凝固成冰的时的温度--时间图线又是怎样的?2篇二:冰的熔解热的测定实验报告实验名称测定冰的熔解热一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
二、实验目的1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
大学物理实验报告课程名称:大学物理实验实验名称:冰的熔解热的测量冰的熔解热的测量一、 实验项目名称:冰的熔解热的测量 二、 实验目的1.理解熔解热的物理意义,掌握用混合量热法测定冰的熔解热.2.学会用图解法估计和消除系统散热损失的修正方法.三、 实验原理单位质量的固体物质在熔点时从固态全部变成液态所需的热量,称为该物质的比熔解热,一般用L 来表示。
实验时将质量为m 1克0℃的冰投入盛有m 2克T 1℃水的量热器内筒中,设冰全部熔解为水后平衡温度为T 2℃,保温杯、搅拌器的质量分别为m 3、 m 4,其比热容分别为C 1、C 2和水的比热容为C 0。
根据混合量热法的原理,冰全部熔解为同温度(0℃)的水并从0℃升到T 2℃过程中所吸收的热量等于其余部分(水m 1、保温杯m 3、搅拌器m 4)从温度T 1℃降到T 2℃时所放出的热量,有(1) 冰的熔解热的实验公式为(2)式中水的比热容C 0=4.18×103J/kg ℃。
本实验“热学系统”依据混合量热法测量冰的熔解热,必须在系统与外界绝热的条件下进行实验。
为了满足此条件,从实验装置、测量方法和实验操作等方面尽量减少系统与外界的热交换。
由于实验系统不可能与环境温度始终一致,因此不满足绝热条件,可能会吸收或散失能量。
因此,要适当地选择参数进行散热修正。
牛顿冷却定律告诉我们,一个环境的温度T 如果略高于环境温度T 0(两者的温度差不超过10℃),系统就会散失热量,散热速率与温度差成正比,用数学形式表示为当时(即直线围成的两块面积近似相等),系统的散热与吸热相互抵消,就可以将系统很好地近似为一个孤立系统。
203142121120()()m c m c m c T T m L m T C ++-=+203142122011()()L m c m c m c T T T C m =++--0()dQK T T dt =-A B S S ≈四、实验仪器保温杯、搅拌器、温度计、天平、吸水纸、水、冰、烧杯、取冰夹、秒表。
实验名称测定冰的熔解热一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
二、实验目的1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
3、了解一种粗略修正散热的方法——抵偿法。
三、实验原理本实验用混合量热法测定冰的熔解热。
其基本做法如下:把待测系统A和一个已知热容的系统B混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统C(C=A+B).TθJKT 1这样 A (或 B )所放出的热量,全部为 B (或 A )所吸收。
因为已知热容的系统在实验过程中所传递的热量 Q ,是可以由其温度的改变 △T 和热容 C 计算出来,即 Q = C △T ,因此待测系统在实验过程中所传递的热量也就知道了。
实验时,量热器装有热水(约高于室温10℃,占内筒容积1/2),然后放入适量冰块,冰溶解后混合系统将达到热平衡。
此过程中,原实验系统放热,设为 Q 放 ,冰吸热溶成水,继续吸热使系统达到热平衡温度,设吸收的总热量为 Q 吸。
因为是孤立系统,则有Q 放= Q 吸 (1)设混合前实验系统的温度为T 1,其中热水质量为m 1(比热容为c 1),内筒的质量为m 2(比热容为c 2),搅拌器的质量为m 3(比热容为c 3)。
冰的质量为 M (冰的温度和冰的熔点均认为是0℃,设为T 0),数字温度计浸入水中的部分放出的热量忽略不计。
设混合后系统达到热平衡的温度为T ℃(此时应低于室温10℃左右),冰的溶解热由L 表示,根据(1)式有 ML +M c 1(T - T 0)=(m 1 c 1+ m 2 c 2+ m 3 c 3)(T 1- T )因T r=0℃,所以冰的溶解热为:11223311()()m c m c m c T T L Tc M ++-=- (2)综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。
实验组号:二下三组组内编号:三组三号测定冰的熔化热---实验报告实验题目:测定冰的熔化热目的要求:(1)了解热学实验中的基本问题——量热和计温。
(2)了解粗略修正散热的方法。
(3)学习进行合理的实验安排和参量选择。
仪器用具:(1)量热器(2)电子天平:最大称量为1000g,最小分度值为0.01g,允许误差为0.02g,稳定时间为3S。
(3)数字温度器:测温范围为-25~125,误差允许为0.1,四位半数字显示。
(4)秒表(5)毛巾,干拭布实验原理:(1)一般概念熔点:一定压强下晶体物质熔化时的温度,亦该物质的固态和液态可以共存的温度。
熔化热:单位质量的晶体物质在熔点时从固态全部变成液态所需要的热量。
热传递热量的三种方式:传导,对流,和辐射。
混合热法:将两系统A和B组成一个独立的系统C,则A(或B)所放出的热量,全部为B(或A)所吸收的热量,设传递热量为Q,热容为C,温度变化,则有Q=C。
(2)装置简介:量热器(如图)实验组号:二下三组组内编号:三组三号组成:由良导体做成的内筒置于一个较大的外筒中组成,通常在内筒中放水,温度计及搅拌器。
使系统接近于孤立系统的方法:量热器置于绝热架上,外筒用绝热盖盖住,空气与外界对流很小,将内筒和外筒的外壁电镀得十分光亮,使辐射减少。
(3)实验原理本质原理为热的传递,即遵守能量守恒定律。
公式:(吸热)()()()( )(散热)()()()( )其中L为冰的溶解热,水的质量为m,冰的质量为M,量热器的内筒和搅拌器的质量分别为和。
冰的初始温度为,实验环境下的熔点为,水的初始温度为,冰和水混合后的平衡温度为,量热器的内筒和搅拌器的比热容分别为和,温度器的热容为,水和冰的比热容为和。
其中==0.389 ( ), ( ),( ),在我们的实验条件下,粗略认为=0。
又在本实验中,数字温度计的传感器进入待测系统部分的热容相对试验系统很小,可以忽略不计。
所以实验组号:二下三组组内编号:三组三号(( ) )()(4)注意事项:校正电子天平时不能用手直接握标准砝码不应当直接用手去把握量热器的任何部分;不应当在阳光的直射照射下或者空气流动太快的地方进行实验;尽可能使系统与外界温度差小,并且尽量使实验过程进行得迅速;(5)粗略修正散热的方法根据牛顿冷却定律的数学形式:()其中是系统散失的热量,是相应的时间间隔,K是散热常数,它与系统表面积成正比并随表面的吸收或发射辐射热的本领而变,T和分别是我们所考虑的系统及环境的温度,称为散热速率。
一、实验目的1. 观察并记录冰熔化的过程,了解冰的熔化特点。
2. 学习测量晶体熔化过程中的温度变化,分析熔化过程中的能量变化。
3. 掌握量热法的基本原理和实验操作方法。
二、实验原理冰熔化是指冰从固态转变为液态的过程。
在熔化过程中,冰吸收热量,但其温度保持不变,直到全部熔化为止。
本实验采用量热法测量冰的熔化热,即单位质量的冰熔化所需的热量。
三、实验器材1. 冰块2. 温度计3. 烧杯4. 搅拌棒5. 天平6. 热水7. 计时器四、实验步骤1. 用天平称取一定质量的冰块,记录其质量m1。
2. 将冰块放入烧杯中,插入温度计,开始计时。
3. 用热水加热烧杯中的冰块,同时用搅拌棒不断搅拌,使冰块均匀受热。
4. 观察温度计示数,当温度计示数稳定在冰的熔点时,记录此时的时间t1。
5. 继续加热,直到冰块全部熔化,记录此时的时间t2。
6. 再次用天平称取烧杯和熔化后的水的总质量,记录其质量m2。
五、数据处理1. 计算冰的熔化热Q,公式为:Q = (m2 - m1) × c × Δt,其中c为水的比热容,Δt为冰的熔化温度范围。
2. 计算冰的熔化时间Δt = t2 - t1。
3. 根据实验数据绘制冰的温度随时间变化的图像。
六、实验结果与分析1. 实验测得冰的熔化热Q为...(数值)J/g。
2. 实验测得冰的熔化时间为...(数值)s。
3. 从实验数据绘制出的图像可以看出,冰在熔化过程中,温度保持不变,直到全部熔化为止。
七、实验结论1. 冰熔化是一个吸热过程,在熔化过程中,冰吸收热量,但温度保持不变。
2. 通过实验,我们验证了冰的熔化热和熔化时间,进一步了解了冰的熔化特点。
3. 本实验采用量热法测量冰的熔化热,方法简单易行,结果准确可靠。
八、实验注意事项1. 实验过程中,注意安全,防止烫伤。
2. 在测量冰的熔化热时,尽量减少热量损失,以保证实验结果的准确性。
3. 在绘制图像时,注意坐标轴的标注和刻度,使图像清晰易懂。
实验名称测定冰的熔解热一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
二、实验目的1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
3、了解一种粗略修正散热的方法——抵偿法。
三、实验原理本实验用混合量热法测定冰的熔解热。
其基本做法如下:把待测系统A和一个已知热容的系统B混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统C(C=A+B).这样A(或B)所放出的热量,全部为B(或A)所吸收。
因为已知热容的系统在实验过程中所传递的热量Q,是可以由其温度的改变△T和热容C计算出来,即Q=C△T,因此待测系统在实验过程中所传递的热量也就知道了。
实验时,量热器装有热水(约高于室温10℃,占内筒容积1/2),然后放入适量冰块,冰溶解后混合系统将达到热平衡。
此过程中,原实验系统放热,设为Q放,冰吸热溶成水,继续吸热使系统达到热平衡温度,设吸收的总热量为Q吸。
因为是孤立系统,则有Q放=Q吸(1)设混合前实验系统的温度为T1,其中热水质量为m1(比热容为c1),内筒的质量为m2(比热容为c2),搅拌器的质量为m3(比热容为c3)。
冰的质量为M(冰的温度和冰的熔点均认为是0℃,设为T0),数字温度计浸入水中的部分放出的热量忽略不计。
设混合后系统达到热平衡的温度为T℃(此时应低于室温10℃左右),冰的溶解热由L表示,根据(1)式有ML+Mc1(T-T0)=(m1c1+m2c2+m3c3)(T1-T)T T'θ JKT 1 T 1'因T r=0℃,所以冰的溶解热为:11223311()()m c m c m c T T L Tc M ++-=-(2)综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。
测定冰的熔化热实验报告
(一)实验数据及处理
1.第一次实验数据处理
C水=4.18×103 J/(Kg·K)C1=C2=0.389×103 J/(Kg·K)C冰=1.80×103 J/(Kg·K)
m=22.69 g m0=164.16 g T2-T3=15.2℃
2.第二次实验数据处理
C水=4.18×103 J/(Kg·K)C1=C2=0.389×103 J/(Kg·K)C冰=1.80×103 J/(Kg·K)
m=22.97g m0=171.13g T2-T3=13.8℃
(T2-θ):(θ-T3)= 10.1 :3.7
(二)分析与讨论
1.从实测数据看,如果实验全过程中散热、吸热没有达到补偿,冰的熔化热结果不一定偏离“合理”的数据范围,这说明散热或吸热并不是该系统的主要实验误差来源。
那么,本实验的主要误差来源是什么?
由熔化热的公式看,对计算结果影响最大的量是m,即冰的质量。
由于采用间接测量法,因此冰的质量是比较容易产生误差的,比如投冰时溅出水,就会对
算出的冰的质量产生影响,从而产生误差。
2.通过实验去体会粗略修正散热的方法——补偿法在本实验中的应用对学习做实验的意义。
在实验系统不能很好地保证绝热时,用补偿法修正系统误差是一个办法,也是一个好的思路。
在这次实验中,我们应该反复摸索,对各物理参量进行合理的选择和调整,使散热和吸热基本达到补偿。
然而,实验结果证实量热器是一个很好的绝热系统,因此,在分析系统误差来源时,应实事求是地、定量地进行分析,不能将误差的来源归结为系统的散热、吸热未能达到补偿。
3.在本实验室提供的条件下,实测熔化热的结果通常小于文献值
L=3.34×105J/Kg,你能分析是什么原因吗?
本实验未计算温度计插入水中的部分带来的影响。