实验五、冰的熔化热的测定(混合法)知识分享
- 格式:ppt
- 大小:1.82 MB
- 文档页数:21

用混合量热法测定冰的熔解热一. 目的要求1. 正确使用量热器,熟练使用温度计;2. 用混合量热法测定冰的熔解热;3. 进行实验安排和参量选取;4. 学会一种粗略修正散热的方法——抵偿法。
二. 引言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
kg 1物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
单位:1kg J -⋅。
本实验用混合量热法测定冰的熔解热。
其基本做法如下:把待测系统A与某已知热容的系统B相混合,并设法使其成为一个与外界无热量交换的孤立系统B)A C(+=。
这样A(或B)所放出的热量将全部为B(或A)所吸收,因而满足热平衡方程:吸放Q Q = (18.1) 已知热容的系统在实验过程中所传递的热量Q 是可以由其温度的改变θ∆及其热容s C 计算出来的:θ∆=s C Q (18.2) 于是,待测系统在实验过程中所传递的热量即可求得。
冰的熔解热也就可以据此测定。
由上所述, 保持实验系统为孤立系统是混合量热法所要求的基本实验条件。
为此,整个实验在量热器内进行,同时要求实验者本人在测量方法及实验操作等方面去设法保证。
当实验过程中系统与外界的热量交换不能忽略时,就必须作一定的散热修正。
三. 原理 质量M 、温度0θ'的冰块与质量m 、温度1θ的水相混合,冰全部熔解为水后,测得平衡温度为2θ。
假定量热器内筒与搅拌器的质量分别为1m 、2m ,其比热容分别为1c 和2c ;数字式温度计之测温传感器(铂电阻测温探头)自身热容甚小,可忽略不计;水及冰的比热容分别为c 和i c (在-40℃~0℃范围内,11K kg kJ 8.1--⋅⋅=i c );冰的熔点为0θ。
则由热平衡方程可得:()()()()2122110200θθθθθθ-++=-++'-m c m c cm cM ML M c i 本实验条件下,冰的熔点可认为是0℃,也可选取冰块的温度C 00='θ。

实验名称冰的溶解热的测量一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
单位质量时的晶体在熔点时以固态全部变成液态所需要的热量,叫做该晶体物质的熔解热。
二、教学目标1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
3、熟练掌握量热器及物理天平的使用方法。
4、了解一种粗略修正散热的方法——抵偿法。
三、教学重点1、理解和掌握混合量热法测定冰的熔解热的原理和方法。
2、理解散热修正的原理和方法。
四、教学难点1、正确选择测量温度的方法和时机。
2、严格按操作要求取用冰块和使用量热器。
五、实验原理本实验采用混合量热法测定冰的熔解热。
原理如下:把待测系统A和一个已知热容的系统B混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统C (C=A+B)。
这样A(或B)所放出的热量,全部为B(或A)所吸收。
因为已知热容的即Q C T =∆ ,因此待测系统在实验过程中所传递的热量也就知道了。
综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。
本实验采用量热器,使待测系统和已知热容的系统合二为一,组成一个近似绝热的孤立系统。
量热器的种类很多,随测量的目的、要求、测量精度的不同而异。
本实验所用量热器如图1所示,它是由良导体(铁)做成的内筒与外筒相套而成。
通常在内筒中放水、待测物体、搅拌器及温度计,这些装置和材料一起组成实验所需的热力学系统。
量热器内外筒之间填充绝热泡沫,合上绝热盖可阻隔内部与外界的空气对流,由于空气是热的不良导体,所以内外筒间借热传导方式传递的热量便可降至很小。
同时由于内外筒的表面都有光亮的电镀层,使得它们发射或吸收辐射热的本领变得很小,因此使实验系统和外界环境之间因辐射而产生的热量交换降至很小。


冰的熔解热实验报告冰的熔解热实验报告引言:冰是我们日常生活中常见的物质,它的熔解过程是我们熟知的现象。
然而,我们是否了解冰的熔解背后的科学原理呢?通过进行冰的熔解热实验,我们可以深入探究这一现象,进一步了解物质的性质和能量转化过程。
实验目的:本实验的目的是测量冰的熔解热,通过实验结果了解冰的熔解过程中的能量转化。
实验器材:1. 冰块2. 量热器3. 温度计4. 温度计夹5. 夹子6. 计时器实验步骤:1. 将量热器放在实验台上,并用夹子固定。
2. 在量热器中放入适量的冰块,记录下冰块的质量。
3. 用温度计测量室温,并记录下来。
4. 将温度计夹在量热器的夹子上,确保温度计的测量部分与冰块接触。
5. 开始计时,并观察冰块的熔化过程。
6. 当冰块完全熔化后,停止计时。
实验数据:1. 冰块质量:20g2. 室温:25°C3. 熔化时间:4分钟实验结果:根据实验数据,我们可以计算出冰的熔解热。
首先,我们需要计算冰块熔化过程中释放的热量。
根据热量守恒定律,冰块熔化释放的热量等于水的升温所吸收的热量。
我们可以通过以下公式计算出熔解热:熔解热 = 释放的热量 / 冰块质量由于我们已经知道了冰块的质量和熔化时间,我们可以通过以下步骤计算出熔解热:1. 计算释放的热量:根据水的比热容和水的质量,我们可以计算出水的升温所吸收的热量。
释放的热量 = 水的质量× 比热容× 温度变化2. 计算熔解热:将释放的热量除以冰块的质量,即可得到熔解热的数值。
实验讨论:通过实验数据的计算,我们可以得到冰的熔解热的数值。
然而,实验结果可能会受到一些误差的影响。
首先,温度计的准确性会对实验结果产生一定的影响。
其次,熔化过程中的环境条件也可能会对实验结果产生一定的影响,如室温的变化等。
因此,在实验过程中,我们需要尽量减小这些误差的影响,提高实验结果的准确性。
结论:通过本次实验,我们成功测量了冰的熔解热,并了解了冰的熔解过程中的能量转化过程。

XXXXXXXX 学院物理系实验报告 班级: XXXX 分组:XX 姓名:XX 学号: XXX 同组人:实验题目:冰的熔化热的测定 教师评分: 日期:实验报告:(包括实验目的、原理、仪器用具、步骤,数据处理、结论及问题讨论等项目) 实验目的:1.混合法测冰的熔化热;2. 学习消除测量系统热散失的影响。
实验仪器: 保温桶、冰柜、温度计、天平、量热器、秒表。
实验原理:温度不同的物体混合后,热量由高温物体传到低温物体,最后系统将达到均匀稳定的平衡温度,如果在混合过程中与外界没有热交换,则高温物体放出的热量等于低温物体所吸收的热量,此称为热平衡原理。
本实验即根据热平衡原理测冰的融化热L将质量m ,温度为0℃的冰块置入量热器内,与质量为0m ,温度为0t 的水相混合,设量热器内系统达到热平衡时温度为1t 。
若忽略量热器与外界的热交换,根据热平衡原理可知,冰块熔化成水并升温吸热与水和内筒等的降温放热相等。
即:010*******()(-)mL mC t m C m C m C t t +=++ (3-1)解得冰的熔化热为:00112201011()(-)-L m C m C m C t t C t m=++ (3-2) 式中:m 为冰的质量,0m 为量热器内筒中所取温水的质量,00 4.18()C J g C =⋅为水的比热,1m ,1C 为量热器内筒及搅拌器的质量和比热(二者同材料), 22m C 是温度计插入水中部分的热容(对水银温度计22 1.9m C V =,V 数值上等于温度计插入水中体积的毫升数,单位为o J C ;,0t ,1t 为投冰前、后系统的平衡温度。
实验中可测出m , 0m ,1m ,22m C ,0t ,1t 的值,0C ,1C 为已知量,故可以求出L 的值。
班级: XXXX 分组:XX 姓名:XX 学号: XXX 同组人:实验题目:冰的熔化热的测定 教师评分: 日期:实验报告:(包括实验目的、原理、仪器用具、步骤,数据处理、结论及问题讨论等项目)上述结论是在假定冰熔化过程中,系统与外界没有热交换的条件。


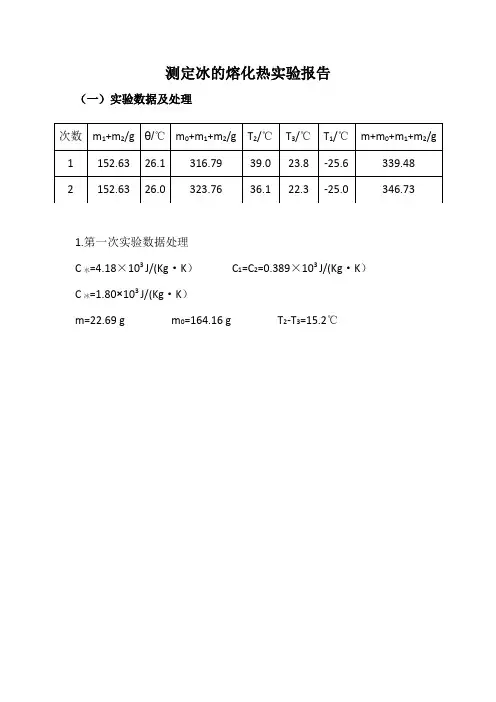
测定冰的熔化热实验报告(一)实验数据及处理1.第一次实验数据处理C水=4.18×103 J/(Kg·K)C1=C2=0.389×103 J/(Kg·K)C冰=1.80×103 J/(Kg·K)m=22.69 g m0=164.16 g T2-T3=15.2℃2.第二次实验数据处理C水=4.18×103 J/(Kg·K)C1=C2=0.389×103 J/(Kg·K)C冰=1.80×103 J/(Kg·K)m=22.97g m0=171.13g T2-T3=13.8℃(T2-θ):(θ-T3)= 10.1 :3.7(二)分析与讨论1.从实测数据看,如果实验全过程中散热、吸热没有达到补偿,冰的熔化热结果不一定偏离“合理”的数据范围,这说明散热或吸热并不是该系统的主要实验误差来源。
那么,本实验的主要误差来源是什么?由熔化热的公式看,对计算结果影响最大的量是m,即冰的质量。
由于采用间接测量法,因此冰的质量是比较容易产生误差的,比如投冰时溅出水,就会对算出的冰的质量产生影响,从而产生误差。
2.通过实验去体会粗略修正散热的方法——补偿法在本实验中的应用对学习做实验的意义。
在实验系统不能很好地保证绝热时,用补偿法修正系统误差是一个办法,也是一个好的思路。
在这次实验中,我们应该反复摸索,对各物理参量进行合理的选择和调整,使散热和吸热基本达到补偿。
然而,实验结果证实量热器是一个很好的绝热系统,因此,在分析系统误差来源时,应实事求是地、定量地进行分析,不能将误差的来源归结为系统的散热、吸热未能达到补偿。
3.在本实验室提供的条件下,实测熔化热的结果通常小于文献值L=3.34×105J/Kg,你能分析是什么原因吗?本实验未计算温度计插入水中的部分带来的影响。

实验名称测定冰的熔解热一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
二、实验目的1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
3、了解一种粗略修正散热的方法——抵偿法。
三、实验原理本实验用混合量热法测定冰的熔解热。
其基本做法如下:把待测系统A和一个已知热容的系统B混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统C(C=A+B).这样A(或B)所放出的热量,全部为B(或A)所吸收。
因为已知热容的系统在实验过程中所传递的热量Q,是可以由其温度的改变△T和热容C计算出来,即Q=C△T,因此待测系统在实验过程中所传递的热量也就知道了。
实验时,量热器装有热水(约高于室温10℃,占内筒容积1/2),然后放入适量冰块,冰溶解后混合系统将达到热平衡。
此过程中,原实验系统放热,设为Q放,冰吸热溶成水,继续吸热使系统达到热平衡温度,设吸收的总热量为Q吸。
因为是孤立系统,则有Q放=Q吸(1)设混合前实验系统的温度为T1,其中热水质量为m1(比热容为c1),内筒的质量为m2(比热容为c2),搅拌器的质量为m3(比热容为c3)。
冰的质量为M(冰的温度和冰的熔点均认为是0℃,设为T0),数字温度计浸入水中的部分放出的热量忽略不计。
设混合后系统达到热平衡的温度为T℃(此时应低于室温10℃左右),冰的溶解热由L表示,根据(1)式有ML+Mc1(T-T0)=(m1c1+m2c2+m3c3)(T1-T)T T'θ JKT 1 T 1'因T r=0℃,所以冰的溶解热为:11223311()()m c m c m c T T L Tc M ++-=-(2)综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。

实验名称测定冰的熔解热一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
二、实验目的1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
3、了解一种粗略修正散热的方法——抵偿法。
三、实验原理本实验用混合量热法测定冰的熔解热。
其基本做法如下:把待测系统A和一个已知热容的系统B混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统C (C=A+B).这样A(或B)所放出的热量,全部为B(或A)所吸收。
因为已知热容的系统在实验过程中所传递的热量Q,是可以由其温度的改变△T 和热容C计算出来,即Q = C△T,因此待测系统在实验过程中所传递的热量也就知道了。
实验时,量热器装有热水(约高于室温10℃,占内筒容积1/2),然后放入适量冰块,冰溶解后混合系统将达到热平衡。
此过程中,原实验系统放热,设为Q放,冰吸热溶成水,继续吸热使系统达到热平衡温度,设吸收的总热量为Q吸。
因为是孤立系统,则有Q放= Q吸(1)设混合前实验系统的温度为T1,其中热水质量为m1(比热容为c1),内筒的质量为m2(比热容为c2),搅拌器的质量为m3(比热容为c3)。
冰的质量为M(冰的温度和冰的熔点均认为是0℃,设为T0),数字温度计浸入水中的部分放出的热量忽略不计。
设混合后系统达到热平衡的温度为T℃(此时应低于室温10℃左右),冰的溶解热由L表示,T T'θ JKT 1 T 1'根据(1)式有 ML +M c 1(T - T 0)=(m 1 c 1+ m 2 c 2+ m 3 c 3)(T 1- T )因T r=0℃,所以冰的溶解热为:11223311()()m c m c m c T T L Tc M ++-=- (2)综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。

实验名称测定冰的熔解热一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
二、实验目的1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
3、了解一种粗略修正散热的方法——抵偿法。
三、实验原理本实验用混合量热法测定冰的熔解热。
其基本做法如下:把待测系统A和一个已知热容的系统B混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统C(C=A+B).这样A(或B)所放出的热量,全部为B(或A)所吸收。
因为已知热容的系统在实验过程中所传递的热量Q,是可以由其温度的改变△T和热容C计算出来,即Q=C△T,因此待测系统在实验过程中所传递的热量也就知道了。
实验时,量热器装有热水(约高于室温10℃,占内筒容积1/2),然后放入适量冰块,冰溶解后混合系统将达到热平衡。
此过程中,原实验系统放热,设为Q放,冰吸热溶成水,继续吸热使系统达到热平衡温度,设吸收的总热量为Q吸。
因为是孤立系统,则有Q放=Q吸(1)设混合前实验系统的温度为T1,其中热水质量为m1(比热容为c1),内筒的质量为m2(比热容为c2),搅拌器的质量为m3(比热容为c3)。
冰的质量为M(冰的温度和冰的熔点均认为是0℃,设为T0),数字温度计浸入水中的部分放出的热量忽略不计。
设混合后系统达到热平衡的温度为T℃(此时应低于室温10℃左右),冰的溶解热由L表示,根据(1)式有ML+Mc1(T-T0)=(m1c1+m2c2+m3c3)(T1-T)T T'θ JKT 1 T 1'因T r=0℃,所以冰的溶解热为:11223311()()m c m c m c T T L Tc M ++-=-(2)综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。
实验名称测定冰的熔解热一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
二、实验目的1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
3、了解一种粗略修正散热的方法——抵偿法。
三、实验原理本实验用混合量热法测定冰的熔解热。
其基本做法如下:把待测系统A和一个已知热容的系统B混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统C(C=A+B).TθJKT 1这样 A (或 B )所放出的热量,全部为 B (或 A )所吸收。
因为已知热容的系统在实验过程中所传递的热量 Q ,是可以由其温度的改变 △T 和热容 C 计算出来,即 Q = C △T ,因此待测系统在实验过程中所传递的热量也就知道了。
实验时,量热器装有热水(约高于室温10℃,占内筒容积1/2),然后放入适量冰块,冰溶解后混合系统将达到热平衡。
此过程中,原实验系统放热,设为 Q 放 ,冰吸热溶成水,继续吸热使系统达到热平衡温度,设吸收的总热量为 Q 吸。
因为是孤立系统,则有Q 放= Q 吸 (1)设混合前实验系统的温度为T 1,其中热水质量为m 1(比热容为c 1),内筒的质量为m 2(比热容为c 2),搅拌器的质量为m 3(比热容为c 3)。
冰的质量为 M (冰的温度和冰的熔点均认为是0℃,设为T 0),数字温度计浸入水中的部分放出的热量忽略不计。
设混合后系统达到热平衡的温度为T ℃(此时应低于室温10℃左右),冰的溶解热由L 表示,根据(1)式有 ML +M c 1(T - T 0)=(m 1 c 1+ m 2 c 2+ m 3 c 3)(T 1- T )因T r=0℃,所以冰的溶解热为:11223311()()m c m c m c T T L Tc M ++-=- (2)综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。
混合法测冰的熔化热【实验简介】温度测量和量热技术是热学实验的中最基本问题。
本实验主要学习利用量热学的实验方法混合法测量冰的熔化热。
量热学是以热力学第一定律为理论基础的,它所研究的范围就是如何计量物质系统随温度变化、相变、化学反应等吸收和放出的热量。
量热学的常用实验方法有混合法、稳流法、冷却法、潜热法、电热法等。
本实验应用混合发测冰的熔化热,使用的基本仪器为量热器。
由于实验过程中量热器不可避免地要参与外界环境的热交换而散失对热量,因此,本实验采用牛顿冷却定理克服和消除热量散失对实验的影响,以减小实验系统误差。
【实验目的】1、掌握基本的量热方法——混合法;2、测定冰的熔化热;3、学习消除系统与外界热交换影响量热的方法。
【实验仪器和用具】量热器(BDI-302A型),数字温度计(SN2202或DM-T)或水银温度计(0~50℃,0.1℃)、烧杯、电子天平(YJ6601)、冰柜、或恒温数显水浴锅、保温桶、小量筒(10ml,0.5ml)、电子秒表或机械秒表等。
【实验原理】1、热平衡方程式在一定压强下,固体发生熔化时的温度称为熔化温度或熔点,单位质量的固态物质在熔点时完全熔化为同温度的液态物质所需要吸收的热量称为熔化热,用L表示, 单位为J Kg或J g。
将质量m,温度为0℃的冰块置入量热器内,与质量为m,温度为t的水相混合,设量热器内系统达到热平衡时温度为1t。
若忽略量热器与外界的热交换,根据热平衡原理可知,冰块熔化成水并升温吸热与水和内筒等的降温放热相等。
即:010*******()(-)mL mC t m C m C m C t t+=++(3-1)电子天平图3-5图3-2 量热器图3-3 量热器结构图图3-4 电子天平解得冰的熔化热为:00112201011()(-)-L m C m C m C t t C t m=++ (3-2) 上式中:m 为冰的质量,0m 为量热器内筒中所取温水的质量,00 4.18()C J g C =⋅为水的比热,1m ,1C 为量热器内筒及搅拌器的质量和比热(二者同材料), 22m C 是温度计插入水中部分的热容(对水银温度计22 1.9m C V =,V 数值上等于温度计插入水中体积的毫升数,单位为o J C ; 对数字温度计的22m C 可不计。
45实验4-4 测定冰的熔解热混合法是热学实验中的一种常用方法,其基本原理可用热平衡方程式来描述,即在一个孤立系统中,一部分物体所吸收的热量等于该系统中其它物体所放出的热量。
本实验用混合法测冰的熔解热,关键是必须保证系统为孤立系统•(即系统与外界环境没有热交换)。
【实验目的】1.掌握用混合法测定冰的熔解热的方法。
2.学习散热修正的一种方法。
【实验器材】量热器、物理天平、温度计、水、冰块、秒表、取冰夹子等。
【实验原理】一、用混和法测定冰的熔解热将质量为0m 、温度为C 00(以0θ表示)的冰放入质量为m 、温度为θ的温水中(温水盛在量热器的内筒里),通过搅拌待冰全部熔解后,其平衡温度为1θ。
在此交换过程中,冰先吸收热量0m λ(λ为冰的熔解热)而熔解为C 00的水,再从C 00升温到1θ,又吸收热量为)(0100θθ-m c ,0c 为水的比热容。
量热器系统(内筒、搅拌器、温度计)与原来的温水放出的热量可表示为(m c 0+11m c +22m c +30m c ))(1θθ-。
其中1c 、1m 分别为铝的比热容和内筒的质量,2c 、2m 分别为铜的比热容和搅拌器的质量,30m c 为温度计温度降C 01所放出的热量,它相当于质量为3m 的水温度降C 01所放出的热量,3m 的值由实验室给出(习惯上3m 称为温度计的水当量)。
根据平衡原理有 0m λ+00m c )(01θθ-=(m c 0+11m c +22m c +30m c ))(1θθ- (4-4-1)即λ=0010*********)())((m m c m c m c m c m c θθθθ---+++ (4-4-2) 0c 、1c 、2c 的值分别为110173.4--⋅⋅=K g J c 、111904.0--⋅⋅=K g J c 、112385.0--⋅⋅=K g J c (它们随温度的变化可忽略不计)。
可以看出,本实验的关键是必须保持系统为孤立系统•,即系统与外界环境没有热交换,热传递有三种方式:①热传导;②热对流;③热辐射。
学生姓名:学号:专业班级:班级编号:试验时间:时分第周星期座位号:教师编号:成绩:冰的比熔化热的测量一、实验目的1.理解熔化热的物理意义,掌握混合量热法测冰的熔解热。
2.学会一种图解法估计和消除系统散热损失的修正方法二、实验原理1.混合量热法测定冰的溶化热比熔化热是指在一定压强下,单位质量的固体物质在熔点时从固相转变为温度的液相的过程中所吸收的热量,称为该物质的比熔解热,一般用L来表示实验时将质量为m1温度为0℃的冰投入盛有m2温度为T1℃水的量热器内筒中,设冰全部熔解为水后平衡温度为T2℃,保温杯、搅拌器的质量分别为m3、m4,其比热容分别为c1、c2和水的比热容为c0。
根据混合量热法的原理,冰全部熔解为同温度(0℃)的水并从0℃升到T2℃过程中所吸收的热量等于其余部分(水m1、保温杯m3、搅拌器m4)从温度T1℃降到T2℃时所放出的热量,有m2c0+m3c1+m4c2T1−T2=m1L+m1T2c0冰的熔化热的实验公式为L=1m1m2c0+m3c1+m4c2T1−T2−T2c0式中水的比热容c0=4.18×103J/kg℃,保温杯、搅拌器的比热容c1=c2=0.9002×103J/kg℃。
本实验“热学系统”依据混合量热法测量冰的熔解热,必须在系统与外界绝热的条件下进行实验。
为了满足此条件,从实验装置、测量方法和实验操作等方面尽量减少系统与外界的热交换。
由于实验系统不可能与环境温度始终一致,因此不满足绝热条件,可能会吸收或散失能量。
因此,要适当地选择参数进行散热修正。
牛顿冷却定律告诉我们,一个环境的温度T如果略高于环境温度T0(两者的温度差不超过10~15℃),系统就会散失热量,散热速率与温度差成学生姓名:学号:专业班级:班级编号:试验时间:时分第周星期座位号:教师编号:成绩:正比,用数学形式表示为dQ=K(T−T0)当S A≈S B时(即直线围成的两块面积近似相等),系统的散热与吸热相互抵消,就可以将系统很好地近似为一个孤立系统。
个人收集整理仅供参考学习实验名称测定冰的熔解热一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
二、实验目的1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
3、了解一种粗略修正散热的方法——抵偿法。
三、实验原理本实验用混合量热法测定冰的熔解热。
其基本做法如下:把待测系统A和一个已知热容的系统B混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统C (C=A+B).这样A(或B)所放出的热量,全部为B(或A)所吸收。
因为已知热容的系统在实验过程中所传递的热量Q,是可以由其温度的改变△T 和热容C计算出来,即Q = C△T,因此待测系统在实验过程中所传递的热量也就知道了。
实验时,量热器装有热水(约高于室温10℃,占内筒容积1/2),然后放入适量冰块,冰溶解后混合系统将达到热平衡。
此过程中,原实验系统放热,设为Q放,冰吸热溶成水,继续吸热使系统达到热平衡温度,设吸收的总热量为Q吸。
因为是孤立系统,则有Q放= Q吸(1)设混合前实验系统的温度为T1,其中热水质量为m1(比热容为c1),内筒的质量为m2(比热容为c2),搅拌器的质量为m3(比热容为c3)。
冰的质量为M(冰的温度和冰T T'θ JKT 1 T 1'的熔点均认为是0℃,设为T 0),数字温度计浸入水中的部分放出的热量忽略不计。
设混合后系统达到热平衡的温度为T ℃(此时应低于室温10℃左右),冰的溶解热由L 表示,根据(1)式有 ML +M c 1(T - T 0)=(m 1 c 1+ m 2 c 2+ m 3 c 3)(T 1- T )因T r=0℃,所以冰的溶解热为:11223311()()m c m c m c T T L Tc M ++-=- (2)综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。
实验名称测定冰的熔解热一、前言物质从固相转变为液相的相变过程称为熔解。
一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。
对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。
物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。
二、实验目的1、学习用混合量热法测定冰的熔解热。
2、应用有物态变化时的热交换定律来计算冰的溶解热。
3、了解一种粗略修正散热的方法——抵偿法。
三、实验原理本实验用混合量热法测定冰的熔解热。
其基本做法如下:把待测系统A和一个已知热容的系统B混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统C(C=A+B).这样A(或B)所放出的热量,全部为B(或A)所吸收。
因为已知热容的系统在实验过程中所传递的热量Q,是可以由其温度的改变△T和热容C计算出来,即Q=C△T,因此待测系统在实验过程中所传递的热量也就知道了。
实验时,量热器装有热水(约高于室温10℃,占内筒容积1/2),然后放入适量冰块,冰溶解后混合系统将达到热平衡。
此过程中,原实验系统放热,设为Q放,冰吸热溶成水,继续吸热使系统达到热平衡温度,设吸收的总热量为Q吸。
因为是孤立系统,则有Q放=Q吸(1)设混合前实验系统的温度为T1,其中热水质量为m1(比热容为c1),内筒的质量为m2(比热容为c2),搅拌器的质量为m3(比热容为c3)。
冰的质量为M(冰的温度和冰的熔点均认为是0℃,设为T0),数字温度计浸入水中的部分放出的热量忽略不计。
设混合后系统达到热平衡的温度为T℃(此时应低于室温10℃左右),冰的溶解热由L表示,根据(1)式有ML+Mc1(T-T0)=(m1c1+m2c2+m3c3)(T1-T)T T'θ JKT 1 T 1'因T r=0℃,所以冰的溶解热为:11223311()()m c m c m c T T L Tc M ++-=-(2)综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。