2017九年级化学复习化学反应基本类型专题练习(最新整理)
- 格式:pdf
- 大小:236.00 KB
- 文档页数:3

初三化学九下反应方程式所有知识点总结和常考题型练习题一、知识点总结1. 反应方程式的定义和组成部分- 反应方程式是描述化学反应的化学方程式,由反应物、生成物、反应条件和反应箭头组成。
2. 反应方程式的平衡原则- 反应方程式中的原子数目在反应前后保持不变。
3. 反应物和生成物的表示方法- 反应物和生成物可以用化学式或化学名来表示。
4. 反应方程式的平衡调整- 对不平衡的反应方程式,通过调整系数使得反应前后的原子数目平衡。
5. 氧化还原反应方程式的表示- 氧化还原反应方程式通过电子的转移来表示反应过程。
二、常考题型练题1. 平衡下列反应方程式,并指出反应类型:- 铁与氧气反应生成氧化铁:2Fe + 3O2 → 2Fe2O3(合成反应)2. 平衡下列反应方程式,并指出反应类型:- 碘化钠与氯化银反应生成氯化钠和碘:2NaI + AgCl → 2NaCl + I2(置换反应)3. 以下哪个是氧化还原反应方程式:- A. HCl + NaOH → NaCl + H2O- B. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag- C. Zn + HCl → ZnCl2 + H2- D. Fe2O3 + 3CO → 2Fe + 3CO2答案:B4. 平衡下列反应方程式,并指出反应类型:- 硫化铁与氧气反应生成二氧化硫和三氧化二铁:4FeS2 +11O2 → 8SO2 + 2Fe3O4(合成反应)5. 平衡下列反应方程式,并指出反应类型:- 碳酸钙热分解生成氧气和碳酸钙:CaCO3 → CaO + CO2(分解反应)总结:初三化学九下反应方程式的知识点包括反应方程式的定义、组成部分、平衡原则、表示方法以及氧化还原反应方程式。
在复过程中,常见的考题类型包括平衡反应方程式和识别反应类型。
通过不断练和巩固,我们能够更好地理解和掌握反应方程式的相关知识。

初中化学四大基本反应类型一、初中常见化学反应类型归纳(1)化合反应:A、单质+ 单质→ 化合物例如:B、单质+ 化合物→ 化合物例如:C、化合物+ 化合物→ 化合物例如:D、多种物质生成一种物质例如:NH3 + CO2 + H2O =NH4HCO3(2)分解反应:A、氧化物的分解例如:B、酸的分解(含氧酸)例如:H2CO3→C、不溶性碱的分解例如:Mg(OH)2→D、某些盐的分解例如: CaCO3 →(3)置换反应A、非金属+ 金属氧化物→ 金属+ 金属氧化物例如:C、+ CuO →B、金属(H前面)+ 酸(稀盐酸、稀硫酸)→ 盐+ 氢气例如:C、金属(一般不选K、Na、Ca)+ 盐溶液→ 另一金属+ 另一种盐例如:D、水与其它单质的反应例如:2Na + 2H2O=2NaOH + H2↑,C + H2O =CO + H2(4)复分解反应A、金属氧化物+ 酸→ 盐+水例如:B、碱+ 酸→ 盐+ 水例如:C、碱+ 盐→ 另一种碱+ 另一种盐例如:D、盐+ 盐→ 两种新盐例如:E、盐+ 酸→ 另一种盐+ 另一种酸例如:二、化学反应发生的条件化学反应能否发生与反应物质本身的性质(内因)和外界条件(外因)有关。
(1)外界条件例如,燃烧需要点燃,氢气还原氧化铜需要加热,水分解需要通电,碳酸钙分解需要高温,氯酸钾分解制氧气需要加热和催化剂,像点燃、加热、高温、通电、催化剂都是外界条件。
(2)金属活动性顺序表(注重基础)A按金属活动性由强到弱的顺序写出14种常见金属的活动性顺序表。
K Ca (H)B、排在氢前面的金属置换酸中的氢生成氢气。
C、排在前面的金属能把排在后面的金属从它的盐溶液中置换出来。
(一般不使用K、Ca、Na)D、Fe与排在其后的金属的盐溶液反应也只能生成亚铁盐。
(3)复分解反应发生的条件A、反应物:在上面的复分解反应类型中C、D两类的反应物一般要求均可溶;B、生成物:一般要有或或水生成。
一、化合反应(一)、金属+ 氧气-------- 金属氧化物1、镁在空气中燃烧:2、铁在氧气中燃烧:3、铝在空气中燃烧:4、铜在空气中受热:5、汞在空气中受热:(二)、非金属+ 氧气-------- 非金属氧化物6、氢气在空气中燃烧:7、红磷在空气中燃烧:8、硫粉在空气中燃烧:9、碳在氧气中充分燃烧:10、碳在氧气中不充分燃烧:(三)、金属氧化物+ 水-------- 碱(可溶性)11、生石灰溶于水:12、氧化钠溶于水:(四)、非金属+ 水-------- 非金属氧化物13、二氧化碳和水反应:14、二氧化硫溶于水:15、三氧化硫溶于水:(五)、其他16、二氧化碳通过灼热碳层:17、一氧化碳在氧气中燃烧(煤气燃烧):18、钠在氯气中燃烧:19、氯气在氢气中点燃(共价化合物的形成、制备盐酸):20、无水硫酸铜作干燥剂:二、分解反应21、氧化汞受热分解:22、双氧水制氧气(实验室制备氧气):23、加热高锰酸钾(实验室制备氧气):24、加热氯酸钾(有少量的二氧化锰)(实验室制备氧气):25、水在直流电的作用下分解:26、碳酸不稳定而分解:27、高温煅烧石灰石(二氧化碳工业制法):28、硫酸铜晶体受热分解:29、碱式碳酸铜(铜绿)受热分解:30、碳酸氢铵受热分解(碳酸氢铵长期暴露空气中会消失):三、置换反应(一定属于氧化还原反应)(一)、金属单质+ 酸-------- 盐+ 氢气31、锌和稀硫酸反应(实验室制氢气):32、铁和稀硫酸反应:33、铝和稀硫酸反应:34、镁和稀硫酸反应:35、锌和稀盐酸:36、铁和稀盐酸:37、铝和稀盐酸:38、镁和稀盐酸:(二)、非金属单质+金属氧化物-------- 金属单质+ 水39、氢气还原氧化铜:40、氢气还原氧化铁:41、氢气还原四氧化三铁:42、木炭还原氧化铜:43、焦炭还原氧化铁:44、水蒸气通过灼热碳层:(三)、金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐45、铁和硫酸铜溶液反应(湿法炼铜、镀铜原理):46、锌和硫酸亚铁溶液反应:47、锌和硫酸铜溶液反应(镀铜):48、铜和硝酸汞溶液反应:49、铜和硝酸银溶液反应(镀银):四、复分解反应(一)、碱性氧化物(金属氧化物)+酸-------- 盐+ 水50、氧化铁和稀盐酸反应:51、氧化铁和稀硫酸反应:52、氧化铜和稀盐酸反应:53、氧化铜和稀硫酸反应:54、氧化镁和稀硫酸反应:55、氧化钙和稀盐酸反应:56、氧化钠和稀盐酸反应:(二)、酸+ 碱-------- 盐+ 水【中和反应】57、盐酸和烧碱起反应:58、盐酸和氢氧化钾反应:59、盐酸和氢氧化铜反应:60、盐酸和氢氧化钙反应:61、盐酸和氢氧化铁反应:62、氢氧化铝药物治疗胃酸过多:63、硫酸和烧碱反应:64、硫酸和氢氧化钾反应:65、硫酸和氢氧化铜反应:66、硫酸和氢氧化铁反应:67、硫酸和氢氧化钡反应:68、硝酸和烧碱反应:(三)、酸+ 盐-------- 另一种酸+ 另一种盐69、石灰石(或大理石)与稀盐酸反应:70、碳酸钠与稀盐酸反应(泡沫灭火器的原理):71、碳酸镁与稀盐酸反应:72、盐酸和硝酸银溶液反应:73、硫酸和碳酸钠反应:74、硫酸和氯化钡溶液反应:(四)、碱+ 盐-------- 另一种碱+ 另一种盐75、氢氧化钠与硫酸铜:76、氢氧化钠与氯化铁:77、氢氧化钠与氯化镁:78、氢氧化钠与氯化铜:79、氢氧化钙与碳酸钠:80、氢氧化钠与硝酸铵:(五)、盐+ 盐----- 两种新盐81、氯化钠溶液和硝酸银溶液:82、硫酸钠和氯化钡:其他(不属于四种基本反应类型)(一)有机物的燃烧83、甲烷在空气中燃烧(甲烷和天然气的燃烧):84、酒精(乙醇)在空气中燃烧(氧炔焰、焊接切割金属):(二)还原剂和氧化物反应85、一氧化碳还原氧化铜:86、一氧化碳还原氧化铁:(三)酸性氧化物+碱-------- 盐+ 水87、氢氧化钠和二氧化碳反应(苛性钠暴露在空气中变质)(除去二氧化碳):88、氢氧化钠吸收二氧化硫气体(处理硫酸工厂的尾气SO2):89、氢氧化钠吸收三氧化硫气体:90、二氧化碳通过澄清石灰水(消石灰放在空气中变质)(检验二氧化碳):91、氢氧化钙(熟石灰,消石灰)吸收二氧化硫:一、化合反应(一)、金属+ 氧气-------- 金属氧化物1、镁在空气中燃烧:2Mg+O22MgO(剧烈燃烧,耀眼白光,放热,生成白色固体)2、铁在氧气中燃烧:3Fe+2O2 Fe3O4 (剧烈燃烧,火星四射,放热,生成黑色固体)3、铝在空气中燃烧:4Al+3O2 2Al2O3(银白金属变为白色固体)4、铜在空气中受热:2Cu+O22Cu(红色金属变为黑色固体)5、汞在空气中受热:2Hg+O22HgO(由银白液体,生成红色固体)(二)、非金属+ 氧气-------- 非金属氧化物6、氢气在空气中燃烧:2H2+O2 2H2O(淡蓝火焰,放热,生成使无水CuSO4变蓝的液体)7、红磷在空气中燃烧:4P+5O2 2P2O5(剧烈燃烧,放热,放出大量白烟)8、硫粉在空气中燃烧:S+O2SO2 (剧烈燃烧,放热,生成有刺激味气体;在空气中淡蓝色火焰,在氧气中蓝紫色火焰)9、碳在氧气中充分燃烧:C+O2 CO2(剧烈燃烧,发出白光,放热,生成使澄清石灰水变浑浊的气体)10、碳在氧气中不充分燃烧:2C+O22CO(三)、金属氧化物+ 水-------- 碱(可溶性)11、生石灰溶于水:CaO+H2O==Ca(OH)2 (放热)12、氧化钠溶于水:Na2O+H2O==2NaOH (放热)(四)、非金属+ 水-------- 非金属氧化物13、二氧化碳和水反应:CO2+H2O==H2CO3(二氧化碳通入紫色石蕊试液,溶液变红,说明二氧化碳溶于水显酸性)14、二氧化硫溶于水:SO2+H2O==H2SO315、三氧化硫溶于水:SO3+H2O==H2SO4(五)、其他16、二氧化碳通过灼热碳层:C+CO2 2CO17、一氧化碳在氧气中燃烧(煤气燃烧):2CO+O2 2CO2(蓝色火焰)18、钠在氯气中燃烧:2Na+Cl22NaCl(剧烈燃烧,黄色火焰)19、氯气在氢气中点燃(共价化合物的形成、制备盐酸):H2+Cl22HCl (苍白色火焰,瓶口白雾)20、无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O (白色固体变蓝)二、分解反应21、氧化汞受热分解:2HgO2Hg+O2↑ (红色固体变为银白液体,生成使带火星木条复燃的气体)22、双氧水制氧气(实验室制备氧气):2H2O22H2O+O2↑23、加热高锰酸钾(实验室制备氧气):2KMnO4K2MnO4+MnO2+O2↑24、加热氯酸钾(有少量的二氧化锰)(实验室制备氧气):2KClO32KCl+3O2↑25、水在直流电的作用下分解:2H2O2H2↑+O2↑26、碳酸不稳定而分解:H2CO3==H2O+CO2↑27、高温煅烧石灰石(二氧化碳工业制法):CaCO3CaO+CO2↑28、硫酸铜晶体受热分解:CuSO4·5H2O CuSO4+5H2O(蓝色晶体变为白色粉末)29、碱式碳酸铜(铜绿)受热分解:Cu2(OH)2CO32CuO+H2O+CO2↑(绿色固体变黑色固体,生成使澄清石灰水变浑浊气体和使无水CuSO4变蓝的液体)30、碳酸氢铵受热分解(碳酸氢铵长期暴露空气中会消失):NH4HCO3NH3↑+H2O+CO2↑(白色固体消失,有刺激性气味的气体生成,且能使湿润的PH试纸变蓝,生成使澄清石灰水变浑浊气体)三、置换反应(一定属于氧化还原反应)(一)、金属单质+ 酸-------- 盐+ 氢气31、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑32、铁和稀硫酸反应:Fe+H2SO4==FeSO4+H2↑(溶液由无色变为浅绿色)33、铝和稀硫酸反应:2Al+3H2SO4==Al2(SO4)3+3H2↑34、镁和稀硫酸反应:Mg+H2SO4==MgSO4+H2↑35、锌和稀盐酸:Zn+2HCl==ZnCl2+H2↑36、铁和稀盐酸:Fe+2HCl==FeCl2+H2↑(溶液由无色变为浅绿色)37、铝和稀盐酸:2Al+6HCl==2AlCl3+3H2↑38、镁和稀盐酸:Mg+2HCl==MgCl2+H2↑(二)、非金属单质+金属氧化物-------- 金属单质+ 水39、氢气还原氧化铜:H2+CuO Cu+H2O(黑色固体逐渐变为红色,生成使无水硫酸铜变蓝的液体)40、氢气还原氧化铁:3H2+ Fe2O32Fe+3H2O (红色固体逐渐变为银白色,生成使无水硫酸铜变蓝的液体)41、氢气还原四氧化三铁:4H2+ Fe3O43Fe+4H2O (黑色固体逐渐变为银白色,生成使无水硫酸铜变蓝的液体)42、木炭还原氧化铜:C+2CuO 2Cu+CO2↑(黑色固体逐渐变为红色,生成使澄清石灰水变浑浊的气体)43、焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑44、水蒸气通过灼热碳层:C + H2O(g)H2+CO (产物是水煤气的主要成分)(三)、金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐45、铁和硫酸铜溶液反应(湿法炼铜、镀铜原理):Fe+CuSO4==FeSO4+Cu(银白色金属表面覆盖一层红色物质)46、锌和硫酸亚铁溶液反应:Mg+FeSO4==Fe+MgSO4(溶液由浅绿色变为无色)47、锌和硫酸铜溶液反应(镀铜):Zn+CuSO4==ZnSO4+Cu(青白色金属表面覆盖一层红色物质)48、铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg49、铜和硝酸银溶液反应(镀银):Cu+2AgNO3==2Ag+Cu(NO3)2(红色金属表面覆盖一层银白色物质)四、复分解反应(一)、碱性氧化物(金属氧化物)+酸-------- 盐+ 水50、氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O51、氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O(红色固体(铁锈)溶解,溶液呈黄色)52、氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O(黑色固体溶解、溶液呈蓝色)53、氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O(黑色固体溶解、溶液呈蓝色)54、氧化镁和稀硫酸反应:MgO+H2SO4==MgSO4+H2O(白色固体溶解)55、氧化钙和稀盐酸反应:CaO+2HCl==CaCl2+H2O(白色固体溶解)56、氧化钠和稀盐酸反应Na2O+2HCl==2NaCl+H2O(白色固体溶解)(二)、酸+ 碱-------- 盐+ 水【中和反应】57、盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O58、盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O59、盐酸和氢氧化铜反应:2HCl+Cu(OH)2==CuCl2+2H2O(蓝色沉淀溶解,溶液呈蓝色)60、盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O61、盐酸和氢氧化铁反应:3HCl+Fe(OH)3==FeCl3+3H2O(红褐色沉淀溶解,溶液呈黄色)62、氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O63、硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O64、硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O65、硫酸和氢氧化铜反应:H2SO4+Cu(OH)2==CuSO4+2H2O66、硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O67、硫酸和氢氧化钡反应:H2SO4+Ba(OH)2==BaSO4↓+2H2O(生成不溶解于稀硝酸的白色沉淀,应用于检验硫酸根)68、硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O(三)、酸+ 盐-------- 另一种酸+ 另一种盐69、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法,除水垢):CaCO3+2HCl==CaCl2+H2O+CO2↑70、碳酸钠与稀盐酸反应(泡沫灭火器的原理): Na2CO3+2HCl==2NaCl+H2O+CO2↑71、碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑72、盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO3(生成不溶于稀硝酸的白色沉淀,常应用于检验氯离子)73、硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑74、硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl(生成不溶于稀硝酸的白色沉淀,常应用于检验硫酸根)(四)、碱+ 盐-------- 另一种碱+ 另一种盐75、氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4(蓝色沉淀生成、上部为澄清溶液)76、氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3↓+3NaCl(溶液黄色褪去,有红褐色沉淀生成)77、氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓+2NaCl(有白色沉淀生成)78、氢氧化钠与氯化铜:2NaOH+CuCl2==Cu(OH)2↓+2NaCl(溶液蓝色褪去,有蓝色沉淀生成)79、氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH80、氢氧化钠与硝酸铵:NaOH + NH4NO3 ==NaNO3+NH3↑+H2O(生成使湿润石蕊试纸变蓝色的气体,应用于检验溶液中的铵根离子)(五)、盐+ 盐----- 两种新盐81、氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO3(生成不溶于稀硝酸的白色沉淀,常应用于检验氯离子)82、硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl(生成不溶于稀硝酸的白色沉淀,常应用于检验硫酸根)其他(不属于四种基本反应类型)(一)有机物的燃烧83、甲烷在空气中燃烧(甲烷和天然气的燃烧):CH4+2O2CO2+2H2O(蓝色火焰,放热,生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体)84、酒精(乙醇)在空气中燃烧(氧炔焰、焊接切割金属):C2H5OH+3O22CO2+3H2O (蓝色火焰,放热,有黑烟,生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体)(二)还原剂和氧化物反应85、一氧化碳还原氧化铜:CO+CuO Cu+CO286、一氧化碳还原氧化铁:3CO+Fe2O32Fe+3CO2 (黑色固体逐渐变红色,生成使澄清石灰水变浑浊的气体)(三)酸性氧化物+碱-------- 盐+ 水87、氢氧化钠和二氧化碳反应(苛性钠暴露在空气中变质)(除去二氧化碳):2NaOH+CO2==Na2CO3+H2O88、氢氧化钠吸收二氧化硫气体(处理硫酸工厂的尾气SO2):2NaOH+SO2==Na2SO3+H2O89、氢氧化钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O90、二氧化碳通过澄清石灰水(消石灰放在空气中变质)(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O91、氢氧化钙(熟石灰,消石灰)吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O。

初三化学《化学反应》测试题及答案
1. 下列物质的化学反应中,属于还原反应的是()。
- A. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
- B. Fe + S → FeS
- C. 2Al + 3CuCl2 → 2AlCl3 + 3Cu
- D. 2Na + Cl2 → 2NaCl
答案:B
2. 以下有关化学反应的叙述,正确的是()。
- A. 化学反应只有从左到右的过程
- B. 化学反应总是伴随着能量的吸收
- C. 化学反应的产物总是比反应物少
- D. 化学反应是物质的变化过程
答案:D
3. 下列化学反应方程式中,属于氧化反应的是()。
- A. CaCO3 → CaO + CO2
- B. CH4 + 2O2 → CO2 + 2H2O
- C. NaCl + AgNO3 → NaNO3 + AgCl
- D. HCl + NaOH → NaCl + H2O
答案:B
4. 化学反应的标志是()。
- A. 反应物颜色的变化
- B. 反应物的相对分子质量的变化
- C. 反应物在反应前后固体、液体和气体的变化- D. 反应物量的变化
答案:A
5. 化学反应的速率决定于()。
- A. 温度和反应物浓度
- B. 触媒和光照强度
- C. 反应物的性质和催化剂
- D. 溶液的酸碱度和压强
答案:A
以上是初三化学《化学反应》测试题及答案,希望对你有所帮助!。

初中化学《四种基本反应类型》专项考试题带解析.doc初中化学《四种基本反应类型》专项考试题带解析姓名:_____________ 年级:____________ 学号:______________题型选择题填空题简答题xx题xx题xx题总分得分⼀、选择题(共14题)评卷⼈得分1.对下列有⽔⽣成的四个化学⽅程式的反应类型,判断不正确的是()①2H2+O22H2O②H2CO3=H2O+CO2↑③H2+CuO Cu+H2O④SO2+2NaOH=Na2SO3+H2O.A.①是化合反应B.②是分解反应C.③是置换反应D.④是复分解反应【答案】考点:反应类型的判定.专题:化学反应的基本类型和能量变化.分析:化合反应:两种或两种以上物质反应后⽣成⼀种物质的反应,其特点可总结为“多变⼀”;分解反应:⼀种物质反应后⽣成两种或两种以上的物质,其特点可总结为“⼀变多”;置换反应是⼀种单质和⼀种化合物反应⽣成另⼀种单质和另⼀种化合物的反应;复分解反应是两种化合物相互交换成分⽣成两种新的化合物的反应.解答:解:A、①2H2+O22H2O,该反应符合“多变⼀”的特征,属于化合反应,故选项说法正确.B、②H2CO3=H2O+CO2↑,该反应符合“⼀变多”的特征,属于分解反应,故选项说法正确.C、③H2+CuOCu+H2O,该反应是⼀种单质和⼀种化合物反应⽣成另⼀种单质和另⼀种化合物的反应,属于置换反应,故选项说法正确.D、④SO2+2NaOH=Na2SO3+H2O,该反应不是两种化合物相互交换成分⽣成两种新的化合物的反应,不属于复分解反应,故选项说法错误.故选:D.点评:本题难度不⼤,掌握化合反应、分解反应、置换反应、复分解反应的特征并能灵活运⽤是正确解答本题的关键.难度:容易知识点:如何正确书写化学⽅程式2.⼯业制镁的⽅法为:将含碳酸钙的贝壳制成⽯灰乳;在海⽔中加⼊⽯灰乳,过滤;在氢氧化镁中加⼊盐酸,结晶;电解熔融氯化镁.该⽅法中的化学反应不包括()A.化合反应B.置換反应C.分解反应D.复分解反应【答案】考点:反应类型的判定.专题:化学反应的基本类型和能量变化.分析:根据各步反应结合物质的性质判断所发⽣的反应,以此判断反应类型.解答:解:①把贝壳制成⽯灰乳,涉及的反应有分解、化合;②在引⼊的海⽔中加⼊⽯灰乳,沉降、过滤、洗涤沉淀物,发⽣复分解反应;③将沉淀物与盐酸反应,结晶,过滤,得到含结晶⽔的晶体,发⽣复分解反应;④将得到晶体在⼀定条件下加热得到⽆⽔氯化镁,涉及分解反应;⑤电解熔融氯化镁,得到⾦属镁,为分解反应.没有涉及的反应为置换反应,故选B点评:本题考查镁的冶炼,题⽬难度不⼤,注意把握物质的性质,可不写化学⽅程式就能判断出.难度:容易知识点:化学⽅程式单元测试3.分析推理是学习化学常⽤的⼀种⽅法.下列推理正确的是()A.Zn置换H2是有元素化合价变化的置换反应,则所有置换反应都有元素化合价变化B.酸碱中和反应有盐和H2O⽣成的反应⼀定是酸碱中和反应C.⼀定温度下的不饱和溶液还能溶解溶质,则⼀定温下的饱和溶液不能溶解任何物质D.CH4充分燃烧⽣成的H2O和CO2,则充分燃烧⽣成H2O和CO2的物质只含C、H元素【答案】考点:置换反应及其应⽤;饱和溶液和不饱和溶液;中和反应及其应⽤;质量守恒定律及其应⽤.专题:化学⽤语和质量守恒定律;化学反应的基本类型和能量变化;溶液、浊液与溶解度;常见的酸酸的通性.分析:A.根据置换反应的特点来分析;B.根据中和反应的概念来分析;C.根据饱和溶液的概念来分析;D.根据质量守恒定律来分析.解答:解:A.Zn置换H2是置换反应,锌元素和氢元素的化合价在反应前后都发⽣了变化,置换反应中元素的化合价⼀定发⽣改变,故正确;B.中和反应的⽣成物⼀定是盐和⽔,但是⽣成盐和⽔的反应不⼀定是中和反应,如⼆氧化碳与氢氧化钠反应⽣成碳酸钠和⽔,⽣成物是盐和⽔,但是不属于中和反应,故错误;C.在⼀定温度下,⼀定量的溶剂中还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液,不能继续溶解这中溶质的溶液,叫做这种溶质的饱和溶液,但是此溶液还能继续溶解其他溶质,故错误;D.根据质量守恒定律可知,甲烷完全燃烧⽣成⼆氧化碳和⽔,但是燃烧⽣成⼆氧化碳和⽔的物质中⼀定含有碳元素和氢元素,可能含有氧元素,故错误.故选A.点评:本题考查的知识点较多,解题关键是抓住定义和物质的性质,对于错误的推理要通过反例推翻.难度:容易知识点:化学⽅程式单元测试4.下列化学反应属于复分解反应是()A.CH4+2O2CO2+2H2O3Fe+2CO2Fe3O4C.NaOH+HCl═NaCl+H2OD.H2CO3═CO2↑+H2O【答案】考点:复分解反应及其应⽤.专题:化学反应的基本类型和能量变化.分析:复分解反应是两种化合物相互交换成分⽣成两种新的化合物的反应,据此进⾏分析判断.解答:解:A、CH4+2O2CO2+2H2O,该反应的反应物中氧⽓是单质,不是两种化合物相互交换成分⽣成两种新的化合物的反应,不属于复分解反应,故选项错误.B、3Fe+2CO2Fe3O4,该反应符合“多变⼀”的特征,属于化合反应,故选项错误.C、NaOH+HCl═NaCl+H2O,该反应是两种化合物相互交换成分⽣成两种新的化合物的反应,属于复分解反应,故选项正确.D、H2CO3═CO2↑+H2O,该反应符合“⼀变多”的特征,属于分解反应,故选项错误.故选:C.点评:本题难度不⼤,掌握复分解反应的特征(换成分,价不变)是正确解答本题的关键.难度:容易知识点:如何正确书写化学⽅程式5.下列物质间发⽣的化学反应属于复分解反应的是()A.镁条在空⽓中燃烧⽣成氧化镁B.锌粒和稀硫酸反应⽣成氢⽓C.氢氧化钠溶液和硫酸铜溶液混合⽣成氢氧化铜沉淀D.⾼温煅烧⽯灰⽯⽣成⽣⽯灰【答案】考点:复分解反应及其应⽤.专题:化学反应的基本类型和能量变化.分析:复分解反应是两种化合物相互交换成分⽣成两种新的化合物的反应,据此进⾏分析判断.解答:解:A、镁条在空⽓中燃烧⽣成氧化镁,该反应符合“多变⼀”的特征,属于化合反应,故选项错误.B、锌粒和稀硫酸反应⽣成氢⽓,同时⽣成硫酸锌,该反应是⼀种单质和⼀种化合物反应⽣成另⼀种单质和另⼀种化合物的反应,属于置换反应,故选项错误.C、氢氧化钠溶液和硫酸铜溶液混合⽣成氢氧化铜沉淀,同时⽣成硫酸钠,该反应是两种化合物相互交换成分⽣成两种新的化合物的反应,属于复分解反应,故选项正确.D、⾼温煅烧⽯灰⽯⽣成⽣⽯灰和⼆氧化碳,该反应符合“⼀变多”的特征,属于分解反应,故选项错误.故选:C.点评:本题难度不⼤,掌握复分解反应的特征(换成分,价不变)是正确解答本题的关键.难度:容易知识点:化学⽅程式单元测试6.下列有关化学反应类型的判断,错误的是()选项化学⽅程式反应类型A4Fe(OH)2+O2+2H20=4Fe(OH)3化合反应B2KMnO4K2MnO4+MnO2+O2↑分解反应CBaCl2+2AgNO3=2AgCl↓+Ba(NO3)2复分解反应DFe3O4+4CO3Fe+4CO2置换反应A.ABC.CD.D【答案】考点:反应类型的判定.专题:化学反应的基本类型和能量变化.分析:化合反应:两种或两种以上物质反应后⽣成⼀种物质的反应,其特点可总结为“多变⼀”;分解反应:⼀种物质反应后⽣成两种或两种以上的物质,其特点可总结为“⼀变多”;置换反应是⼀种单质和⼀种化合物反应⽣成另⼀种单质和另⼀种化合物的反应;复分解反应是两种化合物相互交换成分⽣成两种新的化合物的反应.解答:解:A、4Fe(OH)2+O2+2H20=4Fe(OH)3,该反应符合“多变⼀”的特征,属于化合反应,故选项错误.B、2KMnO4K2MnO4+MnO2+O2↑,该反应符合“⼀变多”的特征,属于分解反应,故选项错误.C、BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2,该反应是两种化合物相互交换成分⽣成两种新的化合物的反应,属于复分解反应,故选项错误.D、Fe3O4+4CO3Fe+4CO2,该反应的反应物均为化合物,不属于置换反应,故选项正确.故选:D.点评:本题难度不⼤,掌握化合反应(“多变⼀”)、分解反应(“⼀变多”)、置换反应、复分解反应(换成分,价不变)的特征是正确解答本题的关键.难度:容易知识点:化学⽅程式单元测试7.2014年12⽉16⽇,沪昆⾼铁长怀段正式开通,极⼤⽅便了市民出⾏,促进邵阳地区经济的发展.建设中⽤到Fe2O3+2AlAl2O3+2Fe对钢轨中的缝隙进⾏焊接,该反应的基本类型是()A.复分解反应B.化合反应C.置换反应D.分解反应【答案】考点:反应类型的判定.专题:化学反应的基本类型和能量变化.分析:由题意,反应的化学l难度:中等知识点:如何正确书写化学⽅程式8.下列有关化学反应,对其反应类型的判断,正确的是()①CuO+2HCl═CuCl2+H2O②3CO+Fe2O32Fe+3CO2③Cu+2AgNO3═Cu(NO3)2+2Ag④C+CO22CO.A.①分解反应B.②置换反应C.③复分解反应D.④化合反应【答案】考点:反应类型的判定.专题:化学反应的基本类型和能量变化.分析:根据反应原理分析反应特征确定反应类型.化合反应:两种或两种以上物质反应后⽣成⼀种物质的反应,其特点可总结为“多变⼀”;分解反应:⼀种物质反应后⽣成两种或两种以上的物质,其特点可总结为“⼀变多”;置换反应是⼀种单质和⼀种化合物反应⽣成另⼀种单质和另⼀种化合物的反应;复分解反应是两种化合物相互交换成分⽣成两种新的化合物的反应.解答:解:①是由两种化合物相互交换成分⽣成两种新的化合物的反应,属于复分解反应;②属于氧化还原反应,因为反应物是两种化合物,故不属于置换反应;③符合⼀种单质与⼀种化合物反应⽣成⼀种新的单质与⼀种新的化合物,属于置换反应;④符合“多变⼀”的特征,属于化合反应.故选D.点评:掌握四种基本反应类型的概念与特点是解题的关键.难度:容易知识点:化学⽅程式单元测试9.氢⽓在氯⽓中燃烧的化学⽅程式是H2+Cl22HCl,该反应属于()A.分解反应B.化合反应C.复分解反应D.置换反应【答案】考点:反应类型的判定.专题:化学反应的基本类型和能量变化.分析:根据题意,氢⽓在氯⽓中燃烧的化学⽅程式是H2+Cl22HCl,该反应的反应物是两种,⽣成物是⼀种,据此结合四种基本的反应类型的特征,进⾏分析判断.解答:解:氢⽓在氯⽓中燃烧的化学⽅程式是H2+Cl22HCl,该反应符合“多变⼀”的特征,属于化合反应.故选:B.点评:本题难度不⼤,掌握化合反应的特征(“多变⼀”)是正确解答本题的关键.难度:容易知识点:如何正确书写化学⽅程式10.钛(Ti)是⼀种⼴泛应⽤于航空、航天等领域的重要⾦属,⼯业上制钛的化学⽅程式为:TiCl4+2Mg Ti+2MgCl2,该反应属于()化合反应B.分解反应C.置换反应复分解反应【答案】考点:反应类型的判定.专题:化学反应的基本类型和能量变化.分析:根据反应物、⽣成物的种类可以判断反应类型.解答:解:TiCl4+2MgTi+2MgCl2中,反应物和⽣成物都是⼀种单质和⼀种化合物,属于置换反应.故选:C.点评:判断反应类型时,要紧紧围绕反应物和⽣成物的种类进⾏分析、判断,从⽽可以得出正确的结论.难度:容易知识点:如何正确书写化学⽅程式11.下表所列的各基本反应类型对应的化学⽅程式实例正确的是()基本反应类型化学⽅程式实例A化合反应CO2+H2O═HCO3B分解反应2KClO22KCl+3O2↑C复分解反应KOH+NaCl═KCl+NaOHD置换反应Zn+H2SO4═ZnSO4+2H2↑A.B.BC.CD.【答案】考点:反应类型的判定.专题:化学反应的基本类型和能量变化.分析:A、化合反应是指由两种或两种以上物质反应⽣成另外⼀种物质的反应;B、分解反应⼀种物质⽣成两种或两种以上的其他物质的反应;C、复分解反应是两种化合物相互交换成分⽣成另两种化合物的反应;D、置换反应中应是单质与化合物反应⽣成单质和化合物的反应;解答:解:A、CO2+H2O═HCO3符合“多变⼀”的特点,属于化合反应;B、2KClO22KCl+3O2↑符合“⼀变多”的特点,但是化学式KClO2错误,故错误;C、复分解反应主要是物质相互交换成分,或理解为离⼦重新结合,若有⽓体或⽔或沉淀⽣成,该反应才发⽣.KOH+NaCl═KCl+NaOH不能发⽣,故错误;D、Zn+H2SO4═ZnSl 该反应中CO2是⽣成物C.该反应是复分解反应D.该反应是化合反应【答案】考点:化合反应及其应⽤;复分解反应及其应⽤;常见化学反应中的质量关系.专题:物质的变化与性质;化学反应的基本类型和能量变化.分析:由三种物质在密闭容器这个反应前后质量⽐例的变化,确定是反应物还是⽣成物,进⽽进⽽可以确定反应类型.解答:解:A、由氧化钙在反应前后质量⽐例的变化,反应后氧化钙的质量分数减少,氧化钙应为反应物,故选项说法错误.B、由⼆氧化碳钙在反应前后质量⽐例的变化,反应后⼆氧化碳的质量分数减少,⼆氧化碳应为反应物,故选项说法错误.C、由碳酸钙在反应前后质量⽐例的变化,反应后碳酸钙的质量分数增⼤,碳酸钙应为⽣成物,该反应的反应物是⼆氧化碳和氧化钙,⽣成物是碳酸钙,该反应符合“多变⼀”的特征,属于化合反应,故选项说法错误.D、由C选项的分析,该反应是化合反应,故选项说法正确.故选:D.点评:本题难度不⼤,考查的是质量守恒定律的应⽤,解题的关键是分析图中质量⽐例的变化,灵活运⽤质量守恒定律.难度:容易知识点:化学⽅程式单元测试13.下列化学反应中属于分解反应的是()A.NH3+H2O+CO2=NH4HCO3B.2A1+3H2SO4=A12(SO4)3+3H2↑C.2KMnO4K2MnO4+MnO2+O2↑D.CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓【答案】考点:分解反应及其应⽤.专题:化学反应的基本类型和能量变化.分析:分解反应:⼀种物质反应后⽣成两种或两种以上的物质,其特点可总结为“⼀变多”;据此进⾏分析判断.解答:解:A、NH3+H2O+CO2=NH4HCO3,该反应符合“多变⼀”的特征,属于化合反应,故选项错误.B、2A1+3H2SO4=A12(SO4)3+3H2↑,该反应是⼀种单质和⼀种化合物反应⽣成另⼀种单质和另⼀种化合物的反应,属于置换反应,故选项错误.C、2KMnO4K2MnO4+MnO2+O2↑,该反应符合“⼀变多”的特征,属于分解反应,故选项正确.D、CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓,该反应是两种化合物相互交换成分⽣成两种新的化合物的反应,属于复分解反应,故选项错误.故选:C.点评:本题难度不⼤,掌握分解反应的特征(“⼀变多”)是正确解答本题的关键.难度:容易知识点:如何正确书写化学⽅程式14.下列属于置换反应的是()A.3CO+Fe2O32Fe+3CO2B.CH4+2O2CO2+2H2OC.Zn+H2SO4═ZnSO4+H2↑D.Na2CO3+CaCl2═CaCO3↓+2N aCl【答案】考点:置换反应及其应⽤.专题:化学反应的基本类型和能量变化.分析:置换反应是⼀种单质和⼀种化合物反应⽣成另⼀种单质和另⼀种化合物的反应,据此进⾏分析判断.解答:解:A、3CO+Fe2O32Fe+3CO2,该反应的反应物均为化合物,不属于置换反应,故选项错误.B、CH4+2O2CO2+2H2O,该反应的⽣成物均为化合物,不属于置换反应,故选项错误.C、Zn+H2SO4═ZnSO4+H2↑,该反应是⼀种单质和⼀种化合物反应⽣成另⼀种单质和另⼀种化合物的反应,属于置换反应,故选项正确.D、Na2CO3+CaCl2═CaCO3↓+2NaCl,该反应是两种化合物相互交换成分⽣成两种新的化合物的反应,属于复分解反应,故选项错误.故选:C.点评:本题难度不⼤,掌握置换反应的特征(反应物和⽣成物均是两种,其中⼀种是单质和另⼀种是化合物)是正确解答本题的关键.难度:容易知识点:如何正确书写化学⽅程式⼆、填空题(共3题)1.观察如图并回答问题:由图可知,HCl与NaOH的反应实质是H+ 和OH﹣之间的反应,此反应可表⽰为:H++0H﹣=H2O.像这种⽤实际参与反应的离⼦来表⽰反应的式⼦称为离⼦⽅程式.任何复分解反应都可⽤离⼦⽅程式来表⽰.【练习】按照书写化学⽅程式的要求写出下列反应的离⼦⽅程式HCl溶液与AgNO溶液反应:__________________.HNO3溶液与Na2CO3溶液反应:__________________.【归纳】复分解反应的实质是:阴阳离⼦结合⽣成__________________的反应.【应⽤】判断在⽔溶液中⼀定能⼤量共存的离⼦组是__________________.a、Na+、H+、Cl﹣、CO32﹣b、H+、Ba2+、Cl﹣、SO42﹣c、Cu2+、Na+、NO3﹣、OH﹣d、H+、K+、Cl﹣、SO42﹣.【答案】考点:复分解反应的条件与实质;书写化学⽅程式、⽂字表达式、电离⽅程式.专题:化学反应的基本类型和能量变化.分析:【练习】由题意,⽤实际参与反应的离⼦来表⽰反应的式⼦称为离⼦⽅程式,据此结合反应的实质进⾏分析解答.【归纳】根据复分解反应发⽣的条件,两种物质相互交换成分有沉淀、⽓体或⽔⽣成,进⾏分析解答.【应⽤】根据复分解反应的条件,离⼦间若能互相结合成沉淀、⽓体或⽔,则离⼦不能共存,据此进⾏分析判断即可.解答:解:【练习】盐酸与硝酸银溶液反应⽣成氯化银沉淀和硝酸,反应实质是Ag+和Cl﹣反应⽣成氯化银沉淀,反应的离⼦⽅程式为:Ag++Cl﹣=AgCl↓.硝酸与碳酸钠溶液反应⽣成硝酸钠、⽔和⼆氧化碳,反应实质是H+和CO32﹣反应⽣成⽔和⼆氧化碳,反应的离⼦⽅程式为:2H++CO32﹣=CO2↑+H2O.【归纳】由复分解反应发⽣的条件,两种物质相互交换成分有沉淀、⽓体或⽔⽣成,复分解反应的实质是:阴阳离⼦结合⽣成沉淀、⽓体和⽔.【应⽤】a.H+、CO32﹣两种离⼦能结合成⽔和⼆氧化碳,不能⼤量共存,故选项错误.b.Ba2+、SO42﹣两种离⼦能结合成硫酸钡沉淀,不能⼤量共存,故选项错误.c.Cu2+、OH﹣两种离⼦能结合成氢氧化铜沉淀,不能⼤量共存,故选项错误.d.四种离⼦间不能结合成沉淀、⽓体或⽔,能⼤量共存,故选项正确.故答案为:【练习】Ag++Cl﹣=AgCl↓;2H++CO32﹣=CO2↑+H2O;【归纳】沉淀、⽓体或⽔;[应⽤]d.点评:应能利⽤复分解反应发⽣的条件来判断反应的发⽣,认识复分解反应的实质是离⼦能结合⽣成⽔或⽓体或沉淀.当然要完整解答本题对化学⽤语的熟练掌握是必须的.难度:中等知识点:化学与⽣活单元测试2.如图,初中化学中,我们学习了酸和碱发⽣中和反应的实质是H++OH﹣=H2O.像这种实际参加反应的离⼦符号来表⽰反应的式⼦叫离⼦⽅程式.离⼦⽅程式的书写⼀般按以下步骤:(以Na2SO4与BaCl2反应为例)①写出反应的化学⽅程式:Na2SO4+BaCl2=BaSO4↓+2NaCl②把易溶于⽔、易电解的物质写出离⼦形式,把难溶的物质、⽓体和⽔等仍⽤化学式表⽰.上述⽅程式可改写成:2Na++SO42﹣+Ba2++2Cl﹣=BaSO4↓+2Na++2Cl﹣③删去⽅程式两边不参加反应的离⼦:Ba2++SO=BaSO4↓④检查⽅程式两边各元素的原⼦个数和电荷总数是否相等.请回答:(1)下列各组中的离⼦,能在溶液中⼤量共存的是__________________A.K+H+SO42﹣OH﹣B.Na+Ca2+CO32﹣NO3﹣C.Na+H+Cl﹣CO32﹣D.Na+Cu2+Cl﹣SO42﹣(2)写出稀盐酸滴在⽯灰⽯上所发⽣反应的离⼦⽅程式__________________.(3)写出⼀个与离⼦⽅程式Mg+2H+=Mg2++H2↑相对应的化学⽅程式__________________.(4)酸、碱、盐在⽔溶液中发⽣的复分解反应实质上就是两种化合物在溶液中相互交换离⼦的反应,只要具备⽣成物中有⽓体或沉淀或__________________⽣成,反应就能发⽣.【答案】考点:复分解反应的条件与实质;离⼦或物质的共存问题;书写化学⽅程式、⽂字表达式、电离⽅程式.专题:化学反应的基本类型和能量变化.分析:(1)离⼦之间不反应⽣成⽓体、沉淀、弱电解质或络合物或发⽣氧化还原反应、双⽔解反应的就能共存,据此分析解答.(2)反应⽣成氯化钙、⽔、⼆氧化碳,⽔、⼆氧化碳、碳酸钙在离⼦反应中保留化学式;<br/>(2)反应⽣成KCl和碘,氯⽓、碘在离⼦反应中保留化学式.(3)⾮氧化性的强酸如稀硫酸、稀盐酸与⾦属镁的反应;(4)复分解反应实质上就是两种化合物在溶液中相互交换离⼦的反应,⽣成物中有⽓体或沉淀或⽔;反应就能发⽣.解答:解:(1)A.H+和OH﹣反应⽣⽔,故错误;B.Ca2+和 CO32﹣⽣成碳酸钙沉淀,所以不能共存,故B错误;C.H+和 CO32﹣反应⽣成⼆氧化碳和⽔,故错误;D.这⼏种离⼦之间不反应,所以能⼤量共存,故正确;故选:D;(2)⽯灰⽯和盐酸反应的离⼦反应为:CaCO3+2H+=Ca2++H2O+CO2↑;故填:CaCO3+2H+=Ca2++H2O+CO2↑;(3)与离⼦⽅程式Mg+2H+=Mg2++H2↑相对应的化学⽅程式:Mg+H2SO4=MgSO4+H2↑或Mg+2HCl=MgCl2+H2↑;故填:Mg+H2SO4=MgSO4+H2↑或Mg+2HCl=MgCl2+H2↑.(4)复分解反应实质上就是两种化合物在溶液中相互交换离⼦的反应,⽣成物中有⽓体或沉淀或⽔;反应就能发⽣.故填:⽔.点评:本题考查的是复分解反应的条件和复分解反应的实质,完成此题,可以依据已有的知识进⾏难度:中等知识点:化学与⽣活单元测试3.Fe+CuSO4=Cu+FeSO4是湿法炼铜的原理,属于基本反应类型中的__________________反应,根据化学式,判断该化学反应前后元素化合价升⾼的是__________________元素.【答案】考点:反应类型的判定;有关元素化合价的计算.专题:化学式的计算;化学反应的基本类型和能量变化.分析:根据反应物、⽣成物的种类可以判断反应类型;单质中元素的化合价为零,化合物中元素的化合价代数和为零.解答:解:Fe+CuSO4=Cu+FeSO4中,反应物和⽣成物都是⼀种单质和⼀种化合物,属于置换反应;铁单质中铁元素的化合价为零,硫酸亚铁中,铁元素的化合价是+2,铜单质中铜元素的化合价为零,硫酸铜中铜元素的化合价是+2,因此该化学反应前后元素化合价升⾼的是铁元素.故填:置换;铁.点评:判断反应类型时,要紧紧围绕反应物和⽣成物的种类进⾏分析、判断,从⽽得出正确的结论.难度:容易知识点:如何正确书写化学⽅程式。
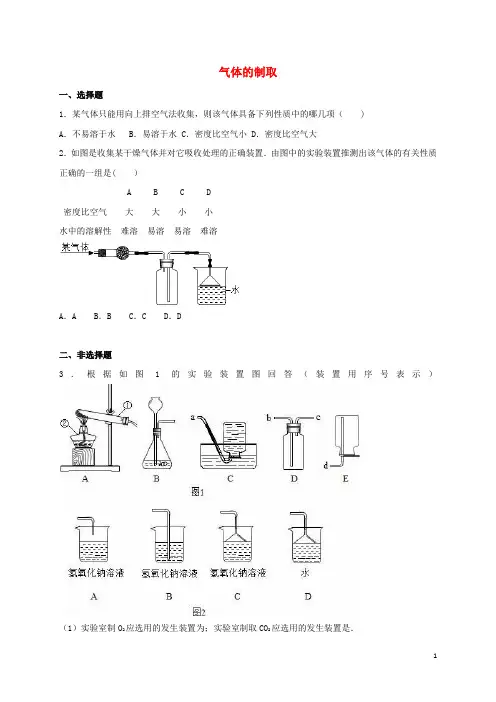
气体的制取一、选择题1.某气体只能用向上排空气法收集,则该气体具备下列性质中的哪几项()A.不易溶于水B.易溶于水 C.密度比空气小 D.密度比空气大2.如图是收集某干燥气体并对它吸收处理的正确装置.由图中的实验装置推测出该气体的有关性质正确的一组是( )A B C D密度比空气大大小小水中的溶解性难溶易溶易溶难溶A.A B.B C.C D.D二、非选择题3.根据如图1的实验装置图回答(装置用序号表示)(1)实验室制O2应选用的发生装置为;实验室制取CO2应选用的发生装置是.(2)硫化氢是一种有毒的气体,其密度比空气大,能溶于水,它的水溶液叫氢硫酸.实验室通常用块状固体硫化亚铁(FeS)与稀硫酸在常温下反应制取H2S气体,制取气体应选用的发生装置是,收集装置是.气体由(填导管口代号)导入集气瓶.(3)如图2处理尾气的效果最好的是.不能应用点燃的方法处理尾气.原因是,反应方程式为.4.有下列几种气体,其性质如下表:A B C D水溶性易溶于水易溶于水难溶于水难溶于水密度比空气大比空气小比空气大比空气小只能用排空法收集的是;既能用排水法,又能用向下排空法收集的是.5.根据下列装置图回答问题.(1)实验室制取氧气选用的装置为 (填写装置代号,下同),反应的化学方程式为.(2)实验室制取氢气选用的装置为,若检验集气瓶中氢气是否收集满,应采取的方法是.6.实验室里常用大理石跟稀盐酸反应来制取二氧化碳,某同学认真研究了课本中的实验装置(如图甲),对其中的气体发生装置部分进行了改进(如图乙).请回答下列问题:(1)说明该同学进行改进的目的:;(2)写出两种检验b中已充满二氧化碳气体的方法:①; ②.7.根据下列装置图回答问题:(1)某气体可利用无水醋酸钠与碱石灰加热反应制得,则应选用的发生装置为(2)实验室用制取氢气,可选用的发生装置是;该装置还能用于制备气体.(3)生成的氢气中混有少量氯化氢和水蒸气.要除去这些杂质,得到纯净、干燥的氢气,则气体通过C、D、E各装置时导管口的连接顺序是:含杂质的氢气→→→→→→(4)若装置E加满水,来测量产生气体的体积,气体应从端进入,还需用到的主要仪器是.8.如图所示,是某同学设计的制取纯净、干燥的C02的气体的装置.回答下列问题:(1)指出图中装置的错误:.(2)B中NaHC03溶液的作用是除掉C02中混有少量HCl气体,C中浓H2SO4的作用是;B中的NaHC03溶液不能换成石灰水,理由是.(3)该同学改正了上述装置中的错误后进行实验时,发现D中C02仍不能集满,可能的原因是:①;②.9.氨(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,氨水显碱性.实验室里加热氯化铵(NH4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水.(1)用化学方程式表示实验室制取氨气的化学反应原理:;(2)实验室里选择气体发生装置和收集装置应考虑哪些因素?最好选用上图哪种气体发生装置制取氨气?;(3)按如图安装好装置后,打开橡皮管上的夹子,将胶头滴管中的少量水挤人盛满干燥氨气的烧瓶中,此时可观察到什么现象?.10.某校自然科学研究性学习小组,在查阅课外资料时,发现过氧化钠(Na202)的化学性质有:①2Na202+2H20═4NaOH+02↑;②2Na202+2C02═2Na2C03+02.为了验证过氧化钠和二氧化碳反应的产物,设计了如下图所示的实验装置.根据实验装置做了如下实验:Ⅰ.关闭,打开,向A中慢慢加入稀盐酸,(填操作),证明反应有02生成.Ⅱ.打开夹子1,关闭夹子2,向C中慢慢加入稀盐酸,反应一会儿后把生成的气体通入装置D中,发现澄清石灰水变浑浊.请回答下列问题:(1)装置B中装的试剂是:;其作用是:.(2)实验Ⅱ中,打开夹子1的目的是:.(3)根据上述事实,过氧化钠的用途有: (写出一种即可).气体的制取参考答案与试题解析一、选择题1.某气体只能用向上排空气法收集,则该气体具备下列性质中的哪几项()A.不易溶于水B.易溶于水 C.密度比空气小 D.密度比空气大【考点】常用气体的收集方法;化学性质与物理性质的差别及应用.【专题】结合课本知识的信息.【分析】只能用向上排空气法收集的气体的密度大于空气的密度,并溶于水或与水反应.【解答】解:某气体只能用向上排空气法收集,说明该气体的溶于水或与水反应,密度大于空气的密度.故答案为:BD【点评】收集气体的方法有排水法和排空气法,不溶于水且不与水反应的气体用排水法收集;排空气法中的向下排气法,适用于密度小于空气密度的气体;向上排空气法,适用于密度大于空气密度的气体.2.如图是收集某干燥气体并对它吸收处理的正确装置.由图中的实验装置推测出该气体的有关性质正确的一组是()A B C D密度比空气大大小小水中的溶解性难溶易溶易溶难溶A.A B.B C.C D.D【考点】化学性质与物理性质的差别及应用;常用气体的收集方法.【专题】压轴实验题;物质的变化与性质.【分析】用排空气收集气体时,密度大于空气的气体采取向上排气法收集,密度小于空气则向下排气法收集;吸收处理气体,一般是把气体通入水中或能与之反应的溶液中,对于极易溶于水的气体,在吸收处理时要防止水倒吸,需要特殊装置,该装置的优点是:增大接触面积,充分吸收气体,还能防止倒吸.【解答】解:图中的收集气体方法:气体从位于集气瓶口的导管进入,瓶中的空气则是从位于瓶底部的导管被排出,这种收集气体的方法也就属于向下排空气法,说明该气体密度小于空气;题图中采取使用漏斗倒扣在水面处吸收处理气体,这一特别的装置能防止水倒吸,说明该气体极易溶于水.故选C.【点评】本题考查了分析实验的能力,从多角度对气体的收集方法进行了综合考查,考虑收集气体的方法时,应该从气体的密度、水溶性等角度进行分析解答.二、非选择题3.根据如图1的实验装置图回答(装置用序号表示)(1)实验室制O2应选用的发生装置为 A ;实验室制取CO2应选用的发生装置是 B .(2)硫化氢是一种有毒的气体,其密度比空气大,能溶于水,它的水溶液叫氢硫酸.实验室通常用块状固体硫化亚铁(FeS)与稀硫酸在常温下反应制取H2S气体,制取气体应选用的发生装置是 B ,收集装置是 D .气体由 b (填导管口代号)导入集气瓶.(3)如图2处理尾气的效果最好的是 C .不能应用点燃的方法处理尾气.原因是硫化氢气体是一种大气污染物,它在点燃条件下,能与空气中的氧气反应生成二氧化硫气体有毒气体,反应方程式为2H2S+3O22SO2+2H2O .【考点】常用气体的发生装置和收集装置与选取方法;实验室制取氧气的反应原理;二氧化碳的实验室制法;书写化学方程式.【专题】常见气体的实验室制法、检验、干燥与净化.【分析】(1)根据实验室制取O2的反应原理是加热高锰酸钾或加热氯酸钾与二氧化锰来制取氧气,属于“固固加热型”可确定发生装置;根据实验室制取CO2的反应原理是碳酸钙与稀盐酸反应生成二氧化碳气体,属于“固液不加热型"可确定发生装置;(2)根据题目信息结合化学方程式的书写分析;根据反应物状态和反应条件选择发生装置,根据生成气体的性质选择收集装置;(3)根据硫化氢和氢氧化钠反应生成盐和水即可,根据硫化氢气体是一种大气污染物,它在点燃条件下,能与空气中的氧气反应生成二氧化硫气体有毒气体解答.【解答】解:(1)实验室制取O2,其反应原理是加热高锰酸钾或加热氯酸钾与二氧化锰来制取氧气,所以应选用的发生装置是A,实验室制取CO2,其反应原理是碳酸钙与稀盐酸反应生成二氧化碳气体,所以应选用的发生装置是B;(2)根据实验室用块状硫化亚铁固体(FeS)和稀硫酸常温反应来制取H2S气体,可知化学反应方程式是:FeS+H2SO4═FeSO4+H2S↑;硫化亚铁和稀硫酸在常温下即可反应,因此可以选用B装置作为发生装置;硫化氢密度比空气大,能溶于水,所以可以用向上排空气法来收集,因此可选D装置;硫化氢气体应从b端导入集气瓶,将空气从c端排出;(3)因硫化氢气体有毒,不能排放到空气中,要对尾气进行处理,硫化氢溶于水是氢硫酸,能与氢氧化钠反应,故可用氢氧化钠溶液吸收.为防止倒吸,应增加吸收面积,可采用倒扣的漏斗,因此应选C;硫化氢气体是一种大气污染物,它在点燃条件下,能与空气中的氧气反应生成二氧化硫气体有毒气体,反应方程式为:2H2S+3O22SO2+2H2O答案:(1)A,B(2)B,D,b(3)C 硫化氢气体是一种大气污染物,它在点燃条件下,能与空气中的氧气反应生成二氧化硫气体有毒气体 2H2S+3O22SO2+2H2O【点评】实验室制取气体的发生装置应根据反应物的状态和反应发生的条件来确定.一般分为两种:①固体与固体反应生成气体,反应需要加热,简称“固固加热型”.选择实验室制取O2的发生装置;②固体与液体反应生成气体,反应不需要加热,简称“固液不加热型”.选择实验室制取CO2的发生装置.4.有下列几种气体,其性质如下表:A B C D水溶性易溶于水易溶于水难溶于水难溶于水密度比空气大比空气小比空气大比空气小只能用排空法收集的是AB ;既能用排水法,又能用向下排空法收集的是 D .【考点】常用气体的收集方法.【专题】常见气体的实验室制法、检验、干燥与净化.【分析】从气体的收集方法与气体的密度有关:密度比空气大且不和空气中的成分发生反应的可用向上排空气法收集,密度比空气小且不和空气中的成分发生反应的可用向下排空气法收集;还与气体的水溶性有关:难溶或不易于水,则可有排水法收集,能溶于水或易溶于水,则不能用排水法收集去分析解答.【解答】解:A、由于A易溶于水,所以不能用排水法收集,密度比空气大,故可用向上排空气法收集;B、由于B易溶于水,所以不能用排水法收集,密度比空气小,故可用向下排空气法收集;C、由于C难溶于水,所以能用排水法收集,密度比空气大,故可用向上排空气法收集;D、由于D难溶于水,所以能用排水法收集,密度比空气小,故可用向下排空气法收集;所以只能用排空气法收集的是:AB;既能用排水法,又能用向下排空法收集的是:D;故答案为:AB D.【点评】气体的收集方法与气体和密度和水溶性有关.5.根据下列装置图回答问题.(1)实验室制取氧气选用的装置为A(填写装置代号,下同),反应的化学方程式为2KClO32KCl+3O2↑.(2)实验室制取氢气选用的装置为 B ,若检验集气瓶中氢气是否收集满,应采取的方法是在导管口收集一试管气体,用拇指堵住管口,移近酒精灯火焰,移开拇指,如果听到尖锐的爆鸣声,说明氢气不纯,没有收集满;如果听到噗噗声,说明氢气是纯净的,已经收集满.【考点】氧气的制取装置;氢气的制取和检验;书写化学方程式.【专题】常见气体的实验室制法、检验、干燥与净化.【分析】(1)氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气;(2)通常情况下,锌和稀硫酸反应生成硫酸锌和氢气,氢气难溶于水,密度比空气小;氢气与空气或氧气混合达到一定程度时,即达到氢气的爆炸极限时,遇明火会发生爆炸.【解答】解:(1)实验室制取氧气应该用A装置制取,因为试管口没有塞一团棉花,应该是利用氯酸钾制取氧气,反应的化学方程式为:2KClO32KCl+3O2↑.故填:A;2KClO32KCl+3O2↑.(2)实验室制取氢气时不需要加热,可以用B装置作为发生装置;检验集气瓶中氢气是否收集满的方法是:在导管口收集一试管气体,用拇指堵住管口,移近酒精灯火焰,移开拇指,如果听到尖锐的爆鸣声,说明氢气不纯,没有收集满;如果听到噗噗声,说明氢气是纯净的,已经收集满.故填:B;在导管口收集一试管气体,用拇指堵住管口,移近酒精灯火焰,移开拇指,如果听到尖锐的爆鸣声,说明氢气不纯,没有收集满;如果听到噗噗声,说明氢气是纯净的,已经收集满.【点评】不能直接通过点燃导管口的气体来检验是否收集满氢气,因为不纯的氢气点燃时也可能发生爆炸,因此要采取科学的方法来检验氢气是否收集满.6.实验室里常用大理石跟稀盐酸反应来制取二氧化碳,某同学认真研究了课本中的实验装置(如图甲),对其中的气体发生装置部分进行了改进(如图乙).请回答下列问题:(1)说明该同学进行改进的目的:使反应容易控制,可随时使反应发生和停止;(2)写出两种检验b中已充满二氧化碳气体的方法:①将燃着的木条放在集气瓶口,看是否熄灭;②将蘸有澄清石灰水的玻璃棒放在集气瓶口,看石灰水是否变浑浊.【考点】二氧化碳的实验室制法;二氧化碳的检验和验满.【专题】常见气体的实验室制法、检验、干燥与净化.【分析】(1)装置乙除用试管代替甲中的锥形瓶外,添加了有孔塑料板,使得固体药品与液体药品可以分离;改变了装置甲中药品一直接触的不足;(2)集气瓶内二氧化碳从瓶底部慢慢充满,收集满时在瓶口有大量二氧化碳,可利用二氧化碳不支持燃烧、能使澄清的石灰水变浑浊的性质检验瓶口的二氧化碳.【解答】解:(1)装置改进后的有孔板可以把固体与液体分离开来,当关闭导管时,装置内压强升高而把液体压回长颈漏斗,使得液体与固体脱离接触反应停止,当打开导管,装置内压强减小,长颈漏斗内液体重新流入装置,液体与固体接触,反应继续;使反应容易控制,可随时使反应发生和停止.(2)验证瓶口充满二氧化碳的方法是:①将燃着的木条放在集气瓶口,看是否熄灭;②将蘸有澄清石灰水的玻璃棒放在集气瓶口,看石灰水是否变浑浊.故答案为:(1)使反应容易控制,可随时使反应发生和停止;(2)①将燃着的木条放在集气瓶口,看是否熄灭;②将蘸有澄清石灰水的玻璃棒放在集气瓶口,看石灰水是否变浑浊.【点评】此题考查实验室制取二氧化碳装置的改进优点,并掌握验满二氧化碳的方法,使用燃烧木条放在瓶口木条熄灭及二氧化碳通常使澄清的石灰水变浑浊的性质即可完成验满操作.7.根据下列装置图回答问题:(1)某气体可利用无水醋酸钠与碱石灰加热反应制得,则应选用的发生装置为 A(2)实验室用制取氢气,可选用的发生装置是 B ;该装置还能用于制备氧气和二氧化碳气体.(3)生成的氢气中混有少量氯化氢和水蒸气.要除去这些杂质,得到纯净、干燥的氢气,则气体通过C、D、E各装置时导管口的连接顺序是:含杂质的氢气→ d → c → a → b → f →e(4)若装置E加满水,来测量产生气体的体积,气体应从 f 端进入,还需用到的主要仪器是量筒.【考点】常用气体的发生装置和收集装置与选取方法;量气装置;气体的净化(除杂);氢气的制取和检验.【专题】常见气体的实验室制法、检验、干燥与净化.【分析】(1)根据反应物的状态和反应条件选择发生装置;(2)据反应物状态和反应条件选择发生装置,该套装置属于固液常温制取气体,结合实验室制取氧气、二氧化碳的方法分析解答;(3)根据浓硫酸的吸水性可以将水蒸气除去,氯化氢需要用碱液进行吸收进行分析,在洗气时注意长进短出的顺序,洗气装置中导管要长进短出,气体从溶液中出来时会带来部分水蒸气,收集时短进解答;(4)排水法收集气体,气体从短管进,水从长管出.洗气时长进短出.【解答】解:(1)用无水醋酸钠和碱石灰的混合固体在加热条件下制取甲烷气体,属于加热固体型,故选发生装置A;(2)实验室利用锌和稀硫酸反应制取氢气,不需要加热,故选发生装置B,该套装置属于固液常温制取气体,实验室利用双氧水制取氧气、利用大理石和稀盐酸制取二氧化碳均可用此发生装置; (3)在洗气时注意长进短出的顺序,洗气装置中导管要长进短出,气体通过氢氧化钠将氯化氢除去,再通过浓硫酸将水蒸气除去,最后只剩氢气,收集时,氢气的密度小于空气,短进,含杂质的氢气dcabfe;(4)当需要测量气体体积时,由于气体的体积无法直接测量,所以需要等量代换的方式,因此将装置内装满水,采取测量液体体积的方式,测量体积需要用量筒,而液体的排出需要气体短进长出.答案:(1)A(2)B 氧气和二氧化碳(3)dcabfe(4)f 量筒【点评】依据反应物的状态和反应条件选择发生装置,依据气体的密度、溶解性,及是否与空气中气体反应或是否与水反应选择收集装置.8.如图所示,是某同学设计的制取纯净、干燥的C02的气体的装置.回答下列问题:(1)指出图中装置的错误:收集二氧化碳的集气瓶中导管应伸到底部.(2)B中NaHC03溶液的作用是除掉C02中混有少量HCl气体,C中浓H2SO4的作用是除去水分;B 中的NaHC03溶液不能换成石灰水,理由是石灰水也可以和二氧化碳反应.(3)该同学改正了上述装置中的错误后进行实验时,发现D中C02仍不能集满,可能的原因是:①装置的气密性不好;②药品的量不足.【考点】二氧化碳的实验室制法;气体的净化(除杂).【专题】常见气体的实验室制法、检验、干燥与净化.【分析】(1)从用向上排空气法收集二氧化碳时,由于二氧化碳的密度比空气大,进入集气瓶后,沉积在集气瓶的底部,二氧化碳自下而上,充满集气瓶去分析解答;(2)浓硫酸具有吸水性,可以除去二氧化碳中的水分;由于石灰水既和二氧化碳反应,又能和氯化氢气体反应去分析解答;(3)如果装置漏气,则在集气瓶中就收集不到二氧化碳;如果药品的量不足,产生的二氧化碳过少,也不能充满集气瓶去分析解答;【解答】解:(1)用向上排空气法收集二氧化碳时,由于二氧化碳的密度比空气大,进入集气瓶后,沉积在集气瓶的底部,二氧化碳自下而上,充满集气瓶,所以导气管应伸入集气瓶的底部;故答案为:收集二氧化碳的集气瓶中导管应伸到底部;(2)浓硫酸具有吸水性,可以除去二氧化碳中的水分;由于石灰水既和二氧化碳反应,又能和氯化氢气体反应,所以不能用石灰水除去二氧化碳中的氯化氢气体;故答案为:除去水分石灰水也和二氧化碳反应;(3)如果装置漏气,则在集气瓶中就收集不到二氧化碳;如果药品的量不足,产生的二氧化碳过少,也不能充满集气瓶;故答案为:装置气密性不好药品的量不足.【点评】用向上排空气法收集气体时,导气管应伸入集气瓶的底部.9.氨(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,氨水显碱性.实验室里加热氯化铵(NH4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水.(1)用化学方程式表示实验室制取氨气的化学反应原理:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O ;(2)实验室里选择气体发生装置和收集装置应考虑哪些因素?最好选用上图哪种气体发生装置制取氨气?反应物的状态和反应的条件,气体的性质或气体的密度、溶解性等,应选用C装置制取氨气;(3)按如图安装好装置后,打开橡皮管上的夹子,将胶头滴管中的少量水挤人盛满干燥氨气的烧瓶中,此时可观察到什么现象?烧杯中的水由玻璃管进入烧瓶,形成喷泉,烧瓶内的液体呈红色,因为氨极易溶于水,氨水显碱性.【考点】常用气体的发生装置和收集装置与选取方法;化学性质与物理性质的差别及应用.【专题】新信息筛选题.【分析】(1)根据题干中的条件:加热氯化铵(NH4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水.写出化学反应式;(2)反应物的状态、反应条件、气体的密度、溶解性等是选择的依据;制取氨气是固固加热反应,据此选择反应装置;(3)从氨气极易溶于水,氨气溶于水后烧瓶中的压强变小,和氨水呈碱性,使酚酞试液变红考虑现象.【解答】解:(1)反应物是氯化铵(NH4Cl)和熟石灰两种固体的混合物,反应条件是加热,生成物是氯化钙和水以及氨(NH3).根据以上条件可写出化学反应式,然后配平即可.故答案为:2NH4Cl+Ca (OH)2=CaCl2+2NH3↑+2H2O(2)实验室里选择气体发生装置和收集装置是由反应物的状态和反应的条件,气体的性质或气体的密度、溶解性等决定的.因制取氨气是固固混合,反应条件是加热,为防止生成的水珠倒流炸裂试管,应选用C装置制取氨气.故答案为:反应物的状态和反应的条件,气体的性质或气体的密度、溶解性等,应选用C装置制取氨气(3)因为氨极易溶于水,打开橡皮管上的夹子,将胶头滴管中的少量水挤人盛满干燥氨气的烧瓶中,氨气溶于水,使烧瓶内的压强变小,烧杯中的水由玻璃管进入烧瓶,形成喷泉.又因氨水显碱性,水中加入了酚酞,所以烧瓶中的液体呈红色.故答案为:烧杯中的水由玻璃管进入烧瓶,形成喷泉,烧瓶内的液体呈红色,因为氨极易溶于水,氨水显碱性.【点评】本题通过试验装置的连接,考查学生的总结能力和对新问题的处理能力.10.某校自然科学研究性学习小组,在查阅课外资料时,发现过氧化钠(Na202)的化学性质有:①2Na202+2H20═4NaOH+02↑;②2Na202+2C02═2Na2C03+02.为了验证过氧化钠和二氧化碳反应的产物,设计了如下图所示的实验装置.根据实验装置做了如下实验:Ⅰ.关闭 1 ,打开 2 ,向A中慢慢加入稀盐酸,用带火星的木条放在C装置的导气管口,带火星的木条复燃(填操作),证明反应有02生成.Ⅱ.打开夹子1,关闭夹子2,向C中慢慢加入稀盐酸,反应一会儿后把生成的气体通入装置D中,发现澄清石灰水变浑浊.请回答下列问题:(1)装置B中装的试剂是:浓硫酸;其作用是:除去二氧化碳中的水蒸气.(2)实验Ⅱ中,打开夹子1的目的是:使装置A中生成的C02及时排出,防止装置内压力过大而发生危险(叙述合理酌情给分).(3)根据上述事实,过氧化钠的用途有:呼吸面具(或潜水艇)中氧气的来源(其他合理答案也给分)(写出一种即可).【考点】实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;二氧化碳的实验室制法.【专题】科学探究.【分析】Ⅰ根据盐酸和碳酸钙反应生成二氧化碳,二氧化碳能和过氧化钠反应生成氧气,氧气具有助燃性,能使带火星的木条复燃进行解答;(1)根据浓硫酸具有吸水性进行解答;(2)从装置内的压力考虑;(3)从过氧化钠能与二氧化碳反应生成氧气考虑.【解答】解:Ⅰ、盐酸和碳酸钙反应生成二氧化碳,二氧化碳能和过氧化钠反应生成氧气,氧气具有助燃性,能使带火星的木条复燃,所以实验操作是:关闭夹子1,打开夹子2,向A中慢慢加入稀盐酸,用带火星的木条放在C装置的导气管口,带火星的木条复燃,证明有反应有02生成;故填:1;2;用带火星的木条放在C装置的导气管口,带火星的木条复燃;(1)浓硫酸具有吸水性,所以装置B中装的试剂是:浓硫酸;其作用是:除去二氧化碳中的水蒸气;故答案为:浓硫酸;除去二氧化碳中的水蒸气;(2)因在实验(一)中A装置中已发生反应,生成二氧化碳气体,关闭夹子2后,生成的气体无法向外排放,聚集到装置内,达到一定的压力会有危险,所以要打开夹子1使装置A中生成的C02及时排出.故答案为:使装置A中生成的C02及时排出,防止装置内压力过大而发生危险(叙述合理酌情给分).(3)根据实验可知过氧化钠能与二氧化碳反应生成氧气,所以过氧化钠可用于呼吸面具(或潜水艇)中氧气的来源.故答案为:呼吸面具(或潜水艇)中氧气的来源(其他合理答案也给分).【点评】本题以实验的形式考查常见物质的反应和常见气体的性质,是对化学基础知识的灵活运用,我们可在学好基础知识的基础上以不变应万变.。

初三化学反应练习题(带答案)
1. 下列物质中,属于化学反应的是()。
a. 水沸腾
b. 钢丝在电炉中熔化
c. 铅在温度逐渐升高时变软
d. 煤在燃烧时冒烟火
答案:d
2. 化学反应中物质的性质会发生()变化。
a. 体积
b. 颜色
c. 温度
d. 纯度
答案:b、c、d
3. 下面哪个不是化学反应中常见的现象()。
a. 出现气体
b. 生成固体
c. 放出光、热
d. 颜色变化
答案:b
4. 以下哪一个不是观察化学反应进行的方法()。
a. 用观察管进行酒精的燃烧实验
b. 用显微镜观察燃烧物质的微粒
c. 用实验室天平观察实验物质的质量变化
d. 用手掌感受燃烧物质产生的热量
答案:b
5. 化学反应后新生成的产物是()。
a. 反应物
b. 臭氧层
c. 产生的多种物质
d. 氮氧化物
答案:c
6. 下列化学反应中,不属于氧化反应的是()。
a. 铁锈生成
b. 酒精燃烧
c. 酸和碱中和反应
d. 碳燃烧
答案:c
7. 下列化学反应中,属于还原反应的是()。
a. 金在氢气中加热变成红色
b. 铁和硫磺发生反应生成黑色物质
c. 氢气与氧气反应生成水
d. 氢气燃烧生成水
答案:a、b、d。
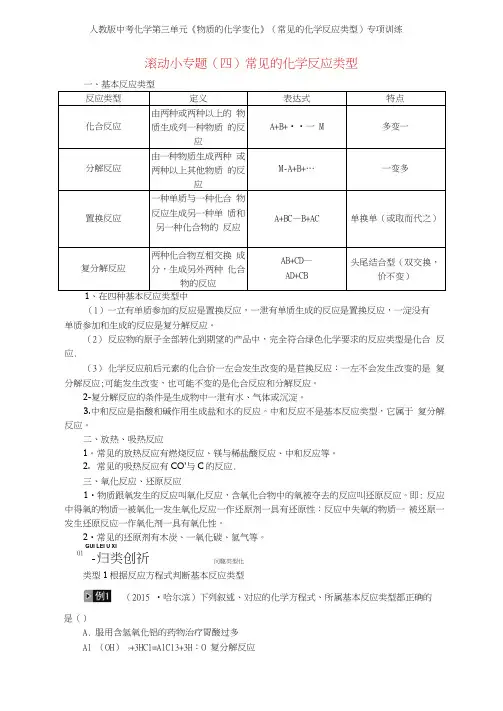
滚动小专题(四)常见的化学反应类型一、基本反应类型 反应类型 定义表达式特点化合反应由两种或两种以上的 物质生成列一种物质 的反应A+B+••一 M多变一分解反应由一种物质生成两种 或两种以上其他物质 的反应M-A+B+…一变多置换反应一种单质与一种化合 物反应生成另一种单 质和另一种化合物的 反应 A+BC —B+AC单换单(或取而代之)复分解反应两种化合物互相交换 成分,生成另外两种 化合物的反应AB+CD — AD+CB头尾结合型(双交换,价不变)、在四种基本反应类型中 (1)一立有单质参加的反应是置换反应,一泄有单质生成的反应是置换反应,一淀没有单质参加和生成的反应是复分解反应。
(2) 反应物的原子全部转化到期望的产品中,完全符合绿色化学要求的反应类型是化合 反应.(3) 化学反应前后元素的化合价一左会发生改变的是苣换反应:一左不会发生改变的是 复分解反应;可能发生改变,也可能不变的是化合反应和分解反应。
2-复分解反应的条件是生成物中一泄有水、气体或沉淀。
3.中和反应是指酸和碱作用生成盐和水的反应。
中和反应不是基本反应类型,它属于 复分解反应。
二、放热、吸热反应1。
常见的放热反应有燃烧反应、镁与稀盐酸反应、中和反应等。
2. 常见的吸热反应有CO’与C 的反应.三、氧化反应、还原反应1•物质跟氧发生的反应叫氧化反应,含氧化合物中的氧被夺去的反应叫还原反应。
即: 反应中得氧的物质一被氧化一发生氧化反应一作还原剂一具有还原性:反应中失氧的物质一 被还原一发生还原反应一作氧化剂一具有氧化性。
2•常见的还原剂有木炭、一氧化碳、氢气等。
类型1根据反应方程式判断基本反应类型(2015 •哈尔滨)下列叙述、对应的化学方程式、所属基本反应类型都正确的是()A. 服用含氢氧化铝的药物治疗胃酸过多 Al (OH ) 3+3HCl=AlC13+3H :O 复分解反应GUI LEI U XI01-归类创祈问駆类型化Bo拉瓦锡研究空气成分2HgO=^=2Hg+0二分解反应C.用天然气作燃料CH-.+0:错误! CO: + 2H=0 氧化反应D.验证铜和铝的活动性3C U+A12(SO:) ,=3CuS0i+2Al 置换反应思路点拨:首先判断叙述或应用是否与原理一致,再看化学方程式书写是否规范,最后判断反应类型是否正确。
1.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质质量如下表,则该密闭容器中发生的化学反应类型为物质甲乙丙丁反应前质量 /g42585反应后质量 /g待测27019A .分解反应B .化合反应C.置换反应D.复分解反应2.钛台金是 2l 世纪的重要材料,工业上制取钛的一个反应是:氩气气氛TiCl 4+2Mg ====Ti高温+2MgCl 2,该反应类型属于A. 化合反应B. 分解反应C.置换反应D. 复分解反应3.氢氟酸可用于在玻璃上雕刻各种精美图案,雕刻过程中发生的反应为:4HF + SiO 2= SiF4↑+2H 2O,该反应属于A. 化合反应B. 分解反应C.置换反应D. 复分解反应4.海藻中含有丰富的碘,“ 2NaI+ Cl 2==2NaCl + I2”是实验室从海藻中提取碘单质的反应方程式,它属于A. 置换反应B. 分解反应C.化合反应D.复分解反应5.右图所示微观变化的化学反应类型,与下列反应的反应类型一致的是MnO 2A . 2KClO 3=2KCl + 3O 2↑△B.2HI +Cl === 2HCl + I2高温C.CO2 + C=2COD. 2HCl + CuO === CuCl 2 + H 2O6.为了解决交通瓶颈制约,我国第六次对铁路列车实行大提速。
提速前须将原有铁路短轨或长轨焊接为超长轨,常用2Al + Fe 2O3Al 2 O3 + 2Fe 这一反应原理来焊接钢轨。
该反应属于A. 化合反应B. 复分解反应C.分解反应D. 置换反应7.以下是某两种物质在一定条件下发生化学反应的微观示意图:(其中和分别表示两种不同的原子)由图可知,下列说法中正确的是①该反应属于化合反应②生成物可能是氧化物③反应遵守质量守恒定律④反应前后分子和原子种类都不变⑤分子在化学变化中可以再分,而原子不能再分A. .①②③⑤ B .①②④⑤C.①③④⑤D.①②③④⑤8.在一密闭容器中有甲、乙、丙、丁四种物质,一定条件下使之反应,一段时间后测得反应前后各物质的质量如下:物质甲乙丙丁反应前质量 /g901082反应后质量 /g1159.2529.7510则该密闭容器中发生的化学反应类型为A .置换反应B .分解反应C.化合反应D.复分解反应9.在一个密闭容器中放入 X 、Y 、 Z、W 四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应的认识不正确的是1.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质质量如下表,则该密闭容器中发生的化学反应类型为物质甲乙丙丁反应前质量 /g42585反应后质量 /g待测27019A .分解反应B .化合反应C.置换反应D.复分解反应2.钛台金是 2l 世纪的重要材料,工业上制取钛的一个反应是:氩气气氛TiCl 4+2Mg ====Ti高温+2MgCl 2,该反应类型属于A. 化合反应B. 分解反应C.置换反应D. 复分解反应3.氢氟酸可用于在玻璃上雕刻各种精美图案,雕刻过程中发生的反应为:4HF + SiO 2= SiF4↑+2H 2O,该反应属于A. 化合反应B. 分解反应C.置换反应D. 复分解反应4.海藻中含有丰富的碘,“ 2NaI+ Cl 2==2NaCl + I2”是实验室从海藻中提取碘单质的反应方程式,它属于A. 置换反应B. 分解反应C.化合反应D.复分解反应5.右图所示微观变化的化学反应类型,与下列反应的反应类型一致的是MnO 2A . 2KClO 3=2KCl + 3O 2↑△B.2HI +Cl === 2HCl + I2高温C.CO2 + C=2COD. 2HCl + CuO === CuCl 2 + H 2O6.为了解决交通瓶颈制约,我国第六次对铁路列车实行大提速。

1.属于分解反应的是()A.B.C.D.2.属于分解反应的是()A.B.C.D.3.一氧化碳和氧化铜反应,体现了一氧化碳具有()A. 可燃性B. 还原性C. 氧化性D. 稳定性4.属于化合反应的是()A.B.C.D.5.“绿色化学”是世纪化学发展的主导方向和理念,其核心要求是从源头上消除污染,减少副产物排放,实现原子利用率达到。
以下化学反应类型中最能体现这一理念的是()A. 分解反应B. 化合反应C. 复分解反应D. 置换反应6. 碳酸钙可以作牙膏中的摩擦剂,如图是用石灰石制备高纯度碳酸钙的流程图。
回答下列问题:(1)步骤②属于________(填“放热”或“吸热”)反应。
7.属于()A. 化合反应B. 分解反应C. 置换反应D. 复分解反应8.化学反应:属于()A. 化合反应B. 分解反应C. 置换反应D. 复分解反应9.生活中常见的下列变化,不属于缓慢氧化的是()A. 钢铁生锈B. 汽油燃烧C. 食物腐败D. 葡萄酿酒10.下列反应属于分解反应的是()A. 硫在氧气中燃烧B. 细铁丝在氧气中燃烧C. 木炭在空气中燃烧D. 加热氯酸钾和二氧化锰混合物制取氧气11.下列反应属于化合反应的是()A. 蜡烛氧气二氧化碳水B. 铁氧气四氧化三铁C. 食盐水食盐水D. 氧化汞氧气汞12.下列反应属于分解反应的是()A. 水氧气氢气B. 铁氧气四氧化三铁C. 铝氧气氧化铝D. 石蜡氧气二氧化碳水13.属于化合反应的是()A.B.C.D.14.属于分解反应的是()A.B.C.D.15.工业炼铁中会发生一氧化碳与氧化铁的反应,该反应中发生还原反应的物质是()A.B.C.D.16.下列反应中属于化合反应的是()A.B.C.D.17.下列说法正确是()A. 氧化反应一定是化合反应B. 氧化反应一定发光放热C. 物质与氧气发生的反应属于氧化反应D. 带火星的木条一定能在含有氧气的集气瓶中复燃18.下列反应,属于分解反应的是()A. 氢气氯气氯化氢B. 蜡烛氧气二氧化碳水C. 过氧化氢水氧气D. 铁氧气四氧化三铁19.我们已经熟知的下列物质中,溶于水时不会放出大量热量的是()A. 生石灰B. 氢氧化钠固体C. 浓硫酸D. 氢氧化钙20.属于分解反应的是()A.B.C.D.参考答案1.【答案】B【知识点】分解反应2.【答案】C【知识点】分解反应3.【答案】B【知识点】氧化还原反应4.【答案】D【知识点】化合反应5.【答案】B【知识点】化合反应6.(1)【答案】放热【知识点】吸放热反应7.【答案】C【知识点】置换反应8.【答案】C【知识点】置换反应9.【答案】B【知识点】缓慢氧化10.【答案】D【知识点】分解反应11.【答案】B【知识点】化合反应12.【答案】A【知识点】分解反应13.【答案】A【知识点】化合反应14.【答案】A【知识点】分解反应15.【答案】B【知识点】氧化还原反应16.【答案】C【知识点】化合反应17.【答案】C【知识点】氧化还原反应18.【答案】C【知识点】分解反应19.【答案】D【知识点】吸放热反应20.【答案】A【知识点】分解反应。

九年级化学反应类型练习题及答案本文将提供九年级化学反应类型练习题及答案,帮助学生巩固和提高对化学反应类型的理解和应用能力。
以下是一些常见的反应类型及相应的练习题,并附有答案供参考。
一、合成反应1. 用化学式表示镁和氧气的反应物和生成物,并写出反应方程式。
答案:反应物:镁(Mg) + 氧气(O₂) 生成物:氧化镁(MgO) 反应方程式:2Mg + O₂ → 2MgO2. 下列哪个是合成反应? A. 2H₂ + O₂ → 2H₂O B. NH₃ + HCl → NH₄Cl C. CaCO₃ → CaO + CO₂ D. CH₄ + 2O₂ → CO₂ + 2H₂O 答案:C. CaCO₃ → CaO + CO₂二、分解反应1. 分解反应是指将一个化合物分解为两个或更多的物质。
写出下列分解反应的反应方程式:a) 碳酸氢钠分解产生二氧化碳和水。
答案:2NaHCO₃ → CO₂ + H₂O + Na₂CO₃b) 氢氧化铜分解产生氧气和铜。
答案:2Cu(OH)₂ → O₂ + 2Cu + 2H₂O2. 下列哪个是分解反应? A. 2H₂ + O₂ → 2H₂O B. NH₃ + HCl → NH₄Cl C. CaCO₃ → CaO + CO₂ D. 2H₂O₂ → 2H₂O + O₂答案:D. 2H₂O₂ → 2H₂O + O₂三、置换反应1. 写出下列置换反应的反应方程式:a) 铁和铜(II)硫酸反应产生铁(II)硫酸和铜。
答案:Fe + CuSO₄ → FeSO₄ + Cub) 锌和盐酸反应产生氢气和氯化锌。
答案:Zn + 2HCl → H₂ + ZnCl₂2. 下列哪个是置换反应? A. 2H₂ + O₂ → 2H₂O B. 2Na + Cl₂ → 2NaCl C. CaCO₃ → CaO + CO₂ D. 2HCl + NaOH → NaCl + 2H₂O 答案:B. 2Na + Cl₂ → 2NaCl四、双替反应1. 双替反应是指两个化合物中的阳离子和阴离子交换位置,生成两个新的化合物。

化学反应的特征及类型一、选择题1.下图表示某个化学反应,据图分析判断,下列各项中,正确的是A.该反应属于置换反应B.反应中乙、丙两物质质量比为2∶1C.图示中x的数值为4D.反应前后氢元素的化合价没有发生改变【答案】AC2.生活中的下列变化,属于物理变化的是【答案】C3.在Cu2(OH)2CO3→CuO→CuCl2→Cu(OH)2各步转化的化学反应中,不包括的化学反应基本类型是__、__ A.化合反应 B.分解反应 C.置换反应 D.复分解反应.【答案】 A C4.某两种物质在一定条件下能发生化学反应,其微观示意图如下:(说明:一种小球代表一种元素的原子)则下列说法中正确的是A.图示中反应共有八种物质 B.该反应属于复分解反应C.图示中的反应有化合价的变化 D.此化学反应符合质量守恒定律【答案】CD5.乙醇俗称酒精,有关乙醇性质的描述中属于化学性质的是A.无色液体 B.挥发性 C.与水能互溶 D.可燃性【答案】D6.对于化学反应A+B=C+D ,下列说法错误的是()A.若A、B为化合物,该反应一定是复分解反应B.若A、C为单质,B、D为化合物,该反应一定是置换反应C.若A为可溶性碱,B为可溶性盐,则C和D可能是两种沉淀物D.若C、D为盐和水,则该反应一定是中和反应【答案】AD7.下列变化中,与其他变化有根本区别的是A.樟脑丸放在衣橱中消失 B.木材做成课桌 C.食物腐败 D.石蜡熔化【答案】C8.通过下列反应,无法得到单质的是( )A.分解反应 B.置换反应 C.化合反应 D.复分解反应【答案】CD9.下列关于各物质的叙述中,其中属于物质的化学性质的是( )A.铁在潮湿的空气中易生锈 B.石蜡受热会熔化C.酒精容易挥发 D.氧气能变成淡蓝色液氧【答案】A10.下列有关生活事件中,从物质变化的角度分析,主要体现化学变化的是()A.浯溪碑林雕刻 B.用葡萄酿酒 C.羊角塘鞭炮爆炸 D.铁杵磨成针【答案】BC11.下列描述能体现出该物质的物理性质的是( )A.氧气用于气焊 B.氢气用作高能洁净的燃料C.金刚石用来裁玻璃 D.铜用于制作电线E.酒精要密封保存 F.澄清的石灰水可用于检验二氧化碳气体【答案】CDE12.打雷放电时,空气中有极少的氧气(O2)会转变成臭氧(O3),氧气(O2)和臭氧(O3),以下说法错误的是A.该变化是物理变化 B.该变化是化学变化C.氧气和臭氧是同一种物质 D.氧气和臭氧是两种不同的物质【答案】AC13.下列有关反应方程式正确,且反应前后有元素化合价升高和降低的是()A.铁和盐酸混合:2Fe+6HCl=2FeCl3+3H2↑B.碳酸铵与硫酸反应:(NH4)2CO3+H2SO4=(NH4)2SO4+H2O+CO2↑C.石英和纯碱高温:SiO2+Na2CO3高温Na2SiO3+CO2↑D.磁铁矿(Fe3O4)高温下同CO:Fe3O4+4CO 高温3Fe+4CO2【答案】D14.下列反应属于复分解反应的是A.CO2+ H2O==H2CO3 B.2HC1 +Ca(OH)2=CaCl2+ 2H2OC.2KMnO 4K2MnO4+MnO2+O2↑ D.2Na+2H2O==2NaOH + H2↑【答案】B15.工业上可用如下反应侧取金属钡:2Al+4BaO3Ba↑+Ba(AlO2)2。
第7章例1 写出下列反应的化学方程式,并在括号内注明基本反应类型:(1)硫在氧气里燃烧:,( )反应。
(2)过氧化氢溶液中加入二氧化锰:,( )反应。
(3)氢氧化钠溶液中加入稀盐酸:,( )反应。
(4)澄清石灰水和碳酸钠溶液混合:,( )反应。
例2A~E是五种不同类别的常见物质:铁、二氧化碳、氢氧化钙、氯化铜、硫酸中的某一种,B常用于中和酸性土壤,E属于酸类。
它们之间的相互关系如右图所示(其中实线表示物质间可以相互反应,虚线表示物质间不能反应)。
请回答下列问题:(1)E的化学式为,B与E反应的化学方程式为,该反应的类型是反应。
(2)C与D反应的化学方程式为(3)虚线相邻物质间存在转化关系的是→(填化学式)。
1.下列化学反应属于右边关系图中阴影部分的是()A.CuO+CO 加热Cu+CO2B.2H2O 通电2H2↑+O2↑C.CaO+H2O ==Ca(OH)2D.2NaOH+H2SO4 == Na2SO4+2H2O2.从海水中提取碘,有如下化学反应:2NaI+Cl2==2NaCl+I2,这一反应所属类型是()A.化合反应B.复分解反应C.置换反应D.分解反应3.下列反应属于复分解反应的是()A.C+O2CO2B.CO+CuO Cu+CO2C.2H2O 2H2↑+O2↑D.HCl+NaHCO3 ==NaCl+CO2↑+H2O4.质量守恒定律是化学反应中的重要规律,我能运用此规律解答下列问题:(1)某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2==2CO2+3H2O(反应条件已略去),则X的化学式为。
(2)在催化剂并加热的条件下,A与B反应生成C和D。
反应前后分子变化的微观示意图如下所示:①下列说法正确的是(填序号)a.该反应类型为置换反应b.4种物质中只有D属于氧化物c.反应前后,氮元素化合价升高d.化学反应中分子可以再分,而原子不能②该反应的化学方程式为5.写出下列反应的化学方程式,并注明反应的基本类型。
化学基本反应类型练习题一、选择题1. 下列反应中,属于化合反应的是:A. Zn + H2SO4 → ZnSO4 + H2↑B. 2H2O → 2H2↑ + O2↑C. CaO + H2O → Ca(OH)2D. CuSO4 + 5H2O → CuSO4·5H2O2. 下列反应中,属于分解反应的是:A. 2H2 + O2 → 2H2OB. CaCO3 → CaO + CO2↑C. 2KClO3 → 2KCl + 3O2↑D. NaOH + HCl → NaCl + H2O3. 下列反应中,属于置换反应的是:A. H2 + Cl2 → 2HClB. Cu + 2AgNO3 → Cu(NO3)2 + 2AgC. CaO + H2O → Ca(OH)2D. NaOH + HCl → NaCl + H2O二、填空题1. 在反应2Mg + O2 → 2MgO中,反应物是______,物是______,这是一种______反应。
2. 在反应H2O → 2H2↑ + O2↑中,反应物是______,物是______,这是一种______反应。
3. 在反应Zn + CuSO4 → ZnSO4 + Cu中,反应物是______,物是______,这是一种______反应。
三、判断题1. 所有化合反应都是多变一的反应。
()2. 置换反应的反应物和物都是一种单质和一种化合物。
()四、简答题1. 请写出两个化合反应的实例。
2. 请写出两个分解反应的实例。
3. 请写出两个置换反应的实例。
五、实验题1. 设计一个实验,验证镁与氧气反应氧化镁。
2. 设计一个实验,验证水的分解反应。
3. 设计一个实验,验证铁与硫酸铜溶液的置换反应。
六、配平化学方程式题(1) H2 + O2 → H2O(2) KClO3 → KCl + O2(3) Zn + H2SO4 → ZnSO4 + H2(1) N2 + H2 → NH3(2) Pb(NO3)2 → PbO + NO2 + O2(3) Al + Fe2O3 → Al2O3 + Fe七、归类题将下列反应归类为化合反应、分解反应、置换反应或复分解反应:1. 2H2 + O2 → 2H2O2. CaCO3 → CaO + CO2↑3. Zn + CuSO4 → ZnSO4 + Cu4. NaOH + HCl → NaCl + H2O5. 2KClO3 → 2KCl + 3O2↑八、推断题1. 某金属与稀硫酸反应,氢气和一种盐。
基础化学练习题2017预备部分化学计量(⼀)选择题1.下列符号中表⽰物质的量的符号是()(A) mol (B) n (C) mol·L -1 (D) c2.⽤N A 代表阿伏加德罗常数,下列说法正确的是()(A) 0.5 mol Al 与⾜量盐酸反应转移电⼦数为1 N A(B) 标准状况下,11.2 L SO 3所含的分⼦数为0.5 N A(C) 0.1 mol CH 4所含的电⼦数为1 N A(D) 46 g NO 2和N 2O 4的混合物含有的电⼦数为1 N A3.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH =1,c (Al 3+)=0.4 mol·L -1,c (SO 42-)=0.8 mol·L -1,则c (K +)为()mol·L -1(A) 0.15 (B) 0.2 (C) 0.3 (D) 0.44.混合⽓体某组分的摩尔分数与体积分数在数值上的关系是()(A) 成正⽐ (B) 相等(C) 成反⽐ (D) 既不相等也不成⽐例,但有⼀定关系5.反应)()(21)(23322g NH g N g H →+,当反应进度ξ=1mol 时,意味着() (A) 反应掉1mol H 2 (B) 反应掉1mol N 2(C) ⽣成1 mol NH 3 (D) 反应掉N 2和H 2共1 mol(⼆)填空题1.将5.00g NaOH 、CaCl 2、NaCl 分别置于⽔中,配成500 mL 溶液,则(1)c (NaOH) =()mol·L -1;(2)c (1/2CaCl 2) =()mol·L -1 ;(3)c(NaCl) = ( ) mol·L -1。
2.每100ml ⾎浆含K +和Cl - 分别为20.0mg 和366.0mg ,则⾎浆中c (K +)=()mmol·L -1;c (Cl -)=()mmol·L -1。
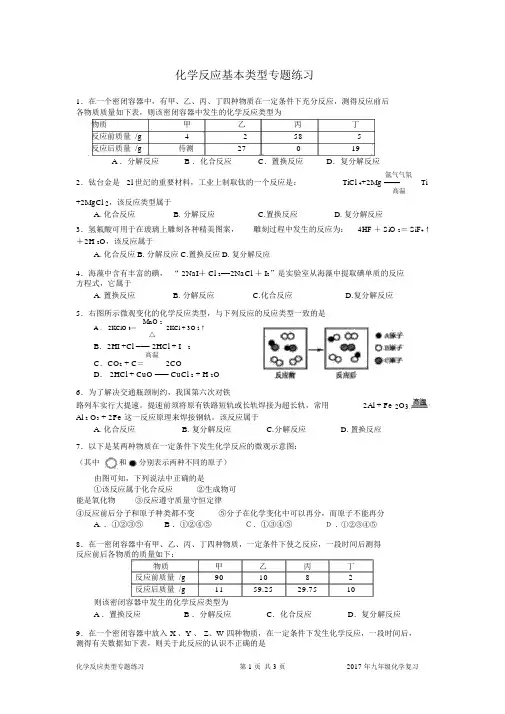
化学反应基本类型专题练习
1.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质质量如下表,则该密闭容器中发生的化学反应类型为
物质甲乙丙丁
反应前质量/g
42585反应后质量/g 待测
27019 A .分解反应 B .化合反应 C .置换反应 D .复分解反应
2.钛台金是2l 世纪的重要材料,工业上制取钛的一个反应是:TiCl 4+2Mg Ti 氩气气氛 ==== 高温
+2MgCl 2,该反应类型属于
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
3.氢氟酸可用于在玻璃上雕刻各种精美图案,雕刻过程中发生的反应为:4HF +SiO 2=SiF 4↑
+2H 2O ,该反应属于
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
4.海藻中含有丰富的碘,“2NaI +Cl 2==2NaCl +I 2”是实验室从海藻中提取碘单质的反应方
程式,它属于
A.置换反应
B.分解反应
C.化合反应
D.复分解反应
5.右图所示微观变化的化学反应类型,与下列反应的反应类型一致的是
A .2KClO 32KCl + 3O 2↑MnO 2
= △B .2HI +Cl === 2HCl + I 2
C .CO 2 + C 2CO 高温
=D .2HCl + CuO === CuCl 2 + H 2O 6.为了解决交通瓶颈制约,我国第六次对铁
路列车实行大提速。
提速前须将原有铁路短轨或长轨焊接为超长轨,常用2Al + Fe 2O 3
Al 2O 3 + 2Fe 这一反应原理来焊接钢轨。
该反应属于
A.化合反应
B.复分解反应
C.分解反应
D.置换反应
7.以下是某两种物质在一定条件下发生化学反应的微观示意图:
(其中
和分别表示两种不同的原
子)
由图可知,下列说法中正确的是
①该反应属于化合反应 ②生成物可能
是氧化物 ③反应遵守质量守恒定律 ④反应前后分子和原子种类都不变 ⑤分子在化学变
化中可以再分,而原子不能再分
A..①②③⑤B .①②④⑤ C.①③④⑤ D. ①②③④⑤
8.在一密闭容器中有甲、乙、丙、丁四种物质,一定条件下使之反应,一段时间后测得反应前后各物质的质量如下:
物质甲乙丙丁
反应前质量/g
901082反应后质量/g 1159.2529.7510
则该密闭容器中发生的化学反应类型为
A .置换反应
B .分解反应
C .化合反应
D .复分解反应
9.在一个密闭容器中放入X 、Y 、Z 、W 四种物质,在一定条件下发生化学反应,一段时间
后,测得有关数据如下表,则关于此反应的认识不正确的是
物 质
X Y Z W 反应前的质量(g )
211616反应后的质量(g )
17m 611 A .物质Y 可能是该反应的催化剂 B .该反应为复分解反应
C .反应后Z 和Y 的质量比为6:1
D .反应的Z 和W 的质量比为2:1
10.在一个密闭容器中放入W 、G 、H 、P 四种物质,在一定条件下发生化学反应,一段时
间后,测得有关数据如下表,关于此反应的认识不正确的是
物质
W G H P 反应前质量/g
181232反应后质量/g 待测
26212A .物质H 一定是该反应的催化剂 B .该反应一定是化合反应
C .在反应物和生成物中,G 、P 的质量比为4:5
D .待测值为13
11.在一个密闭容器内有X 、Y 、Z 、Q 四种物质,在一定条件下充分反应,测得反应前后
各物质的质量如下表,试判断该密闭容器中发生的反应属于
物质
X Y Z Q 反应前质量/g
22785反应后质量/g 待测
24014A .分解反应B .置换反应C .化合反应D .复分解反应
12.小林查阅资料获得有关物质燃烧的新信息:(1)2Na+C122NaCl (2)2Mg+CO 2点燃
=2MgO+C 。
由此形成以下几点认识,其中正确的是:点燃
== ①反应(2)属于置换反应
②工业上常用反应(1)生产食盐 ③燃烧不一定要有氧气参与
④使用CO :灭火应有所选择 A .只有①②④ B .只有①④ C .只有①③④ D .只有②⑨
13.初中化学反应的基本类型包括:化合反应、分解反应、置换反应和复分解反应。
下列反
应属于分解反应的是
A.Fe + CuSO 4===FeSO 4 + Cu
B . 2H 2O 2H 2↑+ O 2↑通电 ==C.CaO + H 2O ===Ca(OH)2
D. NaOH + HCl ===NaCl + H 2O 14.我国首只火星探测器“萤火一号”将踏上访问火星的旅程,其重要部件太阳能帆板使用的高纯硅制备原理是:2H 2+SiCl 4 Si+4HCl 。
该反应属于
高温 ==A .化合反应 B .置换反应 C .分解反应D .复分解反应
15.汽车尾气中的CO 在四氧化三钴(Co 3O 4)纳米棒的催化作用下,低温即与O 2反应生成
CO 2。
下列关于该反应的说法中,不正确的是
A.反应类型为化合反应
B.可降低汽车尾气对大气的污染
C.反应前后Co 3O 4质量改变
D. 反应前后碳元素的化合价改变
16.某两种物质在一定条件下会发生化学反应,其微观示意图如下,则下列说正确的是
A .图示中共有两种原子
B. 图示中的反应物都是单质
C.反应后物质质量增加
D.该反应不属于置换反应
答案:1.A ;2.C ;3.D ;4.A ;5.B ;6.D ;7.A ;8.B ;9.B ;10.A ,C ;11.A ;12.C ;13.B ;14.B ;15.C ;16.D ;
(说明:一种小球代表一种原子)
“”
“”
At the end, Xiao Bian gives you a passage. Minand once said, "people who learn to learn are very happy people.". In every wonderful life, learning is an eternal theme. As a professional clerical and teaching position, I understand the importance of continuous learning, "life is diligent, nothing can be gained", only continuous learning can achieve better self. Only by constantly learning and mastering the latest relevant knowledge, can employees from all walks of life keep up with the pace of enterprise development and innovate to meet the needs of the market. This document is also edited by my studio professionals, there may be errors in the document, if there are errors, please correct, thank you!。