材料科学基础 第二章 固体材料的结构
- 格式:pdf
- 大小:1.90 MB
- 文档页数:51





《材料科学基础》总结及重点第一章 材料的结构与键合1、金属键、离子键、共价键、分子键(范德华力)、氢键的特点,并解释材料的一些性能特点。
2、原子间的结合键对材料性能的影响。
用金属键的特征解释金属材料的性能—①良好的延展性;②良好的导电、导热性;③具有金属光泽。
3、比较金属材料、陶瓷材料、高分子材料、复合材料在结合键上的差别。
本章重要知识点: 1. 金属键、离子键、共价键、分子键、氢键的特点。
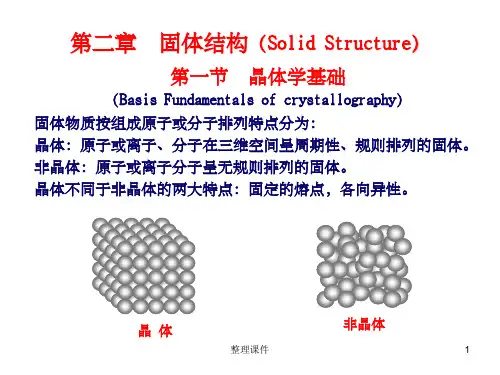
第二章 固体结构1、晶体与非晶体(在原子排列上的区别)2、空间点阵、晶格、晶胞及选取晶胞的的原则、七大晶系及各自的特点,布拉菲点阵(14种) 、晶格常数、晶胞原子数。
3、晶面指数、晶面族、晶向指数、晶向族、晶带和晶带定理、晶面间距、配位数、致密度、八面体间隙、四面体间隙。
各向同性与各向异性、实际晶体的伪各向异性、同素异构转变(重结晶、多晶型性转变) 。
(1)指数相同的晶向.和晶面必然垂直。
如[111]⊥(111)(2)当一晶向[uvw]位于或平行某一晶面(hkl )时,则必然满足晶带定理:h ·w+k ·v+l ·w =04、能绘出三维的体心、面心立方和密排六方晶胞,根据原子半径计算出金属的体心和面心立方晶胞的晶胞常数。
三种典型晶体结构的特征(包括:晶胞形状、晶格常数、晶胞原子数、原子半径、配位数、致密度、各类间隙尺寸与个数,最密排面(滑移面)和最密排方向的指数与个数,滑移系数目等);即:bcc 、fcc 、hcp 的晶格特征及变形能力(结合塑性变形一章的内容你必须知道常用金属材料的滑移面与滑移系的指数)。
给画出晶胞指出滑移面和滑移方向。
能标注和会求上述三种晶胞的晶向和晶面指数。
晶向和晶面指数的一些规律。
求晶面间距d (hkl )、晶面夹角。
5、晶面间距:d (hkl ) 的求法:(1)立方晶系:222)(l k h ad hkl ++= (2)正交晶系:222)(1⎪⎭⎫ ⎝⎛+⎪⎭⎫ ⎝⎛+⎪⎭⎫ ⎝⎛=c l b k a h d hkl (3)六方晶系:2222)()(341⎪⎭⎫ ⎝⎛+++=c l a k hk h d hkl (4)四方晶系:2222)()/(/)(1c l a k h d hkl ++=以上公式仅适用于简单晶胞,复杂晶胞要考虑其晶面层数的增加。

第 2 章结晶结构一、名词解释1.晶体:晶体是内部质点在三维空间内周期性重复排列,具有格子构造的固体2.空间点阵与晶胞:空间点阵是几何点在三维空间内周期性的重复排列晶胞:反应晶体周期性和对称性的最小单元3.配位数与配位多面体:化合物中中心原子周围的配位原子个数成配位关系的原子或离子连线所构成的几何多面体4.离子极化:在离子化合物中,正、负离子的电子云分布在对方离子的电场作用下,发生变形的现象5.同质多晶与类质同晶:同一物质在不同的热力学条件下具有不同的晶体结构化学成分相类似物质的在相同的热力学条件下具有相同的晶体结构6.正尖晶石与反尖晶石:正尖晶石是指2价阳离子全部填充于四面体空隙中,3价阳离子全部填充于八面体空隙中。
反尖晶石是指2价阳离子全部填充于八面体空隙中,3价阳离子一半填充于八面体空隙中,一半填充于四面体空隙。
二、填空与选择1.晶体的基本性质有五种:对称性,异相性,均一性,自限性和稳定性(最小内能性)。
2.空间点阵是由 C 在空间作有规律的重复排列。
( A 原子 B离子 C几何点 D分子)3.在等大球体的最紧密堆积中有面心立方密堆积和六方密堆积二种排列方式,前者的堆积方式是以(111)面进行堆积,后者的堆积方式是以(001)面进行堆积。
4.如晶体按立方紧密堆积,单位晶胞中原子的个数为 4 ,八面体空隙数为 4 ,四面体空隙数为 8 ;如按六方紧密堆积,单位晶胞中原子的个数为 6 ,八面体空隙数为6 ,四面体空隙数为 12 ;如按体心立方近似密堆积,单位晶胞中原子的个数为 2 ,八面体空隙数为 12 ,四面体空隙数为 6 。
5.等径球体最紧密堆积的空隙有两种:四面体空隙和八面体空隙。
一个球的周围有 8个四面体空隙、 6 个八面体空隙;n个等径球体做最紧密堆积时可形成 2n 个四面体空隙、 n 个八面体空隙。
不等径球体进行堆积时,大球做最紧密堆积或近似密堆积,小球填充于空隙中。
6.在离子晶体中,配置于正离子周围的负离子数(即负离子配位数),决定于正、负离子半径比(r +/r -)。



第2章 固体材料的结构一、选择题1.空间电子的意义为()。
[浙江大学2006研]A.晶体中杂质原子的分布规律B.晶体中原子或分子的空间规则排列C.晶体中与原子或分子的电荷空间分布规律【答案】B2.间隙相和间隙固溶体的区别在于()。
[东南大学2005研]A.间隙相的结构比间隙固溶体简单B.间隙相中原子结合符合化合价规律,间隙固溶体不符合化合价规律C.间隙固溶体中间隙原子在溶剂晶格的间隙中,间隙相中原子在正常原子位上D.间隙相中有点阵畸变,间隙固溶体中没有点阵畸变【答案】C3.离子晶体通常借助表面离子的极化变形和重排来降低其表面能,对于下列离子晶体的表面能,最小的是()。
[南京工业大学2008研]A.CaF2B.PbF2C.Pbl2D.BaSO4E.SrSO4【答案】C二、填空题1.材料的结合键决定其弹性模量的高低。
氧化物陶瓷材料以______键为主,结合键______故其弹性模量______;金属材料以______键为主,结合键______故其弹性模量______;高分子材料的分子链上是______键,分子链之间是______键,故其弹性模量______。
【答案】离子;较强;较高;金属;较弱;较低;共价;分子;最低2.固溶体中,当溶质原子和溶剂原子分别占据固定位置,且每个晶胞中溶质原子和溶剂原子数之比一定时,这种有序结构被称为______。
[北京工业大学2009研]【答案】超点阵3.形成有序固溶体的必要条件是:______、______、______。
[中南大学2003研]【答案】异类原子之间相互吸引力大于同类原子之间吸引力;一定的化学成分;较慢的冷却速度4.无序固溶体转变为有序固溶体时,合金性能变化的一般规律是:强度和硬度______,塑性______,导电性______。
[中南大学2003研]【答案】升高;降低;降低三、判断题1.固溶体是一种溶解了杂质组分的非晶态固体。
[中南大学2004研]【答案】×2.形成连续固溶体的最主要条件是溶质和溶剂的晶体结构要一致,例如,银和铝都具有面心立方结构。
北京科技大学材料科学与工程专业814 材料科学基础主讲人:薛老师第二章固体结构例题讲解1.什么是晶面族?立方晶系{111}晶面族包含哪些晶面?答:在晶体内凡是晶面间距和晶面上的原子分布完全相同,只是空间位向不同的晶面我们可以把它们归并为同一个晶面族中,即晶面族,用{hkl}表示。
立方晶系{111}包括:(111)(111)(111)(111)(111)(111)(111)(111),这八个晶面构成一个八面体,因此晶面族{111}也成为八面体的面。
2.面心立方结构(100)和(111)晶面的夹角是多少?{100}的面间距是多少?答:(1) 所以:222222321321332211,cos b b b a a a b a b a b a ba b a b a ++⨯++++=⨯⨯>=<31111001101011cos 222222=++++⨯+⨯+⨯=ϕ︒==7.5431cos arc ϕ晶面的位向表示方法!!(2)面心立方,晶面间距:晶面为{100},则带入公式,得到d=a,(a 最好自己设一下)因为是立方晶系需要对晶面进行判断是否需要修复!!面心立方h 、k 、l 不全为奇数或者偶数时,需要修正,可知,该晶面需要修正所以:d=a/2.222)()()h (d l k a hkl ++=3.晶带定律的应用例:已知晶体中两个不平行的晶面(h1k1l1)(h2k2l2),证明(h3k3l3)与这两个晶面属于同一晶带,其中h3=h2+h1,k3=k2+k1,l3=l2+l1.答:设两个不平行的晶面所属晶带的晶带轴为[uvw]。
根据晶带定律,带入已知条件得到:h1u+k1v+l1w=0,h2u+k2v+l2w=0移项相加,得:(h1+h2)u+(k1+k2)v+(l1+l2)w=0,带入题目中的已知条件,可以得到h3u+k3v+l3w=0所以,第三个晶面与前面两个晶面属于同一个晶带。
例:在体心立方晶胞中画出一个最密排方向,并标明晶向指数,再画出过该方向的两个不同的低指数晶面,写出对应的晶面指数,这两个晶面与晶向构成什么关系?xzy G FE DOCBA注意点:1.画图一定要清洗,最好分开类画2.选取晶向的时候一定要选择对后期选择晶面有利的晶向3.回答晶带时,最好加上什么是晶带定律?4.六方晶系晶面、晶向指数例:写出图中六方晶胞EFGHIJE的晶面指数,以及EF,FG,GH,HI,IJ,JE 各晶向的晶向指数。
第二章固体材料的结构固体材料的各种性质主要取决于它的晶体结构。
原子之间的作用
结合键与晶体结构密切相关。
通过研究固体材料的结构可以最直接、最有效地确定结合键的类型和特征。
固体材料主要包括:金属、合金、非金属、离子晶体、陶瓷
研究方法:X光、电子、中子衍射——最重要、应用最多
§2-1 结合键
结合键——原子结合成分子或固体的
结合键决定了物质的物理、化学、力学性质。
一切原子之间的结合力都起源于原子核与电子间的静电交互作用(库仑力)。
不同的结合键代表了实现
结构)的不同方式。
一、离子键
典型的金属与典型的非金属元素就是通过离子键而化合的。
从而形成离子化合物或离子晶体
由共价键方向性特点决定了的SiO2四面体晶体结构
极性共价键非极性共价键
五、氢键
含有氢的分子都是通过极性共价键结合,极性分子之间结合成晶体时,通过氢键结合。
例如:H 2O ,HF ,NH 3等
固态冰
液态水
§2-2 金属原子间的结合能一、原子作用模型
固态金属相邻二个原子之间
存在两种相互作用:
a) 相互吸引——自由电子吸引
金属正离子,长程力;
b) 相互排斥——金属正离子之
间的相互排斥,短程力。
平衡时这二个力相互抵消,
原子受力为0,原子处于能量最
低状态。
此时原子间的距离为
r0。
§2-3 合金相结构
基本概念
♦合金——由两种或两种以上的金属或金属非金属元素通过化学键结合而组成的具有金属特性的材料。
♦组元、元——组成合金的元素。
♦相——具有相同的成分或连续变化、结构和性能的区域。
♦组织——合金发生转变(反应)的结果,可以包含若干个不同的相,一般只有一到二个相。
♦合金成分表示法:
(1) 重量(质量)百分数
A-B二元合金为例
m B——元素B的重量(质量
m A——元素A的重量(质量
合金中的相分为:固溶体,化合物两大类。
固溶体
金属晶体(溶剂)中溶入了其它元素(溶质)后,就称为固溶体。
一、固溶体的分类:
♦按溶质原子在溶剂中的位置分为:
置换固溶体,间隙固溶体
♦按溶解度分为:
有限固溶体,无限固溶体
♦按溶质原子在溶剂中的分布规律分为:
有序固溶体,无序固溶体
置换固溶体:溶质原子置换了溶剂点阵中部分溶剂原子。
间隙固溶体:溶质原子分布于溶剂晶格间隙中。
固溶体的两种类型(置换和间隙)
1.溶剂原子的分布完全随机,完全无序
2.若同类原子结合力较强,会产生溶质原子的偏聚
3.若异类原子的结合力较强,则溶质原子趋于以异类原子为邻的短程有序分布
完全无序偏聚短程有序
二、影响置换固溶体溶解度的因素
1.晶体结构因素
类型相同,溶解度大。
当原子半径相近时,甚至可以无限互溶。
如Cu-Ni合金。
2.原子尺寸因素
溶剂、溶质原子尺寸差别越小,溶解度越大。
3.电负性因素
溶剂、溶质原子的电负性相差越大,化学亲和力越大,溶解度越小。
因为容易形成化合物。
置换固溶体大小溶质原子引起的点阵畸变
溶入同量溶质原子时,△R越大,引起的晶格畸变越大,畸变
能越高,极限溶解度就越小
间隙固溶体示意图1
间隙固溶体中的点阵畸变
五、固溶强化
晶格畸变处的原子偏离了平衡位置,造成内能增大,产生应力场,结果使溶剂晶体的强度、硬度提高。
这种效应称为固溶强化。
固溶强化的原理在生产实践中应用非常广泛。
如,工程上实际使用的金属材料几乎都是合金,而不使用纯金属。
金属间化合物
金属间化合物是指金属与金属元素、金属与非金属元素结合而成的化合物。
1、特点
♦晶体结构不同于任一组元,一般较为复杂;
♦可以用化学式表示:A m B n;
♦仍具有金属的性质,但各种性能都不同于其组元;
一般规律:熔点高,硬度高,脆性大。
2、分类
♦价化合物——电负性是决定因素
♦电子化合物——电子浓度是决定因素
♦间隙化合物——原子尺寸是决定因素
ZrH
2
§2-4 离子化合物一、AB型离子化合物
♦NaCl型结构(岩盐结构)Cl-离子FCC点阵的结点,Na 位于八面体间隙的中心。
Java动画
较大的S2-离子占据FCC晶胞
二、AB
型离子化合物
2
CaF2(萤石)型结构
Ca2+离子占据FCC结点,F-离子占据所有四面体间隙。
陶杰编教材,P.76,图2-82
清华教材,P.107,图2-55
B3型离子化合物
三、A
2
典型:Al
O3(刚玉)
2
陶杰编教材,P.78,图2-87
清华教材,P.109,图2-58
§2-5硅酸盐结构简介
硅酸盐——丰富、廉价的陶瓷材料。
应用最多的:
重要的硅酸盐矿物:长石、高岭土、滑石、橄榄石等。
按化学成分分为:正硅酸盐,即
偏硅酸盐,即( (
硅酸盐结构的基本特点:
基本结构:[SiO
4
]四面体,Si原子位于
方石英(SiO
)的晶体结构:
2。