热学现象的宏观规律
- 格式:ppt
- 大小:5.87 MB
- 文档页数:2

高中物理| 10.4热力学第二定律的微观解释热力学第二定律的本质自然界一切与热现象有关的宏观过程都是不可逆的。
1.有序和无序有序:只要确定了某种规则,符合这个规则的就叫做有序。
无序:不符合某种确定规则的称为无序。
无序意味着各处都一样,平均、没有差别,有序则相反。
有序和无序是相对的。
2.宏观态和微观态宏观态:符合某种规定、规则的状态,叫做热力学系统的宏观态。
微观态:在宏观状态下,符合另外的规定、规则的状态叫做这个宏观态的微观态。
系统的宏观态所对应的微观态的多少表现为宏观态无序程度的大小。
如果一个“宏观态”对应的“微观态”比较多,就说这个“宏观态”是比较无序的,同时也决定了宏观过程的方向性——从有序到无序。
3.热力学第二定律的统计意义对于一个热力学系统,如果处于非平衡态,我们认为它处于有序的状态,如果处于平衡态,我们认为它处于无序的状态。
在热力学中,序:区分度。
热力学第二定律的微观意义:一切自然过程总是沿着无序性增大的方向进行。
下面从统计观点探讨过程的不可逆性微观意义,并由此深入认识第二定律的本质。
不可逆过程的统计性质——以气体自由膨胀为例一个被隔板分为A、B相等两部分的容器,装有4个涂以不同颜色的气体分子。
开始时,4个分子都在A部,抽出隔板后分子将向B部扩散并在整个容器内无规则运动。
隔板抽出后,4个气体分子在容器中可能的分布情形1023/mol,这些分子全部退回到A部的几率为。
此数值极小,意味着此事件永远不会发生。
一般来说,若有N个分子,则共有2N 种可能方式,而N个分子全部退回到A部的几率1/2N.对于真实理想气体系统N热力学第二定律的微观意义一切自发过程总是沿着分子热运动的无序性增大的方向进行。
不可逆过程的本质系统从热力学概率小的状态向热力学概率大的状态进行的过程。
自发过程的规律:概率小的状态(有序)→概率大的状态(混乱)统计物理基本假定—等几率原理:对于孤立系,各种微观态出现的可能性(或几率)是相等的。


热力学第二定律的表述理解热力学第一定律阐明了能量转换过程中的守恒关系,指出了不消耗能量而能不断输出功的第一类永动机确是一种幻想。
热力学第二定律则更深刻地揭示了能量的品质问题。
熵,或许发明这一物理量的先贤也未始能预料到其对自然科学甚至哲学竟能产生如此巨大的影响。
热力学第二定律有数种表达形式,最闻名于世的有克劳修斯表达和开尔文表达。
1.开尔文表述英国物理学家开尔文(1824~1907),1845年毕业于剑桥大学,1846年受聘为格拉斯哥大学自然哲学教授,长达50余年,1851年被选为英国皇家学会会员,1877年被选为法国科学院院士,1890年至1895年担任皇家学会会长,他对热学和电磁学的发展都作出了重要的贡献。
1851年开尔文在爱丁堡皇家学会会刊上发表了一篇论文,题目是“论热的动力理论”,文章指出:不存在这样一个循环过程,系统从单一热源吸收热量,使之完全变为有用功而不产生其他影响.表述中“单一热源”是指温度均匀且恒定的热源;“其他影响”指除了由单一热源吸热,把吸收的热用来做功以外的任何其他变化.若有其他影响产生时,把由单一热源吸来的热量全部用以对外做功是可能的.自然界任何形式的能都可能转化为热,但热却不能在不产生其他影响的条件下完全转变成其他形式的能.开尔文的论述虽然较克劳修斯晚一年,但他的论述更为明确,使得热力学第二定律的研究更加深入,此外,开尔文还从第二定律断言:能量耗散是普遍趋势.2.克劳修斯表述德国物理学家克劳修斯(1822~1888),曾在柏林大学学习4年,后于1848年毕业于哈雷大学.1850年他任柏林皇家炮工学校物理教授,1855年后他相继任苏黎士维尔茨堡和波恩大学物理教授.他除了建立热力学第二定律,引入态函数——熵,还对气体分子动理论做了较全面的论述,用统计平均的方法导出了理想气体的压强、温度和气体的平均自由程公式。
克劳修斯于1850年在《德国物理学年鉴》上率先发表了《论热的动力及能由此推出的关于热本质的定律》,把卡诺定理作了扬弃而改造成与热力学第一定律并列的热力学第二定律.他提出,热量总是自动地从高温物体传到低温物体,不可能自动地由低温物体向高温物体传递.或者说不可能把热量从低温物体传到高温物体,而不引起其他变化.即在自然条件下,这个转变过程是不可逆的,若想让热传递的方向逆转,则必须消耗功才能实现.以上两种表述是等效的,说明了热量不可能全部转化为机械功以及这一转化过程的方向性.人们一度曾设想一种能从单一热源吸收热量,使之完全转变成有用的机械功而不产生其他影响的第二类永动机,第二类永动机虽不违背热力学第一定律,但违背热力学第二定律,因而是不可能造成的.第二定律除了以上两种表述外,还有其他不同的表述,例如热效率为100%的热机是不可能制成的;不需要由外加功而可操作致冷的机器是不可能造成的等.第二定律无论采用何种表述,其内容实质相同,不外乎主张不可逆变化的存在.各种表述的实质在于说明一切与热现象有关的实际宏观过程都是不可逆的。


人类最伟大的十个科学发现之九:热力学四大定律18世纪,卡诺等科学家发现在诸如机车、人体、太阳系和宇宙等系统中,从能量转变成“功”的四大定律。
没有这四大定律的知识,很多工程技术和发明就不会诞生。
热力学的四大定律简述如下:热力学第零定律——如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡。
热力学第一定律——能量守恒定律在热学形式的表现。
热力学第二定律——力学能可全部转换成热能,但是热能却不能以有限次的实验操作全部转换成功(热机不可得)。
热力学第三定律——绝对零度不可达到但可以无限趋近。
法国物理学家卡诺(Nicolas Leonard Sadi Carnot,1796~1823)(左图)生于巴黎。
其父L.卡诺是法国有名的数学家、将军和政治活动家,学术上很有造诣,对卡诺的影响很大。
卡诺身处蒸汽机迅速发展、广泛应用的时代,他看到从国外进口的尤其是英国制造的蒸汽机,性能远远超过自己国家生产的,便决心从事热机效率问题的研究。
他独辟蹊径,从理论的高度上对热机的工作原理进行研究,以期得到普遍性的规律;1824年他发表了名著《谈谈火的动力和能发动这种动力的机器》(右图),书中写道:“为了以最普遍的形式来考虑热产生运动的原理,就必须撇开任何的机构或任何特殊的工作介质来进行考虑,就必须不仅建立蒸汽机原理,而且建立所有假想的热机的原理,不论在这种热机里用的是什么工作介质,也不论以什么方法来运转它们。
”卡诺出色地运用了理想模型的研究方法,以他富于创造性的想象力,精心构思了理想化的热机——后称卡诺可逆热机(卡诺热机),提出了作为热力学重要理论基础的卡诺循环和卡诺定理,从理论上解决了提高热机效率的根本途径。
卡诺在这篇论文中指出了热机工作过程中最本质的东西:热机必须工作于两个热源之间,才能将高温热源的热量不断地转化为有用的机械功;明确了“热的动力与用来实现动力的介质无关,动力的量仅由最终影响热素传递的物体之间的温度来确定”,指明了循环工作热机的效率有一极限值,而按可逆卡诺循环工作的热机所产生的效率最高。


高考物理:热力学三大定律总结!热力学第一定律是能量守恒定律。
热力学第二定律有几种表述方式:克劳修斯表述为热量可以自发地从温度高的物体传递到温度低的物体,但不可能自发地从温度低的物体传递到温度高的物体;开尔文-普朗克表述为不可能从单一热源吸取热量,并将这热量完全变为功,而不产生其他影响。
以及熵增表述:孤立系统的熵永不减小。
热力学第三定律通常表述为绝对零度时,所有纯物质的完美晶体的熵值为零,或者绝对零度(T=0)不可达到。
第一定律热力学第一定律也就是能量守恒定律。
自从焦耳以无以辩驳的精确实验结果证明机械能、电能、内能之间的转化满足守恒关系之后,人们就认为能量守恒定律是自然界的一个普遍的基本规律。
内容一个热力学系统的内能U增量等于外界向它传递的热量Q与外界对它做功A的和。
(如果一个系统与环境孤立,那么它的内能将不会发生变化。
)符号规律热力学第一定律的数学表达式也适用于物体对外做功,向外界散热和内能减少的情况,因此在使用:△E=-W+Q时,通常有如下规定:①外界对系统做功,A>0,即W为正值。
②系统对外界做功,A<0,即W为负值。
③系统从外界吸收热量,Q>0,即Q为正值④系统从外界放出热量,Q<0,即Q为负值⑤系统内能增加,△U>0,即△U为正值⑥系统内能减少,△U<0,即△U为负值理解从三方面理解1.如果单纯通过做功来改变物体的内能,内能的变化可以用做功的多少来度量,这时系统内能的增加(或减少)量△U就等于外界对物体(或物体对外界)所做功的数值,即△U=A2.如果单纯通过热传递来改变物体的内能,内能的变化可以用传递热量的多少来度量,这时系统内能的增加(或减少)量△U就等于外界吸收(或对外界放出)热量Q的数值,即△U=Q3.在做功和热传递同时存在的过程中,系统内能的变化,则要由做功和所传递的热量共同决定。
在这种情况下,系统内能的增量△U就等于从外界吸收的热量Q和外界对系统做功A之和。

热传导现象的宏观规律与微观机理摘要:热传导是个非常重要的物理过程,在生活和生产中有着普遍的应用。
本文从宏观和微观上分析了热传导的宏观规律和微观机理,介绍傅里叶定律,最后指出了其在生活生活中的应用。
关键词:热传导;热量;热传导现象;导热系数The phenomenon of heat conduction of macro-mecha nism and micro-mechanism of the lawAbstract:Thermal conductivity is a very important physical processes in the production of life and have widespread application. In this paper, macro-and micro-analysis of the heat conduction of macro-and micro-mechanism of the law to introduce the Fourier's law, concluded that its application to live life.Key words: Thermal conductivity; heat; heat conduction phenomenon; thermal conductivity前言热传导是由于分子热运动强弱程度(即温度)不同所产生的能量传递。
当气体中存在温度梯度时,做杂乱无章运动的气体分子,在空间交换分子对的同时交换了具有不同热运动平均能量的分子,因而发生能量的迁移。
固体和液体中分子热运动的形式为振动。
温度高处分子热运动能量较大,因而振动的振幅大;温度低处分子振动的振幅小。
因为整个固体或液体都是由化学键把所有分子联结而成的连续介质,一个分子的振动也将导致物体中所有分子的振动,同样局部分子较大幅度的振动也将使其他分子的平均振幅增加。

热力学第二定律自发变化的方向性热力学研究热量传递和能量转化的规律,其中热力学第二定律是一个基本原理,揭示了自然界中物质和能量传递的规律。
该定律提供了一个判断热现象是否自发发生的准则,即自发变化的方向性。
本文将探讨热力学第二定律自发变化的方向性以及在自然界中的应用。
热力学第二定律表达了一个重要观点:封闭系统中熵的增加是自然界中热现象发生的指示。
熵是表示物质无序程度的物理量,也可以理解为系统能量的分散程度。
热力学第二定律通过熵的概念,指出了自然界中系统趋于混乱和无序的方向性。
根据热力学第二定律,熵的增加是一个自发发生的过程。
自发变化是指不需要外界干预就会发生的变化。
在宏观尺度上,我们观察到的多数自然过程都是与熵增加相关的。
例如,热量从高温物体传递到低温物体,气体的自由扩散,液体的混合等,都是伴随熵的增加而发生的自发过程。
这些过程遵循热力学第二定律,使得系统内部的能量分布更加平均,从而增加了系统的熵。
热力学第二定律的这个观点在科学技术的各个领域都有着广泛的应用。
例如,工程领域中热机的设计和优化,需要考虑热力学第二定律对热效率的限制。
热机转化热能为机械能,包括汽车引擎、蒸汽机等。
根据热力学第二定律,热机的效率不能超过理论上的最大值,即卡诺循环的效率。
因此,工程师们需要通过改进热机的结构和工作条件,提高其效率。
另一个例子是化学反应中的自发性变化。
根据热力学第二定律,一个化学反应自发进行的条件是反应的自由能变化(ΔG)小于零。
自由能变化是化学反应在恒温、恒压下的可用能量变化。
当自由能变化为负值时,反应能够自发进行,产生化学平衡。
这个原理常常应用于工业生产中的化学反应,例如合成氨、合成尿素等。
热力学第二定律的方向性还可以解释一些自然界中的现象。
例如,热传导是热量从高温区域向低温区域传播的过程。
根据热力学第二定律,这个过程是不可逆的,因为热力学第二定律要求热量从高温区域传递到低温区域以增加系统熵。
这也解释了我们为什么感觉到热量总是从热的地方流向冷的地方。

物理热力学第二定律知识点整理归纳物理热力学第二定律知识点整理归纳物理是高中生学好高中的重要组成部分,学好直接影响着高中三年的成绩。
下面是店铺收集整理的物理热力学第二定律知识点整理归纳,希望大家喜欢!一、热力学第二定律建立的历史过程19世纪初,巴本、纽可门等发明的蒸汽机经过许多人特别是瓦特的重大改进,已广泛应用于工厂、矿山、交通运输,但当时人们对蒸汽机的理论研究还是非常缺乏的。
热力学第二定律就是在研究如何提高热机效率问题的推动下,逐步被发现的,并用于解决与热现象有关的过程进行方向的问题。
1824年,法国陆军工程师卡诺在他发表的论文论火的动力中提出了著名的卡诺定理,找到了提高热机效率的根本途径。
但卡诺在当时是采用热质说的错误观点来研究问题的。
从1840年到1847年间,在迈尔、焦耳、亥姆霍兹等人的努力下,热力学第一定律以及更普遍的能量守恒定律建立起来了。
热动说的正确观点也普遍为人们所接受。
1848年,开尔文爵士(威廉汤姆生)根据卡诺定理,建立了热力学温标(绝对温标)。
它完全不依赖于任何特殊物质的物理特性,从理论上解决了各种经验温标不相一致的缺点。
这些为热力学第二定律的建立准备了条件。
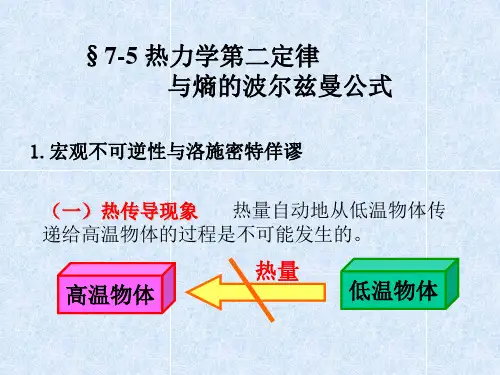
1850年,克劳修斯从热动说出发重新审查了卡诺的工作,考虑到热传导总是自发地将热量从高温物体传给低温物体这一事实,得出了热力学第二定律的初次表述。
后来历经多次简练和修改,逐渐演变为现行物理教科书中公认的克劳修斯表述。
与此同时,开尔文也独立地从卡诺的工作中得出了热力学第二定律的另一种表述,后来演变为更精炼的现行物理教科书中公认的开尔文表述。
上述对热力学第二定律的两种表述是等价的,由一种表述的正确性完全可以推导出另一种表述的正确性。
二、热力学第二定律的实质1、可逆过程与不可逆过程一个热力学系统,从某一状态出发,经过某一过程达到另一状态。
若存在另一过程,能使系统与外界完全复原(即系统回到原来的状态,同时消除了原来过程对外界的一切影响),则原来的过程称为可逆过程。
高二物理知识点:热力学第二定律的适用范
围
热力学第二定律的适用范围
(1)热力学第二定律是宏观规律,对少量分子组成的微观系统是不适用的。
(2)热力学第二定律适用于“绝热系统”或“孤立系统”,对于生命体(开放系统)是不适用的。
早在1851年开尔文在叙述热力学第二定律时,就曾特别指明动物体并不像一架热机一样工作,热力学第二定律只适用于无生命物质。
(3)热力学第二定律是建筑在有限的空间和时间所观察到的现象上,不能被外推应用于整个宇宙。
19世纪后半期,有些科学家错误地把热力学第二定律应用到无限的、开放的宇宙,提出了所谓“热寂说”。
他们声称:将来总有一天,全宇宙都是要达到热平衡,一切变化都将停止,从而宇宙也将死亡。
要使宇宙从平衡状态重新活动起来,只有靠外力的推动才行。
这就会为“上帝创造世界”等唯心主义提供了所谓“科学依据”。
“热寂说”的荒谬,在于把无限的、开放的宇宙当做热力学中所说的“孤立系统”。
热力学中的“孤立系统”与无所不包、完全没有外界存在的整个宇宙是根本不同的。
事实上,科学后来的发展已经提供了许多事实,证明宇宙演变的过程不遵守热力学第二定律。
正如恩格斯在《自然辩证法》中指出了“热寂说”的谬误。
他根据物质运动不灭的原理,深刻地指出:“放射到太空中去的热一定有可能通过某种途径——
指明这一途径,将是以后自然科学的课题——
转变为另一运动形式,在这种运动形式中,它能重新集结和活动起来。
”热力学第二定律和热力学第一定律一样,是实践经验的总结,它的正确性是由它的一切推论都为实践所证实而得到肯定的。
物理学中的热力学规律热力学是物理学中研究热能转化与传递的学科,它涉及到能量、温度和热量等概念。
热力学规律是描述热力学系统行为的基本原理和定律。
下面,我们将探讨一些重要的热力学规律。
一、热力学第一定律热力学第一定律是能量守恒定律在热力学中的体现。
根据热力学第一定律,一个封闭系统的内能变化等于系统所吸收的热量减去所做的功。
这可以用以下公式表示:ΔU = Q - W其中,ΔU代表系统的内能变化,Q代表系统所吸收的热量,W代表系统所做的功。
这个定律告诉我们,能量在系统中是守恒的,能量可以从一个形式转化为另一个形式,但总能量不变。
二、热力学第二定律热力学第二定律是描述自然界中热能传递方向的定律。
根据热力学第二定律,热量永远不会自发地从低温物体传递到高温物体,而是自发地从高温物体传递到低温物体。
这个定律可以用热力学中的熵来描述。
熵是一个描述系统无序程度的物理量,它与热力学第二定律密切相关。
根据热力学第二定律,一个孤立系统的熵永远不会减少,只会增加或保持不变。
这意味着自然界中的过程总是趋向于增加系统的熵,即趋向于增加系统的无序程度。
三、热力学第三定律热力学第三定律是描述温度趋于绝对零度时系统性质的定律。
根据热力学第三定律,当温度趋于绝对零度时,系统的熵趋于一个有限值。
也就是说,绝对零度是热力学系统的一个特殊点,它对应于系统的最低熵状态。
热力学第三定律的一个重要应用是描述物质的冷却过程。
根据这个定律,当物质冷却到接近绝对零度时,它的熵趋于零,从而使得物质的性质发生显著变化。
例如,超导材料在低温下可以表现出零电阻和完全磁场排斥的特性。
四、热力学平衡态热力学平衡态是指一个系统在没有外界扰动时达到的稳定状态。
根据热力学规律,一个系统在平衡态时,各个宏观性质不随时间变化。
例如,一个封闭的热力学系统在达到平衡态后,温度、压力和物质的分布等性质都保持不变。
热力学平衡态是热力学研究的重要对象,它可以用来描述宏观系统的性质和行为。
热力学系统中的热力学性质研究热力学是研究热力学系统的学科。
热力学系统可以是一个物体,一个化学反应体系,或者一个热机(例如汽车引擎或蒸汽机)。
对于这些热力学系统,热力学家们希望能够理解其中的热力学性质,如温度、压力、物质的状态等等。
本文将介绍一些热力学系统中的常见热力学性质及其研究方法。
一、热力学性质的分类热力学性质可以分为两类,即宏观性质和微观性质。
1.宏观性质宏观性质是指能够直接观察到的热力学性质,如温度、压力、体积、熵等等。
这些性质通常是由大量分子的运动状态所确定的。
热力学家们通过实验或数学模型,能够计算、预测这些性质可以如何变化。
2.微观性质微观性质是指在分子尺度下,如每个分子的速度、位置、能量等等。
这些性质的了解对于我们理解宏观性质变化,以及热力学系统的开发和应用非常重要。
二、热力学性质的研究方法1.热力学实验热力学实验是一种通过测量热力学系统的宏观性质来研究热力学性质的方法。
实验通常包括控制变量来进行测量,例如控制温度、压强不变,来测量体积或热量的变化。
通过这些实验,我们可以得到一些定量的结果,用于分析热力学系统的性质及其变化规律。
2.计算机模拟计算机模拟是一种通过计算机模拟热力学系统的微观运动状态,来研究热力学性质的方法。
通过计算机模拟,我们可以了解每个分子的运动,以及大量分子的行为。
这种方法的优点是可以控制变量、精确测量,并且可以很好地模拟实际系统的行为。
我们可以通过计算机模拟从微观层面,来研究热力学系统的性质。
三、热力学系统的常见性质1. 熵熵是一个用来描述热力学系统无序程度的物理量。
它是热力学第二定律的重要概念,也是热力学中最重要的性质之一。
热力学第二定律认为,热流从高热能体到低热能体,并且能量转化成一种引起无序性的形式。
这个“无序性”可以通过熵来计算和描述。
2. 温度温度是热力学系统中的一个重要宏观性质,它的单位是开尔文。
我们可以测量热力学系统的温度变化,来了解这个系统的性质。
《热力学》教材:大学物理(下册)吴百诗主编第11章热力学基础§11.1 热力学的研究对象和研究方法一.热学的研究对象热学研究热现象的理论热力学从能量转换的观点研究物质的热学性质和其宏观规律核心:热能转化为机械能二. 热学的研究方法宏观量描述宏观物体特性的物理量;如温度、压强、体积、热容量、密度、熵等。
微观量描述微观粒子特征的物理量;如质量、速度、能量、动量等。
§11.2 平衡态与理想气体状态方程一.热力学系统热力学系统:热力学研究的具体对象,简称系统系统与外界的相互作用:热传递(能力交换),质量交换等系统分类:开放系统:系统与外界有物质交换和能量交换封闭系统:系统与外界没有物质交换,只有能量交换孤立系统:系统与外界没有物质交换,也没有能量交换二.气体的状态参量体积(V)气体分子可能到达的整个空间的体积压强(p)大量分子与器壁及分子之间不断碰撞而产生的宏观效果温度(T)大量分子热运动的剧烈程度温标:温度的数值表示方法热力学温标:符号:T ,单位:开尔文,简称:开,用K表示国际上规定水的三相点温度为273.16 K摄氏温标:符号:t ,单位:℃摄氏温标与热力学温标的关系:t=T-273.15水的冰点0℃为273.15K,(一个大气压)水的三相点:在没有空气的密闭容器内使水的三相平衡共存,其温度就是三相点温度。
选择水的三相点为热力学温标的基准点比选用冰点、沸点更准确,更容易复现。
三相点温度的测量与压力无关。
三.平衡态定义:在没有外界影响的情况下,系统各部分的宏观性质在长时间内不发生变化的状态。
说明:(1) 不受外界影响是指系统与外界不通过作功或传热的方式交换能量。
例如:两头处于冰水、沸水中的金属棒是一种稳定态,而不是平衡态。
提问:人体的体温保持在36℃,是稳定态?还是平衡态? (2) 但可以处于均匀的外力场中;例如:处于重力场中气体系统的粒子数密度随高度变化,但它是平衡态。
(3) 平衡态是热动平衡,宏观参量不变,微观参量变化剧烈。