【步步高】高考化学大一轮复习 第十章 盐类的水解配套导学案(含解析)鲁科版
- 格式:doc
- 大小:349.50 KB
- 文档页数:11

课时分层训练(二十七)盐类的水解(建议用时:45分钟)(对应学生用书第314页)A级基础达标1.下列物质能促进水的电离且溶液为酸性的是()A.NaHSO4B.明矾C.NaHCO3D.NaHSO3B[A项,NaHSO4电离出的H+抑制水的电离;B项,明矾电离出的Al3+水解促进水电离,呈酸性;C项,NaHCO3电离出的HCO-3以水解为主,促进水电离,呈碱性;D项,NaHSO3电离出的HSO-3以电离为主,抑制水电离。
] 2.(2018·西安模拟)下列物质在常温时发生水解,对应的离子方程式正确的是()A.Na2CO3:CO2-3+2H2O H2CO3+2OH-B.NH4Cl:NH+4+H2O NH3↑+H2O+H+C.CuSO4:Cu2++2H2O Cu(OH)2+2H+D.NaF:F-+H2O===HF+OH-C[A项,应为CO2-3+H2O HCO-3+OH-;B项,应为NH+4+H2O NH3·H2O+H+;D项,应为F-+H2O HF+OH-。
]3.(2018·石家庄模拟)有关下列两种溶液的说法中,正确的是()【导学号:95160282】①0.1 mol/L CH3COONa溶液②0.1 mol/L CH3COOH溶液A.常温时,溶液中[CH3COO-]:①<②B.加水稀释①,溶液中[CH3COOH][OH-][CH3COO-]变大C.向②中滴加①至溶液呈中性,滴加过程中水的电离平衡正向移动D.向②中滴加①至溶液呈中性,溶液中[Na+]>[CH3COO-]C[选项A,①中CH3COO-微弱水解,②中微弱电离出CH3COO-,故[CH 3COO -]:①>②,错误。
选项B ,①中CH 3COO -水解:CH 3COO -+H 2O CH 3COOH +OH -,[CH 3COOH][OH -][CH 3COO -]是其水解平衡常数,只与温度有关,错误。
学案47盐类的水解[考纲要求] 1.了解盐类水解的原理,了解阻碍盐类水解程度的要紧因素。
2.了解盐类水解的应用。
知识点一盐类水解的原理1.概念在溶液中盐电离出来的离子跟______________________结合生成____________的反映。
2.实质问题试探1.如何证明Na2CO3溶液呈碱性是由CO2-3水解引发的?3.特点4.规律有弱才水解,越弱越水解;谁强显谁性;同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCl、KNO3强酸弱碱盐NH4Cl、Cu(NO3)2弱酸强碱盐CH3COONa 、Na2CO3问题试探2.同浓度的Na2CO3和CH3COONa溶液相较,谁的pH较大?什么缘故?知识点二水解反映方程式的书写1.书写形式盐+水盐中的离子+水________________________________________________________________________2.书写规律(1)多元弱酸的正盐(如Na2S):____________________________________________(要紧),____________________________________(次要)。
(2)多元弱碱的正盐(如AlCl3):________________________________________________________________________。
(3)双水解反映(如Na2S与AlCl3溶液混合)________________________________________________________________________。
易错警示一样盐类水解程度很小,水解产物很少,不标“↑”或“↓”,不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。
问题试探3.以下离子方程式中,属于水解反映的是( )A.HCOOH+H2O HCOO-+H3O+B.CO2+H2O HCO-3+H+C.CO2-3+H2O HCO-3+OH-D.HS-+H2O2-+H3O+知识点三阻碍盐类水解的因素1.内因酸或碱越弱,其对应的弱酸阴离子或弱碱阳离子的水解程度________,溶液的碱性或酸性________。

课时分层训练(二十七) 盐类的水解(建议用时:45分钟)A 级 基础达标1.下列物质能促进水的电离且溶液为酸性的是( )A .NaHSO 4B .明矾C .NaHCO 3D .NaHSO 3 B [A 项,NaHSO 4电离出的H +抑制水的电离;B 项,明矾电离出的Al 3+水解促进水电离,呈酸性;C 项,NaHCO 3电离出的HCO -3以水解为主,促进水电离,呈碱性;D 项,NaHSO 3电离出的HSO -3以电离为主,抑制水电离。
]2.下列物质在常温时发生水解,对应的离子方程式正确的是( )A .Na 2CO 3:CO 2-3+2H 22CO 3+2OH - B .NH 4Cl :NH +4+H 23↑+H 2O +H + C .CuSO 4:Cu 2++2H 22+2H + D .NaF :F -+H 2O===HF +OH -C [A 项,应为CO 2-3+H 2-3+OH -;B 项,应为NH +4+H 23·H 2O +H +;D 项,应为F -+H 2+OH -。
] 3.有关下列两种溶液的说法中,正确的是( )【导学号:95160282】①0.1 mol/L CH 3COONa 溶液②0.1 mol/L CH 3COOH 溶液A .常温时,溶液中[CH 3COO -]:①<②B .加水稀释①,溶液中[CH 3COOH][OH -][CH 3COO -]变大 C .向②中滴加①至溶液呈中性,滴加过程中水的电离平衡正向移动D .向②中滴加①至溶液呈中性,溶液中[Na +]>[CH 3COO -]C [选项A ,①中CH 3COO -微弱水解,②中微弱电离出CH 3COO -,故[CH 3COO -]:①>②,错误。
选项B ,①中CH 3COO -水解:CH 3COO -+H 23COOH +OH -,[CH 3COOH][OH -][CH 3COO -]是其水解平衡常数,只与温度有关,错误。
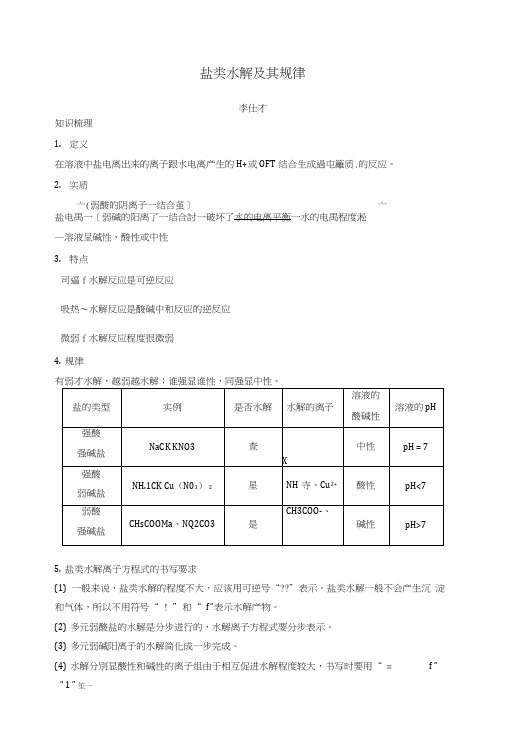
盐类水解及其规律李仕才知识梳理1.定义在溶液中盐电离出来的离子跟水电离产生的H+或OFT结合生成過屯籬质.的反应。
2.实质亠(弱酸的阴离子一结合茧]亠盐电禺一〔弱碱的阳离了一结合討一破坏了水的电离平衡一水的电禺程度淞―溶液呈碱性、酸性或中性3.特点司逼f水解反应是可逆反应吸热〜水解反应是酸碱中和反应的逆反应微弱f水解反应程度很微弱4.规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCK KNO3查X中性pH = 7强酸弱碱盐NH.1CK Cu(N03)2星NH寺、Cu2+酸性pH<7弱酸强碱盐CHsCOOMa、NQ2CO3是CH3COO-、碱性pH>75.盐类水解离子方程式的书写要求(1)一般来说,盐类水解的程度不大,应该用可逆号“??”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“ ! ”和“ f ”表示水解产物。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
(3)多元弱碱阳离子的水解简化成一步完成。
(4)水解分別显酸性和碱性的离子组由于相互促进水解程度较大,书写时要用“ = f ”“ 1 ” 笙一「正误判I断・辨析易错易混J(1)溶液呈中性的盐一定是强酸、强碱生成的盐(X)(2)酸式盐溶液可能呈酸性,也可能呈碱性(J)(3)某盐溶液呈酸性,该盐一定发生了水解反应(X)(4)常温下,pH=10的CHsCOONa溶液与pH=4的WC1溶液,水的电离程度相同3)(5)常温下,pH=ll的CDCOONa溶液与pH=3的CH3COOH溶液,水的电离程度相同(X)(6)WHCO3、NaHSOi都能促进水的电离(X)(7)向NaA102溶液中滴加NaHCO3溶液,有沉淀和气体生成(X)(8)S2_+2H 2O^^?H2S + 2Oir( X)(9)FJ+ + 3HQ?k^?Fe(0H)31 +3H+(X)(10)明矶溶液显酸性:A13++3H2O^^A1 (OH)3+3H+( V)r规范描述・培养答题能力」1.怎样用最简单的方法区别NaCl溶液、氯化钱溶液和碳酸钠溶液?答案三种溶液各取少许分别滴入紫色石蕊溶液,不变色的为NaCl溶液,变红色的为氯化鞍溶液,变蓝色的为碳酸钠溶液。

难溶电解质的溶解平衡一、沉淀溶解平衡1.沉淀的溶解平衡是怎样建立的?勒夏特列原理是否适用于该平衡?2.难溶电解质溶解能力的大小,通常怎样表示?其大小受哪些因素的影响?3.影响沉淀溶解平衡的因素有哪些?各怎样影响?典例导悟1下表是五种银盐的溶度积常数(25 ℃):A.五种物质在常温下溶解度最大的是Ag2SO4B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀C.氯化银、溴化银和碘化银三种物质在常温下的溶解度逐渐增大D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动听课记录:变式演练1下列叙述不正确的是()A.CaCO3能够溶解在CO2的水溶液中B.Mg(OH)2可溶于盐酸,不溶于NH4Cl溶液C.AgCl可溶于氨水D.MgSO4溶液中滴加Ba(OH)2得到两种沉淀典例导悟2(2008·山东理综,15)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是()提示BaSO4(s)Ba2+(aq)+SO2-4(aq)的平衡常数K sp=c(Ba2+)·c(SO2-4),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点B.通过蒸发可以使溶液由d点变到c点C.d点无BaSO4沉淀生成D.a点对应的K sp大于c点对应的K sp听课记录:二、溶度积的计算和有关判断思考:(1)已知K sp(AgCl)=1.8×10-10mol2·L-2,则将AgCl放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)是多少?(2)已知K sp[Mg(OH)2]=1.8×10-11mol3·L-3,则将Mg(OH)2放入蒸馏水中形成饱和溶液,溶液的pH为多少?(3)在0.01 mol·L-1的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的pH是多少?当Mg2+完全沉淀时,溶液的pH值为多少?典例导悟3(2011·泰安月考)已知K sp(AgCl)=1.8×10-10mol2·L-2,K sp(Ag2CrO4)=1.9×10-12mol3·L-3,现在向0.001 mol·L-1KCrO4和0.01 mol·L-1KCl混合液中滴加0.01 mol·L-12AgNO3溶液,通过计算回答:(1)Cl-、CrO2-4谁先沉淀?(2)刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是多少?(设混合溶液在反应中体积不变)变式演练2一定温度下的难溶电解质A m B n在水溶液中达到沉淀溶解平衡时,其平衡常数K sp=c m(A n+)×c n(B m-),称为难溶电解质的溶度积。
高三化学《盐类的水解》导学案【考纲要求】1.了解盐类水解的原理。
2.了解影响水解程度的主要因素。
3.能运用水解常数与电离常数、离子积常数的关系进行计算【课堂重难点突破】【考点一】盐类水解的规律【问题组】1、盐溶液能水解,其溶液一定呈现酸性或碱性吗?2、盐溶液呈现酸性,一定是强酸弱碱盐水解引起的吗?3、相同条件下,酸性越强,对应盐溶液的碱性强弱呢?【归纳小结】【拓展练】1、已知酸性:CH3COOH>H2CO3>HClO>HCO-3,则相同条件下CH3COONa、Na2CO3、NaClO、NaHCO3四种盐溶液的碱性强弱顺序为______________________________。
2、已知HSO-3的电离程度大于水解程度,HCO-3的电离程度小于水解程度,则同浓度的NaHSO4、NaHCO3、NaHSO3溶液pH大小顺序为____________________。
3、同浓度的(NH4)2CO3、 (NH4)2SO4、 (NH4)2Fe(SO4)2、NH4Cl、NH4HSO4、NH4HCO3溶液中c(NH+4)的大小顺序为___________________________________________。
【归纳小结】【深入研究】1、常温下,pH=4的NH4Cl溶液与pH=4的盐酸中发生电离的水是多少?2、常温下pH=10的CH3COONa溶液与pH=4的CH3COOH溶液,水的电离程度相同吗?3、常温下pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同吗?【考点二】多角度攻克影响盐类水解的因素以FeCl3溶液(Fe3++3H23+3H+)为例,填写改变外界条件对上述平衡的影响。
【归纳整理】【对点练1】正误判断,正确的打“√”,错误的打“×”(1)水解平衡右移,盐离子的水解程度可能增大,也可能减小( )(2)稀溶液中,盐的浓度越小,水解程度越大,其溶液酸性(或碱性)也越强( )(3)关于FeCl3溶液,加水稀释时,c3+c-的值减小( )(4)取5 mL pH=5的NH4Cl溶液,加水稀释至50 mL,c(NH+4)c(H+)减小【对点练2】NH4C l稀溶液中分别加入少量下列物质或改变如下条件,能使c(NH4+)/c(Cl-)比值一定增大的是①HCl 气体②氨气③H2O④NH4Cl 固体⑤ NaOH固体⑥降温()A. ③④⑤B. ②④C. ②③⑥D. ②④⑥【考点三】K a、K w、K h三者关系的应用【例题1】5.25 ℃时,H2SO3-3+H+的电离常数K a=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数K h=________【归纳小结】【对点练】1、已知25 ℃时,NH 3·H 2O 的电离平衡常数K b =1.8×10-5 mol·L -1,该温度下1 mol·L -1的NH 4Cl 溶液中[H +]=________ mol·L -1。
东北师范大学厚普公益学校高二上学期化学学科导学案专题会考复习2编写教师:尚诗羽【知识梳理】一、非金属单质及其化合物._, r-flfttt:与金属及其他非金属反应~|CM—I一1 1-与水.蹴反丿• 消毒剂.漂白剂(漂白液与漂白粉)―可燃性:生成$02―稳定性:空气的主要成分m亲氣性:以&0圾硅腹盐的形式存在一半导体性:信息技术与光电技术材料—打水反应:酸雨NaCIO. Ca(C10)2—消琏剂.漂白粉复杂硅战盐一砌瓷.玻璃.水渥(一)氯1、液氯、新制的氯水和久置的氯水比较液氯新制氯水久置氯水分类纯净物混合物混合物成分C12C12、H20、HCIO、H+、C1—、C10—、极少量的为0H—H+、Cl—、H20、极少量的0H—稀盐酸审查教师:黄文静单质氧化物化合物氢化物SO:■ N6 —SiO2_与环境的关系:大气污染马陆治,—与强碱反应:制Na^SiO,硅腹盐材料的基础-- 与水反应:制猱水—与設反应:制技盐—液化:制冷剂H2SO4 > HNO八HCIO —辄化性阿■厂相性------- 胶体性质:制并胶含氧酸盐NaiSiOj —黏胶剂(水玻璃).防火剂含氧酸2、氯气的性质(二)硅及其化合物1、二氧化硅和二氧化碳比较(三)硫、氮1、二氧化硫23可造成空气污染的气体:1)CO2过量会导致温室效应2)SO2排放过量会形成酸雨3)氮的氧化物会引起光化学烟雾【跟踪练习】:1.检查SO2中是否含有CO2气体,可采用的方法是()A.通过品红溶液B.通过澄清的石灰水C.先通过澄清的石灰水,再通过氢氧化钠溶液D.先通过酸性KMnO4溶液,再通过澄清石灰水2.下列物质中不能使有色布条褪色的是A.氯水B.次氯酸钙溶液C.漂白粉溶液D.氯化钙溶液二、化学反应速率及化学平衡1・化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示: _______注意解答题中要带单位mol/L*min或mol/L*s2.可逆反应1)定义:在同一条件下,能同时向正、逆两个方向进行的化学反应称为可逆反应。
第三节盐类的水解【高考目标导航】考纲导引考点梳理1.了解盐类水解的原理。
2.了解影响盐类水解程度的主要因素。
3.了解盐类水解反应的利用。
1.盐类水解的原理。
2.水解方程式的书写。
3.盐类水解的影响因素。
【基础知识梳理】一、盐类水解的原理1.概念:水溶液中盐的离子与水电离出的H+或OH—结合生成弱电解质的反应。
2.实质:,破坏了水的电离平衡;促进了水的电离,使得c(H+)≠c(OH—),从而使溶液显示不同程度的酸、碱性。
3.条件:(1)盐必须溶于水中;(2)盐中必须有弱酸根离子或弱碱阳离子(有弱才水解)。
4.特征:(1)水解属可逆反应,逆反应是中和反应,是吸热反应,因此水解方程式要用可逆号“”。
(2)通常水解很微弱,存在水解平衡。
21世纪教育网5.盐类水解规律有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强显谁性,同强显中性。
盐的类型实例是否水解水解的离子21世纪教育网溶液的酸碱性溶液的pH6.水解方程式的书写 (1)书写形式:盐类的水解反应是中和反应的逆反应,中和反应的程度很大,水解反应的程度很小,故写盐类的水解反应方程式或离子方程式时,一般不写“=”而写“”。
(2)书写规律1一般盐类水解的程度很小,水解产物也少,通常不生成沉淀或气体,也不发生分解。
在书写盐类水解的离子方程式时一般不标“↑”或“↓”,也不把生成物(如NH 3·H2O 、H 2CO 3)写成其分解产物的形式。
2多元弱酸盐的水解分步进行,以第一步为主,一般只写第一步水解的离子方程式,如Na 2CO 3的水解离子方程式:OH CO 2-23+-+OH HCO -33多元弱碱阳离子的水解方程式一步写完,如FeCl 3的水解离子方程式:Fe 3++3H 2OFe (OH )3+3H +4能完全水解的离子组,由于水解程度较大,书写时要用“===”、“↑”、“↓”等,如NaHCO 3与AlCl 3混合溶液的反应离子方程式:Al 3++3HCO ===Al (OH )3↓+3CO 2↑ 。
第28讲盐类水解复习目标1.了解盐类水解的原理及其一般规律。
2.掌握水解离子方程式的书写。
3.了解影响盐类水解程度的主要因素。
4.了解盐类水解的应用。
5.能利用水解常数(K h)进行相关计算。
考点一盐类的水解原理必备知识整理1.盐类的水解2.水解离子方程式的书写(1)多元弱酸盐水解:________进行,以________为主。
如Na2CO3水解的离子方程式:________________________________________________________________________,________________________________________________________________________。
(2)多元弱碱阳离子水解:方程式___________________________________________________________________完成。
如FeCl3水解的离子方程式:____________________________________________。
(3)阴、阳离子相互促进水解:水解程度较大,书写时要用“===”“↑”“↓”等。
如NaHCO3与AlCl3溶液混合,反应的离子方程式:________________________________________________________________________。
微点拨①盐类发生水解后,其水溶液往往显酸性或碱性,但也有特殊情况,如CH3COONH4溶液显中性。
②NH4+与CH3COO-、HCO3−、CO32−等在水解时相互促进,其水解程度比单一离子的水解程度大,但水解程度仍然比较弱,不能进行完全,在书写水解方程式时用“⇌”。
3.水解的规律4.水解常数及应用(1)含义:盐类水解的平衡常数,称为水解常数,用K h表示。
(2)表达式①对于A-+H2O⇌HA+OH-,K h=________________________________________________________________________ ________________________________________________________________________。
学案47盐类的水解[考纲要求] 1.了解盐类水解的原理,了解影响盐类水解程度的主要因素。
2.了解盐类水解的应用。
知识点一盐类水解的原理1.定义在溶液中盐电离出来的离子跟______________________结合生成____________的反应。
2.实质问题思考1.怎样证明Na2CO3溶液呈碱性是由CO2-3水解引起的?3.特点4.规律有弱才水解,越弱越水解;谁强显谁性;同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCl、KNO3强酸弱碱盐NH4Cl、Cu(NO3)2弱酸强碱盐CH3COONa、Na2CO3问题思考2.同浓度的Na2CO3和CH3COONa溶液相比,谁的pH较大?为什么?知识点二水解反应方程式的书写1.书写形式盐+水盐中的离子+水2.书写规律(1)多元弱酸的正盐(如Na2S):____________________________________________(主要),____________________________________(次要)。
(2)多元弱碱的正盐(如AlCl3):________________________________________________________________________。
(3)双水解反应(如Na2S与AlCl3溶液混合)________________________________________________________________________。
易错警示一般盐类水解程度很小,水解产物很少,不标“↑”或“↓”,不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。
问题思考3.下列离子方程式中,属于水解反应的是()A.HCOOH+H2O-+H3O+B.CO2+H2O-3+H+C.CO2-3+H2O-3+OH-D.HS-+H2O2-+H3O+知识点三影响盐类水解的因素1.内因酸或碱越弱,其对应的弱酸阴离子或弱碱阳离子的水解程度________,溶液的碱性或酸性________。
问题思考4.在CH3COONa溶液中,加入少量冰醋酸对CH3COO-的水解平衡将产生什么影响?5.(1)为什么热的纯碱液去油渍效果会更好?(2)配制FeCl3溶液时,常加入少量的盐酸,为什么?一、盐类水解的应用22溶解于稀盐酸中,加热、过滤,调节滤液的pH为3;②对①所得滤液按下列步骤进行操作:已知Cu2+、Fe2+在pH为4~5时不水解,而Fe3+却几乎完全水解而沉淀。
请回答下列问题:(1)X是什么物质?__________。
其反应的离子方程式是________________________________________________________________________。
(2)Y物质应具备的条件是________________________________________________________________________,生产中Y可选:______________。
(3)溶液乙在蒸发结晶时应注意:________________________________________________________________________。
变式演练1下列有关问题,与盐的水解有关的是()①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干AlCl3溶液得到Al(OH)3固体A.①②③B.②③④C.①④⑤D.①②③④⑤2.盐溶液蒸干时所得产物的判断方法判断盐溶液蒸干灼烧后的产物的一般思路是什么?二、计算溶液中由水电离出的H+或OH-浓度的方法1.在25 ℃时,由纯水电离出的c(H+)、c(OH-)分别为多少?在中性溶液中,由水电离出的c(H-)和c(OH-)与纯水一样吗?2.在酸溶液中,H+和OH-的来源分别是什么?举例说明怎样计算由水电离产生的c(OH +)的大小。
3.碱溶液中,H+和OH-的来源又是什么?怎样计算由水电离产生的c(OH-)?4.在可水解的盐溶液中,H+和OH-的来源怎样?举例说明此时计算溶液中由水电离产生的c(H+)的方法。
典例导悟2(2011·南京模拟)(1)在常温下,某硫酸和硫酸铝两种溶液的pH都是3,那么硫酸中水电离出的c(H+)是硫酸铝溶液中水电离出的c(H+)的________倍。
(2)在常温下,设某pH的硫酸中水电离出的c(H+)=1.0×10-a mol·L-1,相同pH的硫酸铝中水电离出c(H+)=1.0×10-b mol·L-1(a,b都是小于14的正数),那么a和b之间满足的数量关系是(用一个等式和一个不等式表示)____________________。
变式演练2(1)pH=3的H2SO4和pH=3的NH4Cl溶液中,由水电离出的c(H+)各是多少?(2)pH=11的NaOH和pH=11的Na2CO3溶液中,由水电离出的c(H+)各是多少?二者相差多少倍?(3)某溶液中,由水电离出的c(H+)=10-5mol·L-1,求该溶液的pH。
(4)某溶液中,由水电离出的c(H+)=10-12mol·L-1,求该溶液的pH。
题组一盐类水解的原理及水解的离子方程式1.判断正误(1)某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐()(2010·天津理综-4A)(2)由0.1 mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2+OH-()(2010·福建理综-10D)(3)在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7()(2010·全国理综Ⅰ-9B)(4)0.1 mol·L-1的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH()(2010·上海-14C)2.(2011·重庆理综,8)对滴有酚酞试液的下列溶液,操作后颜色变深的是()A.明矾溶液加热B.CH3COONa溶液加热C.氨水中加入少量NH4Cl固体D.小苏打溶液中加入少量NaCl固体题组二溶液中微粒浓度大小的比较3.(2011·全国理综,9)室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是()A.若pH>7,则一定是c1V1=c2V2B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)C.当pH=7时,若V1=V2,则一定是c2>c1D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)4.(2011·天津理综,4)25 ℃时,向10 mL 0.01 mol·L-1 KOH溶液中滴加0.01 mol·L-1苯酚溶液,混合溶液中粒子浓度关系正确的是()A.pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-)B.pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-)C.V[C6H5OH(aq)]=10 mL时,c(K+)=c(C6H5O-)>c(OH-)=c(H+)D.V[C6H5OH(aq)]=20 mL时,c(C6H5O-)+c(C6H5OH)=2c(K+)5.(2010·广东理综,12)HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是()A.c(Na+)>c(A-)>c(H+)>c(OH-)B.c(Na+)>c(OH-)>c(A-)>c(H+)C.c(Na+)+c(OH-)=c(A-)+c(H+)D.c(Na+)+c(H+)=c(A-)+c(OH-)题组三盐类水解的应用6.(2011·广东理综,11)对于0.1 mol·L-1 Na2SO3溶液,正确的是()A.升高温度,溶液pH降低B.c(Na+)=2c(SO2-3)+c(HSO-3)+c(H2SO3)C.c(Na+)+c(H+)=2c(SO2-3)+2c(HSO-3)+c(OH-)D.加入少量NaOH固体,c(SO2-3)与c(Na+)均增大7.(2009·北京理综,11)有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa 与NaHCO3。
下列各项排序正确的是()A.pH:②>③>④>①B.c(CH3COO-):②>④>③>①C.溶液中c(H+):①>③>②>④D.c(CH3COOH):①>④>③>②8.(2009·福建理综,10)在一定条件下,Na2CO3溶液存在水解平衡:CO2-3+H2-3+OH-。
下列说法正确的是()A.稀释溶液,水解平衡常数增大B.通入CO2,平衡朝正反应方向移动C .升高温度,c (HCO -3)c (CO 2-3)减小答案题组一 盐类水解的概念和离子方程式的书写1.(2011·济宁质检)广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是水解物质和水分别离解成两部分,然后两两重新结合成新的物质。
根据信息,下列说法不正确的是( )A .CaO 2的水解产物是Ca(OH)2和H 2O 2B .PCl 3的水解产物是HClO 和PH 3C .Al 4C 3的水解产物之一是CH 4D .Al 2S 3的水解产物是Al(OH)3和H 2S2.下列离子方程式属于盐的水解,且书写正确的是( )A .NaHCO 3溶液:HCO -3+H 2O 2-3+H 3O +B .NaHS 溶液:HS -+H 2O 2S +OH -C .Na 2CO 3溶液:CO 2-3+2H 2O2CO 3+2OH -D .NH 4Cl 溶于D 2O 中:NH +4+D 2ONH 3·D 2O +H +3.现有S 2-、SO 2-3、NH +4、Al 3+、Na +、SO 2-4、AlO -2、Fe 3+、HCO -3、Cl -等离子,按要求填空:(1)在水溶液中,该离子水解呈碱性的是________________________________________________________________________。