2018_2019学年高中化学第1章化学反应与能量转化章末小结与测评课件鲁科版选修420180907315
- 格式:pdf
- 大小:1.38 MB
- 文档页数:5

章末达标检测卷(一)一、选择题(本题包括15个小题,每小题3分,共45分)1.下列设备工作时,将化学能转化为热能的是()A B C D硅太阳能电池锂离子电池太阳能集热器燃气灶解析能;C项是太阳能转化成热能;D项是化学能转化成热能。
答案:D2.已知X+Y===M+N为吸热反应,对该反应的下列说法中正确的是()A.X的能量一定低于M的能量B.Y的能量一定低于N的能量C.X和Y具有的总能量一定低于M和N具有的总能量D.因该反应为吸热反应,故该反应一定要加热才可发生解析:吸热反应是指反应物所具有的总能量比生成物所具有的总能量低,而不能特指某物质所具有的能量比另一物质所具有的能量高或者低,除非已给数据可以计算各自数据.对于吸热反应并不一定都需要加热才可以发生.答案:C3.下列叙述不正确的是()A.电解池的阳极上发生氧化反应,阴极上发生还原反应B.原电池跟电解池连接后,电子从原电池的负极流向电解池的阴极,经过溶液到达电解池的阳极,然后再回流到原电池的正极C.电镀时,电镀池中的阳极发生氧化反应D.用惰性电极电解饱和食盐水时,在阴极区得到氢氧化钠溶液和氢气解析:电解池中阳极上失去电子发生氧化反应,阴极上得到电子发生还原反应,A项正确;电子不能通过溶液,电子的流向是从原电池的负极流向电解池的阴极,从电解池的阳极流向原电池的正极,B项错误;电镀池属于电解池,则电镀池中的阳极发生氧化反应,C项正确;用惰性电极电解饱和食盐水时,阴极上水电离出的氢离子放电生成氢气,阴极区溶液中氢氧根离子浓度增大,与钠离子结合生成氢氧化钠,D项正确.答案:B4.下列说法或表示方法正确的是( )A.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出的热量多B.由反应C(s,石墨)===C(s,金刚石) ΔH=+1。
90 kJ/mol可知,金刚石比石墨稳定C.在101 kPa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ的热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l)ΔH=-285。


高中化学鲁科版选择性必修1第一章化学反应与能量转化单元小结高中化学鲁科版(2019)选择性必修1第一章化学反应与能量转化单元小结一、单选题1.已知H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ/mol,则反应HCl(g)=12H2(g)+12Cl2(g)的△H为()A.+184.6kJ/mol B.-92.3kJ/mol C.-369.2kJ/mol D.+92.3kJ/mol2.以石墨作电极,电解AgNO3溶液,可在两极分别得到Ag和O2,下列说法正确的是A.氧化性:Ag+ > H+,还原性:NO-3> OH-B.Ag附着在阳极:Ag+ + e-=AgC.电解过程中溶液的酸性将逐渐减弱D.电路中每转移1mol电子,可生成1molAg和0.25molO23.下列关于电解CuCl2溶液(如图所示)的说法中,不正确...的是()A.阴极石墨棒上有红色的铜附着B.阳极电极反应为:2Cl--2e-=Cl2C.电解过程中,Cl-和OH-向阳极移动D.总反应为:CuCl2=Cu2++2Cl-4.化学反应都伴随着能量变化,下列反应中属于吸热反应的是()A.氯化铵的水解B.SO2的催化氧化C.工业合成氨D.生石灰吸收水5.海港、码头的钢制管桩会受到海水的长期侵蚀,常用外加电流法对其进行保护,如图所示,其中高硅铸铁为惰性辅助阳极。
下列说法不正确...的是A .钢制管桩应与电源的负极相连B .通电后外电路的电子被强制流向钢制管桩C .高硅铸铁及钢制管桩周边没有电极反应发生D .保护电流应该根据环境条件变化进行调整6.一个化学反应无论是一步完成还是分几步完成,反应热都是一样的。
该定律称为盖斯定律。
依据图示关系,下列说法不正确...的是A .石墨燃烧是放热反应B .1 mol C(石墨)和1 mol CO 分别在足量O 2中燃烧,全部转化为CO 2,后者放热多C .C(石墨) +12O 2(g) = CO(g) ΔH =ΔH 1-ΔH 2 D .化学反应的ΔH ,只与反应体系的始态和终态有关,与反应途径无关7.2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家,磷酸铁锂锂离子电池充电时阳极反应式为,+44LiFePO -Li +FePO -→x xe x x ,电池放电时,锂离子从石墨晶体中脱嵌出来,通过隔膜迁移到磷酸铁锂晶体表面,然后重新嵌入到磷酸铁锂的晶格内,放电工作示意图如图。

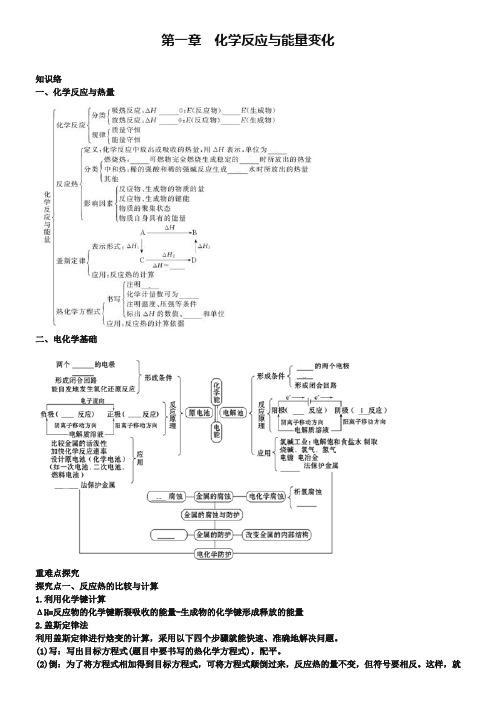
第一章化学反应与能量变化知识络一、化学反应与热量二、电化学基础重难点探究探究点一、反应热的比较与计算1.利用化学键计算ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量2.盖斯定律法利用盖斯定律进行焓变的计算,采用以下四个步骤就能快速、准确地解决问题。
(1)写:写出目标方程式(题目中要书写的热化学方程式),配平。
(2)倒:为了将方程式相加得到目标方程式,可将方程式颠倒过来,反应热的量不变,但符号要相反。
这样,就不用再做减法运算了。
方程式相减时容易出错要特别注意。
(3)乘:为了将方程式相加得到目标方程式,可将方程式乘以某 个数(可以是分数),反应热也要相应地乘。
(4)加:上面的几个方面做好了,只要将方程式相加即可得目标方程式,反应热也据此相加得出。
3.根据热化学方程式计算(1)根据热化学方程式计算:热化学方程式中ΔH 与各物质的物质的量(质量、体积等)对应成比例,已知热化学方程式,便可计算一定量的反应物发生反应所放出的热量或放出一定量的热量时消耗或生产的物质的质量、体积和物质的量。
常用的计算方法有列方程或方程组法、平均值法、极限法、十字交叉法、估算法等。
(2)根据计算书写热化学方程式:根据一定量的反应物或生成物的量计算出反应放出或吸收的热量,换算成1 mol 反应物或生成物的热效应,书写热化学方程式。
【典例1】已知:(1)ΔH=-348.3 kJ ·mol -1(2) ΔH=-31.0 kJ ·mol -1则Zn(s)+Ag 2O(s)====ZnO(s)+2Ag(s)的ΔH 等于( )A .-317.3 kJ ·mol -1B .-379.3 kJ ·mol -1C .-332.8 kJ ·mol -1D .317.3 kJ ·mol -1A 【解析】根据“四字方针”写、倒、乘、加,Ag 2O(s)和Ag(s)在反应(2)中是生成物和反应物,而在目标方程式中是反应物和生成物,所以,应将反应(2)颠倒再与反应(1)相加得:Zn(s)+Ag 2O(s)====ZnO(s)+2Ag(s),ΔH=-348.3 kJ ·mol -1+31.0 kJ ·mol -1=-317.3 kJ ·mol -1。
