新兽药临床试验申请表
- 格式:doc
- 大小:34.50 KB
- 文档页数:5

新兽药(生物制品除外)临床试验申请表
申请单位(盖章):
兽药名称:
申请日期:年月日受理日期:年月日
上海市畜牧办公室制
填表说明
1. 本表须用黑色钢笔、签字笔填写,也可以自制,用A4纸打印,一式二份。
一份表格仅限于一个产品,不同产品需另行填写。
字迹不清、项目填写不全者,不予受理。
2. 本表1~5栏由申请单位填写。
3. 6~8栏由上海市畜牧办公室填写。
4. 本表签章复印件无效。
申报新兽药临床试验,必须提交以下资料:
1.新兽药(生物制品除外)临床试验申请表一份;
2.申请报告一份(内容包括研制单位基本情况,新兽药名称、来源和特性);
3.临床试验方案原件一份
4.委托试验合同书正本一份;
5.试验承担单位资质证明复印件一份;
6.农业部认定的兽药安全评价实验室出具的安全性评价试验报告及其他临床前研究资料一份;
7.试制产品生产工艺、质量标准(草案)、试制研究总结报告及检验报告;
8.试制单位《兽药GMP证书》和《兽药生产许可证》复印件。

新兽药临床试验申请表
申请单位(盖章):
兽药名称:
申请日期:年月日
受理日期:年月日
中华人民共和国农业部制
填表说明
1.
本表须用黑色钢笔、签字笔填写,也可以自制,用A4纸打印,一式二份。
一份表格仅限于一种制品,不同制品需另行填写。
字迹不清、项目填写不全者,不予受理。
2. 本表1~5栏由申请单位填写。
3.
6栏由拟实施临床试验单位所在地省级畜牧兽医行政管理部门填写,并签字、盖章。
4.
7~8栏由申报单位所在地省级畜牧兽医行政管理部门填写,并签字、盖章。
5. 本表签章复印件无效。
申请编号:
精品文档word文档可以编辑!谢谢下载!。

临床实验方案申请表申请人姓名:_____________________申请日期:_____________________一、研究方案概述研究题目:研究目的:研究设计类型:研究受试者人数估计:研究地点:研究周期:研究经费预算:二、研究背景与目的请简要描述研究的背景,并明确研究的目的。
三、研究设计与方法1. 研究类型请标明该实验属于哪种类型的研究(例如前瞻性队列研究、随机对照试验等),并说明为什么选择此种研究设计。
2. 研究受试者请描述研究计划中受试者的招募标准,并说明研究受试者的数量及受试者的来源。
3. 干预措施请详细描述研究计划中的干预措施,包括药物、手术、治疗等。
4. 观测指标请列出研究计划中的主要观测指标,并解释为什么选择这些指标。
5. 数据收集和处理请描述数据的收集方式和数据处理的方法,并解释为什么选择这些方法。
6. 伦理准备是否已获得相关伦理委员会的批准?若已获得,请提供伦理委员会的批准文件的编号和日期。
7. 预期结果请简要描述你预期的研究结果,以及对该领域的贡献。
四、研究计划及预算请详细描述研究计划的时间表和研究经费的预算。
请列出每个时间节点的主要工作内容与预计完成时间,以及各项经费的具体用途。
五、团队成员及分工请列出参与研究计划的研究人员姓名和职称,并说明每位成员的具体分工。
六、科研保密及知识产权保护声明请就科研保密和知识产权保护方面做出明确的声明,确保研究成果的合法性和权益保护。
七、参考文献请列出参考文献,确保研究计划的科学性和可靠性。
以上为临床实验方案申请表的内容,申请人请按照表格要求填写相关信息,并提交至相关部门审核。
祝您申请成功,研究顺利!。
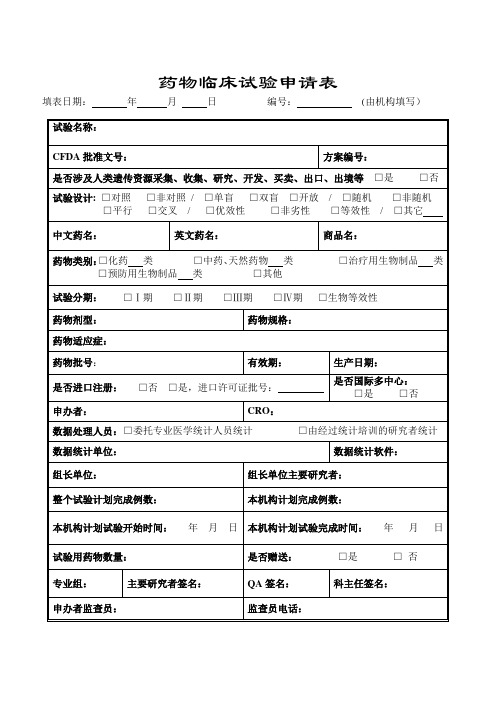
药物临床试验申请表填表日期:年月日编号:(由机构填写)有时候想拼命的攀登,但总是力不从心。
可是,每个人境况是不同的,不要拿别人的标准,来塑造自己的人生。
太多的失望,太多的落空,纯属生活的常态。
岁月告诉我:挫败,总会袭人,并且,让你承受,但也,负责让你成长。
人生漫长,却又苦短,幽长的路途充满险阻,谁不曾迷失,谁不曾茫然,谁不曾煎熬?多少美好,毁在了一意孤行的偏执。
好也罢,坏也罢,人生的路,必须自己走过,才能感觉脚上的泡和踏过的坑。
因为懂得,知分寸;因为珍惜,懂进退。
最重要的是,与世界言和,不再为难自己和别人。
《菜根谭》中说:花看半开,酒饮微醉。
就是说,做事不必完美,享乐不可享尽,这是一种含苞待放的人生状态。
即使是最美的月亮,也会有盈亏的自然之道。
否则便是过犹不及,弄巧成拙。
心灵松绑了,活着才自由。
半生已过,走走停停,看透了生活,选择了顺流的方式,行走。
流水今日,明月前身。
感谢每一粒种子,每一缕清风,每一个阳光的日子,于时光的碎屑中,静品一盏流年的香茗。
撕开浮云的遮掩,其实,每个人心中都有各自的山水,都有一段难捱的时光,好在,总有一天,你的淡然低调,你的暗自努力,你的理性豁达,终将点燃你的整个世界,让故事的结局,美好而温柔。
苏轼在《水调歌头》里写道:人有悲欢离合,月有阴晴圆缺,此事古难全。
是的,层次越高的人,越懂得,人生本就不是尽善尽美,也正因为有了缺憾,才显得是那么的多姿多彩。
心情平和,与是非渐行渐远,再多的兵荒马乱,也抵不过时光的洪流,唯有日常才惊天动地。
夫切菜,妻拌菜,菜菜交缠,洒在热腾腾的面条上,剥头蒜就着,哧啦哧啦的,心里爽透了。
这世间最美的,不就是这样的烟火么。
人生,是一个苏醒的过程。
一首经典,低徊吟唱,年少不知歌者意,再听已是曲中人。


新兽药生物制品除外临床试验申请表申请人基本信息•申请人姓名:______________•申请人职称:______________•申请人电话:______________•申请人邮箱:______________申请药品基本信息•药品名称:______________•药品分类:______________•研究人群:______________•进口/国产:______________•生产企业:______________•样品基本信息:______________试验计划研究设计•研究类型:______________•设计类型:______________•分组情况:______________•干预情况:______________•观察时间:______________研究对象•研究对象总数:______________•男性:______________•女性:______________•年龄范围:______________•入选标准:______________试验药品•给药途径:______________•给药剂量:______________•给药时间:______________•用药周期:______________观察指标•主要观察指标:______________•次要观察指标:______________安全性•不良事件采集方式:______________•不良事件分类标准:______________•不良事件处理方式:______________数据管理和统计分析•数据管理:______________•统计分析方法:______________伦理与法律•伦理委员会意见:______________•受试者知情同意书:______________•试验执行机构名称:______________备注•其他需要说明的事项:______________。
附件1流水号:新兽药注册申请表申请单位:申请日期:中华人民共和国农业部制填表说明1.通用名称:应当使用正式颁布的兽药国家标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。
申报复方制剂或者中兽药制剂自拟兽药名称的,应当预先进行兽药名称核查工作。
2.英文名称/拉丁名:英文名填写INN英文名;中兽药制剂没有英文名的,可以免填;申报中药材的需提供拉丁名。
3.品种类别:按照《兽药注册资料要求》填写。
4.注册分类:按照《兽药注册资料要求》填写。
5.是否特殊管理兽药:属于兽用麻醉药品、精神药品、医疗用毒性药品、放射性药品管理办法管理的特殊药品,应分别选填。
6.专利:所申请兽药的专利情况应当经过检索后确定,发现本品已在中国获得保护的有关专利信息均应填写。
本项申请实施了其他专利权人专利的,应当注明是否得到其实施许可。
已知有外国专利的,注明专利权人。
7.同品种境外是否获准上市:系指同品种境外上市情况。
境外已经获准上市的,应填写上市国家或地区名称、所有人、批准机关、批准日期及相关链接,已在多个国家或地区上市的应逐一填写。
8.委托试验单位相关信息:委托其他试验单位完成的试验,如药动学试验、药敏试验、临床试验等,应逐项填写该试验单位的名称、试验负责人、联系电话等。
9.本项内容是各申请机构对于本项申请符合法律、法规和规章,以及注册资料、数据、样品真实性、合法性等的郑重保证,各申请机构应当一致同意。
10.其他特别申明事项:需要另行申明的事项。
11.中试生产企业相关信息:中试生产企业是指具备本产品生产条件,申请生产本产品并提供质量复核用样品的生产企业;尚不具备生产条件或尚未确定本产品生产企业的,填中试样品委托生产企业。
12.注册申请联系人:是指具体办理注册事务的联系人,用于通知缴费、接收评审意见等。
对于联合申请注册的,应指定具体的注册申请单位及联系人。
在注册申请过程中联系人发生变更,请及时与相关机构人员联系,以免不能及时获得信息,耽误注册。
临床试验申请表(申办者)申请日期:年月日机构受理号(由GCP办公室填写):项目名称类别(请在□内划×)□药物临床试验(□中药□化学药□生物制品□其他)注册分类:临床试验分期:□Ⅱ期□Ⅲ期□Ⅳ期□其他□医疗器械临床试验,注册分类:□诊断试剂临床试验试剂种类:□二类□三类□其他试验分类:□新研制体外诊断试剂□已有同品种批准上市产品□变更申请□进口注册产品□研究者发起的临床试验,资助情况:□其他申办单位批件号临床研究预期起止时间参加试验的中心数组长单位组长单位主要研究者本机构研究科室本机构主要研究者本研究的总病例数本机构拟承担病例数备案资料目录(请在口内划×):1.资料目录2.临床试验申请表(申办者)3.国家食品药品监督管理局临床试验批件或注册批件4.申办单位委托本机构开展临床试验的委托书5.若药物临床试验批件的申请人与委托本机构的申办单位不一致时,提供转让合同等相关证明文件6.申办者资质证明(企业法人营业执照、组织机构代码证等)7.药品生产许可证8.药品生产GMP证书9.申办者对CRO的委托函10.CRO资质证明11.监查员的介绍信(附身份证复印件和GCP培训证书复印件)12.试验药物及对照药检验合格报告13.研究者手册(版本号/日期)14.临床研究方案(版本号/日期)15.知情同意书(版本号/日期)16.研究病历(版本号/日期)17.病例报告表(版本号/日期)18.保险声明19.组长单位伦理委员会批件(若本中心为参加单位)20.各参加研究单位及主要研究者名单21. 自我提交资料的真实性保证申明及承担法律责任的承诺22.药品超温说明23.中心实验室资质(如需要)24.其他资料(注明)□□□□□□□□□□□□□□□□□□□□□□□□第1页共2页主要研究内容监查员:联系电话:传真:填表人签名(签字盖章有效):日期:以下由GCP办公室填写GCP办公室秘书审核资料签署意见签名日期GCP办公室主任签署意见签名日期机构副主任签署意见签名日期机构主任签署意见签名日期备注:表格填写不得空项,共2页,双面打印,填表人签名签日期,加盖申办者公章后,交至GCP 办公室。
新兽药临床试验申请表
申请单位(盖章):
兽药名称:
申请日期:年月日受理日期:年月日
中华人民共和国农业部制
填表说明
1. 本表须用黑色钢笔、签字笔填写,也可以自制,用A4纸打印,一式二份。
一份表格仅限于一种制品,不同制品需另行填写。
字迹不清、项目填写不全者,不予受理。
2. 本表1~5栏由申请单位填写。
3. 6栏由拟实施临床试验单位所在地省级畜牧兽医行政管理部门填写,并签字、盖章。
4. 7~8栏由申报单位所在地省级畜牧兽医行政管理部门填写,并签字、盖章。
5. 本表签章复印件无效。
申请编号:
7.有效期自年月日至年月日
8.备注。