医院植入医疗器械知情同意书
- 格式:doc
- 大小:20.50 KB
- 文档页数:1

心脏起搏器植入手术知情同意书背景心脏起搏器植入手术是一种常见的治疗心脏病的方法,通过植入起搏器来帮助控制心脏节律,改善心脏功能。
在进行该手术前,医生需要向患者充分解释手术的目的、过程、风险以及术后护理等内容,确保患者对手术有全面的了解并能够做出知情同意。
手术目的心脏起搏器植入手术旨在治疗心律失常、心脏传导阻滞等疾病,帮助恢复正常的心脏节律,提高心脏功能,减少症状和风险。
手术过程心脏起搏器植入手术一般分为以下几个步骤:1. 术前准备:包括检查患者的身体情况、心脏功能评估以及血液检测等。
2. 局麻:在手术区域进行局部麻醉,使患者在手术过程中不会感到疼痛。
3. 切口:医生会在胸部麻醉区域进行手术切口,以便插入起搏器导线和植入器。
4. 插入导线:医生会通过血管将起搏器导线引入心脏,并定位在适当的位置。
5. 植入器植入:医生将起搏器植入器插入切口,并将起搏器与导线连接。
6. 测试和调试:医生会进行起搏器的测试和调试,以确保其正常工作。
7. 缝合切口:手术结束后,医生会缝合手术切口,完成手术。
风险和并发症尽管心脏起搏器植入手术在大多数情况下是安全的,但仍然存在一定的风险和并发症,包括但不限于:- 感染:手术切口可能会感染,需要进行抗生素治疗。
- 出血:手术过程中可能会出现局部或全身性出血。
- 漏气:手术过程中可能会导致肺部气胸。
- 心脏穿孔:在插入导线过程中,可能会发生心脏穿孔,需要立即处理。
- 起搏器失灵:起搏器可能会出现失灵,需要进一步修复或更换。
术后护理术后,患者需要注意以下事项:1. 定期复诊:根据医生的建议进行定期复诊,以监测起搏器的功能。
2. 注意感染:保持手术切口干燥、清洁,并根据医生建议更换敷料。
3. 避免剧烈运动:术后一段时间内避免剧烈运动,以免影响起搏器的正常工作。
4. 一般注意事项:遵循医生的建议,保持良好的生活方式和心理状态,定期检查心脏。
同意声明我已充分了解心脏起搏器植入手术的目的、过程、风险和术后护理,并经过医生的解释和讨论,现已清楚地理解并同意接受该手术。

工作文档医疗器械临床试验用知情同意书在医疗器械临床试验过程中,保护受试者的权益和安全至关重要。
为了确保受试者充分了解试验的目的、过程、风险和可能的好处,知情同意书作为一个重要的工作文档被广泛使用。
本文将探讨知情同意书的重要性、内容以及编写过程中需要注意的事项。
1. 知情同意书的重要性知情同意书是医疗器械临床试验中确保受试者知情同意的关键文件。
它对于保护受试者的自主权、隐私权和身体权益起到了重要的作用。
同时,知情同意书也是研究者和机构之间的法律文件,明确了双方的责任和义务。
2. 知情同意书的内容知情同意书应包含以下重要内容:2.1 试验目的和假设明确试验的目的、研究问题和假设,让受试者理解他们参与试验的重要性和意义。
2.2 试验设计和程序详细描述试验的设计、程序和持续时间,包括受试者会接受的任何测试、操作或治疗。
2.3 风险与好处清楚地列出试验过程中可能的风险和不适,并说明可能的好处和可能带来的前景。
对风险与好处进行真实准确的描述,确保受试者有充分的信息做出知情决策。
2.4 受试者权益和保障说明受试者的权益,例如保密性、自主权以及对试验过程中的随时退出的权利。
同时也提到跟踪受试者的长期安全性评估和相关数据保护措施。
2.5 赔偿及保险解释试验中的赔偿措施和受试者能否享受与试验相关的医疗保险。
2.6 关联机构和人员的联系方式提供试验负责人、研究者和监管机构的联系方式,便于受试者在试验过程中遇到问题时进行咨询和报告。
3. 知情同意书的编写过程编写知情同意书时,需要注意以下事项:3.1 清晰简明的语言使用简单清晰的语言,避免使用专业术语和复杂的句子结构。
确保受试者能够理解文中的内容。
3.2 遵守伦理指南和法律法规知情同意书应符合伦理指南和法律法规的要求。
在编写过程中,可参考相关指南和规定,确保内容的合法性和伦理性。
3.3 涵盖试验相关的所有信息确保知情同意书覆盖试验的所有关键信息,包括试验的目的、过程、风险和可能的好处。

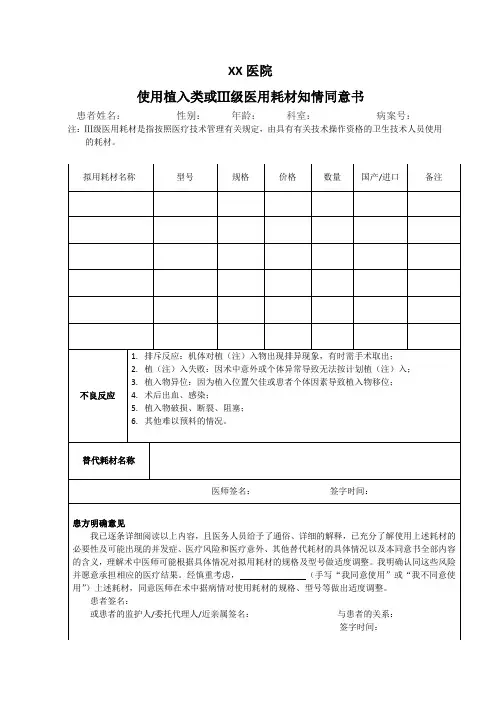
植入性医疗器械使用知情同意书
患者姓名:性别:年龄:岁科室:住院号:
诊断:食管癌
手术(或检查治疗)名称:食管癌沙氏探条扩张术+覆硅胶膜食管支架置入术
植入性医疗器械产品名称:覆硅胶膜食管支架
植入性医疗器械可能发生的风险及可能产生的后果:
1.术中出血或迟发出血;
2.消化道急性或迟发穿孔;
3.支架移位或滑脱,需重新放置;
4.治疗后不适,如胸痛、胸闷、烧心、异物感等,严重者可能需要取出支架。
5.心、脑血管意外;
6.其他不可预见的情况。
准备采取的应对措施:
1.适度扩张,小心、轻柔操作,如扩张困难可考虑暂时不放置支架;
2.支架放置后再次确定位置是否合适;
3.支架放置后对症治疗,如止痛、抑酸、止血等;
4.如出现大出血或穿孔,需要手术治疗。
5.其他视具体情况做相应处理。
医师签名:
签字时间:20 年月日
患者(或家属、代理人)意见:
签字人与患者关系:签名:
签字时间:20 年月日
植入性医疗器械使用登记表
姓名:性别:年龄:科室:床号:住院号:术前诊断:食管癌
手术名称:食管癌沙氏探条扩张术+覆硅胶膜食管支架置入术
植入性医疗器械资料粘贴处。
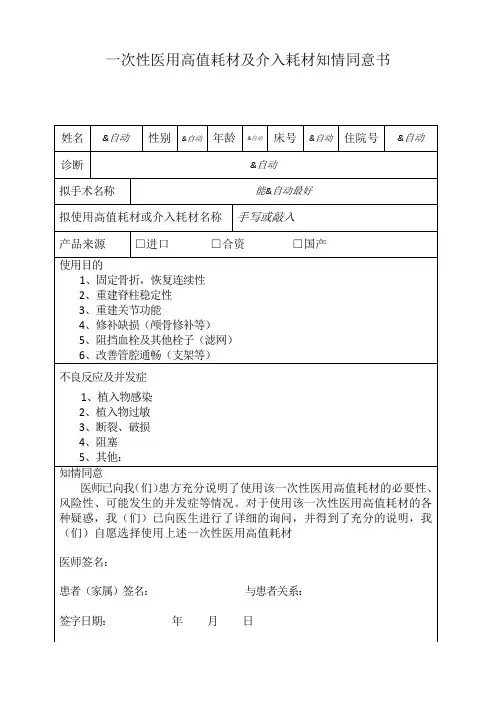


甘肃省武威肿瘤医院
125I粒子植入知情同意书
姓名:性别:年龄:岁科室:床号:住院号:
诊断:
影像引导下125I粒子植入术是肿瘤局部治疗的新方法,具有控制肿瘤、缓解症状、减轻痛苦及延长生命的作用,已成为肿瘤综合治疗的主要手段之一。
但此手术术中及术后可能发生以下意外和/或并发症,特向患者及家属说明:
1、麻醉意外,严重者可导致休克;
2、术中使用药物过敏引起皮疹,喉头水肿、窒息等,严重者可引起过敏性休克危及生命;
3、手术应激促使发生心,脑血管意外,严重者可引起心衰或肢体感觉运动功能障碍,甚至死亡;
4、手术无法按拟定方案完成需变更处理;术前不可预知事件发生造成身心创伤;
5、引起气胸或血气胸;肠道、脏器损伤造成肠道破裂穿孔、胰瘘、腹膜炎;
6、穿刺过程中引起大出血、失血性休克,甚至危及生命;
7、肿瘤沿针道种植、肿瘤破裂出血;
8、术后可出现发热、感染、胸痛、咳嗽、气短、咯血等不适症状;
9、粒子移位,致异位栓塞,如脑栓塞、肺栓塞、肢体末端栓塞;
10、肿瘤复发或病情进展;
11其他:
我们的医护人员将严格按照规程进行介入操作治疗,努力避免上述意外和并发症的发生。
在发生上述意外或并发症时会采取积极的治疗补救措施,同时敬请患者家属谅解。
并保证在出现上述并发症时,不追究医务人员的责任。
如同意介入治疗,请您签字,谢谢。
患者签字:(盖章)
受委托人签字:(盖章)
医师签字:(盖章)
年月日。

高级医疗器械使用知情同意书本知情同意书由甲方(医疗机构名称)和乙方(患者姓名)签署,旨在确保乙方在接受高级医疗器械治疗前完全理解其风险和利益,并自愿同意接受治疗。
1.治疗描述:乙方已被告知接受高级医疗器械治疗的目的、过程和预期效果。
这包括任何可能的风险和副作用。
2.风险与副作用:乙方已被告知接受治疗可能存在的风险和副作用,包括但不限于:(列举可能的风险和副作用)。
3.其他选择:乙方已被告知关于治疗的其他选择,并已理解高级医疗器械治疗与其他治疗方法之间的相对优劣。
4.后果与保证:乙方承认并同意,治疗结果可能因个体差异而有所不同。
医疗机构和医务人员无法对治疗效果做出100%的保证。
5.自愿同意:乙方确认已经接受详细解释和咨询,并完全理解治疗的各个方面,包括风险和预期效果。
乙方明确表示自愿接受治疗,理解并接受治疗带来的一切风险。
6.后续治疗:乙方明白,在治疗之后可能需要进一步的检查、治疗或康复措施。
乙方同意遵守医疗机构提供的后续治疗建议。
7.取消同意:乙方保留在治疗开始前取消同意的权利。
乙方应在取消同意前与医疗机构取得联系。
8.法律责任:乙方确认知情同意书的内容,并明白签署本同意书意味着乙方放弃任何法律索赔的权利,除非由于医疗机构的严重过失导致不可预见的损害。
我已经详细阅读并理解上述内容,在签署本知情同意书之前,我已得到了满意的解释和咨询。
我愿意自愿接受高级医疗器械治疗,并确认同意上述条款。
签署日期:________ 年 _____ 月 _____ 日签署地点:____________________________甲方(医疗机构名称):___________________ 乙方(患者姓名):_______________________。

高效医疗器械使用知情同意书
本文档旨在确保在使用医疗器械前,您对相关事项有清晰的了解和知情同意。
请在使用医疗器械之前仔细阅读并签署本同意书。
1. 目的
本同意书的目的是保障您在使用医疗器械时的权益和安全,以确保医疗器械的高效使用。
2. 医疗器械说明
请您在使用医疗器械之前,仔细了解以下内容:
- 医疗器械名称:
- 医疗器械用途:
- 医疗器械操作方法:
- 医疗器械使用风险:
3. 知情同意
在签署本同意书之前,请确保您已经了解以下内容,并且对使用医疗器械的风险和效果有充分的认识:
- 医疗器械的使用风险和可能的副作用;
- 使用医疗器械可能带来的效果和结果;
- 如何正确操作和维护医疗器械;
- 在使用医疗器械过程中需要遵守的注意事项;
- 如果出现异常情况,应当及时与医疗人员联系。
4. 同意和责任
请在签署本同意书之前,确认以下内容:
- 我已充分阅读并理解本知情同意书的内容;
- 我已经向您提供了对我来说足够的解释和信息;
- 我同意按照医疗人员的指导和要求使用医疗器械;
- 我愿意承担因使用医疗器械而可能产生的风险和后果。
5. 签署
请在下方签署您的姓名和日期,表示您已经阅读并同意上述内容:
姓名:__________________
日期:__________________
请您保留本知情同意书的副本作为参考。
以上为《高效医疗器械使用知情同意书》的内容。
请您在使用医疗器械之前,仔细阅读并签署此文件。
如有任何疑问,请及时与医疗人员沟通。

医方如何正确签署医疗知情同意书知情同意书,作为医疗行为中的一个重要法律文书,但如今由于种种原因,医生工作繁忙、责任心不强亦或是本身就不知道如何正确签署,导致知情同意书签字环节出现问题,面临失去法律效力的窘境。
* 案例阐述*患者陈某因不稳定性心绞痛、心脏梗死等症状入南京市某医院行冠状动脉造影+支架+IVUS术。
术中,医生植入支架后发现其贴壁不是很好,在此情况下,要放入球囊进行扩张。
不巧的是,医院以前买的球囊刚好用完。
然而,此时正好有一批某医疗器械有限公司的球囊在做验证。
考虑患者情况紧急,为使手术更加成功,医院口头征询了半麻醉状态下的陈某的同意后,就使用了该球囊。
手术成功完成后,医院找陈某补签临床试验同意书,并将知情同意书直接翻到最后签署页,让其签字。
陈某及其家人提出质疑,称医院未经其同意使用球囊并使陈某精神遭受了较大损害。
后陈某诉至法院。
法院判决——法院经审理认为,医方未在手术前告知原告可能需要使用到球囊以及关于球囊的临床试验,即使如医方所说在手术中征得了原告的同意并且事后原告补签了知情同意书,仍然违反了在试验前向受试者详细说明并征得受试者同意的原则,因此医院没有充分履行说明义务,存在过失。
同时,尽管陈某不存在身体健康的损害后果,但是医院未充分履行知情同意义务,侵害了陈某的自主决定权,造成了其精神损害。
最终,法院判决医院赔偿陈某精神抚慰金25000元。
虽然说,诊治结果是非常成功的,但医院因未充分履行知情同意义务需承担责任。
这个结果对医院而言是否要求过高?面对这个问题,我们不能只简单回答是或否,而是应明白其背后的法律风险及应对措施。
一、什么是知情同意?我国《侵权责任法》第五十五条中规定:“医务人员在诊疗活动中应当向患者说明病情和医疗措施。
需要实施手术、特殊检查、特殊治疗的,医务人员应当及时向患者说明医疗风险、替代医疗方案等情况,并取得其书面同意;不宜向患者说明的,应当向患者的近亲属说明,并取得其书面同意。
医疗器械手术知情同意书尊敬的______________女士/先生您因患______________________须手术治疗被邀请参加一项关于的临床研究,请您在听取了医生的说明并仔细阅读下列信息后,再决定是否参加本项研究。
是在市场应用多年的成熟产品,为了更好的服务中国市场,常州迪恩医疗器械有限公司生产的已经通过天津医疗器械质量检验中心的注册检测,其质量完全合格(如对产品质量有异议, 您有权向天津医疗器械质量检验中心申请鉴定)。
拟申请在我国上市,经国家食品药品监督管理局同意,在江苏省苏北人民医院进行临床验证。
预对进行临床应用评价,验证对患者的有效性和安全性。
研究是通过将常州迪恩医疗器械有限公司(验证组)研制的与已上市的常州市康辉医疗器械有限公司(对照组)生产的同类产品进行对比,比较结果来确定常州迪恩医疗器械有限公司研制的临床使用的安全性和有效性。
作为参加临床研究的志愿者,您需要对以下情况进行了解和确认,以保证您的权益。
1 本研究严格遵守《赫尔辛基宣言》人体生物医学研究的伦理准则,本研究方案和《知情同意书》已获得江苏省苏北人民医院伦理委员会审核批准,并将在他们的监督下严格按照《医疗器械临床试验规定》的要求进行。
2本研究为随机的临床试验,研究中您将有同等机会被分配到使用常州迪恩医疗器械有限公司或常州市康辉医疗器械有限公司生产的。
此研究不会增加您的任何医疗费用,您不能从这项临床研究中获得个人的补偿。
(1)对照组您手术植入所使用的产品是目前已有注册证并正常销售的医疗器械有限公司的产品,因此您需要按正常情况支付手术所需要的内固定器费用。
但在试验中,您的术后四次X光片检查费用是免费的,您应根据试验方案配合检查和治疗。
(2)验证组您手术植入所使用的产品是医疗器械有限公司生产的锁定钢板内固定系统,您在本试验期间手术治疗的内固定器是免费的。
在试验中,您应根据试验方案配合检查和治疗。
3 您的隐私权将得到保护,所有研究记录都将保密。
医方如何正确签署医疗知情同意书知情同意书,作为医疗行为中的一个重要法律文书,但如今由于种种原因,医生工作繁忙、责任心不强亦或是本身就不知道如何正确签署,导致知情同意书签字环节出现问题,面临失去法律效力的窘境。
* 案例阐述*患者陈某因不稳定性心绞痛、心脏梗死等症状入南京市某医院行冠状动脉造影+支架+IVUS术。
术中,医生植入支架后发现其贴壁不是很好,在此情况下,要放入球囊进行扩张。
不巧的是,医院以前买的球囊刚好用完。
然而,此时正好有一批某医疗器械有限公司的球囊在做验证。
考虑患者情况紧急,为使手术更加成功,医院口头征询了半麻醉状态下的陈某的同意后,就使用了该球囊。
手术成功完成后,医院找陈某补签临床试验同意书,并将知情同意书直接翻到最后签署页,让其签字。
陈某及其家人提出质疑,称医院未经其同意使用球囊并使陈某精神遭受了较大损害。
后陈某诉至法院。
法院判决——法院经审理认为,医方未在手术前告知原告可能需要使用到球囊以及关于球囊的临床试验,即使如医方所说在手术中征得了原告的同意并且事后原告补签了知情同意书,仍然违反了在试验前向受试者详细说明并征得受试者同意的原则,因此医院没有充分履行说明义务,存在过失。
同时,尽管陈某不存在身体健康的损害后果,但是医院未充分履行知情同意义务,侵害了陈某的自主决定权,造成了其精神损害。
最终,法院判决医院赔偿陈某精神抚慰金25000元。
虽然说,诊治结果是非常成功的,但医院因未充分履行知情同意义务需承担责任。
这个结果对医院而言是否要求过高?面对这个问题,我们不能只简单回答是或否,而是应明白其背后的法律风险及应对措施。
一、什么是知情同意?我国《侵权责任法》第五十五条中规定:“医务人员在诊疗活动中应当向患者说明病情和医疗措施。
需要实施手术、特殊检查、特殊治疗的,医务人员应当及时向患者说明医疗风险、替代医疗方案等情况,并取得其书面同意;不宜向患者说明的,应当向患者的近亲属说明,并取得其书面同意。
可编辑修改精选全文完整版请根据所申请开展的医疗新技术研究项目具体情况编写和更改(范本中的楷体字、黑体字为书写知情同意书应保留的语言,空格下划线及其它字体部分为申报者根据所申请开展的医疗新技术研究项目具体情况来填写的部分)知情同意书尊敬的患者:我们将邀请您参加一项新技术治疗研究(或临床治疗研究)。
在您决定是否参加这项研究之前,请尽可能仔细阅读以下内容,它可以帮助您了解该项新技术治疗研究(或临床治疗研究)以及为何要进行这项研究,研究的程序和期限,参加研究后可能给您带来的益处、风险和不适。
如果您愿意,您也可以和您的亲属、朋友一起讨论,或者请您的医生给予解释,帮助您做出决定是否参加此项临床(或新技术)研究。
如有任何疑问请您向负责该项新技术(或研究)的医生或研究者提出。
一. 医疗新技术项目情况介绍(1)研究背景和研究目的(本研究的目的是为了评价检查或治疗方法治疗病的有效性和安全性,其研究结果将用于新技术的临床推广或应用或证实)(2)目标疾病的常规治疗(或检查诊断)方法及特点介绍(3)关于此项临床(或新技术)研究背景资料(包括研究概况、预期参加受试者人数、是否已通过伦理委员会审核及研究目的、主要研究内容、过程与期限、检查操作、受试者预期可能的受益和风险,告知受试者可能被分配到试验的不同组别等)。
研究概况()(本研究将在新疆医科大学第一附属医院科(或研究中心)进行,预计有名受试者自愿参加)。
(本研究已经得到批准,新疆医科大学第一附属医院伦理委员会已经审议此项研究是遵从赫尔辛基宣言原则,符合医疗道德的。
)主要研究内容()过程与期限()如果参加研究将需要做以下工作:A.在您入选研究前您将接受以下检查以确定您是否可以参加研究医生将询问、记录您的病史,对您进行体格检查您需要做等理化检查B.若您以上检查合格,将按以下步骤进行研究(按随访时间点详细陈述治疗及各检查项目)治疗观察将持续天。
治疗后第天:您应治疗后第天:这时候研究结束了。
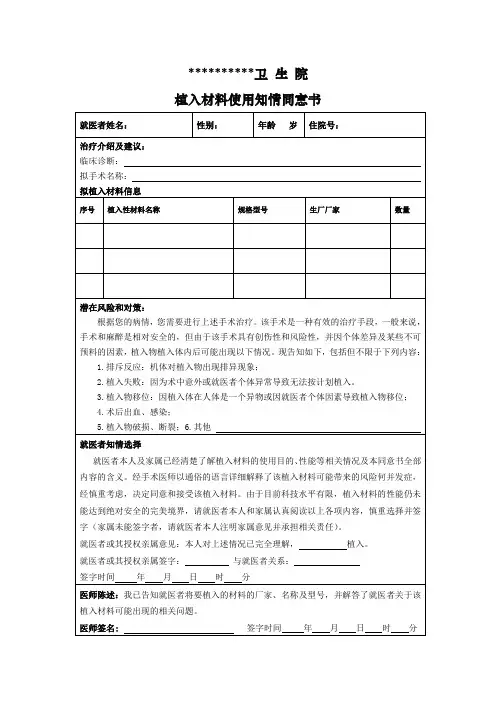
肾动脉支架植入术治疗知情同意书
姓名:性别:年龄:岁科室:床号:住院号:
诊断:肾动脉严重狭窄,经讨论可行介入诊治,以指导进一步诊治方案,改善患者临床症状。
拟定于年月日在麻醉下行肾动脉支架植入术,该诊治有可能发生以下情况的危险性:
1. 造影剂或其他药物反应,严重者可引起过敏性休克。
2. 穿刺部位出血、局部血肿、假性动脉瘤或股动静脉瘤等,必要时需外科手术。
3. 血管损伤,如穿孔、夹层、闭塞、栓塞。
4. 10%可能手术不成功,治疗无效或病情加重。
5. 手术过程中本身疾病所致意外,如心脑血管意外、心跳呼吸暂停等。
6. 其他一些无法预料的并发症及不良反应,20%可能肾功能恶化。
7. 术后各种感染(细菌、真菌、病毒等)。
8. 发生其他难以预料的、危及生命或致残的意外情况。
9. 可能出现肾功能不全、肾功能不全加重、肾动脉栓塞、肾出血坏死等并发症。
我对于上述可能出现的并发症或意外情况表示理解,同意接受该项诊治,并承担医疗风险。
并同意在意外情况下医师有先抢救病人后告知病人的权利以及愿意承担意外情况下增加的医疗费用。
患者或代理人签名:医师签名:
与患者关系:年月日。
医院植入医疗器械知情同意书
患者姓名王×× 性别男年龄 62岁住院号 8743
诊断左胫腓骨中下段骨折
需植入医疗器械名称窄动力钢板;重建钢板
价格×××;×××元
植入医疗器械可能存在的医疗风险:
⊙内固定物折弯、折断、松动、脱出、外露
⊙内固定松动、断裂等引起疼痛、不适感;甚至因移位损伤血管、神经⊙植入物对骨的蚀损造成骨延迟或不愈合
⊙对内固定材料敏感或过敏、排异反应导致疼痛、不适感甚至造成难以治愈的感染⊙内固定材料造成应力遮挡导致骨质疏松引起的并发症(如骨折发生再移位、骨延迟或不
愈合,拆后再折等)
(带锁髓内钉-----⊙锁钉松动、退出、脱落、断裂。
⊙髓内钉断裂。
⊙近髓内钉处
再骨折)。
以上情况医生巳讲明,经慎重考虑,在此我代表患者及家属对植入医疗器械手术风险表示理解,并全权负责同意植入医疗器械手术。
患者代表签字王某与患者关系病人长子
手术医生×××/××× ×××× 年× 月× 日。