化工原理第十章液-液萃取和液-固浸取
- 格式:doc
- 大小:3.17 MB
- 文档页数:13

实验15 液—液萃取实验一.实验目的1.了解液-液萃取原理和实验方法。
2.熟悉转盘萃取塔的结构、操作条件和控制参数。
3.掌握评价传质性能(传质单元数、传质单元高度)的测定和计算方法。
二.实验原理液-液萃取是分离液体混合物和提纯物质的重要单元操作之一。
在欲分离的液态混合物(本实验暂定为:煤油和苯甲酸的混合溶液)中加入一种与其互不相溶的溶剂(本实验暂定为:水),利用混合液中各组分在两相中分配性质的差异,易溶组分较多地进入溶剂相从而实现混合液的分离。
萃取过程中所用的溶剂称为萃取剂(水),混合液中欲分离的组分称为溶质(苯甲酸),萃取剂提取混合液中的溶质称为萃取相,剩余的混合液称为萃余相。
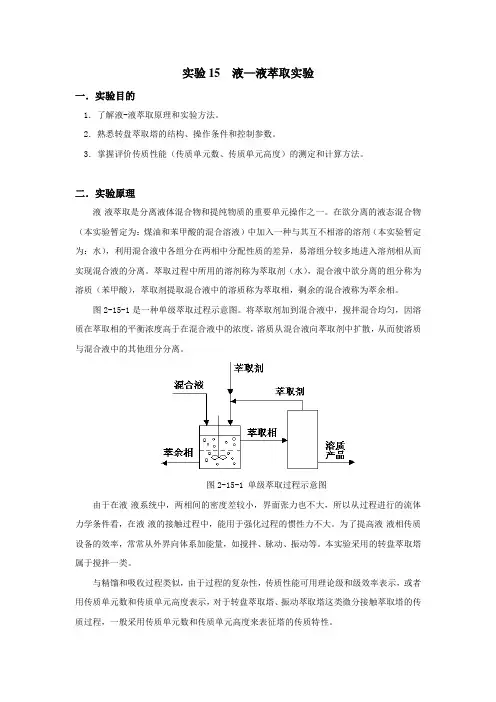
图2-15-1是一种单级萃取过程示意图。
将萃取剂加到混合液中,搅拌混合均匀,因溶质在萃取相的平衡浓度高于在混合液中的浓度,溶质从混合液向萃取剂中扩散,从而使溶质与混合液中的其他组分分离。
图2-15-1单级萃取过程示意图由于在液-液系统中,两相间的密度差较小,界面张力也不大,所以从过程进行的流体力学条件看,在液-液的接触过程中,能用于强化过程的惯性力不大。
为了提高液-液相传质设备的效率,常常从外界向体系加能量,如搅拌、脉动、振动等。
本实验采用的转盘萃取塔属于搅拌一类。
与精馏和吸收过程类似,由于过程的复杂性,传质性能可用理论级和级效率表示,或者用传质单元数和传质单元高度表示,对于转盘萃取塔、振动萃取塔这类微分接触萃取塔的传质过程,一般采用传质单元数和传质单元高度来表征塔的传质特性。
萃取相传质单元数N OE 表示分离过程的难易程度。
对于稀溶液,近似用下式表示:**ln *2112x x x x x x dxN x x OE --=-=⎰(2-15-1) 式中:N OE ——萃取相传质单元数x ——萃取相的溶质浓度(摩尔分率,下同) x * ——溶质平衡浓度x l 、x 2 ——分别表示萃取相进塔和出塔的溶质浓度。
萃取相的传质单元高度用H OE 表示:OE OE H/N H = (2-15-2)式中:H 为塔的有效高度(m )。




第六章吸收§ 1 概述一、化学工业或食品工业中的传质过程1、气体—液体系统1)吸收:物质由气相转移到液相。
2)脱吸(解吸):物质由液相转移到气相。
3)气体增湿;湿分由液相转移到气相。
4)气体减湿;湿分由气相转移到液相。
水果储藏温度为4o C,相对湿度为85%。
2、蒸汽—液体系统精馏3、液体—液体系统液—液萃取:物质由某一液相转移到互不相溶的另一液相。
4、液体—固体系统1)结晶:物质由液相向固相转移。
2)液—固萃取(浸取):物质由液相向固相转移。
3)液体吸附:物质由液相转移到固相表面。
5、气体—固体系统1)干燥:液体物质由固相表面或内部转移到气相。
2)气体吸附:物质由气相转移到固相表面。
二、相组成的表示方法1、质量分率a与摩尔分率x1) 质量分率a :某组分的质量占总质量的百分率。
2) 摩尔分率x :某组分的摩尔量占总摩尔量的百分率。
3)质量分率a 与摩尔分率x 的换算BB A A A A A M x M x M x a ⋅+⋅⋅= BB A A A AA M a M a M a x += 2、质量比a 和摩尔比X Y1)质量比a : BA m m a = 2)摩尔比X ;Y : BA n n X =3、质量浓度与摩尔浓度 1)质量浓度:单位体积均相混合物中某组分的质量。
单位:kg / m 32) 摩尔浓度:单位体积均相混合物中某组分的摩尔量。
单位:kmol / m 3三、吸收概念吸收尾气混合气体吸收液A+S吸收质或溶质A:混合气体中能够溶解的组分。
惰性组分或载体B:混合气体中不能被溶解的组分。
四、吸收操作的分类1、单组分吸收与多组分吸收2、物理吸收与化学吸收3、等温吸收与非等温吸收五、吸收剂的选择1、溶解度2、易脱吸3、选择性4、粘性5、挥发性6、其他§2 扩散现象一、概念1、扩散:当系统内部存在浓度差时,物质总要由高浓度区向低浓度区转移,这种现象称为扩散。
2、分子扩散和涡流扩散分子扩散:只依靠微观的分子运动,而无宏观的混合作用。


萃取分离技术Extraction 5.1 概述利用物质在互不相容的两相之间溶解度的不同而使物质得到分离纯化或浓缩的方法称为萃取。
目标物液体:液液萃取固体:液固萃取(浸取)有机溶剂萃取双水相萃取液膜萃取反胶束萃取超临界萃取5.2 液固萃取(浸取)¾液固萃取,又称浸取或提取,是一种分离和富集某些天然产物、生化试剂和添加剂的有效手段。
由于溶剂渗入固体试样内部是比较缓慢的过程,因此液固萃取需要较长的时间,一般需要连续萃取。
浸提分为冷浸和热浸两种:¾冷浸法:适用于提取遇热易被破坏的物质及含淀粉、树胶、果胶、黏液质的样品。
¾热浸法:由于提高温度有利于有效成分的溶解度故提取效果较冷浸好。
该方法操作时间长,浸出溶剂用量大,往往浸出效率差,不易完全浸出,不适合有效成分含量低的原料。
为了有效成分的浸出,固体样品尽量粉碎传统的液固萃取装置是利用索氏(Soxhlet)提取器浸取在食品工业中的应用食用油¾除了采用传统的压榨法外,常采用溶剂浸提其中所含的油脂。
黄豆经溶剂浸提后,豆渣中残油量往往低于l%,远较压榨法的豆渣的残油率2%~2.5%为低。
除了油料种籽可以采用浸提法抽取其所含的油脂外,有时还采用浸提法抽取鱼肝或鱼皮的油脂。
常用溶剂:己烷、庚烷、环己烷速溶咖啡¾从咖啡豆中浸提出可溶性成分,经喷雾干燥或冷冻干燥可制得速溶咖啡。
食品功能成分的提取5.3 溶剂萃取法(Solvent Extraction)杂质目的产物料液萃取剂Light phaseHeavy phase溶剂萃取过程示意图实验室溶剂萃取过程分液漏斗有机相水相溶剂萃取法的原理萃取是根据不同物质在两相中分配平衡的差异是实现分离的。
物理萃取:利用溶剂对需分离的组分有较高的溶解能力,分离过程纯属物理过程,理论基础是分配定律;化学萃取:溶剂首先有选择性地与溶质化合或络合,从而在两相中重新分配而达到分离目的,服从相律及一般化学反应的平衡定律。


第九章 蒸馏1.在密闭容器中将A 、B 两组分的理想溶液升温至82 ℃,在该温度下,两组分的饱和蒸气压分别为*A p =107.6 kPa 及*B p =41.85 kPa ,取样测得液面上方气相中组分A 的摩尔分数为0.95。
试求平衡的液相组成及容器中液面上方总压。
解:本题可用露点及泡点方程求解。
()()()()95.085.416.10785.416.107总总*B*A 总*B 总*A A 总*AA =-=--==p p p p p p p p x p p y - 解得 76.99=总p kPa8808.085.416.10785.4176.99*B*A *B =--=--=p p p p x 总本题也可通过相对挥发度求解571.285.416.107*B *A ===p p α由气液平衡方程得()()8808.095.01571.295.095.01=-+=-+=y y y x α()()[]kPa 76.99kPa 8808.0185.418808.06.1071A *BA *A =-+⨯=-+x p x p p =总 2.试分别计算含苯0.4(摩尔分数)的苯—甲苯混合液在总压100 kPa 和10 kPa 的相对挥发度和平衡的气相组成。
苯(A )和甲苯(B )的饱和蒸气压和温度的关系为 24.22035.1206032.6lg *A +-=t p 58.21994.1343078.6lg *B +-=t p式中p ﹡的单位为kPa ,t 的单位为℃。
苯—甲苯混合液可视为理想溶液。
(作为试差起点,100 kPa 和10 kPa 对应的泡点分别取94.6 ℃和31.5 ℃)解:本题需试差计算 (1)总压p 总=100 kPa初设泡点为94.6℃,则191.224.2206.9435.1206032.6lg *A =+-=p 得 37.155*A =p kPa同理 80.158.2196.9494.1343078.6lg *B =+-=p 15.63*B =p kPa4.03996.015.6337.15515.63100A ≈=--=x或 ()kPa04.100kPa 15.636.037.1554.0=⨯+⨯=总p则 46.215.6337.155*B *A ===p p α6212.04.046.114.046.2)1(1=⨯+⨯=-+=x x y αα(2)总压为p 总=10 kPa通过试差,泡点为31.5℃,*A p =17.02kPa ,*B p =5.313kPa203.3313.502.17==α 681.04.0203.214.0203.3=⨯+⨯=y随压力降低,α增大,气相组成提高。

第十章浸出法制取油脂浸出法制油脂是现代油脂提取主要方法的一种,也是油脂提取率颇高的一种方法,与压榨法相比具有明显的优势。
随着现代化工业进程的加快,用于浸出法制油的油料品种和浸出的方法也愈来愈多,浸出的功能性也愈来愈强。
首先,浸出法制油的出油率比压榨方法高,浸出法提油后的油料粕残油在1%以下,这对合理利用油料资源有着现实的意义。
其二,提油后的油料粕蛋白质含量相对较高,品质亦好,可作为食品与饲料生产的原料。
其三,生产规模大使加上成本低其四,自动化控制程度较高,浸出法属化工生产单元的组合,很容易实现温度、压力、液位、真空、流量、料位的自动控制。
其五,生产环境好,因其是封闭性生产,无泄诵、无扮尘,且温度低,生产环境比压榨方法的好。
浸出法制油的基本过程是油料溶质通过一定的处理后,用6#溶剂油(正己烷)作为溶剂浸出,浸出所得的溶液称作混合油,棍合油进行熬发和气提得到毛油,浸出后所得的固体物称做湿粕。
湿粕进行脱溶后生产出所需的成品粕,蒸发、气提和蒸脱出的溶剂混合气体进行冷凝分水回收,回收的溶剂循环使用。
浸出工艺过程包括油料没出、混合油蒸发、泥粕蒸脱和溶剂回收四个工序。
第一节油料浸出的概念与方式一、油料浸出的概念浸出是植物油厂对用溶剂提取油料中油脂的俗称。
一般在化工单元操作中称萃取或提取。
它是利用各组分在选定的溶剂中溶解度的不同以分离混合物的单元操作。
萃取又可分为固一液萃取和液液萃取两种。
前者习惯上又叫浸取或浸沥,而后者习惯上就叫萃取。
下面重点谈固-液萃取。
固-液萃取是利用选定的络剂分离固体混合物中的组分的单元操作。
换句话说,就是把固休浸在选定的溶剂中,使易溶解的组分溶解为溶液,然后再和固体残渣分离,例如用6#抽提溶剂油浸出油料中的油脂。
用水没出甜菜中的糖分等。
由于在浸出过程中,固体混合物中的易溶解组分是从固体内部扩散到溶剂中,所以最好用小块状或薄片状的固体混合物,这样将有利于浸出的顺利进行二、油脂浸出方式在油脂浸出工业中,油料浸出的方式可分为间歇式和连续式。
第十章 液-液萃取和液-固浸取1. 25℃时醋酸(A )–庚醇-3(B )–水(S )的平衡数据如本题附表所示。
习题1附表1 溶解度曲线数据(质量分数/%)试求:(1)在直角三角形相图上绘出溶解度曲线及辅助曲线,在直角坐标图上绘出分配曲线。
(2)确定由200 kg 醋酸、200 kg 庚醇-3和400 kg 水组成的混合液的物系点位置。
混合液经充分混合并静置分层后,确定两共轭相的组成和质量。
(3)上述两液层的分配系数A k 及选择性系数β。
(4)从上述混合液中蒸出多少千克水才能成为均相溶液解:(1)溶解度曲线如附图1中曲线SEPHRJ 所示。
辅助曲线如附图1曲线SNP 所示。
分配曲线如附图2 所示。
(2)和点醋酸的质量分率为25.0400200200200A =++=x水的质量分率为50.0400200200400S =++=x由此可确定和点M 的位置,如附图1所示。
由辅助曲线通过试差作图可确定M 点的差点R 和E 。
由杠杆规则可得kg 260kg 80040134013=⨯==M R()kg 540kg 260800=-=-=R M E由附图1可查得E 相的组成为A SB 0.28,0.71,0.01y y y ===R 相的组成为 A S B 0.20,0.06,0.74x x x ===(3)分配系数A A A 0.281.40.20yk x===B B B 0.010.01350.74y k x === 选择性系数 7.1030135.04.1B A ===k k β (4)随水分的蒸发,和点M 将沿直线SM 移动,当M 点到达H 点时,物系分层消失,即变为均相物系。
由杠杆规则可得kg 5.494kg 80055345534=⨯==M H 需蒸发的水分量为()kg 5.305kg 5.494800=-=-H M2. 在单级萃取装置中,以纯水为溶剂从含醋酸质量分数为30%的醋酸–庚醇-3混合液中提取醋酸。
已知原料液的处理量为1 000 kg/h ,要求萃余相中醋酸的质量分数不大于10%。
试(1)水的用量;(2)萃余相的量及醋酸的萃取率。
操作条件下的平衡数据见习题1。
解:(1)物系的溶解度曲线及辅助曲线如附图所示。
由原料组成x F =可确定原料的相点F ,由萃余相的组成x A =可确定萃余相的相点R 。
借助辅助曲线,由R 可确定萃取相的相点E 。
联结RE 、FS ,则其交点M 即为萃取操作的物系点。
由杠杆规则可得习题1 附图1 习题1 附图23726F S ⨯=⨯kg 1423kg 100026372637=⨯=⨯=F S(2)由杠杆规则可确定萃余相的量。
4916R M ⨯=⨯ ()kg 791kg 1423100049164916=+==M R 由附图可读得萃取相的组成为 A 0.14y =萃取率=()0.14242379176.2%10000.3⨯-=⨯3. 在三级错流萃取装置中,以纯异丙醚为溶剂从含醋酸质量分数为30%的醋酸水溶液中提取醋酸。
已知原料液的处理量为2000 kg ,每级的异丙醚用量为800 kg ,操作温度为20 ℃,试求(1) 各级排出的萃取相和萃余相的量和组成;(2)若用一级萃取达到同样的残液组成,则需若干千克萃取剂。
20 ℃时醋酸(A )–水(B )–异丙醚(S )的平衡数据如下:习题3附表 20 ℃时醋酸(A )–水(B )–异丙醚()的平衡数据(质量分数)水 相 有 机 相醋酸(A ) 水(B ) 异丙醚(S ) 醋酸(A ) 水(B ) 异丙醚(S )解:由平衡数据在直角三角形坐标图上绘出溶解度曲线及辅助曲线,如附图所示。
习题2 附图由原料组成x F=,在图中确定原料相点F。
由物料衡算确定一级萃取物系的组成A 20000.30.214 2000800x⨯==+S8000.2862000800x==+由此可确定一级萃取物系点M1的位置。
借助辅助曲线,通过试差作图可由M1确定一级萃取的萃取相点E1和萃余相点R1。
由杠杆规则可得115034.5R M⨯=⨯kg19322800kg505.34505.341=⨯==MR()kg868kg19322800111=-=-=RME由附图可读得一级萃取相和萃余相的组成为110.1100.255yx==由R1的量及组成,以及所加萃取剂的量,通过物料衡算可求得二级萃取的物系点M2。
与一级萃取计算方法相同可得2930E=kg21800R=kg220.100.23yx==与二级萃取计算相同,可得三级萃取计算结果3920E=kg31890R=kg习题3 附图330.080.21y x ==(2)若采用一级萃取达到同样的萃取效果,则萃取物系点为附图中的N 点。
由杠杆规则可得37.526.5F S ⨯=⨯ kg 2830kg 20005.265.375.265.37=⨯==F S 4. 在多级错流萃取装置中,以水为溶剂从含乙醛质量分数为6%的乙醛—甲苯混合液中提取乙醛。
已知原料液的处理量为1 200kg/h ,要求最终萃余相中乙醛的质量分数不大于%。
每级中水的用量均为250 kg/h 。
操作条件下,水和甲苯可视为完全不互溶,以乙醛质量比表示的平衡关系为Y =。
试求所需的理论级数。
解:(a )直角坐标图解法 在X –Y 直角坐标图上绘出平衡曲线Y =,如附图所示。
F F F 0.060.064110.06x X x ===-- 原料中稀释剂的量为()()h kg 1128h kg 06.0112001F =-⨯=-=x F B 操作线的斜率为11284.512250B S -=-=-习题4 附图过X F 作斜率为–的直线,与平衡线交于Y 1,则X F Y 1为一级萃取的操作线。
过Y 1作Y 轴的平行线,与X 轴交于X 1。
过X 1作X F Y 1的平行线,与平衡曲线交于Y 2,X 1Y 2即为二级萃取的操作线。
同理可作以后各级萃取的操作线,其中X i 为第i 级萃余相的组成,直至X n 小于或等于所规定的组成为止。
操作线的条数即为理论级数,即 n =7(b )解析法 由于B 与S 不互溶,故可采用式(10–35)计算理论级数。
F n S 2.20.0640.005K X X Y ==≈=m 2.22500.48761128KS A B ⨯=== ()()F S n S m 0.064ln ln 0.005 6.4ln 1ln 10.4876X Y K X Y K n A ⎡⎤-⎢⎥-⎣⎦===++ 取n =7也可采用迭代计算求理论级数。
平衡关系为 i i 2.2Y X = 操作关系为()i i i-14.512Y X X =-- 由此可得迭代关系为 i i-10.6722X X =迭代计算结果为0F 12345670.0640.04300.02890.01940.01310.008790.005910.003970.005X X X X X X X X X =========<即所需理论级数为7级。
5. 在多级逆流萃取装置中,以水为溶剂从含丙酮质量分数为40%的丙酮–醋酸乙酯混合液中提取丙酮。
已知原料液的处理量为2 000kg/h ,操作溶剂比(F S )为,要求最终萃余相中丙酮质量分数不大于6%,试求(1)所需的理论级数;(2)萃取液的组成和流量。
操作条件下的平衡数据列于本题附表。
习题5附表 丙酮(A )–醋酸乙酯(B )–水(S )的平衡数据(质量分数)萃 取 相萃 余 相丙酮(A ) 醋酸乙酯(B ) 水(S )丙酮(A ) 醋酸乙酯(B ) 水(S )解:(1)由平衡数据在直角三角形坐标图上绘出溶解度曲线及辅助曲线,如附图所示。
由原料组成x F =,在图中确定原料相点F 。
F =1000kg/h 、S /F =,再根据杠杆规则可确定F 、S 的和点M 。
由最终萃取要求x n =确定R n 。
联结R n 、M ,其延长线与溶解度曲线交于E 1,FE 1、R n S 两线的交点Δ即为操作点。
借助辅助曲线作图可得E 1的共轭相点R 1(第一级萃取萃余相点),联结R 1Δ与溶解度曲线交于E 2。
同理可找到R 2、R 3 ……,直至萃余相的组成小于为止,操作线的条数即为理论级数。
由作图可得 n =6(2)联结S 、E 1,并延长交AB 与E ′,E ′即为萃取液的相点,读图可得A 0.65y '= h kg 1800h kg 20009.0=⨯=⎪⎭⎫⎝⎛=F F S S ()h kg 3800h kg 18002000=+=+=S F M 由杠杆规则可得习题5 附图135.527E M ⨯=⨯ h kg 2890h kg 38005.35275.35271=⨯==M E 172.529E E '⨯=⨯h kg 1156h kg 5.722928905.72291=⨯=⨯='E E 6. 在多级逆流萃取装置中,以纯氯苯为溶剂从含吡啶质量分数为35%的吡啶水溶液中提取吡啶。
操作溶剂比(F S )为,要求最终萃余相中吡啶质量分数不大于5%。
操作条件下,水和氯苯可视为完全不互溶。
试在X –Y 直角坐标图上求解所需的理论级数,并求操作溶剂用量为最小用量的倍数。
操作条件下的平衡数据列于本题附表。
习题6附表 吡啶(A )–水(B )–氯苯(S )的平衡数据(质量分数)解:将以质量分数表示的平衡数据转化为质量比表示,其结果列于附表2中。
习题6 附表2由表中数据在–直角坐标系中绘出平衡曲线,如附图中曲线12所示。
由S /F =及x F =可得操作线的斜率0.80.812535165S S SBF A BSB ===⇒=+⎛⎫+ ⎪⎝⎭由最终萃取要求可确定点X n , n n n 0.050.053110.05x X x ===--过点X n 作斜率为的直线与直线F F F 0.350.538110.35x X X x ====--交于J ,则X n J 即为操作线。
在平衡曲线与操作线之间作阶梯至X <,所作的级梯数即为理论级数。
由作图可得理论级数为3n =当萃取剂用量最小时,操作线的斜率最大,此时的操作线为X n B ,其斜率为 max 47.80.985653.8 5.3B S ⎛⎫==⎪-⎝⎭ max min 0.9856 1.210.8125B S S B S S⎛⎫ ⎪⎝⎭===7.在25 ℃下,用纯溶剂S 在多级逆流萃取装置中萃取A 、B 混合液中的溶质组分A 。
原料液处理量为800 kg/h ,其中组分A 的含量为32%(质量分数,下同),要求最终萃余相中A 的含量不大于%。
采用的溶剂比(S /F )为。
试求经两级萃取能否达到分离要求。
操作范围内级内的平衡关系为0.42A A0.76y x = S A 0.996y y =- S A 0.010.06x x =+解:本题为校核型计算,但和设计性计算方法相同。