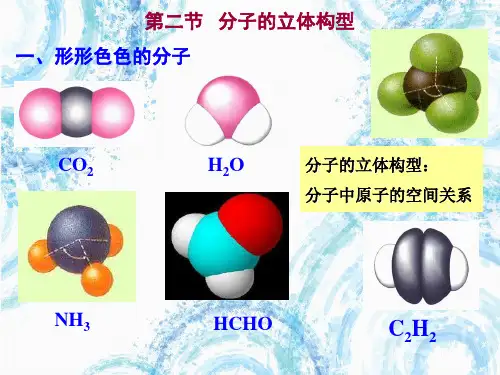
分子的立体构型
- 格式:ppt
- 大小:3.78 MB
- 文档页数:114




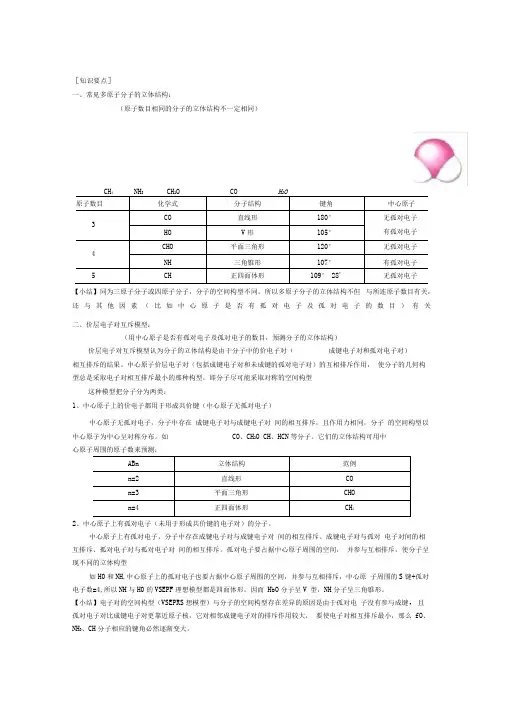
[知识要点]一、常见多原子分子的立体结构:(原子数目相同的分子的立体结构不一定相同)43 22原子数目化学式分子结构 键角中心原子 3CO直线形180° 无孤对电子 HO V 形105° 有孤对电子 4CHO 平面三角形 120° 无孤对电子 NH三角锥形 107° 有孤对电子 5CH正四面体形109° 28'无孤对电子【小结】同为三原子分子或四原子分子,分子的空间构型不同。
所以多原子分子的立体结构不但 与所连原子数目有关,还与其他因素(比如中心原子是否有孤对电子及孤对电子的数目)有关 二、价层电子对互斥模型:(用中心原子是否有孤对电子及孤对电子的数目,预测分子的立体结构)价层电子对互斥模型认为分子的立体结构是由于分子中的价电子对(成键电子对和孤对电子对)相互排斥的结果。
中心原子价层电子对(包括成键电子对和未成键的孤对电子对)的互相排斥作用, 使分子的几何构型总是采取电子对相互排斥最小的那种构型,即分子尽可能采取对称的空间构型这种模型把分子分为两类:1、中心原子上的价电子都用于形成共价键(中心原子无孤对电子)中心原子无孤对电子,分子中存在 成键电子对与成键电子对 间的相互排斥,且作用力相同,分子 的空间构型以中心原子为中心呈对称分布。
如 CO 、CH 2O CH 、HCN 等分子。
它们的立体结构可用中心原子周围的原子数来预测:ABn 立体结构 范例n=2 直线形 CO n=3 平面三角形 CHO n=4正四面体形CH 42、中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
中心原子上有孤对电子,分子中存在成键电子对与成键电子对 间的相互排斥、成键电子对与孤对 电子对间的相互排斥、孤对电子对与孤对电子对 间的相互排斥。
孤对电子要占据中心原子周围的空间, 并参与互相排斥,使分子呈现不同的立体构型如H0和NH ,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥,中心原 子周围的S 键+孤对电子数=4,所以NH 与H0的VSEPF 理想模型都是四面体形。
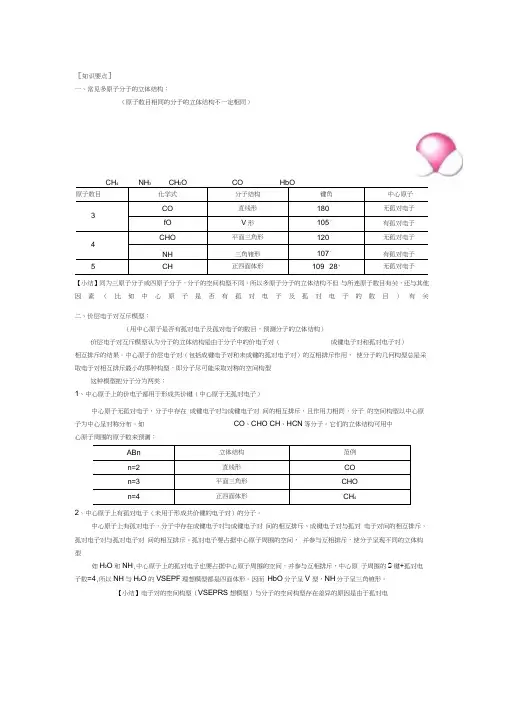
[知识要点]一、常见多原子分子的立体结构:(原子数目相同的分子的立体结构不一定相同)CH4 NH3 CH2O CO HbO原子数目化学式分子结构键角中心原子3CO直线形180°无孤对电子fO V形105°有孤对电子4CHO平面三角形120°无孤对电子NH三角锥形107°有孤对电子5CH正四面体形109° 28' 无孤对电子【小结】同为三原子分子或四原子分子,分子的空间构型不同。
所以多原子分子的立体结构不但与所连原子数目有关,还与其他因素(比如中心原子是否有孤对电子及孤对电子的数目)有关二、价层电子对互斥模型:(用中心原子是否有孤对电子及孤对电子的数目,预测分子的立体结构)价层电子对互斥模型认为分子的立体结构是由于分子中的价电子对(成键电子对和孤对电子对)相互排斥的结果。
中心原子价层电子对(包括成键电子对和未成键的孤对电子对)的互相排斥作用,使分子的几何构型总是采取电子对相互排斥最小的那种构型,即分子尽可能采取对称的空间构型这种模型把分子分为两类:1、中心原子上的价电子都用于形成共价键(中心原子无孤对电子)中心原子无孤对电子,分子中存在成键电子对与成键电子对间的相互排斥,且作用力相同,分子的空间构型以中心原子为中心呈对称分布。
如CO、CHO CH、HCN等分子。
它们的立体结构可用中心原子周围的原子数来预测:ABn立体结构范例n=2直线形COn=3平面三角形CHOn=4正四面体形CH42、中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
中心原子上有孤对电子,分子中存在成键电子对与成键电子对间的相互排斥、成键电子对与孤对电子对间的相互排斥、孤对电子对与孤对电子对间的相互排斥。
孤对电子要占据中心原子周围的空间,并参与互相排斥,使分子呈现不同的立体构型如H2O和NH,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥,中心原子周围的S键+孤对电子数=4,所以NH与H2O的VSEPF理想模型都是四面体形。



化学分子的立体构型与光学异构体化学分子的立体构型是描述分子中原子在空间中的排列方式,涉及到原子之间的化学键角度、距离以及原子与原子的空间环境等因素。
而光学异构体则是指具有相同分子式,但是其立体构型不对称,无法通过旋转或移动来使其重合的分子。
本文将对化学分子的立体构型和光学异构体进行详细探讨。
一、立体构型的概念及意义立体构型指的是分子中原子或原子团的相对排列方式,即空间中的几何结构。
化学分子的立体构型对分子的性质、反应行为以及生物活性等产生了重要影响。
分子的立体构型可以通过分子模型、X射线衍射等手段来确定。
1. 框架构型框架构型是指分子中原子骨架的大致排列方式,不包括具体原子的排列。
框架构型对于分子的性质和反应活性具有重要影响。
2. 手性构型手性构型是一种特殊的立体构型,其特点是具有镜面对称性,无法通过旋转或移动使其与其镜像重合。
手性分子在自然界中广泛存在,对于药物的生物活性以及生物体内的相互作用具有重要的影响。
二、立体构型的描述方法为了描述分子的立体构型,人们发展了不同的表示方法。
1. 空间投影式空间投影式是最直观和常用的描述分子立体构型的方法。
根据不同的原子或原子团在平面上的投影情况,可以将空间投影式进一步分为骨架投影式、棒球棍投影式等。
2. 空间模型空间模型是通过分子模型或者计算机生成的分子图形来表示分子的立体构型。
常见的空间模型有简化球棒模型、线绳模型等。
三、光学异构体的概念及分类光学异构体是指具有相同的分子式,但是其立体构型不对称,无法通过旋转或移动来使其与其镜像重合的分子。
光学异构体可以分为两类:手性异构体和偶极异构体。
1. 手性异构体手性异构体是具有手性构型的分子。
手性分子分为左旋体和右旋体两种,分别表示为左旋异构体和右旋异构体。
手性异构体在化学反应中展现出不同的反应活性和选择性。
2. 偶极异构体偶极异构体是由于分子中极性基团的不同排列而产生的异构体。
偶极异构体在电场中会表现出不同的电性。
促敦市安顿阳光实验学校第二章分子结构与性质第二节分子的立体构型第1课时分子的立体构型(1)知识归纳一、形形色色的分子单原子分子(稀有气体)、双原子分子不存在立体构型,多原子分子中,由于空间的位置关系,会有不同类型的立体异构。
1.子分子——直线形和V形化学式立体构型结构式键角比例模型球棍模型CO2直线形______H 2O V形105°2.四原子分子——平面三角形和三角锥形化学式立体构型结构式键角比例模型球棍模型CH2O 平面三角形120°NH3三角锥形107°3.子分子化学式立体构型结构式键角比例模型球棍模型CH4________ 109°28'4.其他多原子分子的立体构型多原子分子的立体构型形形色色,异彩纷呈。
如白磷(P4,正四面体)、PCl5(三角双锥)、SF6(正八面体)、P4O6、P4O10、C60(“足球”状分子,由平面正五边形和正六边形组成)、C6H12(环己烷)、C10H16(烷)、S8、B12(硼单质)的立体构型如图所示。
P4(正四面体) PCl5(三角双锥)SF6(正八面体)P4O6P4O10 C60椅式C6H12船式C6H12C10H16S8B12二、价层电子对互斥理论1.价层电子对互斥理论的含义价层电子对互斥理论认为,分子的立体构型是价层电子对_____________的结果,价层电子对是指分子中的中心原子上的电子对,包括______________和中心原子上的_____________(未形成共价键的电子对)。
分子中的价层电子对由于_________作用而趋向于尽可能远离以减小排斥力,分子尽可能采取对称的立体构型。
电子对之间的夹角越大,排斥力_______。
2.价层电子对互斥模型电子对数成键电子对数孤电子对数价层电子对立体构型分子的立体构型典例2 2 0 直线形直线形BeCl23 3 0三角形三角形BF3 2 1 V形SnBr24 4 0四面体___________ CH4 3 1 三角锥形NH3 2 2 V形H2O3.价层电子对互斥模型说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。
第二节 分子的立体构型第1课时一、形形色色的分子大多数分子是由两个以上原子构成的,于是就有了分子中的原子的空间关系问题,这就是所谓“分子的立体结构”。
例如,三原子分子的立体结构有直线形和V 形两种。
如C02分子呈直线形,而H 20分子呈V 形,两个H —O 键的键角为105°。
三原子分子立体结构:有直线形C02 、CS 2等,V 形如H 2O 、S02等。
大多数四原子分子采取平面三角形和三角锥形两种立体结构。
例如,甲醛(CH 20)分子呈平面三角形,键角约120°;氨分子呈三角锥形,键角107°。
四原子分子立体结构:平面三角形:如甲醛(CH 20)分子等,三角锥形:如氨分子等。
五原子分子的可能立体结构更多,最常见的是正四面体形,如甲烷分子的立体结构是正四面体形,键角为109°28。
五原子分子立体结构:正四面体形如甲烷、P 4等。
[讲] 此形形色色的分子世界分子的空间结构我们看不见,那么科学家是怎样测定的呢?科学视野—分子的立体结构是怎样测定的?肉眼不能看到分子,那么,科学家是怎样知道分子的形状的呢?早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。
所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。
通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
分子中原子不是固定不动的,而是不断地振动着的。
所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。
通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,结合这些信息,可分析出分子的立体结构。
化学选修三第二章第二节分子的立体构型2选修三第二章第2节 分子的立体构型 第2节 分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O 2、N 2 等。
2.三原子分子有直线形,如CO 2、CS 2等;还有“V ”形,如H 2O 、H 2S 、SO 2等。
3.四原子分子有平面三角形,如BF 3、BCl 3、CH 2O 等; 有三角锥形,如NH 3、PH 3等; 也有正四面体,如P 4。
4.五原子分子有正四面体,如CH 4、CCl 4等,也有不规则四面体,如CH 3Cl 、CH 2Cl 2、CHCl 3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称VSEPR 适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤: (1)确定中心原子A 价层电子对数目 法1.经验总结中心原子的价层电子对数=21(中心离子价电子数+配对原子提供电子总数)对于AB m 型分子(A 为中心原子,B 为配位原子),计算方法如下: n =中心原子的价电子数+每个配位原子提供的价电子数×m 2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4 中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断)N H +4 价层电子对数为21[5+(4×1)-1] = 4对 正四面体 PO -34 价层电子对数为21[5+(0×4)+3] = 4对 正四面体 NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形 法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP )VP是价层电子对,BP是成键电子对(BOND ),LP是孤对电子对(LONE PAIR)VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP=配位原子数+LPLp =21(中心原子价电子数—配位原子未成对电子数之和)IF5Lp =21[7-(5×1)] = 1 构型由八面体−→−四方锥NH+4Lp =21[(5-1)-(4×1)] = 0 正四面体PO-34Lp =21[(5+3)-(4×2)] = 0 正四面体SO-24Lp =21[(6+2)-(4×2)] = 0 正四面体NO2Lp =21[5-(2×2)] =21−→− 1 构型由三角形−→−V形SO-23Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis结构式或结构式直接写出,双键、三键都是1对电子PClClClClCl PCl Cl ClPClClClCl+ClPClClClClCl-ClClClCl+ClPClClClClCl-VP: 5 4 4 6 4(2)价层电子对数目23456价层电子对构型直线形三角形四面体三角双锥八面体(3)价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。