第九章 电解与极化作用
- 格式:doc
- 大小:43.00 KB
- 文档页数:4


第九章电解与极化作用物化试卷(一)1. 当电池的电压小于它的开路电动势时,则表示电池在:(A) 放电 (B) 充电(C) 没有工作 (D) 交替地充放电2. 当发生极化现象时,两电极的电极电势将发生如下变化:(A)φ(平,阳)> φ(阳) ; φ(平,阴)>φ(阴)(B) φ(平,阳)< φ(阳) ; φ(平,阴)> φ(阴)(C) φ(平,阳)< φ(阳) ; φ(平,阴)< φ(阴)(D) φ(平,阳)> φ(阳) ; φ(平,阴)< φ(阴)3. 极谱分析仪所用的测量阴极属于下列哪一种?(A) 浓差极化电极 (B) 电化学极化电极(C) 难极化电极 (D) 理想可逆电极4. 极谱分析中加入大量惰性电解质的目的是:(A) 增加溶液电导 (B) 固定离子强度(C) 消除迁移电流 (D) 上述几种都是5. 极谱分析的基本原理是根据滴汞电极的(A) 电阻 (B) 浓差极化的形成(C) 汞齐的形成 (D) 活化超电势6. 电解金属盐的水溶液时, 在阴极上 :(A) 还原电势愈正的粒子愈容易析出(B) 还原电势与其超电势之代数和愈正的粒子愈容易析出(C) 还原电势愈负的粒子愈容易析出(D) 还原电势与其超电势之和愈负的粒子愈容易析出7. 用铜电极电解 CuCl2的水溶液,在阳极上会发生:(A) 析出氧气 (B) 析出氯气(C) 析出铜 (D) 铜电极溶解8. 25℃时, H2在锌上的超电势为 0.7 V,φ(Zn2+/Zn) = -0.763 V,电解一含有 Zn2+(a=0.01) 的溶液,为了不使H2析出,溶液的 pH值至少应控制在(A) pH > 2.06 (B) pH > 2.72(C) pH > 7.10 (D) pH > 8.029. 通电于含有相同浓度的Fe2+, Ca2+, Zn2+, Cu2+的电解质溶液, 已知φ(Fe2+/ Fe) = -0.440 V ,φ(Ca2+/ Ca) = -2.866 V,φ(Zn2+/ Zn) = -0.7628 V ,φ(Cu2+/ Cu) = 0.337 V 当不考虑超电势时, 在电极上金属析出的次序是 :(A) Cu → Fe → Zn → Ca (B) Ca → Zn → Fe → Cu(C) Ca → Fe → Zn → Cu (D) Ca → Cu → Zn → Fe10. 一贮水铁箱上被腐蚀了一个洞,今用一金属片焊接在洞外面以堵漏,为了延长铁 箱的寿命,选用哪种金属片为好?(A) 铜片 (B) 铁片(C) 镀锡铁片 (D) 锌片11. 在还原性酸性溶液中, Zn的腐蚀速度较Fe为小, 其原因是:(A) φ(Zn2+/Zn)(平) < φ(Fe2+/Fe)(平)(B) φ (Zn2+/Zn) < φ(Fe2+/Fe)(C) φ (H+/H2)(平,Zn) < φ(H+/H2)(平, Fe)(D)φ (H+/H2)(Zn) < φ (H+/H2)(Fe)12. 将铅蓄电池在 10.0 A 电流下充电 1.5 h,则 PbSO4分解的量为:(Mr(PbSO4)= 303)(A) 0.1696 kg (B) 0.0848 kg(C) 0.3392 kg (D) 0.3564 kg13. 铅蓄电池负极反应的交换电流密度,比正极反应的交换电流密度约小两个数量级, 这表明 :(A) 负极反应的恢复平衡的速率大, 容易出现极化(B) 正极反应的恢复平衡的速率大, 容易出现极化(C) 负极反应的恢复平衡的速率小, 容易出现极化(D) 正极反应的恢复平衡的速率小, 容易出现极化14. 298 K、0.1 mol·dm-3的 HCl 溶液中,氢电极的热力学电势为-0.06 V,电解此溶液 时,氢在铜电极上的析出电势φ(H2) 为:(A) 大于 -0.06 V (B) 等于 -0.06 V(C) 小于 -0.06 V (D) 不能判定15. j 代表电池的电流密度,j0代表电极的交换电流密度,以下关系式中哪个反映了 常用参比电极的工作特性?(A) │j│>> j0 (B) │j│<< j0(C) │j│= j0≠0 (D) │j│= j0= 016. Tafel公式 η =a+blgj 的适用范围是 :(A) 仅限于氢超电势(B) 仅限于j ≈ 0, 电极电势稍有偏差的情况(C) 仅限于阴极超电势, 可以是析出氢, 也可以是其他(D) 可以是阴极超电势, 也可以是阳极超电势17. 298K,101.325 kPa 下,以 1 A 的电流电解 CuSO4溶液,析出0.1 mol 铜,需时间 大约是:(A) 20.2 h (B) 5.4 h(C) 2.7 h (D) 1.5 h18. 电解时, 在阳极上首先发生氧化作用而放电的是:(A) 标准还原电势最大者(B) 标准还原电势最小者(C) 考虑极化后,实际上的不可逆还原电势最大者(D) 考虑极化后,实际上的不可逆还原电势最小者19. 金属活性排在H2之前的金属离子, 如Na+ 能优先于H+在汞阴极上析出, 这是由于:(A) φ(Na+/Na) < φ(H+/H2)(B)η(Na) < η(H2)(C) φ (Na+/Na) < φ(H+/H2)( D) H2在汞上析出有很大的超电势, 以至于φ(Na+/Na) >φ(H+/H2)20. 下列对铁表面防腐方法中属于"电化保护"的是:(A) 表面喷漆 (B) 电镀(C) Fe表面上镶嵌Zn块 (D) 加缓蚀剂。

九、电解与极化作用答案九、电解与极化作用答案一、选择题( 共26 题)1. 1 分(4802) (A)2. 2 分(4803) (C)3. 1 分(4855) (B)4. 2 分(4857) (C)5. 2 分(4861) (A)6. 2 分(4863) (B)7. 2 分(4869) (C) 8. 1 分(4870) (D) 9. 1 分(4871) (B) 10. 2 分(4889) (B) 11. 2 分(4910) (A) 12. 2 分(4946) (D) 13. 2 分(4921) (B) 14. 2 分(4924) (B) 15. 1 分(4931) (D) 16. 2 分(4932) (B) 17. 2 分(4940) (A) 18. 2 分(4946) (D) 19. 2 分(4947) (A) 20. 2 分(4948) (D)21. 2 分(5102) (D) 22. 2 分(5105) (D) 23. 1 分(5106) (C)24. 2 分(5154) (B) 25. 2 分(5165) (B) 26. 2 分(5166) (C)二、填空题( 共27题)1. 2 分(4801)[答] Pb│H2SO4(m) ;PbO2│H2SO4(m) ;Pb│H2SO4(m) ;PbO2│H2SO4(m)2. 2 分(4807)[答] j = nFr3. 2 分(4815)[答] 电解质虽然不同, 但电极上发生的反应一致, 都是电解水。
4. 2 分(4816)[答] E分解=E可逆+η阴+η阳+IR;增加5. 5 分(4851)[答] 电流密度;电极电位偏离平衡电位或静止电位;浓差极化,电化学极化,有电流通过时,电极电位对平衡电位的偏离。
6. 2 分(4858)[答] 正,负,负,正7. 2 分(4859)[答] 增加;减少8. 5 分(4860)[答] (1) 1.9 V ;0.5 V (3分)(2) 高(2分) 9. 2 分(4866)[答] 低超压;高超压(各1分) 10. 2 分(4867)[答] 电子的电流密度是j e/e, 因每个电子携带电量大小为e, 则:(1)4.94×1015 cm-2·s-1 (1分)(2) 1.56×1016 cm-2·s-1 (0.5分)(3) 3.12×107 cm-2·s-1(0.5分) 11. 5 分(4868)[答] j = j e{exp(-αη F/RT)-exp([1-α ]η F/RT)}.(1)0.31mA·cm-2(2分)(2) 5.41mA·cm-2(2分)(3) 1.39×1042mA·cm-2(1分)- 902 -九、电解与极化作用 答案- 903 -12. 2 分 (4884)[答] 极谱分析的滴汞电极, 铅蓄电池的充电, 氯碱工业, 电镀杂质的分离等. 13. 2 分 (4888)[答] 提供电流, 使研究电极极化; 测量研究电极的超电势值。

第九章 电解与极化作用前边讨论的电池与电极都是可逆的,那么应用能斯特公式来处理电化学体系时,它的前提就是该体系必须是处于热力学平衡态,但是对于一些现实的电化学过程来说一般都是不可逆过程,因此应用Nernst 公式研究电化学问题就具有很大的局限性。
事实上当原电池或电解池,只要有电流通过,就有极化作用发生,该过程就是不可逆过程。
研究不可逆电极反应及其规律性对电化学工业是十分重要的,所以我们要讨论不可逆电极过程。
在这一部分除了讨论电解池中的极化作用外,还要简单介绍一些电解在工业上的应用上及金属的防腐和化学电源等。
§9-1 电极的极化1、不可逆条件下的电极电势一个不可逆电池所具备的条件有两个:①电池反应在充电与放电时互为逆反应;②通过电池的电流I →0,即没有电流通过电池。
显然组成可逆电池的两个电极都是可逆电极,那么可逆电极的电极反应都是在可逆的条件下发生的。
这时电极所具有的电势就称为可逆电极电势。
可逆电极电势对许多电化学和热力学问题的解决是相当重要的。
但是在实践当中许多电化学过程,如进行电解和使用化学电源做电功时,并不是在可逆情况下进行的,也就是说要有电流通过电池或电解池,此时的电极反应就是不可逆的了,不可逆电极的电极电势用“I ϕ”表示,当然这个电极电势与可逆电极的电极电势r ϕ是不相同的,那么我们就把电极在有限电流通过时所表现的电极电位I ϕ与可逆电极电势产生偏差的现象叫做电极的极化。
偏差的大小(绝对值),称为“过电势”。
用“η”表示,||r I ηϕϕ=-,对于原电池,在可逆放电时,两电极的端电压是最大的,这个端电压就是电动势E ,它等于两个可逆电极的电位差。
()()()()r r r r E ϕϕϕϕ=-=-正阳阴负在不可逆条件下进行放电,两电极的端电压用E I 表示,它一定要小于原电池的电动势E ,E I <E ,E I =E-△E其电动势的降低主要是由于两个因素引起的,当有电流通过时, ①电池具有一定的内阻R 的消耗电位降IR ;②不可逆条件电极要产生极化,也会造成电动势下降,所以不可逆电池两电极的电位差通常就叫端电压。




第九章电解与极化作用练习题一. 是非题(2×10=20分)1. 电解,电镀,化学电源和电化腐蚀等都是热力学不可逆过程。
()2. 测分解电压时,要使用伏特计,目的在于测电解池两极的端电压—槽电压。
()3. 用Pt电极电解NaOH稀水溶液时,产物构成的电池是Pt ︳H2(P1)︳NaOH(m)︳O2(P2)︳Pt4. 浓差极化是由于电池或电解池中阴极与阳极电解质溶液浓度不同所引起的。
()5. 超电势的大小是电极极化程度的量度。
()6. 凡能通过氧化—还原反应生产的产物都可用电化学方法生产。
()7. 金属氧化与介质还原在不同地点进行,金属都不会被腐蚀。
()8. 无论金属多么活泼,只要有去极剂存在,金属都不会被腐蚀。
()9. 金属的电势越负,越易被腐蚀。
()10. 外加电流阳极保护或外加电流阴极保护,目的(作用)都是降低腐蚀电流。
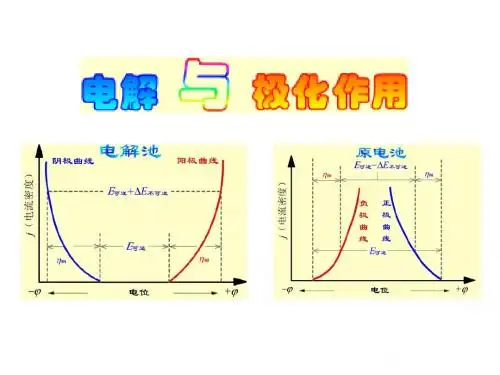
()yes no.二填空题(2×10=20)1. 对电池,正极极化时φIR(不可逆)_______φR(可逆)2. 以Pt电极电解不挥发性酸的水溶液时,实际分解电压一般都为_______ V(取两位有效数字)3. 以Ag电极电解AgNO3溶液时,阴极浓差超电势η阴= RT/F ln(c/c1), c为本体溶液Ag+浓度,c1为电极附近Ag+浓度,则两个浓度的关系是c ______c14.阴极极化时φIR(不可逆)______φR(可逆)5.一极化曲线的图如下此曲线应是极极化曲线(填阴或阳)。
6. 电解池正极上发生反应(填还原或氧化)。
7. 电解槽阴极的析出电势与其可逆电势的关系是φ析,阴φR,阴。
8. 电解处于平衡态时,氧化电流密度与还原电流密度之差i______0.9. 一般情况下,金属离子在金属固体上析出的超电势η 0。
10.一电解池中,Ag的可逆电势为0.681V,Cu的可逆电势为0.327V,首先在阴极上析出的是(填Ag或Cu)。
三.单选题(2×10=20分)1.测定分解电压的装置中要使用伏特计,其作用是(A)测量电路中某一段的电压降(B)测量工作电池的端电压(C)测量槽电压(D)测量理论分解电压2.惰性金属为电极电解H2SO4,下述反应中正确的是(A)正极(B)负极(C)正极(D)负极3.对电化学极化的下列说法中不正确的是(A)电化学极化起因于电荷在相界面上转移的迟缓性(B)电化学极化是因电极反应需要活化能所致(C)在极化电流很大时,活化过电势增长加快(D)电化学极化在电极过程中的任一电极上都存在4.有关浓差极化的下列说法中不正确的是(A)浓差极化是产生浓差极化的根本原因(B)浓差超电势决定于本体溶液中离子浓度与电极附近同种离子浓度之比值(C)浓差超电势可通过搅拌完全消除(D)阴极和阳极浓差超电势不会相等5.在相同条件下,氢析出时超电势最小的是(A)镀铂黑的铂电极(B)光亮铂电极(C)金电极(D)银电极6.在金属的裂缝处常易腐蚀,其原因是(A) 裂缝处易积存水,水电离出H+(B)裂缝处易积集CO2和水(C)裂缝处氧浓度小,易成为腐蚀电池的阴极(D)裂缝处氮浓度小,易成为腐蚀电极的阴极7.两种金属离子共同析出的条件是(A)两种金属离子浓度相同(B)两种金属离子的平衡电势与析出的超电势之差相等(C)两种金属离子的价型相同(D)两种金属离子析出时的超电势与衡电平势均相等8.铁Fe在潮湿空气中(含大量CO2)被电化腐蚀的电池未反应是(A) Fe +1/2O2(g)+2H+ Fe2+ + H2O(B) Fe2++2OH- Fe(OH)2(C) 2Fe(OH)2+H2O+1/2 O2 2Fe(OH)3(D) Fe+3/4 O2(g)+3H++3e- Fe3++3/2 H2O9.对氧浓差微电池——差异充气电池的下列说法不正确的是(A)充O2的电极为阴极(B)充N2的电极为负极(C)O2为去极剂(D)充O2电极的反应Fe+1/2O2+H2O =Fe(OH)210.为保护铁不受腐蚀,有时在其表面镀一层锌或镀一层锡,常称镀锌铁和镀锡铁。

电解与极化0909401078 章祥化学摘要:所谓电解是指在电池上加一个直流电源,并逐渐增加电压直至使电池中物质在电极上发生化学反应。
电解是将电能变成化学能的反应,是电池反应的逆过程。
电解与极化作用在工业制备,材料防腐,燃料电池等方面均有很多应用。
关键词:电解、极化、电化学腐蚀、防腐、燃料电池正文:1:电解与极化过程与原因:电解过程是在不可逆的情况下进行,即所用电解电压大于自发电池的电动势。
而电极极化是指在有电流通过电极时,电极电势偏离于可逆值的现象。
电极发生极化的原因,是因为当有电流流过电极时,在电极上发生一系列的过程,并以一定的速率进行,而每一步都或多或少的存在阻力。
要克服这些阻力,相应的各需要一定的推动力,表现在电极电势上就表现为这样那样的偏离。
2:金属的电化学腐蚀原因:金属表面与周围介质发生化学及电化学作用而遭受破坏,统称金属腐蚀,化学腐蚀作用进行时没有电流产生。
金属表面与介质如潮湿空气,电解质溶液等接触时,因形成微电池而发生电化学作用而引起的腐蚀叫电化学腐蚀。
金属的电化学腐蚀的过程;如在阴极上可能发生氢离子还原成氢气析出(亦称为析氢腐蚀)(2H++2e- H2(g));在酸性气氛中,大气中的氧气在阴极上取得电子,而发生还原反应(亦称为吸氧腐蚀)(O2+4H++4e- 2H2O)。
因为吸氧腐蚀比析氢腐蚀容易发生,即Ψ(Fe2+/Fe)与Ψ(H+/H2)组成电池的电动势比Ψ(Fe2+/Fe)与Ψ(O2/H+,H2O)组成电池的电动势小得多,所以当有氧存在时Fe的腐蚀就更严重。
3:电解的一般应用:3.1电解制备与电镀:电解制备,是指用电解方法实现物质的氧化还原,例如电解食盐水制备氢气,氯气和NaOH的氯碱工业;用电解法提纯金属如电解铜;电解水以制备纯净的氢气和氧气等。
而电解制备法的一般优点有产物比较纯净,易于提纯;通过适当选择电极材料,电流密度和溶液的组成,可以扩大电解还原法的适用范围。
塑料电镀:为改变绝大多数塑料不能导电,没有金属光泽等不足之处,为改进其性能,可在塑料表面进行电镀,其步骤大致是先将塑料表面去油,粗化及各种表面活性处理,然后用化学沉积法在其表面形成很薄的导电层,再把塑料镀件置于电镀槽的阴极,镀上各种所需金属。

第九章电解与极化作用一切现实的电化学过程都是不可逆过程,而应用Nernst 方程式处理电化学体系时,都有一个前提,即该体系需处于热力学平衡态。
从而可见,应用Nernst 方程所能研究的问题范围具有很大的局限性。
所以对不可逆电极过程进行的研究,无论是在理论上或实际应用中,都有非常重要的意义。
因为要使电化学反应以一定的速度进行,无论是原电池的放电或是电解过程,在体系中总是有显著的电流通过。
因此,这些过程总是在远离平衡的状态下进行的。
研究不可逆电极反应及其规律性对电化学工业十分重要,因为它直接涉及工艺流程、能量消耗、产品单耗等因素。
我们将讨论电解过程中在电极上进行的不可逆反应,从中得出不可逆电极过程的一些规律,将它们可应用于电镀、电化学腐蚀、化学电源等方面。
本章将主要介绍通电使体系发生化学变化即电解作用中的一些规律,对于在有电流通过电极的所发生的极化作用的原因也作了介绍。
具体学习内容如下:1、了解分解电压的意义。
2、了解产生极化作用的原因。
了解超电势在电解中的作用。
3、能计算一些简单的电解分离问题。
第一节分解电压使电能转变成化学能的装置称为电解池。
当直流电通过电解质溶液,正离子向阴极迁移,负离子向阳极迁移,并分别在电极上起还原和氧化反应,从而获得还原产物和氧化产物。
若外加一电压在一个电池上,逐渐增加电压直至使电池中的化学反应发生逆转,这就是电解。
实验表明,对任一电解槽进行电解时,随着外加电压的改变,通过该电解槽的电流亦随之变化。
例如,使用两个铂电极电解HCl 溶液时,使用图9.1 的线路装置,改变可变电阻,记录电压表和电流表的读数,则可测量电解槽两端电位差与电流强度的关系曲线。
开始时,当外加电压很小时,几乎没有电流通过电解槽;电压增加,电流略有增加;当电流增加到某一点后,电流随电压增大而急剧上升,同时电极上有连续的气泡逸出。
在两电极上的反应可表示如下:阴极2H+(aH+)+2e.→H2(g, p)阳极2Cl-.(aCl-)→Cl2(g,p)+2e. 图9.1 分解电压的测定装置当电极上有气泡逸出时,H2和Cl2的压力等于大气压力。
第九章电解与极化作用对于电解池,它是一个使电能转变成化学能的装置,是一个电化学的反应器,电解池在工作时是必须有电流通过的通常,一个电解池要连续正常工作,所加的电压要比电动势大得多,这些额外的电能,一部分用以克服电阻,一部分消耗在克服电极的极化作用上,如下列反应:Cu2+(aq) + 2Cl-(aq) = Cu(s) + Cl2(g)E 外CuCl 2石墨Cu −+E 外加电压:η++>IR E E 平衡外电解反应才能顺利进行,实验现象为:Cu 电极:Cu 2++ 2e →Cu(s)石墨电极:2Cl -→Cl 2(g) + 2e Cu 2++ 2Cl -→Cu(s)+ Cl 2(g)无论是原电池还是电解池,只要有电流通过,在电极上就有极化作用发生,电极极化为不可逆过程(1)电极的极化作用(2)金属腐蚀与防腐和电化学的应用(3)化学电源本章主要介绍三方面的内容:§9.1 分解电压1. 分解电压测定在电解一给定的电解液时,对电解池至少需要施加多少大的电压才能使电解顺利进行⎯⎯分解电压。
以铂电极电解0.1mol·dm-3的NaOH水溶液为例,说明分解电压的测定。
分解电压测定装置:VG 阳极阴极0.1m NaOH 溶液Pt 通过可变电阻逐渐增加外加电压,同时记录电流计的变化值,得到电流~电压曲线。
EI 曲线可分为三段:(1)1之前电压升高,电流变化不大→0,现象:在电极上没有气泡的产生。
12(2)1~2 电压升高,电流开始慢慢增大,在电极上有少许的气泡产生,并吸附在电极上。
(3)2~3. V ↑→I ↑↑在电极有大量的气泡逸出。
3从曲线外推得到E 分解=1.69V 。
E 分解=1.69V实验测定的分解电压要大于原电池:Pt, H2(pθ) | NaOH(0.1 mol·kg-1) | O2(pθ), Pt的电动势E可逆=1.229VE分解为实际分解电压,各种电解液的分解电压是通过实验测定E分解>E可逆2. 产生分解电压的原因在电解NaOH 水溶液时,电极反应:阴极:2H 2O + 2e = H 2+ 2OH -阳极:2OH -= ½O 2+ H 2O + 2e 阴极析出氢气,阳极析出氧气,并有部分H 2和O 2吸附在铂电极表面,结果组成了氢氧原电池:-Pt, H 2(p) | NaOH (0.1mol·kg -1)| O 2, Pt +E 外该原电池的极性正好与外加电源的极性相同,产生反电动势。
第九章电解与极化作用练习题一. 是非题(2×10=20分)1. 电解,电镀,化学电源和电化腐蚀等都是热力学不可逆过程。
()2. 测分解电压时,要使用伏特计,目的在于测电解池两极的端电压—槽电压。
()3. 用Pt电极电解NaOH稀水溶液时,产物构成的电池是Pt ︳H2(P1)︳NaOH(m)︳O2(P2)︳Pt4. 浓差极化是由于电池或电解池中阴极与阳极电解质溶液浓度不同所引起的。
()5. 超电势的大小是电极极化程度的量度。
()6. 凡能通过氧化—还原反应生产的产物都可用电化学方法生产。
()7. 金属氧化与介质还原在不同地点进行,金属都不会被腐蚀。
()8. 无论金属多么活泼,只要有去极剂存在,金属都不会被腐蚀。
()9. 金属的电势越负,越易被腐蚀。
()10. 外加电流阳极保护或外加电流阴极保护,目的(作用)都是降低腐蚀电流。
().二填空题(2×10=20)1. 对电池,正极极化时φIR(不可逆)_______φR(可逆)2. 以Pt电极电解不挥发性酸的水溶液时,实际分解电压一般都为_______ V(取两位有效数字)3. 以Ag电极电解AgNO3溶液时,阴极浓差超电势η阴= RT/F ln(c/c1), c为本体溶液Ag+浓度,c1为电极附近Ag+浓度,则两个浓度的关系是c ______c14.阴极极化时φIR(不可逆)______φR(可逆)5.一极化曲线的图如下此曲线应是极极化曲线(填阴或阳)。
6. 电解池正极上发生反应(填还原或氧化)。
7. 电解槽阴极的析出电势与其可逆电势的关系是φ析,阴φR,阴。
8. 电解处于平衡态时,氧化电流密度与还原电流密度之差i______0.9. 一般情况下,金属离子在金属固体上析出的超电势η 0。
10.一电解池中,Ag的可逆电势为0.681V,Cu的可逆电势为0.327V,首先在阴极上析出的是(填Ag或Cu)。
三.单选题(2×10=20分)1.测定分解电压的装置中要使用伏特计,其作用是(A)测量电路中某一段的电压降(B)测量工作电池的端电压(C)测量槽电压(D)测量理论分解电压2.惰性金属为电极电解H2SO4,下述反应中正确的是(A)正极(B)负极(C)正极(D)负极3.对电化学极化的下列说法中不正确的是(A)电化学极化起因于电荷在相界面上转移的迟缓性(B)电化学极化是因电极反应需要活化能所致(C)在极化电流很大时,活化过电势增长加快(D)电化学极化在电极过程中的任一电极上都存在4.有关浓差极化的下列说法中不正确的是(A)浓差极化是产生浓差极化的根本原因(B)浓差超电势决定于本体溶液中离子浓度与电极附近同种离子浓度之比值(C)浓差超电势可通过搅拌完全消除(D)阴极和阳极浓差超电势不会相等5.在相同条件下,氢析出时超电势最小的是(A)镀铂黑的铂电极(B)光亮铂电极(C)金电极(D)银电极6.在金属的裂缝处常易腐蚀,其原因是(A) 裂缝处易积存水,水电离出H+(B)裂缝处易积集CO2和水(C)裂缝处氧浓度小,易成为腐蚀电池的阴极(D)裂缝处氮浓度小,易成为腐蚀电极的阴极7.两种金属离子共同析出的条件是(A)两种金属离子浓度相同(B)两种金属离子的平衡电势与析出的超电势之差相等(C)两种金属离子的价型相同(D)两种金属离子析出时的超电势与衡电平势均相等8.铁Fe在潮湿空气中(含大量CO2)被电化腐蚀的电池未反应是(A) Fe +1/2O2(g)+2H+ Fe2+ + H2O(B) Fe2++2OH- Fe(OH)2(C) 2Fe(OH)2+H2O+1/2 O2 2Fe(OH)3(D) Fe+3/4 O2(g)+3H++3e- Fe3++3/2 H2O9.对氧浓差微电池——差异充气电池的下列说法不正确的是(A)充O2的电极为阴极(B)充N2的电极为负极(C)O2为去极剂(D)充O2电极的反应Fe+1/2O2+H2O =Fe(OH)210.为保护铁不受腐蚀,有时在其表面镀一层锌或镀一层锡,常称镀锌铁和镀锡铁。
第九章电解与极化作用
返回上一页
1. 在298 K时,用Pb(s)电极来电解H2SO4溶液(0.1 mol/kg,γ±=0.265),若在电解过程中,把Pb阴极与另一摩尔甘汞电极相连组成原电池,测得其电动势
E=1.0685 V.试求H2(g)在Pb电极上的超电势(只考虑H2SO4的一级电离).已知
(甘汞)=0.2802 V.
2. 在锌电极上析出氢气的塔菲尔公式为η=0.72+0.116lgj 在298K时,用Zn(s)作阴极,惰性物质作阳极,电解浓度为0.1 mol/kg的ZnSO4溶液,设溶液pH为7.0,若要使H2(g)不和锌同时析出应控制在什么条件?
3. 在298 K时,当电流密度为0.1 A·cm-2时, H2(g)和O2(g)在Ag(s)电极上
的超电势分别为0.87和0.98 V.今用Ag(s)电极插入0.01 mol/kg的NaOH溶液中进行电解,问在该条件下在两个银电极上首先发生什么反应?此时外加电压为
多少?(设活度系数为1)
4. 在298K,标准压力时,某混合溶液中,CuSO4浓度为0.50 mol/kg, H2SO4浓
度为0.01 mol/kg,用铂电极进行电解,首先Cu(s)沉积到Pt电极上.若H2(g)在
Cu(s)上的超电势为0.23V,问当外加电压增加到有H2(g)在电极上析出时,溶液中所余Cu2+的浓度为多少?(设活度系数均为1, H2SO4作一级电离处理)
5. 在298K,标准压力时,以Pt为阴极,C(石墨)为阳极,电解含CdCl2(0.01
mol/kg)和CuCl2(0.02 mol/kg)的水溶液.若电解过程中超电势可忽略不计,试问: (活度系数均为1)
(1) 何种金属先在阴极析出.
(2) 第二种金属析出时,至少须加多少电压?
(3) 第三种金属析出时,第一种金属离子在溶液中的浓度为若干?
(4) 事实上在O2(g)在石墨上是有超电势的.设超电势为0.6 V,则阳极上首先发生什么反应?
6. 在298K, 压力时,用Fe(s)为阴极, C(石墨)为阳极,电解6.0 mol/kg的
NaCl水溶液,若H2(g)在铁阴极上的超电势为0.20 V, O2(g)在石墨阳极上的超电势为0.60 V,Cl2(g)的超电势可忽略不计,试说明两极上首先发生的反应及计算至少须加多少外加电压,电解才能进行?(设活度系数均为1)
7. 在298K, 压力时,电解一含 Zn2+溶液,希望当Zn2+浓度降至1×
mol/kg时,仍不会有H2(g)析出,试问溶液的pH值应控制在多少为好?已知H2(g)在Zn(s)上的超电势为0.72 V,并设此值与浓度无关.
8. 在298K,压力时,用电解沉积法分离Cd2+,Zn2+混合溶液,已知Cd2+,Zn2+
的浓度均为0.10 mol/kg (设活度系数均为1), H2(g)在Cd(s)和Zn(s)上的超电势分别为0.48和0.70 V,设电解液的pH保持为7.0.试问:
(1) 阴极上首先析出的是何种金属?
(2) 第二种金属析出时第一种析出的离子的残留浓度是多少?
(3) 氢气是否有可能析出而影响分离效果?
9. 在298K, 压力时,电解含有
Ag+(a Ag+=0.05),Fe2+(a Fe2+=0.01),Cd2+(a Cd2+=0.001),Ni2+(a Ni2+=0.1)和
H+(a H+=0.001,并设a H+不随电解的进行而变化)的混合溶液,又已知H2(g) 在Ag,Ni,Fe和Cd上的超电势分别为0.20,0.24,0.18和0.30 V.当外加电压从零开始逐渐增加时,试用计算说明在阴极上析出物质的顺序.
10. 在298K,原始浓度Ag+为0.1 mol/kg和CN-为0.25 mol/kg的溶液中形成了配离子Ag(CN)2-,其离解常数Ka=3.8×.试计算在该溶液中Ag+的浓度和
Ag(s)的析出电势. 设活度系数均为1。
11. 欲从镀银废液中回收金属银,废液AgNO3的浓度为 1×mol/kg,还含有少量的Cu2+.今以银为阴极,石墨为阳极用电解法回收银,要求银的回收率达99%.试问阴极电位应控制在什么范围内?
Cu2+的浓度应低于多少才不致使Cu(s)和Ag(s)同时析出?(设所有的活度系数均为1)
12. 工业上目前电解食盐水制造NaOH的反应为
2NaCl + 2H2O =2NaOH + H2(g) +Cl2(g) (1)
有人提出改进方法,改造电解池的结构,使电解食盐水的总反应为 2NaCl + 2H2O + 1/2O2(空气)= 2NaOH +Cl2(g) (2)
(1) 分别写出两种电池总反应的阴极和阳极反应.
(2) 计算在298 K时,两种反应的理论分解电压为各多少?设活度系数均为1,溶液pH=14.
(3) 计算改进方法在理论上可节约多少电能?(用百分数表示)
13. 某一溶液中含KCl,KBr和KI的浓度均为0.1 mol/kg. 今将该溶液放入带有Pt电极的素烧瓷杯内,将杯再放在带有Zn(s)电极和大量0.1 mol/kg的ZnCl2溶液的较大器皿中,若略去液接电势和极化影响,
试求298K时下列各情况所须施加的外加电压最少为若干?设活度系数均为1.
(1) 析出99%的碘.
(2) 析出Br2至Br-浓度为1×mol/kg.
(3) 析出Cl2至Cl-浓度为1× mol/kg.
14. 以Ni(s)为电极,KOH水溶液为电解质的可逆氢,氧燃料电池在298K和压力下稳定的连续工作,试回答下述问题:
(1) 写出该电池的表达式,电极反应和电池反应.
(2) 求一个100 W(1W=3.6 kJ*h-1)的电池,每分钟需要供给298K, 压力的H2(g)多少体积?
已知该电池反应的=-236k J/mol(每mol H2(g))
(3) 该电池的电动势为多少?。