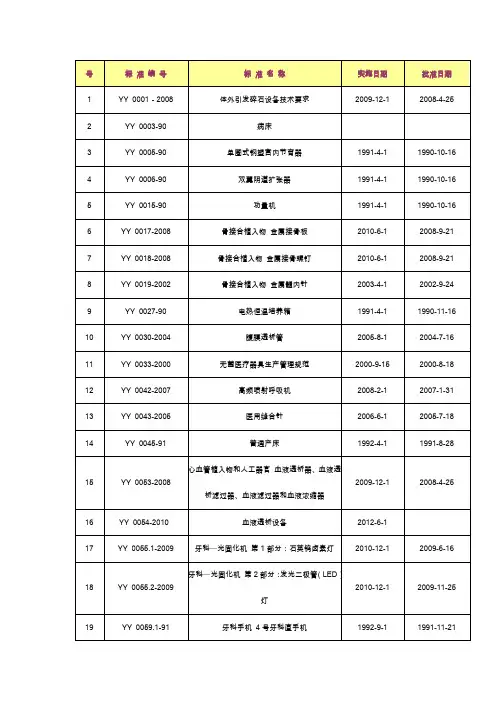
YY 0017-2008 骨接合植入物 金属接骨板 培训资料
- 格式:ppt
- 大小:6.31 MB
- 文档页数:37

医疗器械注册精讲系列(一)‖金属接骨板内固定系统一、产品定义金属接骨板内固定系统适用于四肢骨(包括上肢带骨:锁骨、肩胛骨,自由上肢骨:肱骨、桡骨、尺骨、腕骨、掌骨、指骨,下肢带骨:髋骨、坐骨、耻骨;自由下肢骨:股骨、髌骨、胫骨、腓骨、跗骨、跖骨、趾骨)骨折内固定;由非锁定金属接骨板、非锁定金属接骨螺钉、锁定金属接骨板、锁定金属接骨螺钉和空心螺钉组成;由外科植入物用金属材料制成,包括纯钛、Ti6Al4V钛合金、TC4钛合金、TC4ELI钛合金、Ti6Al7Nb钛合金、00Cr18Ni14Mo3不锈钢、00Cr18Ni15Mo3N不锈钢、高氮不锈钢、锻造钴铬钼合金。
二、基本要求(一)注册单元的划分1.若按照实现某种临床预期用途的产品组合进行申报,金属接骨板内固定系统包括如下注册单元:(1)直型非锁定金属接骨板系统:由直型非锁定金属接骨板、非锁定金属接骨螺钉组成。
(2)解剖型非锁定金属接骨板系统:由解剖型非锁定金属接骨板、非锁定金属接骨螺钉组成。
(3)角度型非锁定金属接骨板系统:由非锁定金属角度固定器、非锁定金属接骨螺钉组成。
(4)锁定型金属接骨板系统:一般由锁定金属接骨板、锁定金属接骨螺钉组成。
2.金属接骨板内固定系统主要包括如下注册单元:(1)直型非锁定金属接骨板;(2)解剖型非锁定金属接骨板;(3)非锁定金属角度固定器;(4)锁定金属接骨板;(5)非锁定金属接骨螺钉:(6)锁定金属接骨螺钉;(7)空心螺钉。
(二)产品技术资料1.提供产品的基本信息,包括:(1)产品各型号、各组件、各关键部位(如接骨板的各种孔型、接骨螺钉的头部及螺纹部分等)的结构图。
(2)产品各组件的材料牌号及其符合的国家标准、行业标准、国际标准,材料牌号的描述应与其符合的标准一致。
进口产品的材料牌号及符合标准不应超过原产国上市证明文件/说明书批准的范围。
(3)接骨板螺钉孔孔径的具体标称值及公差,接骨板长度、宽度、厚度、角度的具体标称值,接骨板螺钉孔的孔数。

《无源外科植入物第1部分:骨接合植入物通用要求》行业标准编制说明一、工作简况任务来源:根据食药监办械管〔2017〕94号《总局办公厅关于印发2017年医疗器械行业标准制修订项目的通知》,确定由天津市医疗器械质量监督检验中心(以下简称天津中心)负责起草“无源外科植入物第1部分:骨接合植入物通用要求”(项目编号:N2017019-Q-TJ)行业标准。
任务下达后,天津中心对此项工作给予了高度重视,及时于2017年3月28日在武汉召开2017年标准制订工作启动会,并公开征集标准参与单位。
启动会上责成标准项目负责人就《无源外科植入物第1部分:骨接合植入物通用要求》标准的立项背景、现有工作基础、标准修订设想、项目工作安排做了详细介绍,并成立了标准起草工作组。
工作组成立后,迅速开展工作,通过查阅相关国际标准、美国标准、国家标准、行业标准等相关资料,收集上一版标准实施过程中的问题和建议,基本确定了标准的修订思路。
工作组于2017年4月至5月编写标准草案,于2017年6月19日至21日在天津组织召开标准修订中期会议,针对标准草案进行深入讨论,会后形成标准的征求意见稿。
二、编制原则和确定标准主要内容的依据目前,涉及无源外科植入物及器械的标准分为三个等级。
一级是对无源外科植入物的通用要求,二级是对各类无源外科植入物的特殊要求,三级是对各种无源外科植入物的专用要求。
本部分作为骨接合植入物的特殊要求,在分类等级中属于二级标准。
骨接合植入物涉及的产品包括接骨板、接骨螺钉、髓内钉、角度固定器、骨针等。
上述产品均植入人体,属于三类高风险医疗器械,产品质量的优劣,将直接关系到患者的健康和安全。
因此,行业标准YY 0341的及时更新对保证骨接合植入物类产品的安全性起着重要作用。
本部分按照GB/T 1.1-2009《标准化工作导则第1部分:标准的结构和编写》及GB/T 20000.2-2009《标准化工作指南第2部分:采用国际标准》的要求进行编写。

金属接骨板内固定系统产品注册技术审查指导原则一、前言金属接骨板内固定系统作为骨科植入性医疗器械,是治疗骨折的主要手段之一,其安全性和有效性直接影响骨折的治疗效果。
本指导原则旨在为申请人/生产企业进行金属接骨板内固定系统的注册申报提供技术指导,同时也为食品药品监督管理部门对注册申报资料的审评提供技术参考。
本指导原则系对金属接骨板内固定系统注册申报资料的一般要求,申请人/生产企业应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
本指导原则是对申请人/生产企业和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
应在遵循相关法规和标准的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围本指导原则涵盖的金属接骨板内固定系统适用于四肢骨(包括上肢带骨:锁骨、肩胛骨,自由上肢骨:肱骨、桡骨、尺骨、腕骨、掌骨、指骨,下肢带骨:髋骨、坐骨、耻骨;自由下肢骨:股骨、髌骨、胫骨、腓骨、跗骨、跖骨、趾骨)骨折内固定;由非锁定金属接骨板、非锁定金属接骨螺钉、锁定金属接骨板、锁定金属接骨螺钉和空心螺钉组成;由外科植入物用金属材料制成,包括纯钛、Ti6Al4V钛合金、TC4钛合金、TC4ELI钛合金、Ti6Al7Nb钛合金、00Cr18Ni14Mo3不锈钢、00Cr18Ni15Mo3N不锈钢、高氮不锈钢、锻造钴铬钼合金。
本指导原则不适用特殊设计及创新设计的产品。
三、基本要求(一)注册单元的划分金属接骨板内固定系统可按照实现某种临床预期用途的产品组合划分注册单元,亦可以组件作为注册单元进行申报:1.若按照实现某种临床预期用途的产品组合进行申报,金属接骨板内固定系统包括如下注册单元:(1)直型非锁定金属接骨板系统:由直型非锁定金属接骨板、非锁定金属接骨螺钉组成。

国家食品药品监督管理局关于发布实施YY 0017-2008《骨接合植入物金属接骨板》等64项医疗器械行业标准的通知【法规类别】行业标准管理【发文字号】国食药监械[2008]605号【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)【发布日期】2008.10.17【实施日期】2010.01.01【时效性】现行有效【效力级别】XE0303国家食品药品监督管理局关于发布实施YY 0017-2008《骨接合植入物金属接骨板》等64项医疗器械行业标准的通知(国食药监械[2008]605号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),各医疗器械标准化技术委员会及归口单位:YY 0017-2008《骨接合植入物金属接骨板》等64项医疗器械行业标准已经审定通过,现予以发布。
其标准编号、名称及实施日期如下:一、强制性行业标准1.YY 0017-2008《骨接合植入物金属接骨板》(代替0017-2002)2.YY 0018-2008《骨接合植入物金属接骨螺钉》(代替0018-2002)3.YY 0068.2-2008《医用内窥镜硬性内窥镜第2部分:机械性能及测试方法》(部分代替YY 0068-1992)4.YY 0068.3-2008《医用内窥镜硬性内窥镜第3部分:标签和随附资料》(部分代替YY 0068-1992)5.YY 0215-2008《医用臭氧消毒柜》(代替YY 0215.2-1995)6.YY 0290.1-2008《眼科光学人工晶状体第1部分:术语》(代替 YY 0290.1-1997)7.YY 0290.3-2008《眼科光学人工晶状体第3部分:机械性能及测试方法》(代替YY 0290.3-1997)8.YY 0290.4-2008《眼科光学人工晶状体第4部分:标签和资料》(代替 YY 0290.4-1997)9.YY 0290.5-2008《眼科光学人工晶状体第5部分:生物相容性》(代替 YY 0290.5-1997)10.YY 0290.8-2008《眼科光学人工晶状体第8部分:基本要求》(代替 YY 0290.8-1997)11.YY 0299-2008《医用超声耦合剂》(代替YY 0299-1998)12.YY 0306-2008《热辐射类治疗设备安全专用要求》(代替YY 0306-1998)13.YY 0323-2008《红外治疗设备安全专用要求》(代替YY 0323-2000)14.YY 0324-2008《红外乳腺检查仪》(代替YY 0324-2000)。



课程代码:课程名称: 骨科器械助理方向学时: 学分:合用专业: 开课学期:开课部门: 北京卓然迈迪克医疗器械技术研究院选修课程: 社交礼仪、医疗仪器管理与维护、公文写作、相关法律法规考核要求:使用教材及主要参考书:《生理学》主编:牛大年人民卫生出版社《骨科学》主编:邱贵兴人民军医出版社《骨与关节疾病影像诊断学》主编:梁碧玲人民卫生出版社一、课程得性质与任务骨科器械专业就是以系统解剖学、病理生理学、影像诊断学、骨外科学为基础,结合骨科器械使用,辅助医生完成手术。
该课程得任务就是使学生掌握常用骨科器械、产品得结构及使用,它包括骨生物力学、骨科内固定学、骨科外固定学、人工关节外科学等。
通过学习,使学生对骨科相关器械与产品有全面得了解。
教学目得与要求:通过本学科得学习,要求学生能系统掌握以下知识与技能: 1、掌握骨生物力学原理、骨组织得病理生理解剖、力学特性与骨得机械性质。
2、掌握人工关节得结构及使用。
3、掌握骨科内固定器械得结构特点及应用,包括螺丝钉、钢板、髓内钉等,同时了解内固定植入物得适应症。
4、掌握骨科外固定器械得结构特点及应用,了解骨科外固定得生物力学原理及适应症。
5、具备独立配合骨科医生完成骨科手术得能力。
6、培养骨科医疗器械研发、生产、销售与技术指导等一系列专业人材。
三、培养规格(一)思想道德方面1、学习马克思主义、毛泽东思想与邓小平理论得基本观点,运用辩证唯物主义与历史唯物主义得世界观、方法论认识主、客观世界,并指导思想与行为;2、具有坚定正确得政治方向,热爱社会主义祖国,拥护中国共产党得领导;3、有理想、有道德、有文化、有纪律;热爱医疗器械行业,具有与蔼、端庄得仪态,严谨、勤快得作风, 良好得职业道德与为骨科医疗事业献身得精神,以高度得责任感与使命感全心全意为人民服务。
(二)文化业务方面培养掌握有一定得人文社科知识与相关自然科学基础、具有较扎实得基础医学理论与实践经验、具有一定得思维能力与实践能力得人材。

《金属异形接骨板使用说明》金属异形接骨板是根据人体的长骨两端特殊形状和生物力学需要设计的一些特殊钢板。
为外科医师进行骨固定手术提供了一种手段,在骨折处理和重建外科中颇具帮助。
但金属异形接骨板仅仅是协助骨的愈合,而并非企图取代正常的骨结构。
通俗地说,在骨正常愈合时,它们是安放于骨折部位的体内夹板,骨及周边软组织的大小和形状制约了金属异形接骨板的大小和强度。
如发生骨不连或延迟愈合,由于金属的疲劳,患者负重或承载可能会最终导致钢板的断裂。
因此,保持骨折部位处于制动状态,直至达到牢固的骨性愈合是十分重要的。
牢固的骨性愈合应通过临床方法和放射学手段予以证实。
外科金属植入物在实际使用中均受到重复性的应力作用,在此作用下金属发生疲劳、患者的体重、活动度及其是否遵医嘱进行负重和承载等诸因素,均对植入物在体内所受力的大小和周次发生影响。
长骨两端都有特殊的形状,手指、足趾所需的钢板与其它部位的也有所不同,根据外科手术的需要异形板有各种形状、大小不同。
如YZSQ手足部异形板(小T 形、小L形);YCQ叉形异形板有Y形、三叶形,Y形并有各四孔、三孔等。
Y 形用于肱骨远端骨折,三叶形用于胫骨近端骨折;YLQ L形异形板与YTQ T形异形板均可用于胫骨近端、肱骨近端骨折(均有三孔、四孔、五孔)。
注册规格型号微型钢板,骨端钢板是习惯名称,对照YY0121-93应改为:手足部异形板YSZQT形异形板YTQ根据客户需要对T型进行了调整,增加了孔,检测报告型号规格为Y型4孔异形板应改为叉形异形板YCQI,因客户需要在YCQI叉形异形板的基础上增加了五个孔。
螺钉孔和球形滑动原理a 球形(螺钉头)向下滑到斜形圆柱体(螺钉孔),螺钉向下和水平的联合运动造成钢板下的骨水平移动而钢板则相对不动。
侧方移动成为不可能。
目的是使螺钉头的位置处在倾斜和向下的圆柱体的交界点。
在这个点上,螺钉头与钉孔有一个球形接触。
在不阻挡螺钉向骨折方向水平运动的情况下产生最大的稳定。

金属异形接骨板标准全文共四篇示例,供读者参考第一篇示例:金属异形接骨板标准是指用于骨折愈合的一种外科手术器械,它能够在骨折部位提供稳定支撑和连接,促进骨头恢复生长。
金属异形接骨板既可以用于传统的骨折治疗,也可以用于复杂的骨折和骨缺损修复。
通过标准化的金属异形接骨板的设计和制造,可以提高手术的成功率和患者的康复速度,减少手术并发症的发生。
下面将详细介绍金属异形接骨板标准的制定和应用。
一、金属异形接骨板标准的制定金属异形接骨板标准的制定需要遵循相关的国际标准和行业规范,确保产品的质量和性能符合医疗器械的要求。
制定金属异形接骨板标准的过程主要包括以下几个环节:1. 研究分析:对国际上已有的金属异形接骨板标准进行研究分析,了解其发展历史、应用范围和技术要求。
2. 制定制度:根据行业特点和国家政策法规,制定金属异形接骨板标准的制度,明确标准的适用范围和制定的程序。
3. 制定技术标准:制定金属异形接骨板的技术要求和测试方法,包括材料的选择、外形尺寸、结构设计、表面处理等方面的要求。
4. 审查审核:组织专家对制定的金属异形接骨板标准进行审查审核,确保标准的合理性和科学性。
5. 发布实施:经过论证和审定后,将金属异形接骨板标准正式发布实施,供相关生产企业和医疗机构参考和使用。
金属异形接骨板标准的应用可以从以下几个方面来进行说明:2. 制造加工:金属异形接骨板的制造加工应符合标准的要求,包括工艺流程、原材料采购、加工设备等方面,确保产品的可靠性和稳定性。
3. 质量控制:金属异形接骨板的质量控制应符合标准的要求,包括检验测试、质量记录、不合格品处理等方面,确保产品符合要求。
4. 临床应用:金属异形接骨板在临床应用时应严格遵守标准的要求,包括手术操作、患者用药、术后护理等方面,确保手术的成功和患者的康复。
5. 定期检查:金属异形接骨板在使用过程中应定期进行检查和维护,以确保产品的性能良好,减少患者的并发症发生。
金属异形接骨板标准的制定和应用对于提高骨折治疗的效果和患者的康复有着重要的意义:1. 提高手术成功率:金属异形接骨板标准的制定和应用可以提高手术的成功率,减少手术风险和并发症的发生。

金属接骨板产品使用说明书产品注册号:国药管械(准)字2003第3460116号执行标准:YZB/国0438-2002《金属接骨板》医疗器械生产企业许可证编号:津药管械生产许2000第0023号(更)一产品名称、规格型号金属接骨板包括:1匙形骨板型号YSQ,分为左、右两种系列。
规格表示方法为:孔数×长度。
其中孔数包括:5~11孔;长度包括:100~226mm。
2手足部骨板型号ZSQ,分为直、左、右多孔型等四种系列。
规格表示方法为:孔数×长度。
其中孔数包括:2~16孔;长度包括:10~70mm。
二结构原理金属接骨板根据人体骨骼的形状,按照仿生的设计而成,目的在于尽可能减小由于骨板预折弯造成的产品应力的破坏。
同时,根据产品所用的不同部位,预定螺钉孔间距和孔径。
根据部位的承重需要,确定所用材料。
三主要技术性能指标1材料:金属接骨板选用纯钛材料制造。
2加工方法:采用机加工成型,并经过表面处理而成。
四用途和适用范围1匙形骨板胫骨远端前侧骨折。
2手足部骨板手足部骨折。
五安装和使用说明1产品的选择:产品根据术前X光片的骨折部位和位置,选择适宜的产品,特别应注意产品的长度及骨折线与接骨板的螺钉孔的位置不能重合。
2灭菌方法:可采用高压蒸汽消毒、煮沸消毒或灭菌液浸泡30分钟消毒均可。
3手术时,应选择与骨板相适宜的螺钉。
4在适宜的位置放置骨板(注意骨板的螺钉孔不得与骨折线接触)。
检查骨板与骨的接触,根据骨板与骨的间隙,用骨扳折弯器对骨板预折弯,使骨板与骨紧密接触。
5接骨板手术安装方法为:首先用接骨板连接骨折(确定骨板与骨紧密接触),使用中立导向器。
第一颗螺钉固定在骨干一端,骨折面和骨板下产生的间隙使对侧骨折端向骨板靠拢。
螺钉固定在远离骨折的中立位。
骨折复位后,在骨折一端钻轴向加压孔,它与附近的骨板形成锐角。
使用负荷导向器对骨折线产生加压。
拧入剩余接骨螺钉时,应注意最后拧入松质骨螺钉。
6骨折愈合后,螺钉应取出。
国家食品药品监督管理总局公告总局关于批准发布YY 0017—2016《骨接合植入物金属接骨板》等64项医疗器械行业标准的公告(2016年第129号)YY 0017—2016《骨接合植入物金属接骨板》等64项医疗器械行业标准已经审定通过,现予以公布。
其中,强制性行业标准自2018年6月1日起实施,推荐性行业标准自2017年6月1日起实施。
标准编号、名称及适用范围见附件。
强制性行业标准内容可在国家食品药品监督管理总局网站(xx)、中国食品药品检定研究院网站(xxx)进行查询。
特此公告。
附件:YY 0017—2016《骨接合植入物金属接骨板》等64项医疗器械行业标准编号、名称及适用范围食品药品监管总局2016年7月29日(公开属性:主动公开)附件YY 0017—2016《骨接合植入物金属接骨板》等64项医疗器械行业标准编号、名称及适用范围一、强制性行业标准(共6项)(一)YY 0017—2016《骨接合植入物金属接骨板》本标准规定了骨接合植入物金属接骨板的相关术语、定义、要求、试验方法、制造、灭菌、包装等要求。
本标准适用于骨科手术时作骨折断端连接用的接骨板。
本标准不适用于颅颌面接骨板、角度固定器、脊柱固定板以及特殊设计接骨板的描述和要求。
本标准代替YY 0017—2008《骨接合植入物金属接骨板》。
(二)YY 0018—2016《骨接合植入物金属接骨螺钉》本标准规定了骨接合植入物金属接骨螺钉的术语、定义、分类、要求、试验方法、制造、灭菌、包装等要求。
本标准适用于骨科手术时固定骨折处用的金属接骨螺钉。
本标准不适用于脊柱及特殊设计的接骨螺钉。
本标准代替YY 0018—2008《骨接合植入物金属接骨螺钉》。
(三)YY 0271.1—2016《牙科学水基水门汀第1部分:粉/液酸碱水门汀》本标准规定了用作永久性粘固、垫底/衬层和修复的牙科粉/液酸碱水门汀的技术要求和试验方法。
本标准适用于手工调和的水基水门汀或机械调和的胶囊水基水门汀,本标准不适用于树脂改性的水基水门汀。