A:NaOH B:Na2CO3 C:氨水 D:MgO
3:铬酸银 (Ag2CrO4 )在298K时的溶解度为0.00445g , 求其溶度积 解析: 因铬酸银难溶,其饱和溶液是极稀的,其密度可视为1g/ml
M(Ag2CrO4)=332g/mol 则: n(Ag2CrO4)= 0.00445g / 332g/mol=1.34×10-5mol
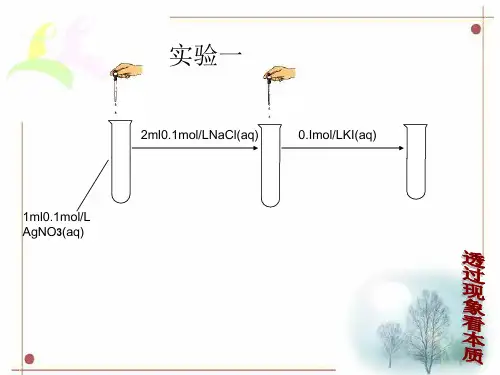
现象 产生白色沉淀 产生黄色沉淀 产生黑色沉淀 无任何现象
上述实验说明了什么? 原因分析:
Ag+ + ClAg+ + I-
2Ag+ + S2-
AgCl AgI
Ag2S
问l↓反应后,混合液中还存在着少量
Ag+和Cl-,即:AgCl(S)
Ag+ (aq) + Cl- (aq)
由于AgCl、AgI、Ag2S的溶解性依次减小 ,而AgCl 在溶液中又存在着沉淀—— 溶解平衡 ;溶液中的Ag+便
和I- 、S2-结合成更难溶的AgI、Ag2S沉淀,破坏了AgCl 的沉淀—— 溶解平衡 ,使AgCl不断溶解,沉淀转化的
实质就是沉淀—— 溶解平衡的移动。说明难溶电解质在
溶液中存在着沉淀—— 溶解平衡 ,即:
当v(溶解)=v(沉淀)时,得到饱和 AgCl溶液,建立溶解平衡
溶解
AgCl(s)
Ag+(aq) + Cl-(aq)
沉淀
3、溶解平衡的特征
逆、等、动、定、变
4、生成难溶电解质的离子反应的限度
难溶电解质的溶解度小于0.01g,离子 反应生成难溶电解质,离子浓度小于 1×10-5mol/L时,认为反应完全,但溶 液中还有相应的离子。
练习: