药物稳定性试验统计分析方法
- 格式:doc
- 大小:711.00 KB
- 文档页数:5
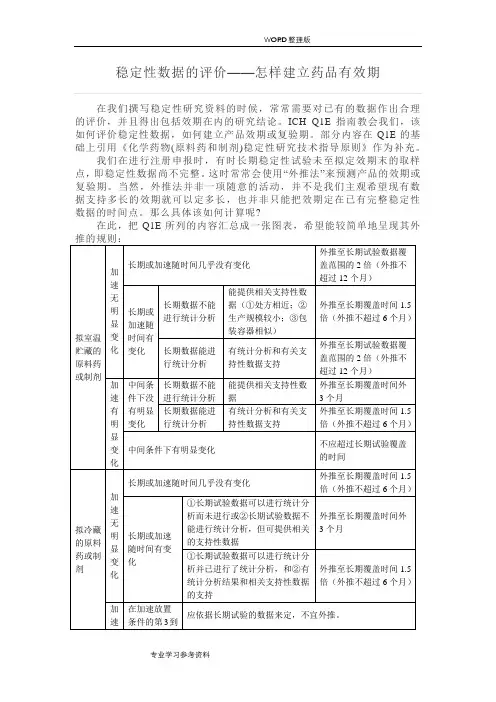
1.1 长期和加速试验数据显示随时间没有或几乎没有变化和变异当考察的某一指标的长期试验数据和加速试验数据显示没有或几乎没有随时间的变化及变异时,表明该原料药或制剂在建议的复验期或有效期内,该指标能很好地符合其认可标准。
在这种情况下,一般认为不必进行统计分析,但应当说明判断理由。
理由中可包括对变化模式或未变化的讨论,对加速试验数据、质量平衡和/或在Q1A中规定的其它支持性数据的相关性的讨论。
可用外推法来设置超过长期试验数据覆盖范围的复验期或有效期,所设置的复验期或有效期可达到长期试验数据覆盖范围的二倍,但不能超过覆盖范围外12个月。
1.2 长期或加速试验数据显示有变化和变异性如果考察的某一指标的长期试验数据和加速试验数据显示了随时间的变化、和/或因子内或各因子间的数据有变异性,则在建立复验期或有效期时应对长期试验数据进行统计分析。
当稳定性差异发生在批次之间、其他因子(如:规格、容器大小和/或装量)之间或除数据组合外的其他因素组合(如规格与容器大小和/或与装量组合)之间,建议的复验期或有效期就不应超过由批次、因子或因子组合中所得到的最短时间期限。
或者,当指标的变化是由一个特定因子(如规格)引起的,可针对该因子的不同水平(如不同规格)设计不同的有效期。
应阐明引起产品变化有差异的原因和这些差异对产品的总体影响。
可用外推来设置超过长期试验数据覆盖范围的复验期或有效期,但是,外推的程度取决于该指标的长期试验数据是否能进行统计分析。
1)数据不能进行统计分析如果长期试验数据不能进行统计分析,但能提供相关支持性数据,建议的复验期或有效期可外推至长期试验数据覆盖时间的1.5倍,但不能超过长期试验覆盖时间外6个月。
有关的支持性数据包括在开发阶段所研究批次的良好的长期试验数据,这些研究批次与进行初步稳定性的批次相比①处方相近;②生产规模较小;③包装容器相似。
2)数据能进行统计分析如果长期试验数据能进行统计分析但未进行统计分析,则外推的程度与“数据不能进行统计分析”相同。

指导原则编号:【H】G P H6-1化学药物稳定性研究技术指导原则二○○五年三月目 录一、概述 (1)二、稳定性研究设计的要点 (1)(一)样品的批次和规模 (1)(二)包装及放置条件 (2)(三)考察时间点 (2)(四)考察项目 (2)(五)分析方法 (3)三、稳定性研究的试验方法 (3)(一)影响因素试验 (4)1.1高温试验 (4)1.2高湿试验 (4)1.3光照试验 (5)(二)加速试验 (5)(三)长期试验 (6)(四)药品上市后的稳定性研究 (6)四、稳定性研究的结果 (7)(一)贮存条件的确定 (7)(二)包装材料/容器的确定 (7)(三)有效期的确定 (7)五、名词解释 (7)六、参考文献 (8)七、附录 (9)(一)国际气候带 (9)(二)低温和冻融试验 (10)(三)稳定性研究报告的一般内容 (10)八、著者 (11)化学药物稳定性研究技术指导原则一、概述药品的稳定性是指原料药及制剂保持其物理、化学、生物学和微生物学性质的能力。
稳定性研究目的是考察原料药或制剂的性质在温度、湿度、光线等条件的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障临床用药安全有效。
稳定性研究是药品质量控制研究的主要内容之一,与药品质量研究和质量标准的建立紧密相关。
稳定性研究具有阶段性特点,贯穿药品研究与开发的全过程,一般始于药品的临床前研究,在药品临床研究期间和上市后还应继续进行稳定性研究。
本文为一般性原则,具体的试验设计和评价应遵循具体问题具体分析的原则。
二、稳定性研究设计的要点稳定性研究的设计应根据不同的研究目的,结合原料药的理化性质、剂型的特点和具体的处方及工艺条件进行。
(一)样品的批次和规模一般地,影响因素试验采用一批样品进行,加速试验和长期试验采用三批样品进行。
稳定性研究应采用一定规模生产的样品,以能够代表规模生产条件下的产品质量。
原料药的合成工艺路线、方法、步骤应与生产规模一致;药物制剂的处方、制备工艺也应与生产规模一致。

ICHQ1D现行第四阶段版本2002年2月7日根据ICH进程,本指导原则由相应的ICH专家工作组制定,并已提交给管理当局征询意见。
在进程的第四阶段,最终的草案被推荐给欧盟、日本和美国的管理当局采纳。
Q1D原编码历史日期新编码2005年11月Q1D 指导委员会批准作为第二阶段草案发布,对外征求意见。
2000年11月10日Q1D 现行第4版本Q1D 指导委员会批准作为第四阶段草案推荐给ICH三方的法规机构采纳2002年2月7日Q1DICH2002年2月7日,在ICH指导委员会会议上进入ICH进程第四阶段,并推荐给ICH 三方管理部门采纳。
1、前言 (1)1.1指导原则的目的 (1)1.2背景 (1)1.3本指导原则适用范围 (1)2、指导原则 (1)2.1总则 (1)2.2简化设计的适用性 (2)2.3括号法 (3)2.3.1设计因素 (3)2.3.2设计上的考虑和潜在风险 (4)2.3.3设计示例 (4)2.4矩阵法设计 (5)2.4.1设计因素 (6)2.4.2设计上需考虑的因素 (6)2.4.3设计示例 (7)2.4.4简化设计的适用性和程度 (9)2.4.5矩阵法设计的潜在风险 (10)2.5数据评估 (11)1、前言1.1指导原则的目的本指导原则的目的是介绍在按照ICH Q1A(R)新原料药和制剂的稳定性试验三方协调指导原则(下文称总指导原则)进行稳定性试验时,如何应用括号法及矩阵法。
1.2背景ICH Q1A(R)指出了矩阵法和括号法在经过论证的情况下可以应用于新原料药及制剂的稳定性试验,但并未提供进一步的指导。
1.3本指导原则适用范围本文件提供了括号法与矩阵法研究设计的指导原则。
在可以应用括号法和矩阵法时,本指导原则明确了具体的原则。
提供的设计示例仅是为了举例说明,不应当被当作唯一或最佳的设计。
2、指导原则2.1总则一项完整的设计方案就是在所有时间点对全部设计因素的每个组合的样品都进行测试。

药物稳定性试验统计分析方法在确定有效期的统计分析过程中,一般选择可以定量的指标进行处理,通常根据药物含量变化计算,按照长期试验测定数值,以标示量%对时间进行直线回归,获得回归方程,求出各时间点标示量的计算值(y'),然后计算标示量(y')95%单侧可信限的置信区间为y'±z ,其中:2202)()(1X Xi X X N S t z N -∑-+⋅⋅=- (12-21)式中,t N -2—概率0.05,自由度N-2的t 单侧分布值(见表12-4),N 为数组;X 0—给定自变量;X —自变量X 的平均值;2-=N QS (12-22) 式中,xy yy bL L Q -=;L yy —y 的离差平方和,N y y L yy /)(22∑-∑=;L xy —xy 的离差乘积之和N y x xy L xy /))((∑∑-∑=;b —直线斜率。
将有关点连接可得出分布于回归线两侧的曲线。
取质量标准中规定的含量低限(根据各品种实际规定限度确定)与置信区间下界线相交点对应的时间,即为药物的有效期。
根据情况也可拟合为二次或三次方程或对数函数方程。
此种方式确定的药物有效期,在药物标签及说明书中均指明什么温度下保存,不得使用“室温”之类的名词。
例:某药物在温度25±2℃,相对温度60±10%的条件下进行长期实验,得各时间的标示量如表12-4。
表12-4 供试品各时间的标示量时间/月 0 3 6 9 12 18 标示量/%99.397.697.398.496.094.0以时间为自变量(x ),标示量%(y )为因变量进行回归,得回归方程 y= 99.18-0.26x ,r=0.8970,查T 单侧分布表,当自由度为4,P=0.05得 t N -2=2.1329279.04444.32==-=N Q S 210)(2=-∑X X i当X 0=0时,(即0月)2202)()(1X X X X N S t z i N -∑-+⋅⋅=- = 2.132×0.9297×210)80(612-+= 1.356按回归方程计算0月时的y'值得99.18%,则y'值置信区间y'±z ,即:99.18 + 1.356=100.54 99.18-1.356=97.82其他各时间(3、6、9、12、18月)的y'及置信区间按同法计算,结果见表12-5。

当加速条件下未发生明显变化时,可根据长期和加速试验的数据来确定复验期或有效期。
1.1长期和加速试验数据显示随时间没有或几乎没有变化和变异当考察的某一指标的长期试验数据和加速试验数据显示没有或几乎没有随时间的变化及变异时,表明该原料药或制剂在建议的复验期或有效期内,该指标能很好地符合其认可标准。
在这种情况下,一般认为不必进行统计分析,但应当说明判断理由。
理由中可包括对变化模式或未变化的讨论,对加速试验数据、质量平衡和/或在Q1A中规定的其它支持性数据的相关性的讨论。
可用外推法来设置超过长期试验数据覆盖范围的复验期或有效期,所设置的复验期或有效期可达到长期试验数据覆盖范围的二倍,但不能超过覆盖范围外12个月。
1.2长期或加速试验数据显示有变化和变异性如果考察的某一指标的长期试验数据和加速试验数据显示了随时间的变化、和/或因子内或各因子间的数据有变异性,则在建立复验期或有效期时应对长期试验数据进行统计分析。
当稳定性差异发生在批次之间、其他因子(如:规格、容器大小和/或装量)之间或除数据组合外的其他因素组合(如规格与容器大小和/或与装量组合)之间,建议的复验期或有效期就不应超过由批次、因子或因子组合中所得到的最短时间期限。
或者,当指标的变化是由一个特定因子(如规格)引起的,可针对该因子的不同水平(如不同规格)设计不同的有效期。
应阐明引起产品变化有差异的原因和这些差异对产品的总体影响。
可用外推来设置超过长期试验数据覆盖范围的复验期或有效期,但是,外推的程度取决于该指标的长期试验数据是否能进行统计分析。
1)数据不能进行统计分析如果长期试验数据不能进行统计分析,但能提供相关支持性数据,建议的复验期或有效期可外推至长期试验数据覆盖时间的1.5倍,但不能超过长期试验覆盖时间外6个月。
有关的支持性数据包括在开发阶段所研究批次的良好的长期试验数据,这些研究批次与进行初步稳定性的批次相比①处方相近;②生产规模较小;③包装容器相似。
药品稳定性OOT确认与分析1.概述2003年10月,美国FDA代表与美国药品研究和制造商协会成员对稳定性OOT问题进行了讨论,强调了稳定性OOT追踪的必要性,2008年,WHO也出了一个ppt讲述稳定性数据的评价,其中也提到了OOT的确认;近年来,药品生产行业及相关部门都强调稳定性的OOT分析,国外客户审计时也经常问到稳定性数据趋势分析的问题,FDA也在483表格中要求企业建立稳定性OOT确认及调查程序,稳定性OOT确认及分析是药品生产企业迫切需要做的,关于这方面国内文献还比较缺乏,《浅析稳定性试验中OOT的确认方法》((中国药科大学国际医药商学院,肖潇,梁毅)是为数不多的讨论稳定性OOT确认的文献,但该文献只是翻译了Identification of Out-of-Trend Stability Results- A Review of the Potential Regulatory Issue and Various Approaches(PhRMA CMC Statistics and Stability Expert Teams)中的部分内容,未做系统的整理。
稳定性数据对药品生产企业非常重要,是确定和延长有效期、以及确定产品标签储存说明的依据,同时,稳定性数据可以用于支持产品或工艺改进,对确保持续的产品质量有重要作用。
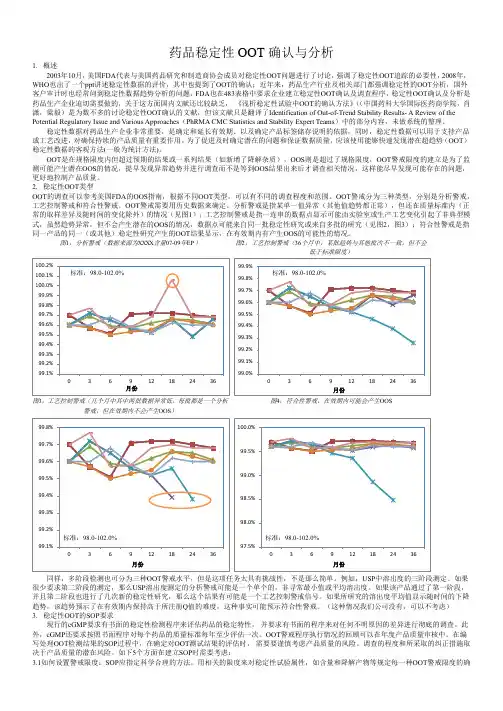
为了促进及时确定潜在的问题和保证数据质量,应该使用能够快速发现潜在超趋势(OOT)稳定性数据的客观方法(一般为统计方法)。
OOT是在规格限度内但超过预期的结果或一系列结果(如新增了降解杂质),OOS则是超过了规格限度,OOT警戒限度的建立是为了监测可能产生潜在OOS的情况,提早发现异常趋势并进行调查而不是等到OOS结果出来后才调查相关情况,这样能尽早发现可能存在的问题,更好地控制产品质量。
2.稳定性OOT类型OOT的调查可以参考美国FDA的OOS指南,根据不同OOT类型,可以有不同的调查程度和范围。


药物稳定性研究药物稳定性是指药物在一定条件下的特性,包括其化学、物理和微生物稳定性。
药物的稳定性对于药物的疗效和安全性具有重要影响。
因此,药物稳定性的研究是药学领域中一项重要的研究内容。
一、药物稳定性的定义和意义药物稳定性是指药物在特定条件下不发生明显的变化,包括其化学成分、药物活性、溶解度和物理性质等方面。
药物稳定性的研究能够揭示药物在不同条件下的变化规律,进而为制药过程和药物使用提供科学依据。
药物稳定性的研究对于药物的质量控制和合理使用至关重要。
药物稳定性的不良变化可能导致药物疗效下降,药物降解产物可能具有毒性或无效。
因此,药物稳定性的研究能够帮助制药企业确保药物的质量,并指导药师合理选用和储存药物。
二、药物稳定性的影响因素1. 温度:温度是影响药物稳定性的主要因素之一。
药物通常会在高温下发生分解和降解反应,而低温则可以减缓药物的降解速度。
2. 光照:药物的稳定性受到光照的影响。
某些药物对光敏感,容易发生光解反应,导致药物分解或者产生有害物质。
3. 氧气:氧气也是药物稳定性的影响因素之一。
氧气能够引起氧化反应,导致药物的降解和失效。
4. pH值:药物稳定性的研究需要考虑药物在不同pH值下的变化。
酸碱性环境能够影响药物的分解和溶解性。
5. 湿度:湿度对于一些药物的稳定性有着显著的影响。
高湿度会导致药物变质、分解和降解。
三、药物稳定性的研究方法1. 加速试验:加速试验是通过改变药物在温度、湿度和光照等条件下的暴露时间,以研究药物在实际使用期限的稳定性。
常见的加速试验方法有热力学法、湿热法和光照法等。
2. 稳定性分析:稳定性分析是通过对药物样品进行化学和物理分析,以评估药物在不同条件下的变化。
稳定性分析的常用方法包括高效液相色谱法、质谱法和红外光谱法等。
3. 数据处理和评估:药物稳定性研究得到的数据需要进行处理和评估。
通过对药物的分析结果进行统计分析和图像处理,可以得到关于药物稳定性的定量和定性表达。

研究药物稳定性的方法
研究药物稳定性的方法包括以下几种:
1. 加速试验:该方法通过对药物在特定条件下进行加速暴露,来模拟长期储存或使用过程中的环境影响。
常用的加速试验方法包括高温、高湿、光照、氧化等暴露条件。
通过检测药物在不同暴露条件下的变化,可以评估药物的稳定性。
2. 长期稳定性试验:该方法通过在一定时间内对药物进行监测,来评估其在常规储存条件下的稳定性。
通常,药物会在不同储存温度下进行稳定性试验,如常温、冷藏和冷冻条件下。
长期稳定性试验通常需要几个月到几年的时间。
3. 加速稳定性试验:该方法结合了加速试验和长期稳定性试验的优点,以更短的时间来评估药物的稳定性。
通过在一段时间内对药物进行加速暴露,并结合数学统计模型,可以预测药物在常规储存条件下的稳定性。
4. 特殊环境条件下的稳定性:某些药物可能会受到特殊环境条件的影响,例如光照、湿度、氧化等。
研究药物在这些特殊条件下的稳定性,可以提供关于储存和使用条件的指导。
除了上述方法,还可以通过物理化学分析技术,如高效液相色谱(HPLC)、气相色谱(GC)、质谱(MS)等,对药物分子结构和药物降解产物进行分析,以了
解药物的稳定性情况。

化学药物稳定性研究技术指导原则(2015年版)附件2化学药物(原料药和制剂)稳定性研究技术指导原则(修订)⼀、概述原料药或制剂的稳定性是指其保持物理、化学、⽣物学和微⽣物学特性的能⼒。
稳定性研究是基于对原料药或制剂及其⽣产⼯艺的系统研究和理解,通过设计试验获得原料药或制剂的质量特性在各种环境因素(如温度、湿度、光线照射等)的影响下随时间变化的规律,并据此为药品的处⽅、⼯艺、包装、贮藏条件和有效期/复检期的确定提供⽀持性信息。
稳定性研究始于药品研发的初期,并贯穿于药品研发的整个过程。
本指导原则为原料药和制剂稳定性研究的⼀般性原则,其主要适⽤于新原料药、新制剂及仿制原料药、仿制制剂的上市申请(NDA/ANDA,New Drug Application/Abbreviated New Drug Application)。
其他如创新药(NCE,New Chemical Entity)的临床申请(IND,Investigational New Drug Application)、上市后变更申请(Variation Application)等的稳定性研究,应遵循药物研发的规律,参照创新药不同临床阶段质量控制研究、上市后变更研究技术指导原则的具体要求进⾏。
本指导原则是基于⽬前认知的考虑,其他⽅法如经证明合理也可采⽤。
⼆、稳定性研究的基本思路(⼀)稳定性研究的内容及试验设计稳定性研究是原料药或制剂质量控制研究的重要组成部分,其是通过设计⼀系列的试验来揭⽰原料药和制剂的稳定性特征。
稳定性试验通常包括影响因素试验、加速试验和长期试验等。
影响因素试验主要是考察原料药和制剂对光、湿、热、酸、碱、氧化等的稳定性,了解其对光、湿、热、酸、碱、氧化等的敏感性,主要的降解途径及降解产物,并据此为进⼀步验证所⽤分析⽅法的专属性、确定加速试验的放置条件及选择合适的包装材料提供参考。
加速试验是考察原料药或制剂在⾼于长期贮藏温度和湿度条件下的稳定性,为处⽅⼯艺设计、偏离实际贮藏条件其是否依旧能保持质量稳定提供依据,并根据试验结果确定是否需要进⾏中间条件下的稳定性试验及确定长期试验的放置条件。

名词解释:1.药物分析:是运用化学的、物理学的、生物学的以及微生物学的方法和技术来研究化学结构已经明确的合成药物或天然药物及其制剂质量的一门学科。
2.重金属:密度在4或5以上的金属3.杂质限量:答:杂质限量是指药物所含杂质的最大允许量。
4.限度检查:亦称限量检查,药物在不影响疗效和不发生毒性的原则下,可以允许有一定限童的杂质存在,这样既可以保证药物质量,又便于生产和贮藏5.一般杂质:一在药物在生产和储藏中容易引入的杂质。
6特殊杂质:药物在生产和贮藏的过程中,根据药物的性质,生产方法和工艺可能会引入的杂质7 精密度:指在规定的测定条件下,同一个均匀样品,经多次取样测定所得结果之间的近似程度。
8E1%1cm百分吸光系数9.准确度:指测试结果与真实值接近的程度。
10药物分析课程:在有机化学,分析化学,药物化学以及其他相关课程基础上开设的11专属性:指在其他成分可能存在下,采用的测定方法能准却测定出被测物的特性12定量限LOD:是指分析方法能够从背景信号中分出药物,所需要的样品中药物的最低浓度13.LOQ定量限:指样品中被测物能被定量测定的最低值14耐用性:是评价其保持不受参数微小变动影响的能力,并可作为正常使用的一个可靠性标准15药品质量标准:国家对药品质量及检测方法所做出的技术规定,是药品生产经营使用检测和监督管理部门共同遵循的法定依据16、滴定度:指每1mL某摩尔浓度的滴定液(标准溶液)所相当的被测药物的质量(g/mL)。
17. RP-HPLC:反相高效液相色谱,狭义上指的是固定相颗粒表面为非极性材料(如含C18链),流动相为极性的一种高效液相色谱。
18恒重:两次称量所得质量之差不得超过一定的允许误差19回收率:回收率包括绝对回收率和相对回收率。
绝对回收率考察的是经过样品处理后能用于分析的药物的比例。
相对回收率严格来说有两种。
一种是回收试验法,另一种是加样回收试验法。
前者是在空白基质中加入药品,标准曲线也是同此,这种测定用得较多,但有标准曲线重复测定的嫌疑。
浅析稳定性试验中OOT的确认⽅法1 OOT 简介1.1 OOT的定义OOT(Out of Trend)结果,⼜称为超趋势结果,是指超出了系统趋势但仍在质量标准限度内的结果。
在稳定性试验中,系统趋势是指稳定性试验结果的正常波动范围。
⽽系统趋势的建⽴既可通过与其他批次稳定性试验结果的⽐较⽽得,也可经对先前稳定性试验结果的分析⽽得。
1.2 OOT与OOS的区别根据ICH的定义,偏差(Deviation)是指对批准指令(⽣产⼯艺规程、岗位操作法和标准操作规程等)或规定标准的任何偏离 [1] 。
OOT 结果和OOS结果均属偏差,但两者偏离程度不同。
OOS 结果是指在检验过程中出现的任何偏离标准(包括药品申报标准、DMF中申报标准、药典标准和企业内控标准)的结果 [2] ;⽽OOT结果则属超出了正常波动范围但未偏离任何标准。
故OOT结果与OOS结果的本质区别在于是否偏离了任何标准。
1.3 OOT确认的必要性如今,OOT问题越来越得到各国药品监管机构制药界的关注。
⽆论从监管⾓度还是商业⾓度,确认稳定性试验中的OOT结果均是⼗分有必要的:从监管⾓度来看,FDA指出OOT结果的确认已经成为上市药品监测的重要部分,现已有多家制药企业接到FDA的483表格要求其建⽴关于稳定性试验中OOT结果的确认和调查的书⾯⽂件 [3] 。
此外,FDA发布了OOS调查的⼯业指南,要求制药企业在评价分析结果和批放⾏决定时应当考虑产品的历史数据,并在此基础上进⾏趋势分析以预测未来OOS结果的可能性 [4] 。
从商业⾓度来看,对稳定性数据进⾏OOT确认有着重要的商业意义。
稳定性试验数据在药品注册申报时可以作为证明产品有效期的依据。
此外,许多公司利⽤稳定性试验数据制定产品的内控标准,确保在整个有效期内始终符合质量标准。
此时稳定性数据就⽤于估计产品在有效期内质量变化,不同批次相同产品质量的⼀致性和含量的变异性。
因此,确认任何偏离预期趋势之外的数据就变得⾮常有必要,因为OOT数据必将对所要进⾏的相关计算产⽣重⼤影响,使稳定性试验数据各项应⽤的效果⼤打折扣。
1.1 术语1.1.1 长期稳定性试验(long term stability testing)在控制的环境条件下(接近实际条件)留样,并定期进行检验。
其目的为了确认适当的贮存条件及制定产品有效期或复验期提供依据。
1.1.2 加速稳定性试验(Accelerated stability testing)通过使用超常的贮存条件来加速产品化学降解或物理变化。
评估在运输期间短期的贮存条件与标签上规定的条件不符时,可能会造成对产品质量的影响;是对长期稳定性研究数据的补充。
1.1.3 影响因素试验1.1.4 是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。
1.2 稳定性年度计划1.2.1 QC经理根据生产品和QA的要求,种制订年度稳定性试验计划,包括:品名、规格、批次、批号、试验方式、稳定性试验项目及方法、责任人等。
1.2.2 稳定性计划经QC经理审核,交质量部负责人批准方可生效。
1.3 原料药影响因素试验1.3.1 原料药进行该试验。
用一批代表性的原料药进行,将样品除去包装后,平放在称量瓶或培养皿中摊成≤5 mm厚的薄层,疏松原料药摊成≤10 mm厚薄层,进行以下实验,考察各项指标的变化情况。
1.3.2 高温试验温度分别选择40℃、60℃两个温度水平。
将样品在60℃温度下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测。
若样品无明显变化,则不进行40℃条件下的试验;若样品有明显变化(如含量下降5%,鉴别不明显,外观色泽变化大等),则须在40℃条件下同法进行试验。
1.3.3 高湿试验选择相对湿度为75%±5%、90%±5%两个湿度水平(T=25℃)。
将样品置于相对湿度90%±5%条件下(装KNO3饱和溶液的干燥器中,用封口胶密封)放置10天,于第5天和第10天取样,按稳定性重点考察项目要求检测,同时准确称量试验前后样品的重量,若样品无明显变化,则不进行75%±5%条件下的试验;若样品有明显变化(如含量下降5%,鉴别不明显,外观色泽变化大、吸湿增重5%以上等),则须在相对湿度75%±5%条件下(装有NaCl饱和溶液的干燥器中,用凡士林密封)同法进行试验。
药物稳定性试验统计分析方法在确定有效期 的统计分析过程中,一般选择可以定量 的指标进行处理,通常根据药物含 量变化计算,按照长期试验测定数值,以标示量%对时间进行直线回归,获得回归方程,求的计算值(y'),然后计算标示量(y')95 %单侧可信限 的置信区间为y' ± z ,其中:zt N2s :,N (XXi X 22(12-21)自变量;X —自变量X 的平均值;(12-22)式中,QL yy bL xy ; L yy — y 的离差平方和,L yy积之和L xy xy ( x )( y )/ N ; b —直线斜率。
将有关点连接可得出分布于回归线两侧的曲线。
取质量标准中规定的含量低限 (根据各况也可拟合为二次或三次方程或对数函数方程。
此种方式确定的药物有效期, 在药物标签及说明书中均指明什么 温度下保存,不得使用“室温”之类的名词。
例:某药物在温度25 ± 2 C,相对温度60 ± 10%的条件下进行长期实验,得各时间 的标示量如表12-4。
表12-4 供试品各时间的标示量以时间为自变量(x ),标示量% (y )为因变量进行回归,得回归方程y= 99.18 — 0.26x , r=0.8970 ,查T 单侧分布表,当自由度为 4, P=0.05 得t N-2=2.132式中,t N-2 —概率 0.05,自由度N-2的t 单侧分布值(见表 12-4),N 为数组;X o —给定品种实际规定限度确定)与置信区间下界线相交点对应 的时间,即为药物的有效期。
根据情出各时间点标示量 2 2y ( y) / N ; L xy — xy 的离差乘2(X i X) 210当X o =o 时,(即0月)Zt N2S ^ 刖=1.35699.18 + 1.356=100.54 99.18 其他各时间( —1.356=97.82;3、6、9、12、18月)的y'及置信区间按同法计算,结果见表 12-5。
药物稳定性试验统计分析方法在确定有效期的统计分析过程中,一般选择可以定量的指标进行处理,通常根据药物含量变化计算,按照长期试验测定数值,以标示量%对时间进行直线回归,获得回归方程,求出各时间点标示量的计算值(y'),然后计算标示量(y')95%单侧可信限的置信区间为y'±z ,其中:2202)()(1X Xi X X N S t z N -∑-+⋅⋅=- (12-21)式中,t N -2—概率0.05,自由度N-2的t 单侧分布值(见表12-4),N 为数组;X 0—给定自变量;X —自变量X 的平均值;2-=N QS (12-22) 式中,xy yy bL L Q -=;L yy —y 的离差平方和,N y y L yy /)(22∑-∑=;L xy —xy 的离差乘积之和N y x xy L xy /))((∑∑-∑=;b —直线斜率。
将有关点连接可得出分布于回归线两侧的曲线。
取质量标准中规定的含量低限(根据各品种实际规定限度确定)与置信区间下界线相交点对应的时间,即为药物的有效期。
根据情况也可拟合为二次或三次方程或对数函数方程。
此种方式确定的药物有效期,在药物标签及说明书中均指明什么温度下保存,不得使用“室温”之类的名词。
例:某药物在温度25±2℃,相对温度60±10%的条件下进行长期实验,得各时间的标示量如表12-4。
表12-4 供试品各时间的标示量时间/月 0 3 6 9 12 18 标示量/%99.397.697.398.496.094.0以时间为自变量(x ),标示量%(y )为因变量进行回归,得回归方程 y= 99.18-0.26x ,r=0.8970,查T 单侧分布表,当自由度为4,P=0.05得 t N -2=2.1329279.04444.32==-=N Q S 210)(2=-∑X X i当X 0=0时,(即0月)2202)()(1X X X X N S t z i N -∑-+⋅⋅=- = 2.132×0.9297×210)80(612-+= 1.356按回归方程计算0月时的y'值得99.18%,则y'值置信区间y'±z ,即:99.18 + 1.356=100.54 99.18-1.356=97.82其他各时间(3、6、9、12、18月)的y'及置信区间按同法计算,结果见表12-5。
药物稳定性试验统计分析方法
在确定有效期的统计分析过程中,一般选择可以定量的指标进行处理,通常根据药物含
量变化计算,按照长期试验测定数值,以标示量%对时间进行直线回归,获得回归方程,求
出各时间点标示量的计算值(y'),然后计算标示量(y')95%单侧可信限的置信区间为y'±z,其中:
zt N
2
1(X X)
S
2()
2
NXiX
(12-21)
式中,t N-2—概率0.05,自由度N-2的t单侧分布值(见表12-4),N为数组;X0—给定自变量;X—自变量X的平均值;
Q
S(12-22)
N2
式中,
22
Q;L yy—y的离差平方和,LyyN
L yy bLyy()/
xy
;L xy—xy的离差乘
积之和L xy xy(x)(y)/N;b—直线斜率。
将有关点连接可得出分布于回归线两侧的曲线。
取质量标准中规定的含量低限(根据各品种实际规定限度确定)与置信区间下界线相交点对应的时间,即为药物的有效期。
根据情况也可拟合为二次或三次方程或对数函数方程。
此种方式确定的药物有效期,在药物标签及说明书中均指明什么温度下保存,不得使用“室温”之类的名词。
例:某药物在温度25±2℃,相对温度60±10%的条件下进行长期实验,得各时间的标示量如表12-4。
表12-4供试品各时间的标示量
时间/月03691218
标示量/%99.397.697.398.496.094.0
以时间为自变量(x),标示量%(y)为因变量进行回归,得回归方程y=99.18-0.26x,r=0.8970,查T单侧分布表,当自由度为4,P=0.05得
tN-2=2.132
S
Q
N2
3.444
4
0.9279
2 ) 210
(X i X
当X0=0时,(即0月)
2
1(XX)
ztS
N2
2
N(XX)
i
2
1(08)
=2.132×0.9297×
6210
=1.356
按回归方程计算0月时的y'值得99.18%,则y'值置信区间y'±z,即:
99.18+1.356=100.54
0.9280-1.356=97.82
其他各时间(3、6、9、12、18月)的y'及置信区间按同法计算,结果见表12-5。
表12-5稳定性数据表
时间/月实测标示量(y)/%计算标示量(y')/%
下界值
y'-z
上界值
y'+z
099.399.1897.82100.54
397.698.4097.3499.45
697.397.6296.7798.47
998.496.8496.0297.66
1296.096.0695.0897.04
1894.094.5092.9296.09
2492.9490.6195.27
3091.3888.2794.49
3689.8285.9193.72
用时间与y、y'、y'-z、y'+z作图,得图12-6,从标示量90%处划一条直线与置信区间下界线相交,自交点作垂线于时间轴相交处,即为有效期,本例有效期为25.5个月。
图12-6药品产品有效期估算图
图12-6
六、经典恒温法
前述实验方法主要用于新药申请,但在实际研究工作中,也可考虑采用经典恒温法,特别对
水溶液的药物制剂,预测结果有一定的参考价值。
经典恒温法的理论依据是前述Arrhenius的指数定律K=Ae
-E/RT,其对数形式为
log E
Klog
2.303RT
A
(12-23)
以logK对1/T作图得一直线,此图称Arrhenius图,直线斜率为-E/(2.303R),由此可
计算出活化能E。
若将直线外推至室温,就可求出室温时的速度常数(K25)。
由K25可求出
分解10%所需的时间(即T0.9)或室温贮藏若干时间以后残余的药物的浓度。
实验设计时,除了首先确定含量测定方法外,还要进行预试,以便对该药的稳定性有一个基本的了解,然后设计实验温度与取样时间。
计划好后,将样品放入各种不同温度的恒温水浴中,定时取样测定其浓度(或含量),求出各温度下不同时间药物的浓度变化。
以药物浓度或浓度的其他函数对时间作图,以判断反应级数。
若以logc对T作图得一直线,则为一级反应。
再由直线斜率求出各温度的速度常数,然后按前述方法求出活化能和T0.9。
要想得到预期的结果,除了精心设计实验外,很重要的问题是对实验数据进行正确的处理。
化学动力学参数(如反应级数、K、E、T1/2)的计算,有图解法和统计学方法,后一种方法比较准确、合理,故近来在稳定性的研究中广泛应用。
下面介绍线性回归法。
例如某药物制剂,在40℃、50℃、60℃、70℃四个温度下进行加速实验,测得各个时间的浓度,确定为一级反应,用线性回归法求出各温度的速度常数,结果见表12-6。
表12-6动力学数据表
3K×105/h-1lgK
T/℃1/T×10
403.1922.66-4.575
503.0947.94-4.100
603.00122.38-3.650
702.91356.50-3.248
将上述数据(logK对1/T)进行一元线性回归,得回归方程:
logK=-47.65.98/T+10.64
E=-(-4765.98)×
4.×8.319
=91309.77(J/mol)=91.31(kJ/mol)除经典恒温法外,还有线性变温法,Q10法,活化能估算法等,在研究工作中,有时可以应用。