Report-头孢地尼CP2015分析
- 格式:pdf
- 大小:278.96 KB
- 文档页数:5
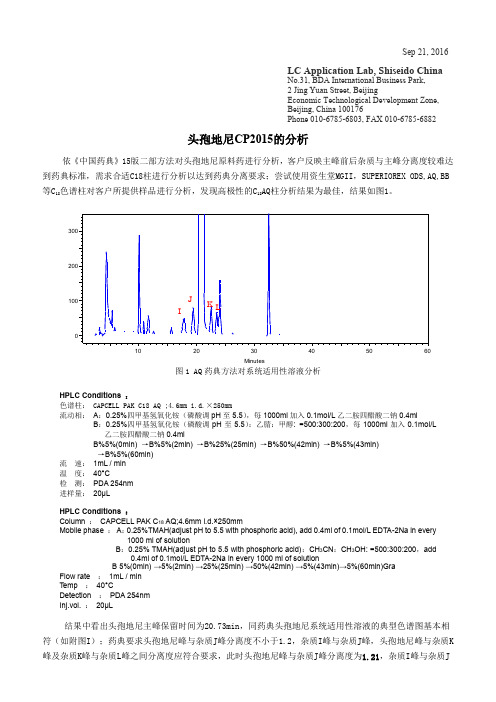
Sep 21, 2016LC Application Lab, Shiseido ChinaNo.31, BDA International Business Park,2 Jing Yuan Street, BeijingEconomic Technological Development Zone,Beijing, China 100176Phone 010-6785-6803, FAX 010-6785-6882头孢地尼CP2015的分析依《中国药典》15版二部方法对头孢地尼原料药进行分析,客户反映主峰前后杂质与主峰分离度较难达到药典标准,需求合适C18柱进行分析以达到药典分离要求;尝试使用资生堂MGII,SUPERIOREX ODS,AQ,BB 等C18色谱柱对客户所提供样品进行分析,发现高极性的C18AQ柱分析结果为最佳,结果如图1。
图1 AQ药典方法对系统适用性溶液分析HPLC Conditions :色谱柱:CAPCELL PAK C18 AQ ;4.6mm i.d.×250mm流动相:A:0.25%四甲基氢氧化铵(磷酸调pH至5.5),每1000ml加入0.1mol/L乙二胺四醋酸二钠0.4ml B:0.25%四甲基氢氧化铵(磷酸调pH至5.5):乙腈:甲醇: =500:300:200,每1000ml加入0.1mol/L 乙二胺四醋酸二钠0.4mlB%5%(0min)→B%5%(2min) →B%25%(25min) →B%50%(42min) →B%5%(43min)→B%5%(60min)流速:1mL / min温度:40°C检测:PDA 254nm进样量:20µLHPLC Conditions :Column :CAPCELL PAK C18 AQ;4.6mm i.d.×250mmMobile phase :A:0.25%TMAH(adjust pH to 5.5 with phosphoric acid), add 0.4ml of 0.1mol/L EDTA-2Na in every 1000 ml of solutionB:0.25% TMAH(adjust pH to 5.5 with phosphoric acid):CH3CN:CH3OH: =500:300:200,add0.4ml of 0.1mol/L EDTA-2Na in every 1000 ml of solutionB 5%(0min)→5%(2min) →25%(25min) →50%(42min) →5%(43min)→5%(60min)GraFlow rate :1mL / minTemp :40°CDetection :PDA 254nmInj.vol. :20µL结果中看出头孢地尼主峰保留时间为20.73min,同药典头孢地尼系统适用性溶液的典型色谱图基本相符(如附图I);药典要求头孢地尼峰与杂质J峰分离度不小于1.2,杂质I峰与杂质J峰,头孢地尼峰与杂质K 峰及杂质K峰与杂质L峰之间分离度应符合要求,此时头孢地尼峰与杂质J峰分离度为1.21,杂质I峰与杂质J峰分离度为2.19,头孢地尼峰与杂质K峰分离度为2.77,杂质K峰与杂质L峰分离度为1.70,均符合药典规定。


2015 年我院60 例患者药品不良反应分析发表时间:2016-06-01T15:39:36.513Z 来源:《中国医学人文》2016年第3期作者:普琳梅[导读] 药品不良反应 (ADR) 是指合格药品在正常用法用量下出现的与用药目的无关的有害反应[1]。
普琳梅(云南省传染病专科医院云南昆明 650118)【摘要】目的:通过分析药品不良反应的情况,总结用药经验,为临床更为合理的用药提供帮助。
方法:回顾性的分析2015 年我院出现的60 例药品不良反应情况,统计发生不良反应的性别与年龄分布、性质与类型、给药途径、药物种类、累及器官和系统及主要临床表现等情况。
结果:60 例ADR 中,男性共45 例,女性15 例,男女比例为1.8:1;口服给药途径引起的ADR 有 41 例,占68.33%;静脉滴注16例,占26.67%;抗精神病药引起ADR 居首位,有29 例,占48.33%;其次是抗菌药物引起的ADR,有17 例,占28.33%;抗结核药、抗病毒药引起的ADR 各为6 例,占10%;临床表现以神经- 精神系统损害最多。
结论:持续加强 ADR 监测工作与收集,药剂科注意宣传合理用药知识,加强宣传教育与培训,提高医务人员主动上报的积极性,对保证用药的安全与合理发挥重要作用。
【关键词】药品不良反应,分析,给药途径【中图分类号】 R2 【文献标号】 A 【文章编号】 2095-9753(2016)3-0170-02 药品不良反应 (ADR) 是指合格药品在正常用法用量下出现的与用药目的无关的有害反应[1]。
据相关报道, 每年有数以万计的人死于ADR,ADR 已经是国内外普遍存在的问题。
目前,收集药物不良反应的主要途径是药物不良反应自发呈报,自发性的高低取决于收集工作的开展情况以及医生的重视程度,这也影响着不良反应数。
我院从2015 年4 月份开始,药品不良反应收集工作正在循序渐进开展,经过近一年的工作,不良反应收集工作逐渐显示出重要的临床应用价值。


头孢地尼分散片在健康人体内的药动学及生物等效性林建阳;姜明燕;阚周密;王宁宁【摘要】Objective To develop a sensitive and rapid LC/MS/MS method to determine the plasma concentration of cefdinir and to study the pharmacokinetics and bioequivalence of cefdinir dispersible tablets in healthy volunteers. Methods Twenty healthy male volunteers were given a single oral dosage of 200mg cefdinir test and reference formulations. The concentrations of cefdinir in plasma were determined by LC/MS/MS. The plasma concentration-time curves were plotted and the main pharmacokinetic parameters were calculated. Results The main pharmacokinetic parameters of test and reference formulations in plasma were shown as follows: Tmax=(3.2 ±1.0) and (3.0±0.7)h, Cmax=(1746±552) and (1764±738)ng/mL, t1/2 = (1.7±0.3) and(1.8 ±0.3) h, AUC0-t= (9180± 3050) and (9200±3470)ng-h/mL, AUC0oo=(9180±3050) and(9200±3470)ngh/mL. The relative bioavailability of cefdinir for test drug was (111 .3±44.5)%. Conclusion The two kinds of cefdinir formulations are bioequivalent in healthy volunteers.%目的建立测定人血浆中头孢地尼浓度的LC-MS-MS法,并用该法研究头孢地尼在健康人体内的药动学特征及其相对生物等效性.方法采用LC-MS-MS法,测定20名健康男性受试者口服含头孢地尼200mg 的受试制剂和参比制剂后不同时刻血浆中头孢地尼的浓度,绘制药动学曲线并计算主要药动学参数.结果受试制剂和参比制剂中头孢地尼的主要药动学参数如下:Tmax分别为(3.2±1.0)和(3.0±0.7)h; cmax分别为(1746±552)和(1764±738)ng/mL;t1/2分别为(1.7±0.3)和(1.8±0.3)h;用梯形法计算,AUC0-t分别为(9180±3050)和(9200±3470)ng·h/mL,AUCo-∞分别为(9180±3050)和(9200±3470)ng?h/mL;以AUCo-t计算,头孢地尼分散片的相对生物利用度为(111.3±44.5)%.结论头孢地尼的两种制剂生物等效.【期刊名称】《中国抗生素杂志》【年(卷),期】2012(037)009【总页数】5页(P706-710)【关键词】头孢地尼;液-质联用技术;药动学;生物等效性【作者】林建阳;姜明燕;阚周密;王宁宁【作者单位】中国医科大学附属第一医院药学部,沈阳110001;中国医科大学附属第一医院药学部,沈阳110001;中国医科大学附属第一医院药学部,沈阳110001;中国医科大学附属第一医院药学部,沈阳110001【正文语种】中文【中图分类】R917头孢地尼(cefdinir)是在头孢克肟的基础上研制的第3代口服头孢菌素类抗菌药。

头孢地尼胶囊在健康人体的生物等效性研究陈芬;朱超然;翟学佳;冯霞;邓桂萍;郭卿;蒋立芬;吕永宁【摘要】目的:评价健康人餐后服用两种头孢地尼胶囊的生物等效性。
方法24例男性健康志愿者餐后随机交叉单剂量口服头孢地尼胶囊受试制剂或参比制剂,头孢地尼体内血药浓度采用液相色谱-质谱串联( LC-MS/MS)法测定,药动学参数及等效性采用药动学软件DAS计算和评价。
结果受试制剂和参比制剂的主要药动学参数如下:AUCt分别为(4.35±1.09)和(4.12±1.22)μg��h��mL-1,AUC0-∞分别为(4.53±1.12)和(4.53±1.73)μg��h��mL-1,t1/2分别为(1.74±0.29)和(2.13±1.65) h,tmax分别为(4.44±0.86)和(4.54±1.16) h,Cmax分别为(900±250)和(876±269) ng��mL-1。
结论头孢地尼胶囊受试制剂与参比制剂具有生物等效性。
%Objective To evaluate postprandial pharmacokinetics and bioequivalence of two preparations of cefdinir capsules in Chinese healthy volunteers. Methods In a two-way cross-over study, 24 healthy male volunteers were divided into two groups randomly and a single dose of cefdinir capsules of test and reference preparation were administered orally, respectively.The concentration in plasma was determined by LC-MS/MS. Pharmacokinetic parameters and bioequivalence were calculated and evaluated by DAS. Results The main pharmacokinetic parameters of test and reference were as follows: AUCt (4.35±1.09) μg��h��mL-1 and (4.12±1.22) μg��h��mL-1, AUC0-∞(4.53±1.12) and (4.53±1.73)μg��h��mL-1, t1/2 (1.74±0.29) h and (2.13±1.65) h, tmax(4.44±0.86) h and (4.54 ±1.16) h, Cmax(900±250) ng��mL-1 and (876±269) ng��mL-1 . Conclusion The test and reference preparation of cefdinir capsules are bioequivalent.【期刊名称】《医药导报》【年(卷),期】2015(000)010【总页数】4页(P1288-1291)【关键词】头孢地尼胶囊;液相色谱-质谱串联联用;药动学;生物等效性【作者】陈芬;朱超然;翟学佳;冯霞;邓桂萍;郭卿;蒋立芬;吕永宁【作者单位】华中科技大学同济医学院附属协和医院药剂科,武汉 430022;华中科技大学同济医学院附属协和医院药剂科,武汉 430022;华中科技大学同济医学院附属协和医院药剂科,武汉 430022;华中科技大学同济医学院附属协和医院药剂科,武汉 430022;华中科技大学同济医学院附属协和医院药剂科,武汉 430022;石家庄市华新药业有限责任公司,石家庄050091;河北省人民医院体检中心,石家庄 050051;华中科技大学同济医学院附属协和医院药剂科,武汉 430022【正文语种】中文【中图分类】R978.11;R969.1头孢地尼是第3代头孢菌素类抗菌药物,1988年由日本藤泽药品工业公司合成,1991年在日本上市,1997年被美国食品药品管理局(FDA)批准临床使用[1]。
2015年第二季度细菌耐药性监测结果分析
高义玲
【期刊名称】《临床合理用药杂志》
【年(卷),期】2016(9)2
【摘要】目的分析本院2015年第二季度细菌耐药性监测结果,为临床抗菌药物的合理应用提供参考。
方法对医院2015年4~6月医学检验科出具的耐药监测报告进行回顾性分析,为临床抗菌药物的合理应用提供保障。
结果菌检出数为246株(43种)。
其中占细菌检出率前6位的细菌分别依次为大肠埃希菌(15.38%)、肺炎克雷伯菌肺炎亚种(14.17%)、金黄色葡萄球菌(9.72%)、鲍曼不动杆菌(7.69%)、铜绿假单胞菌(7.69%),白色假丝酵母菌(5.26%)。
结论临床在抗菌药物应用中要根据药敏试验结果选用,从而减少细菌耐药性的产生。
【总页数】2页(P76-77)
【作者】高义玲
【作者单位】南京市东南大学医学院附属南京同仁医院药学部
【正文语种】中文
【中图分类】R978.1
【相关文献】
1.四川省细菌耐药监测网2012年川东地区细菌耐药性监测数据分析
2.四川省细菌耐药监测网2012年川南地区细菌耐药性监测数据分析
3.四川省细菌耐药监测网2012年川西地区细菌耐药性监测分析
4.四川省细菌耐药监测网2012年川北地区
细菌耐药性监测数据分析5.四川省细菌耐药监测网2015年四川省细菌耐药性监测结果分析
因版权原因,仅展示原文概要,查看原文内容请购买。
头孢地尼有关物质分析方法的比较研究李进;王立新;张斗胜;胡昌勤【摘要】目的对中国药典2010版和美国药典34版中头孢地尼有关物质的分析方法进行比较和优化.方法采用两国药典方法分析头孢地尼的有关物质,通过理论塔板数、分离度等参数进行方法评价;运用色谱相关光谱法技术对两种方法分离的头孢地尼有关物质进行相互识别;调整流动相比例,进行分析方法优化.结果中国药典2010版方法的分离能力优于美国药典34版;由色谱相关光谱法分析可知,两种方法中头孢地尼有关物质的洗脱顺序一致;优化后方法还能有效分离降解杂质反式头孢地尼和反应中间体乙酰化头孢地尼.结论优化后的头孢地尼有关物质分析方法的分离能力优于ChP2010版和USP34版方法,能有效对头孢地尼的有关物质进行控制.%Objective To compare and optimize the analytical method for cefdinir related substance in Chinese Pharmacopoeia 2010 edition and United States Pharmacopoeia 34 edition. Methods Cefdinir and its related substances were analyzed using methods in two Pharmacopoeia; an evaluation was made between the two methods by application of the theoretical plate number and resolution parameters; two dimensional chromatographic correlation spectroscopy technique was applied to identify cefdinir related substances detected in two different methods; analytical method was further optimized by adjusting the gradient elution system. Results The separation ability of method in ChP 2010 edition is superior to USP 34; chromatographic correlation spectroscopy technique showed that cefdinir related substances had the same retention behavior when analyzed by the two different methods; the degradation impurityanti-cefdinir and synthesis intermediate acetyl cefdinir was effectively separated by the optimized method. Conclusion The separation capability of optimized method is superior to ChP2010 edition and USP34, which is suitable for the quality control of cefdinir related substances.【期刊名称】《中国抗生素杂志》【年(卷),期】2012(037)008【总页数】6页(P610-614,627)【关键词】二维色谱相关光谱技术;头孢地尼;头孢菌素;有关物质【作者】李进;王立新;张斗胜;胡昌勤【作者单位】中国食品药品检定研究院,北京100050;中国食品药品检定研究院,北京100050;中国食品药品检定研究院,北京100050;中国食品药品检定研究院,北京100050【正文语种】中文【中图分类】R917头孢地尼是第三代头孢菌素类抗生素,对革兰阳性菌和阴性菌均有抗菌作用,临床上用于治疗皮肤感染、术后伤口感染、呼吸道感染等[1]。
2015口服抗菌药市场分析
据IMS数据统计,2015年国内口服抗生素的销售总额为250亿元,其中,头孢类口服抗生素全年销售总额为62.5亿元,占所有口服抗生素销售额的27%左右,为口服抗生素最大的品类。
目前,IMS数据统计显示,口服头孢菌素类抗生素2015年销售排名如下:
数据可见,第三代口服头孢菌素占所有头孢菌素57.08%,二代头孢占39.55%,二三代为主流的口服抗生素品种;而一代仅占3.37%,显示出负增长趋势。
第三代头孢头孢克肟、头孢地尼销售情况良好,并保持了较高的增长率。
口服头孢菌素产品资质分析如下:
从资质分析可见,三代头孢产品所在分级目录省份数量、医保情况一定程度上决定了产品的市场表现。
Sep 21, 2016
LC Application Lab, Shiseido China
No.31, BDA International Business Park,
2 Jing Yuan Street, Beijing
Economic Technological Development Zone,
Beijing, China 100176
Phone 010-6785-6803, FAX 010-6785-6882
头孢地尼CP2015的分析
依《中国药典》15版二部方法对头孢地尼原料药进行分析,客户反映主峰前后杂质与主峰分离度较难达到药典标准,需求合适C18柱进行分析以达到药典分离要求;尝试使用资生堂MGII,SUPERIOREX ODS,AQ,BB 等C18色谱柱对客户所提供样品进行分析,发现高极性的C18AQ柱分析结果为最佳,结果如图1。
图1 AQ药典方法对系统适用性溶液分析
HPLC Conditions :
色谱柱:CAPCELL PAK C18 AQ ;4.6mm i.d.×250mm
流动相:A:0.25%四甲基氢氧化铵(磷酸调pH至5.5),每1000ml加入0.1mol/L乙二胺四醋酸二钠0.4ml B:0.25%四甲基氢氧化铵(磷酸调pH至5.5):乙腈:甲醇: =500:300:200,每1000ml加入0.1mol/L 乙二胺四醋酸二钠0.4ml
B%5%(0min)→B%5%(2min) →B%25%(25min) →B%50%(42min) →B%5%(43min)
→B%5%(60min)
流速:1mL / min
温度:40°C
检测:PDA 254nm
进样量:20µL
HPLC Conditions :
Column :CAPCELL PAK C18 AQ;4.6mm i.d.×250mm
Mobile phase :A:0.25%TMAH(adjust pH to 5.5 with phosphoric acid), add 0.4ml of 0.1mol/L EDTA-2Na in every 1000 ml of solution
B:0.25% TMAH(adjust pH to 5.5 with phosphoric acid):CH3CN:CH3OH: =500:300:200,add
0.4ml of 0.1mol/L EDTA-2Na in every 1000 ml of solution
B 5%(0min)→5%(2min) →25%(25min) →50%(42min) →5%(43min)→5%(60min)Gra
Flow rate :1mL / min
Temp :40°C
Detection :PDA 254nm
Inj.vol. :20µL
结果中看出头孢地尼主峰保留时间为20.73min,同药典头孢地尼系统适用性溶液的典型色谱图基本相符(如附图I);药典要求头孢地尼峰与杂质J峰分离度不小于1.2,杂质I峰与杂质J峰,头孢地尼峰与杂质K 峰及杂质K峰与杂质L峰之间分离度应符合要求,此时头孢地尼峰与杂质J峰分离度为1.21,杂质I峰与杂质J
峰分离度为2.19,头孢地尼峰与杂质K峰分离度为2.77,杂质K峰与杂质L峰分离度为1.70,均符合药典规定。
为达到药典要求使保留时间约为22min,降低流速,再一次分析,分析结果如图2。
附图Ⅰ头孢地尼系统适用性溶液典型色谱图
图2 AQ药典方法对系统适用性溶液分析
HPLC Conditions :
色谱柱:CAPCELL PAK C18 AQ ;4.6mm i.d.×250mm
流动相:A:0.25%四甲基氢氧化铵(磷酸调pH至5.5),每1000ml加入0.1mol/L乙二胺四醋酸二钠0.4ml B:0.25%四甲基氢氧化铵(磷酸调pH至5.5):乙腈:甲醇: =500:300:200,每1000ml加入0.1mol/L 乙二胺四醋酸二钠0.4ml
B%5%(0min)→B%5%(2min) →B%25%(25min) →B%50%(42min) →B%5%(43min)
→B%5%(60min)
流速:0.85mL / min
温度:40°C
检测:PDA 254nm
进样量:20µL
HPLC Conditions :
Column :CAPCELL PAK C18 AQ;4.6mm i.d.×250mm
Mobile phase :A:0.25%TMAH(adjust pH to 5.5 with phosphoric acid), add 0.4ml of 0.1mol/L EDTA-2Na in every
1000 ml of solution
B:0.25% TMAH(adjust pH to 5.5 with phosphoric acid):CH3CN:CH3OH: =500:300:200,add
0.4ml of 0.1mol/L EDTA-2Na in every 1000 ml of solution
B 5%(0min)→5%(2min) →25%(25min) →50%(42min) →5%(43min)→5%(60min)Gra
Flow rate :0.85mL / min
Temp :40°C
Detection :PDA 254nm
Inj.vol. :20µL
此时头孢地尼主峰保留时间为22.18min,为药典所要求保留时间,头孢地尼峰与杂质J峰分离度为1.23,杂质I峰与杂质J峰分离度为2.35,头孢地尼峰与杂质K峰分离度为2.68,杂质K峰与杂质L峰分离度为1.84,均符合药典规定。
在同样的分析环境下对按药典方法所配制的供试品溶液进行分析,分析结果如图3。
图3 AQ药典方法对供试品的分析
HPLC Conditions :
色谱柱:CAPCELL PAK C18 AQ;4.6mm i.d.×250mm
流动相:A:0.25%四甲基氢氧化铵(磷酸调pH至5.5),每1000ml加入0.1mol/L乙二胺四醋酸二钠0.4ml B:0.25%四甲基氢氧化铵(磷酸调pH至5.5):乙腈:甲醇: =500:300:200,每1000ml加入0.1mol/L 乙二胺四醋酸二钠0.4ml
B%5%(0min)→B%5%(2min) →B%25%(25min) →B%50%(42min) →B%5%(43min)
→B%5%(60min)
流速:1.0mL / min
温度:40°C
检测:PDA 254nm
进样量:20µL
HPLC Conditions :
Column :CAPCELL PAK C18 AQ;4.6mm i.d.×250mm
Mobile phase :A:0.25%TMAH(adjust pH to 5.5 with phosphoric acid), add 0.4ml of 0.1mol/L EDTA-2Na in every
1000 ml of solution
B:0.25% TMAH(adjust pH to 5.5 with phosphoric acid):CH3CN:CH3OH: =500:300:200,add
0.4ml of 0.1mol/L EDTA-2Na in every 1000 ml of solution
B 5%(0min)→5%(2min) →25%(25min) →50%(42min) →5%(43min)→5%(60min)Gra
Flow rate :1.0mL / min
Temp :40°C
Detection :PDA 254nm
Inj.vol. :20µL
对供试品分析的结果中,我们发现AQ柱能够使供试品中各杂质均能够得到良好的基线分离。
当然,为了有更多的色谱柱选择,在同样的分析条件也下尝试中等极性的MGII柱,高碳载量的SUPERIOREX ODS,强耐碱性的BB柱对系统适用性溶液进行分析,分析结果如图4,5,6。
图4 MGII对系统适用性溶液分析
图5 ODS对系统适用性溶液分析
图6 BB对系统适用性溶液分析
分析结果发现使用MGII, SUPERIOREX ODS,BB对系统适用性溶液进行分析,主峰与其前杂质J峰的分离度分别为0.95,1.02,0.66,未能符合药典分离要求。
综上实验所述,使用资生堂强极性的C18AQ柱能够使头孢地尼系统适用性溶液中各杂质峰与主峰间良好的分离,且符合药典要求的各杂质峰之间的分离度要求。
张虎郭彦丽。