硝酸银滴定液标定标准操作规程
- 格式:doc
- 大小:23.50 KB
- 文档页数:1

钾离子的测定-硝酸银滴定法GB11896-89
本文档将介绍钾离子测定的一种常用方法:硝酸银滴定法,该方法遵循GB11896-89标准。
下面将详细说明该方法的步骤和注意事项。
实验步骤
1.准备试样:将待测溶液取10 mL,然后用去离子水稀释至100 mL。
2.滴定仪器准备:将硝酸银标准溶液 (0.01 mol/L) 加入滴定瓶中。
3.滴定操作:将稀释后的试样溶液取10 mL,加入滴定瓶中。
使用磁力搅拌器均匀搅拌溶液。
4.滴定终点判断:在滴定过程中,溶液会由无色变为淡黄色,然后逐渐转为浑浊。
当溶液由浑浊变为浅棕色时,即为滴定终点。
5.记录滴定体积:记录滴定瓶中滴定液的滴定体积,即滴定终
点前后的差值。
注意事项
1.硝酸银溶液使用前应经过标定,确保其浓度准确无误。
2.在滴定过程中,试样溶液要充分搅拌,以确保反应充分进行。
3.滴定终点的判断需要观察溶液的颜色变化,并注意变浑浊的
程度。
4.为了获得准确的滴定结果,滴定操作应当尽量精确,滴定液
的滴定速度要适中。
以上就是钾离子测定的硝酸银滴定法的步骤和注意事项。
通过
遵循GB11896-89标准,我们可以准确测定钾离子的含量。

硝酸银滴定液(0.1mol/L)配制与标定的标准操作规程一、目的:建立硝酸银滴定液(0.1mol/L)配制与标定的标准操作规程配制与标定操作规程二、依据:《中华人民共和国药典》2010 年版一部。
三、适用范围:适用于本公司硝酸银滴定液(0.1mol/L)的配制、标定与复标工作。
四、职责:质量检验主任、滴定液配制人、复标人、检验员对本标准的实施负责。
五、操作程序:1、试剂:①硝酸银②基准氯化钠③糊精溶液(1→50)④碳酸钙⑤荧光黄指示液2、仪器和用具①三角瓶250ml ②量筒50ml ③酸式滴定管50ml ④称量瓶⑤铁架台⑥天平⑦ 1000mL的棕色容量瓶3、分子式和分子量:AgNO3169.874、配制浓度所需溶质量及体积16.99→ I000ml取硝酸银17.5g,加水适量使溶解成1000ml,摇匀。
5、反应原理AgNO3+NaCl→AgCl↓+NaNO36、标定取在110℃干燥至恒重的基准氯化钠0.2g,精密称定,加水50ml使溶解,再加糊精溶液(1→50)5ml、碳酸钙0.1g与荧光黄指示液8滴,用本液滴定至浑浊液由黄绿色变为微红色。
每1ml硝酸银滴定液(0.1mol/l)相当于5.84mg的氯化钠。
根据本液的消耗量与氯化钠的取用量,算出本液的浓度,即得。
如需用硝酸银滴定液(0.01mol/l)时,可用硝酸银滴定液(0.1mol/l)在临用前加水稀释制成。
7、计算硝酸银浓度=氯化钠重×0.10.005844 ×硝酸银的ml数8、注意事项:【贮藏】置玻璃塞的棕色玻瓶中,密闭保存。
【说明】①糊精为保护胶体,使沉淀保持胶体状态,以增加吸附力,因此要在整个胶体溶液中观察终点。
②荧光黄为指示剂时要求溶液呈中性或弱碱性,而硝酸银溶液稍带酸性,滴定至终点时溶液pH值在5左右,影响终点观察,加入碳酸钙约0.1g或硼砂溶液2ml,调节酸度,使滴定终点明显,结果准确。
③吸附指示剂可促进卤化银对光的敏感作用,因此在滴定时应避免强光照射,一般应在较暗处观察终点。

制药企业用滴定液的配制及标定标准操作规程1.目的建立滴定液的配制及标定标准操作规程,并按规程进行操作,保证操作规范性与正确性。
2. 依据《中华人民共和国药典》2015年版四部通则8006。
3.范围本标准适用于本公司滴定液的配制及标定。
4.责任配制者、标定者、复核者、QC主任监督5. 内容5.1 概述滴定液系指在容量分析中用于滴定被测物质含量的标准溶液,具有准确的浓度(通常取4 位有效数字)。
5.2 仪器与用具分析天平其分度值(感量)应为0.l m g或小于0.lmg;毫克组砝码需经校正,并列有校正表备用。
滴定管 10、25和50 ml 应附有该滴定管的校正曲线或校正值。
移液管 10、15、20和25 ml 其真实容量应经校准,并附有校正值。
5.3 试液试剂5.3.1 均应按照《中国药典》2015年版四部通则8006项下的规定取用。
5.3.2 基准试剂应有专人负责保管与领用。
5.4 配制滴定液的配制方法有间接配制法与直接配制法两种,应根据规定选用,并应遵循下列有关规定。
5.4.1所用溶剂“水”,系指蒸馏水或去离子水,在未注明有其他要求时,应符合《中国药典》“纯化水”项下的规定。
5.4.2采用间接配制法时,溶质与溶剂的取用量均应根据规定量进行称取或量取,并且制成后滴定液的浓度值应为其名义值的0.95~1.05;如在标定中发现其浓度值超出其名义值的0.95~1.05范围时,应加人适量的溶质或溶剂予以调整。
当配制量大于1000ml时,其溶质与溶剂的取用量均应按比例增加。
5.4.3采用直接配制法时,其溶质应采用“基准试剂”,并按规定条件干燥至恒重后称取,取用量应为精密称定(精确至 4 ~5 位有效数字),并置1000ml量瓶中,加溶剂溶解并稀释至刻度,摇匀。
配制过程中应有核对人,并在记录中签名以示负责。
5.4.4配制浓度等于或低于0.02 mol / L的滴定液时,除另有规定外,应于临用前精密量取浓度等于或大于0. l mol / L的滴定液适量,加新沸过的冷水或规定的溶剂定量稀释制成。

硝酸银滴定液的标定
硝酸银滴定法的标定工作一般分两步完成,一是溶液的稀释标定,二是溶液的浓度标定。
1. 溶液的稀释标定:
1)准备硝酸银标准液:将纯银金属(99.999%)磨碎,放入硝酸,搅拌均匀,继续用硝酸浸泡,将银的残渣清除,使浊的物质沉淀下来,取得淡绿色的溶液。
2)用10ML的烧瓶,将10ML的硝酸银标准液和任意量的纯水放入烧瓶内,搅拌均匀,把烧瓶悬挂进滴定管中。
3)根据具体的要求,按照一定的比例计算出溶液的浓度,然后根据需要输入相应的配置参数滴定模式中,最后将溶液滴入滴定管内,再用白色石英灰按照给定的比例量计算出硝酸银的滴定量。
2. 溶液的浓度标定:
1)准备硝酸银标准液:将纯银金属(99.999%)磨碎,放入硝酸,搅拌均匀,继续用硝酸浸泡,将银的残渣清除,使浊的物质沉淀下来,取得淡绿色的溶液。
2)确定浓度比例:将不同浓度的硝酸银标准液放入烧瓶中,搅拌均匀,依次将该烧瓶悬挂进滴定管中,确定该标准液的比例,直至满足要求。
3)将满足要求的硝酸银标准液滴入滴定管中,用白色石英灰按照给定的比例量计算出硝酸银的滴定量。
再将不同浓度的硝酸银标准液同样放入滴定管中,计算滴定值,根据计算的结果来调整溶液的浓度,以达到浓度标定的要求。

目的:规范硝酸银滴定液的配制操作。
适用范围:硝酸银滴定液。
责任者:配制者、复核者。
=169.87AgNO31.试药及试剂硝酸银(分析纯)氯化钠(基准物)糊精溶液(1→50)碳酸钙荧光黄指示液:取荧光黄0.1g加乙醇 100ml溶解,即得。
2.配制取硝酸银17.5g,加水适量使溶解成1000ml,摇匀。
3.标定3.1 原理荧光黄为具有颜色的阴离子弱酸,在中性溶液中可被带正电荷的物质吸附而显粉红色;硝酸银与氯化钠反应生成AgCL沉淀,微过量的银离子附于AgCL表面,吸附荧光黄阴离子而显红色。
据此可指示终点并算出硝酸银浓度。
反应式如下:Ag++Cl-→AgCl↓(AgCl↓)Ag++FI-(黄色)→(AgCl↓)Ag+·FI-(粉红色)3.2 步骤取在 110℃干燥至恒重的基准氯化钠约0.2g,精密称定,加水50ml使溶解,再加糊精溶液(1→50)5ml、碳酸钙0.1g与荧光黄指示液8滴,用本液滴定至浑浊液由黄绿色变为微红色。
每1ml的硝酸银滴定液(0.1mol/L)相当于 5.844mg的氯化钠。
根据本液的消耗量与氯化钠的取用量,算出本液的浓度,即得。
如需用硝酸银滴定液(0.01mol/L)时,可取硝酸银滴定液(0.1mol/L)在临用前加水稀释制成。
3.3 计算公式硝酸银滴定液的浓度C(mol/L)按下式计算:C(mol/L)= m×0.1000V×5.844式中:m为基准氯化钠的称取量(mg)V为本滴定液的消耗量(ml);5.844 为每1ml的硝酸银液(0.1000mol/L)相当于氯化钠的毫克数。
4.贮藏应置于具塞的棕色玻瓶中,密闭保存。
5.有关注释及注意事项5.1 标定中采用以荧光黄为指示剂的吸附指示剂法,要求生成的氯化银呈胶体状态,以利于到达滴定终点时对指示剂阴离子的吸附而产生颜色的突变,因此在基准氯化钠加水溶解后要加入2%糊精溶液5ml,以形成保护胶体。
5.2 标定需要在中性或弱碱性(pH7~10)中进行,以利于荧光黄阴离子的形成,故需在溶液中加入碳酸钙0.1g,以维持溶液的微碱性。

水质-氯化物的测定-硝酸银滴定法水质氯化物的测定硝酸银滴定法1.范围本方法规定了水中氯化物浓度的硝酸银滴定法。
本方法适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水。
本方法适用的浓度范围为10~500mg/L的氯化物。
高于此范围的水样经稀释后可以扩大其测定范围。
溴化物、碘化物和氰化物能与氯化物一起被滴定。
正磷酸盐及聚磷酸盐分别超过250mg/L及25mg/L时有干扰。
铁含量超过10mg/L时使终点不明显。
2.原理在中性至弱碱性范围内(pH6.5~10.5)。
以铬酸钾为指示剂,用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀,产生砖红色,指示滴定终点到达。
该沉淀滴定的反应如下:Ag++Cl-―AgCl2Ag++CrO42-―Ag2CrO4(砖红色)3.试剂分析中仅使用分析纯试剂及蒸馏水或去离子水。
3.1高锰酸钾,c(1/5KMnO4)=0.01mol/L。
3.2过氧化氢(H2O2),30%。
3.3乙醇(C2H5OH),95%。
3.4硫酸溶液,c(1/2H2SO4)=0.05mol/L。
3.5氢氧化钠溶液,c(NaOH)=0.05mol/L。
3.6氢氧化铝悬浮液:溶解125g硫酸铝钾[KAl(SO4)2·12H2O]于1L蒸馏水中,加热至60℃,然后边搅拌边缓缓加入55mL浓氨水放置约1h后, 移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氯离子为止。
用水稀至约为300mL。
3.7氯化钠标准溶液,0.0141mol/L,相当于500mL/L氯化物含量:将氯化钠(NaCl)置于瓷坩埚内,在500~600℃下灼烧40~50min。
在干燥器中冷却后称取8.2400g,溶于蒸馏水中,在容量瓶中稀释至1000mL。
用吸管吸取10.0mL,在容量瓶中准确稀释至100mL。
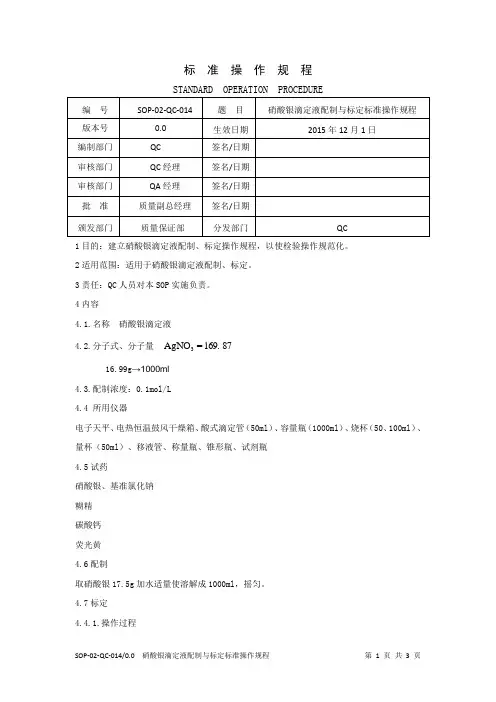
标 准 操 作 规 程STANDARD OPERATION PROCEDURE1目的:建立硝酸银滴定液配制、标定操作规程,以使检验操作规范化。
2适用范围:适用于硝酸银滴定液配制、标定。
3责任:QC 人员对本SOP 实施负责。
4内容4.1.名称 硝酸银滴定液4.2.分子式、分子量 87 169.=AgNO 316.99g →1000ml4.3.配制浓度:0.1mol/L4.4 所用仪器电子天平、电热恒温鼓风干燥箱、酸式滴定管(50ml )、容量瓶(1000ml )、烧杯(50、100ml )、量杯(50ml )、移液管、称量瓶、锥形瓶、试剂瓶4.5试药硝酸银、基准氯化钠糊精碳酸钙荧光黄4.6配制取硝酸银17.5g 加水适量使溶解成1000ml ,摇匀。
4.7标定4.4.1.操作过程取在110℃干燥至恒重的基准氯化钠约0.2g,精密称定,加水50ml使溶解,再加糊精溶液(1→50)5ml、碳酸钙0.1g与荧光黄指示液8滴,用本液滴定至浑浊液由黄绿色变为微红色。
每1ml硝酸银滴定液(0.1mol/L)相当于5.844mg的氯化钠。
根据本液的消耗量与氯化钠的取用量,算出本液的浓度,即得。
如需用硝酸银滴定液(0.01mol/L)时,可取硝酸银滴定液(0.1mol/L)在临用前加水稀释制成。
4.4.2. 计算方法mc(mol/L)=V×5.844式中 m为基准氯化钠的称取量(mg); V为本液滴定的消耗量(ml);5.844为每1ml硝酸银滴定液(0.1mol/L)相当的以毫克表示的氯化钠的质量。
4.5 允许误差滴定液标定不得少于3份标定和复标的相对偏差均不得超过0.1%,标定的平均值和复标所得的平均值,二者的相对偏差不得超过0.1%。
4.6 复标规定滴定液经第一人标定后,必须由第二人进行复标。
其标定份数也不得少于3份。
4.7.注意事项4.7.1. 标定中采用以荧光黄为指示剂的吸附指示剂法,要求生成的氯化银呈胶体状态,以利于在到达滴定终点时对指示剂阴离子的吸附而产生颜色的突变,因此在加入的基准氯化钠溶解后再加入糊精溶液(1→50)5ml,以形成保护胶体。

制药企业用滴定液的配制及标定标准操作规程1.目的建立滴定液的配制及标定标准操作规程,并按规程进行操作,保证操作规范性与正确性。
2. 依据《中华人民共和国药典》2015年版四部通则8006。
3.范围4.责5. 内5.1? 4?5.2?5.3?5.3.1 ?5.3.2 ?5.4滴定液的配制方法有间接配制法与直接配制法两种,应根据规定选用,并应遵循下列有关规定。
?5.4.1所用溶剂“水”,系指蒸馏水或去离子水,在未注明有其他要求时,应符合《中国药典》“纯化水”项下的规定。
?5.4.2采用间接配制法时,溶质与溶剂的取用量均应根据规定量进行称取或量取,并且制成后滴定液的浓度值应为其名义值的0.95~1.05;如在标定中发现其浓度值超出其名义值的0.95~1.05范围时,应加人适量的溶质或溶剂予以调整。
当配制量大于1000ml时,其溶质与溶剂的取用量均应按比例增加。
?5.4.3采用直接配制法时,其溶质应采用“基准试剂”,并按规定条件干燥至恒重后称取,取用量应为精密称定(精确至4?~5?位有效数字),并置1000ml量瓶中,加溶剂溶解并稀释至刻度,摇匀。
配制过程中应有核对人,并在记录中签名以示负责。
?5.4.4配制浓度等于或低于0.02?mol?/?L的滴定液时,除另有规定外,应于临用前精密量取浓度等于或大于0.?l?mol?/?L的滴定液适量,加新沸过的冷水或规定的溶剂定量稀释制成。
? 5.4.?5?配制成的滴定液必须澄清,必要时可滤过;并按药典中各该滴定液项下的[贮藏]条件贮存,经下述标定其浓度后方可使用。
?5.5? 5.5.1?5.5.2?5.5.3,其5.5.45.5.5于20ml5.5.6滴定所得的结果。
?5.5.7标定工作应由初标者(一般为配制者)和再标者在相同条件下各作平行试验3?份,各项原始数据经校正后,根据计算公式分别进行计算:3?份平行试验结果的相对平均偏差,除另有规定外,不得大于0.1?%?;初标平均值和复标平均值的相对偏差也不得大于0.1%;?标定结果按初、复标的平均值计算,取4?位有效数字。

水质氯化物的测定硝酸银滴定法1 主题内容与适用范围本标准规定了水中氯化物浓度的硝酸银滴定法.本标准适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水.本标准适用的浓度范围为10 ~ 500 mg/L 的氯化物,高于此范围的水样经稀释后可以扩大其测定范围。
溴化物、碘化物和氰化物能与氯化物一起被滴定。
正磷酸盐及聚磷酸盐分别超过250mg/L及25mg/L时有干扰.铁含量超过10mg/L 时使终点不明显。
2 原理在中性至弱碱性范围内(pH6.5~ 10.5 )、以铬酸钾为指示剂.用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀.产生砖红色,指示滴定终点到达。
该沉淀滴定的反应如下:++Ag++Cl-—→AgCl↓2Ag++CrO4—→AgCr04↓(砖红色)3 试剂分析中仅使用分析纯试制及蒸馏水或去离子水。
3.1 高锰酸钾,C(1/5KMnO4)=0.01 mol/L。
3.2 过氧化氢(H202) , 30%。
3.3 乙醉(C6H5OH) , 95%。
3.4 硫酸溶液,C(1/2H2SO4)=0.05mol/L 。
3.5 氢氧化钠溶液,C(NaOH)=0.05mol/L 。
3.6 氢氧化铝悬浮液:溶解125g 硫酸铝钾〔KAl(SO4)2· 12H2O〕于1L蒸馏水中.加热至60℃,然后边搅拌边缓缓加入55 mL 浓氨水放置约lh 后,移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氧离子为止。
用水稀至约为300 mL 。
3.7 氯化钠标准溶液,C( Nacl )=0.0l4lmol/L,相当于500 mg/L氯化物含量:将氯化纳(Nacl )置于瓷坩祸内.在500~600℃下灼烧40~50min 。
在干燥器中冷却后称取8.2400g ,溶于蒸馏水中,在容量瓶中稀释至1000mL。

硝酸银标准滴定溶液对氯离子的滴定度1. 概述硝酸银标准滴定溶液是化学分析中常用的一种试剂,它通常用于测定溶液中氯离子的浓度。
氯离子在水中的溶解度较高,因此硝酸银滴定溶液可以准确地测定水样中氯离子的含量。
本文旨在探讨硝酸银标准滴定溶液对氯离子的滴定度的测定方法和相关实验操作。
2. 硝酸银标准滴定溶液的制备硝酸银标准滴定溶液的制备通常采用相对简单的溶液稀释法。
需要称取一定量的硝酸银固体,并将其溶解在适量的双蒸水中,以得到浓度较高的硝酸银溶液。
根据所需的滴定度,将适量的硝酸银溶液稀释至所需浓度,得到最终的硝酸银标准滴定溶液。
在制备过程中,需要注意严格控制硝酸银固体的称取和溶解过程,确保所得硝酸银标准滴定溶液的精确浓度。
3. 氯离子滴定度的测定方法为了测定硝酸银标准滴定溶液对氯离子的滴定度,通常采用钾铬酸盐法。
需要制备一定浓度的钾铬酸钾溶液,并将待测水样中的氯化物转化为氯气。
利用硝酸银标准滴定溶液对生成的氯离子进行滴定。
通过滴定过程中硝酸银标准滴定溶液的消耗量,以及氯离子的浓度和体积,就可以计算出硝酸银标准滴定溶液的滴定度。
4. 实验操作在进行氯离子滴定度的测定实验时,需要严格控制实验操作的每一个步骤,以确保实验结果的准确性。
需要准确称取硝酸银标准滴定溶液,并进行稀释,确保溶液浓度的准确性。
对待测水样进行预处理,将其中的氯化物转化为氯气。
接下来,根据滴定方法,将硝酸银标准滴定溶液逐滴加入水样中,直至溶液呈现明显的沉淀终点。
通过记录滴定溶液的使用量和水样中氯离子的浓度,就可以计算出硝酸银标准滴定溶液对氯离子的滴定度。
5. 实验注意事项在进行硝酸银标准滴定溶液对氯离子滴定度的测定实验时,需要注意以下几点事项:- 实验操作的每一个步骤都需要严格控制,避免实验误差的产生;- 尽量避免光照,因为光照会影响滴定终点的判断;- 实验前需要正确校准滴定管和取样瓶,确保实验数据的准确性;- 实验过程中需要使用均匀搅拌器进行搅拌,保持溶液混合均匀;- 实验后需要正确处理废液和废液物品,避免对环境造成污染。

硝酸银标准溶液标定
硝酸银标准溶液是化学分析实验中常用的一种标准溶液,用于测定氯离子含量。
标定硝酸银标准溶液是保证实验结果准确性的重要步骤,下面将介绍硝酸银标准溶液的标定方法及步骤。
首先,准备好所需试剂和仪器设备。
需要准备的试剂包括硝酸银标准溶液、硝
酸钾溶液、双氯化钠溶液等。
仪器设备包括容量瓶、移液管、PH计、磁力搅拌器等。
其次,进行标定操作。
首先,用容量瓶准确量取一定体积的硝酸银标准溶液,
加入适量的硝酸钾溶液和双氯化钠溶液,使其生成沉淀。
然后,用PH计测定溶液
的PH值,记录下来。
接着,用硝酸银标准溶液对硝酸钾溶液进行滴定,直至沉淀
消失。
记录滴定所需的硝酸银标准溶液的体积。
最后,计算出硝酸银标准溶液的浓度。
根据滴定所需的硝酸银标准溶液的体积
和硝酸银标准溶液的浓度计算出硝酸银标准溶液的浓度。
需要注意的是,在进行硝酸银标准溶液的标定过程中,应该严格按照操作规程
进行,避免操作失误导致实验结果的不准确性。
另外,实验中所用的试剂和仪器设备都应该经过严格的清洗和干燥,以保证实验的准确性。
在实验结束后,应该及时清洗和归还使用的试剂和仪器设备,保持实验室的整
洁和干净。
总之,硝酸银标准溶液的标定是化学分析实验中非常重要的一步,只有准确标
定了硝酸银标准溶液的浓度,才能保证实验结果的准确性。
因此,在进行标定操作时,应该严格按照标定方法和步骤进行,并且注意操作规程,保证实验结果的准确性和可靠性。
1.目的:建立本规程旨在为硝酸银滴定液的配制、标定提供操作标准。
2.范围:本规程对本公司的中心化验室硝酸银滴定液的配制,标定有效。
3.责任:中心化验室滴定液配制人、标定人。
4.检验依据:《中国药典》2015年版四部。
5.内容:分子式: AgNO3分子量:169.875.1 配制取硝酸银17.5g,加水适量使溶解成1000ml,摇匀。
5.2 标定取在110℃干燥至恒重的基准氯化钠约0.2g,精密称定,置250ml锥形瓶中,加水50ml使溶解,再加糊精溶液(1→ 50)5ml、碳酸钙0.1g与荧光黄指示液8滴,用本液滴定至浑浊液由黄绿色变为微红色。
每1ml的硝酸银滴定液(0.1mol/L)相当于5.844mg的氯化钠。
根据本液的消耗量与氯化钠的取用量,算出本液的浓度,即得。
◆如需用硝酸银滴定液(0.01mol/L)时,可取硝酸银滴定液(0.1mol/L)在临用前加水稀释制成。
5.3 原理NaCl+AgNO3→ AgCl ↓+ NaNO35.4 计算公式:m×1000硝酸银滴定液的浓度(mol/L)=V×T式中m为基准氯化钠的称取量(mg);V为本滴定液的消耗量(ml);T为与每1ml硝酸银滴定液相当的氯化钠的毫克数。
5.5 试剂与仪器:◆试剂:硝酸银、基准氯化钠、糊精、碳酸钙、荧光黄指示液。
◆仪器:架盘天平、定量移液管(10ml)、250ml锥形瓶、量筒(1000ml、50ml)、1000ml烧杯、酸式滴定管(25ml)、5ml刻度吸管、电热恒温干燥箱、电子天平、干燥器、扁形称量瓶。
5.6 注意事项◆标定中采用经荧光黄为指示剂的吸附指示剂法,要求生成的氯化银呈胶体状态,以利于到达滴定终点时对指示剂阴离子的吸附而产生颜色的突变,因此在基准氯化钠加水溶解后要加入2%糊精溶液5ml,以形成保护胶体;◆标定需要在中性或弱碱性(PH7-10)中进行,以利于荧光黄阴离子的形成,故需在溶液中加入碳酸钙0.1g,以维持溶液的微碱性;◆氯化银的胶体沉淀遇光极易分解出黑色的金属银,因此在滴定过程中应避免强光,直接照射;5.7 贮藏条件◆本滴定液应避光保存,宜置于具有玻璃塞的棕色瓶中,或用黑布包裹的玻璃瓶,密闭保存,有效期3个月。
硝酸银标准溶液配制及标定
硝酸银标准溶液是常用的配制和标定反应溶液之一。
下面是硝酸银标准溶液的配制和标定方法:
1. 配制硝酸银标准溶液:
a. 准备一定量的纯净硝酸银固体。
b. 称取适量的硝酸银固体,溶解于一定体积(如500 mL)
的纯水中,搅拌溶解。
c. 用纯水稀释至标准容量(如1000 mL),并充分混合均匀。
2. 标定硝酸银标准溶液:
a. 取适量的无机酸(如硝酸或盐酸)加入到待测溶液中,使
其酸度适宜。
b. 取一定体积(如50 mL)的标定溶液,加入少量的指示剂(如氯化钾溶液或甲基橙溶液),开始滴加待测溶液。
c. 持续滴加待测溶液,直到指示剂颜色转变。
记录滴加的溶
液体积。
d. 根据滴加的溶液体积和溶液浓度计算待测溶液中硝酸银的
摩尔浓度。
注意事项:
1. 在配制和使用硝酸银标准溶液时,要注意避免光照和暴露于空气中,因为光和空气中的氧会使溶液中的硝酸银发生分解。
2. 在标定过程中,要确保使用精确的玻璃仪器和准确的滴定过程,以确保结果的准确性。
3. 标定前要检查硝酸银固体是否纯净,非常重要,以避免引入误差。
4. 标定结果要进行多次重复实验,并计算平均值,以提高结果的可靠性。
硝酸银滴定液(0.1mol/l)校正因子测量不确定度评定1.方法:中国药典2000年版二部附录XVF中硝酸银滴定液的配制与标定2.数学模型.F = W ×f A×1000(V1- V0 )×TF:校正因子;W (g):基准物重量;f A:A类标准不确定因子(f A=1);V0(ml):滴定液起始读数; V1(ml):终点读数; T(mg/ml):滴定度;3.因果图分析:V fA校准温度V0校准温度V1Fu2载荷点M Nacl u3重复性u1示值T WM Nacl:氯化钠的摩尔质量(g)4.方差:u ref2(F)= u ref2(f A)+ u ref2(W)+ u ref2(V)+ u ref2(T)式中:u rel(x)为变量x的相对标准不确定度5.相对标准不确定度分量评定:5.1 fP12u rel(f A)= 6.6767×10-4×2/(1.019+1.022)/41/2= 3.27×10-4γ1 = 2×(4-1)= 6 (γ1:自由度)5.2 W 的不确定度评定(天平)B类相对标准不确定度:分度值:0. 1mg,B类不确定度u1=0.0577mg(矩形分布)载荷量最大误差:0.3mg,B类不确定度u2=0.1225mg(三角形分布)重复性误差:0.1mg,B类不确定度u3=0.0408mg(n=6)u rel(W)= ( u12+ u12+ u32)1/2/ W min=1.014×10-3γ2= 50 (γ2:自由度,假设可信度为90%)5.3 V的不确定度评定(滴定管25.00ml, A级)1. 体积:容量允差为±0.04ml (参照JJG 196-1990)体积的标准不确定度:u4=0.04/=0.0231ml2. 温度:实验温度为(23±2)℃,溶液体积膨胀系数为2.1×10-4.℃-1假设温度分布为矩形分布,V的的标准不确定度:u5=V×2.1×10-4×2/=0.0057mlV的B类相对标准不确定度:u rel(V)=( 2×( u42+ u52))1/2/V=1.437×10-3γ3= 50 (γ3:自由度,假设可信度为90%)5.4 滴定度(T)的不确定度评定中国药典2000年版附录ⅩⅧ原子量表查得:滴定度T =0.1×M Nacl=0.1×58.4427 =5.844Na: 22.989770 Na的标准不确定度:u6= 0.000002/=1.16×10-6Cl: 35.453 Cl的标准不确定度:u7= 0.002/=1.16×10-3Nacl的标准不确定度u8=1.16×10-3u rel(T)= 0.1×1.16×10-3 /5.844=2.0×10-5γ4=∞(γ4:自由度)6.相对标准不确定度一览表7.相对合成标准不确定度u rel(F) =(3.272+10.142+14.372+0.22)1/2×10-4=1.79×10-38.有效自由度(γeff)γeff=17.943.274+10.144+14.37+0.24 650 50∞=94.89.扩展不确定度取p=95%,γeff = 94.8,在t分布下k=1.987U k=1.987×1.79×10-3×1.020=0.00410.测量不确定度报告硝酸银滴定液(0.1mol/l)校正因子:F =1.020±0.004 (±符号后为扩展不确定度,k=1.987,p=95%)。
化验室硝酸银滴定法测定水质氰化物操作规程一、实验原理硝酸银滴定法是常用的测定水质中氰化物含量的分析方法。
在硝酸银溶液中,氰化物会与硝酸银反应生成难溶的氰化银沉淀。
通过滴定溶液中的硝酸银,直到生成的氰化银沉淀不再形成。
二、实验仪器与试剂1.实验仪器:分析天平、滴定管、移液器、滴定管架。
2.试剂:氰化物试剂(NaCN)、硝酸银溶液(AgNO3)、氯化钾溶液(KCl)等。
3.辅助试剂:硝酸银指示剂、硝酸银滴定液等。
三、实验操作步骤1. 校准滴定溶液:用硝酸银溶液标定0.1mol/L KCl溶液,记录消耗的滴定液体积。
2.采样:取样时要代表性,避免受到外界的干扰和污染,用特制的容器取样。
3.样品预处理:若水质样本中含有易挥发物,需用磁力搅拌器加热轻微蒸发一定时间,使易挥发物挥发掉。
4.滴定操作:a) 取10ml样品溶液,加入2~3滴硝酸银指示剂。
b)用滴定管将标定好的硝酸银滴定液滴定到样品中,以形成乳白色的沉淀。
c)在沉淀悬浮液颜色由乳白变为浅黄色时停止滴定,并记录滴定液的体积。
d)重复实验3次,取平均值作为测定值。
四、数据处理和计算1. 阳性对照:用0.1mol/L KCl溶液直接进行硝酸银滴定,记录所用滴定液的体积。
阳性对照测定值=(滴定液的体积-试剂背面的所用水的滴定液体积)。
2.阴性对照:用纯水进行硝酸银滴定,记录所用滴定液的体积。
阴性对照测定值=(滴定液的体积-试剂背面所用水的滴定液体积)。
3.计算样品中氰化物的含量:氰化物含量(mg/L)=(样品所需硝酸银滴定液体积 - 阴性对照)× 0.01 × 1000 / 标定体积。
五、实验注意事项1.滴定溶液的标定和盛样方式要规范,润洗玻璃仪器需用蒸馏水冲洗干净。
2.硝酸银滴定液要密封保存,防止光照和氧化。
3.滴定管要用蒸馏水洗净,并用滴定液中提取过的玻璃棒吹干。
4.滴定过程中,滴定液加入过快或过慢都会影响结果,应适当调节滴定速度。
2下 2016年 第6期(总第524期)CHINESE & FOREIGN ENTREPRENEURS216【质量与安全】 Quality and Safety一、实验仪器与试剂需要准备好溶液标定所用的仪器。
1.所需仪器。
六个100 mL 的锥形瓶,一个100 mL 量筒,1 mL、20 mL 的移液管各一支横着摆放在管架上,一支棕色的25 mL 的酸式滴定管安置在大理石滴定台铁架上,一个1 000 mL 的盛放废液的塑料烧杯。
以上仪器均用实验室二级纯水洗干净烘干待用。
2.所需试剂。
用白色细口瓶盛装的氯化钠基准试剂250 mL,用棕色细口瓶盛装的待标定的硝酸银标准溶液500 mL。
二、硝酸银标准溶液标定及其浓度调整的过程1.氯化钠标准溶液中Cl-的浓度计算。
实验室称取了1.684 g 氯化钠基准试剂溶于1 L 实验室用二级纯水中,来标定已配制好的硝酸银标准溶液。
标定前先通过计算求出氯化钠标准溶液中Cl-的浓度,计算公式为:C l -的浓度=M C l -/M N a C l ×m N a C l /V=35.45/58.44×1.684/1=1.024 g/L。
Cl-——氯离子的摩尔质量,单位为克每摩尔(g/mol);MNaCl——氯化钠的摩尔质量,单位为克每摩尔(g/mol);MNaCl——氯化钠基准试剂的质量,单位为克(g);V——二级纯水的体积1升,单位为升(L)。
2.标定配制好的硝酸银标准溶液。
用浓度为1.024 g/L 的氯化钠溶液来标定配制好的硝酸银标准溶液。
具体过程如下:先用20 mL 的移液管量取10 mL 的氯化钠标准溶液,注入锥形瓶中。
用移液管吸液时,先进行润洗。
用右手的拇指和中指捏住移液管的上端,将管的下口插入氯化钠溶液中,插入一般不要太深或太浅,一般为10~20 mL,太浅会产生吸空,把溶液吸入吸耳球内弄脏溶液,太深又会在管外沾附溶液过多。
左手拿洗耳球,接在管的上口把溶液慢慢吸入,先吸入移液管的1/3左右,用右手的食指按住管口,取出,横持,并转动管使溶液接触到刻度以上部位,以置换内壁的水分,然后将溶液从管的下口放入盛废液的烧杯弃去,如此反复洗3次后,即可吸取溶液至刻度以上约5 mm,立即用右手的食指按住管口。
第 1 页 共 1 页
范围:硝酸银滴定液
职责:检验室对本规程的实施负责
正文:
1.试剂和溶液的准备。
1.1糊精溶液:取糊精1g 加水至50ml ,摇匀即得。
1.2荧光黄指示剂:取荧光黄0.1g ,加乙醇100ml 使溶解,即得。
2.操作步骤或程序
2.1AgNO 3=169.87 16.99g →1000ml
2.2配制:取硝酸银17.5g ,加水适量使溶解成1000ml ,摇匀。
2.3标定:取在110℃干燥至恒重的基准氯化钠约0.2g ,精密称定,加水50ml 使溶解,再加糊精溶液(1→50)5ml 、碳酸钙0.1g 与荧光黄指示液8滴,用本液滴定至浑浊液由黄绿色变为微红色,每1m l 的A g N O 3滴定液
(0.1mol /L)相当于5.844mg 的NaCl ,根据本液的消耗量与NaCl 的取用量算出本液的浓度。
——如需用AgNO 3滴定液(0.01mol /L)时,可取AgNO 3滴定液(0.1mol /L) 在临
用前加水稀释。
2.3.1执行《干燥失重检查标准操作规程》。
3.操作标准
——中华人民共和国药典2000年版二部附录XV F
4.操作原理
AgNO 3+NaCl →AgCl ↓+NaNO 3
5.操作结果评价
)/(005844
.01.033L mol V W C AgNO NaCl AgNO ⨯⨯= 6.操作过程的注意事项
6.1标定:同一操作者,在同一实验室用同一测定方法对同一滴定液在正常的分析操作进行滴定的份数不得少于3份。
6.2复标:滴定液经第一人标定后必须由第二人进行再标定3份。
6.3相对偏差:标定的相对偏差不得超过0.1%,标定与复标的相对偏差不得超过0.15%。
6.4使用期限:三个月。
6.5贮藏:置玻璃塞棕色玻瓶中密闭保存。
7.操作中使用的设备及器具
——酸式滴定管、干燥箱、刻度吸管、分析天平(0.1mg )、锥形瓶等。