滴定液、标准溶液配制及标定记录
- 格式:docx
- 大小:54.75 KB
- 文档页数:2

滴定液配制及标定记录
配制记录
滴定液名称配制批号
配制日期配制数量
标定日期标定温度
复标日期复标温度
有效期配置人
配制方法:
标定记录
基准试剂(名称:,批号:)恒重记录操作人/日期:
仪器:□干燥箱,编号:□天平,编号:□其他,名称/编号:干燥温度(℃)干燥时间(min)
□空坩埚□空称量瓶重量(g)□空坩埚□空称量瓶+基准试剂重量(g)
恒重一次重量(g)恒重二次重量(g)
标定步骤:
基准物质称样量(g)滴定液消耗量V(ml)C(mol/L)相对偏差(≤0.1%)
1 2 3 1 2 3 空白C1 C2 C3 均值 1 2 3
(第一行为初始读数,称量天平编号:)标定人/日期:
基准物质称样量(g)滴定液消耗量V(ml)C(mol/L)相对偏差(≤0.1%)
1 2 3 1 2 3 空白C1 C2 C3 均值 1 2 3
(第一行为初始读数,称量天平编号:)复标人/日期:
结论:
间接配置法配制的滴定液F值在0.95-1.05之间,标定与复标浓度均值为: mol/L,两者相对偏差(规定值为≤0.1%)为: %,故本滴定液校正浓度为: mol/L,F值为:。

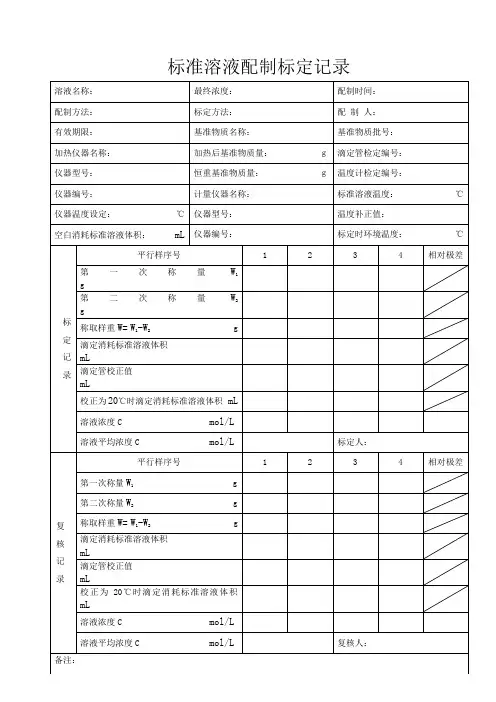
滴定液名称:标示浓度:配制日期:年月日配制标定依据:基准试剂名称:基准试剂来源:基准试剂批号:基准试剂含量:指示剂:标定日期:年月日天平编号:滴定管编号:室温:℃湿度:复标日期:年月日天平编号:滴定管编号:室温:℃湿度:配制记录:配制者:计算公式:TVWF=⨯式中W 为基准试剂量(mg);V 为滴定液校正后的体积(ml);T=mg/ml基准物恒重编号1234基准物第一次干燥后重(g )基准物第二次干燥后重(g )基准物第三次干燥后重(g )基准物称量编号1234称量瓶+基准物重(g)倾出基准物后称量瓶重(g)称取的基准物重W(g)滴定滴定管初读数(ml)滴定管终读数(ml)滴定液消耗体积(ml)体积校正(ml)滴定液实际消耗体积V(ml)计算:1、――――――――――――――=3、――――――――――――――=2、――――――――――――――=4、――――――――――――――=F 值平均值:――――――――――――――――――=相对偏差:%100⨯-xx x i =――――――――――――――×100%=%标定人:复核人:年月日年月日复标基准物恒重编号1234基准物第一次干燥后重(g)基准物第二次干燥后重(g)基准物第三次干燥后重(g)基准物称重编号1234称量瓶+基准物重(g)倾出基准物后称量瓶重(g)称取的基准物重W(g)滴定编号1234滴定管初读数(ml)滴定管终读数(ml)滴定液消耗体积(ml)体积校正(ml)滴定液实际消耗体积V(ml)计算:1、――――――――――――――=3、――――――――――――――=2、――――――――――――――=4、――――――――――――――=F 值平均值:――――――――――――――=相对偏差:%100⨯-xx x i =――――――――――――――×100%=%标定值(F)复标值(F)标定与复标的平均值(F)――――――――――=标定与复标的相对偏差:%标定值+复标值值标定值-复标100⨯=――――――――――――×100%=%使用期限:年月日至年月日复标者:复核者:年月日年月日。

标准溶液的配置标定记录氢氧化钠标准滴定溶液的配置滴定记录① 配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用时用塑料管虹吸上层清液。
氢氧化钠标准溶液:量取毫升氢氧化钠饱和溶液,注入毫升不含二氧化碳的水中,摇匀。
② 标定:称取克于105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0002克。
溶于毫升不含二氧化碳的水中,加2滴1酚酞指示液,用氢氧化钠溶液滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
③ 计算:氢氧化钠标准滴定溶液的浓度[c(NaOH)],数值以摩尔每升(mol/L)表示,按下列公式计算:c(NaOH)=m 1000(V1 V2)M式中:m-----邻苯二甲酸氢钾的质量的准确数值,单位为克(g); V1----氢氧化钠溶液的体积的数值,单位为毫升(mL); V2---空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M----邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)[M(*****4)= 204.22 ]容量分析原始记录检验:审核:检验日期:① 配制:盐酸标准溶液,量取毫升盐酸,注入毫升水中。
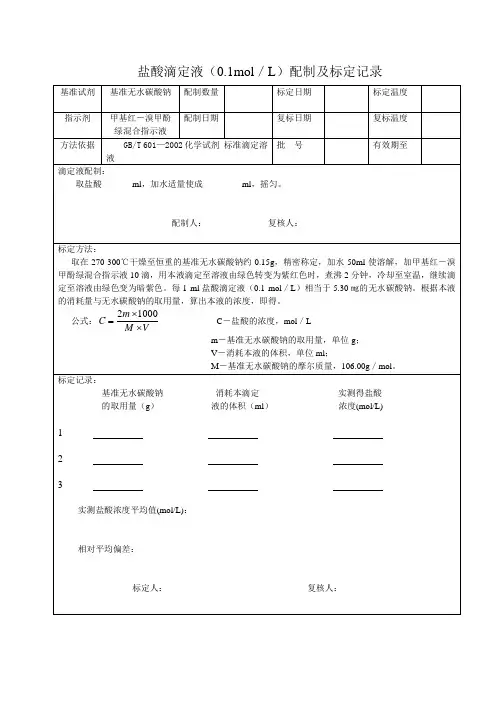
② 标定:称取克于270℃--300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,称准至0.0002克。
,溶于50mL水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色,同时做空白试验。
③ 计算:盐酸标准滴定溶液的浓度[c(HCl)]数值以摩尔每升(mol/L)表示,按下列公式计算:c(HCl)=m 1000(V1 V2)M式中:m----无水碳酸钠的质量的准确数值,单位为克(g) V1---盐酸溶液的体积的数值,单位为毫升(mL)V2---空白试验盐酸溶液的体积的数值,单位为毫升(mL) M---无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M (12 Na2CO3)=52.994]容量分析原始记录检验:审核:检验日期:① 配制:硫酸标准溶液,量取毫升硫酸,注入毫升水中。
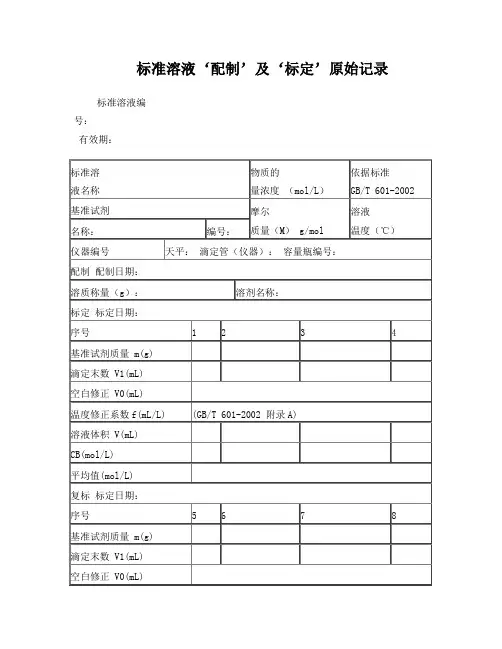
标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:温度修正系数f(mL/L) (GB/T 601-2002 附录A)溶液体积 V(mL)CB(mol/L)平均值(mol/L)计算式:V=(V1-V0)×(1+f/1000)CB=1000m/(M×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度 %RH配制:取定溶 mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量(mL)V1= 、V2= 、V3= 、V4= 、V0= 。
标准溶液浓度计算公式:C=计算结果():C1= C2= C3= C4= C =相对偏差(%):S1= S2= S3= S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃ 、湿度: %RH 标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号:JL/LJ-001-01一、标定方法:GB/T5009.1-2003二、使用仪器:AEL-200电子天平(仪器编号:JYB001)马弗炉(仪器编号:JYC009)三、操作1、量取9ml盐酸,加适量水并稀释至1000ml。
混匀,待标定。
2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
四、记录和结果1、计算公式:c(HCl)=m/[(V1-V2)×0.0530]0.0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基准无水碳酸钠的质量,g2、数据配制人:复核人:配制日期:复核日期:稀释记录表标准溶液(滴定液)管理工作的基本要求关键词(必填项目):标准溶液、滴定液目的(必填项目):对标准溶液的使用等制定统一的要求,便于统一的管理。
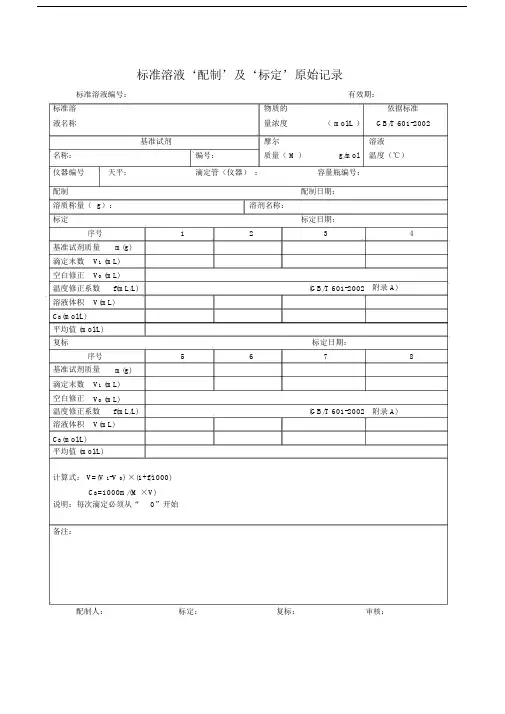
标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:标准溶物质的依据标准液名称量浓度( mol/L )GB/T 601-2002基准试剂摩尔溶液名称:编号:质量( M )g/mol温度(℃)仪器编号天平:滴定管(仪器):容量瓶编号:配制配制日期:溶质称量( g):溶剂名称:标定标定日期:序号1234基准试剂质量m(g)滴定末数V1 (mL)空白修正V0 (mL)温度修正系数f(mL/L)(GB/T 601-2002附录 A)溶液体积V(mL)C B(mol/L)平均值 (mol/L)复标标定日期:序号5678基准试剂质量m(g)滴定末数V1 (mL)空白修正V0 (mL)温度修正系数f(mL/L)(GB/T 601-2002附录 A)溶液体积V(mL)C B(mol/L)平均值 (mol/L)计算式: V=(V 1-V 0) ×(1+f/1000)C B=1000m/(M ×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/ QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度%RH配制:取定溶mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量( mL)V1=、 V2=、 V3=、V4=、V0=。
标准溶液浓度计算公式: C=计算结果():C1=C2=C3=C4= C =相对偏差( %):S1=S2=S3=S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃、湿度:%RH标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号: JL/LJ-001-01一、标定方法: GB/T5009.1-2003二、使用仪器: AEL-200 电子天平(仪器编号: JYB001)马弗炉 (仪器编号:JYC009)三、操作1、量取 9ml 盐酸,加适量水并稀释至 1000ml 。


一、氢氧化钠标准滴定溶液1、配制:称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮;按下表用量,用塑料管量取上层清液,用无二氧化碳的水稀释至1000mL,摇匀;2、标定:按下表的规定量,称取于105℃~110℃电烘箱中干燥至恒量的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液10g/L,用配制的氢氧化钠滴定至溶液呈粉红色,并保持30s;同时做空白试验;氢氧化钠标准滴定溶液的浓度cNaOH,按式1计算:cNaOH=m×1000(V1−V2)×M (1)式中:m—邻苯二甲酸氢钾质量,单位为克g;V1—氢氧化钠溶液体积,单位为毫升mL;V2—空白试验消耗氢氧化钠溶液体积,单位为毫升mL;M—邻苯二甲酸氢钾的摩尔质量,单位为克每摩尔g/molMKHC8H4O4=204.22二、盐酸标准滴定溶液1、配制:按下表规定量,量取盐酸,注入1000mL水中,摇匀;2、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色;同时做空白试验;盐酸标准滴定溶液的浓度cHCl,按式2计算:cHCl=m×1000(V1−V2)×M (2)式中:m—无水碳酸钠质量,单位为克g;V1—盐酸溶液体积,单位为毫升mL;V2—空白试验消耗盐酸溶液体积,单位为毫升mL;M—无水碳酸钠的摩尔质量,单位为克每摩尔g/molM1/2Na2CO3=52.994三、硫酸标准滴定溶液1、配制:按下表规定量,量取硫酸,缓缓注入1000mL水中,冷却,摇匀;2、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色;同时做空白试验;硫酸标准滴定溶液的浓度c1/2H2SO4,按式3计算:c1/2H2SO4=m×1000(V1−V2)×M (3)式中:m—无水碳酸钠质量,单位为克g;V1—硫酸溶液体积,单位为毫升mL;V2—空白试验消耗硫酸溶液体积,单位为毫升mL;M—无水碳酸钠的摩尔质量,单位为克每摩尔g/molM1/2Na2CO3=52.994四、硫代硫酸钠标准滴定溶液cNa2S2O3=0.1mol/L1、配制称取26g五水合硫代硫酸钠或16g无水硫代硫酸钠,加0.2g无水碳酸钠,溶于1000mL水中,缓缓煮沸10min,冷却;放置2周后用4号玻璃滤锅过滤;2、标定称取0.18g已于120℃±2℃干燥至恒量的工作基准试剂重铬酸钾,置于碘量瓶中,溶于25mL水,加2g碘化钾及20mL硫酸溶液20%,摇匀,于暗处放置10min;加150mL水15℃~20℃,用配制的硫代硫酸钠溶液滴定,近终点时加2mL淀粉指示液10g/L,继续滴定至溶液由蓝色变为亮绿色;同时做空白试验;硫代硫酸钠标准滴定溶液的浓度cNa2S2O3,按式4计算:cNa2S2O3=m×1000(V1−V2)×M (4)式中:m—重铬酸钾质量,单位为克g;V1—硫代硫酸钠溶液体积,单位为毫升mL;V2—空白试验消耗硫代硫酸钠溶液体积,单位为毫升mL;M—重铬酸钾的摩尔质量,单位为克每摩尔g/molM1/6K2Cr2O7=49.031五、硫酸铁Ⅱ铵标准滴定溶液{cNH42FeSO42=0.1mol/L}1、制剂配制1.1硫磷混酸溶液于100mL水中缓慢加入150mL硫酸和150mL磷酸,摇匀,冷却至室温,用高锰酸钾溶液调至微红色;1.2N-苯代邻氨基苯甲酸指示液2g/L临用前配制称取0.2gN-苯代邻氨基苯甲酸,溶于少量水,加0.2g无水碳酸钠,温热溶解,稀释至100mL;2、配制:称取40g六水合硫酸铁Ⅱ铵,溶于300mL硫酸溶液20%中,加700mL水,摇匀;3、标定临用前标定:称取0.18g已于120℃±2℃电烘箱中干燥至恒量的工作基准试剂重铬酸钾,溶于25mL水中,加10mL硫磷混酸溶液,加70mL水,用配制的硫酸铁Ⅱ铵溶液滴定至橙黄色消失,加2滴N-苯代邻氨基苯甲酸指示液2g/L,继续滴定至溶液由紫红色变为亮绿色;硫酸铁Ⅱ铵标准滴定溶液的浓度{cNH42FeSO42},按式5计算:cNH42FeSO42=m×1000V×M (5)式中:m—重铬酸钾质量,单位为克g;V—硫酸铁Ⅱ铵溶液体积,单位为毫升mL;M—重铬酸钾的摩尔质量,单位为克每摩尔g/molM1/6K2Cr2O7=49.031六、乙二胺四乙酸二钠标准滴定溶液1、配制:按下表规定量,称取乙二胺四乙酸二钠,加1000mL水,加热溶解,冷却,摇匀;2、标定:2.1乙二胺四乙酸二钠标准滴定溶液cEDTA=0.1mol/L,cEDTA=0.05mol/L按下表规定量,称取于800℃±50℃的高温炉中灼烧至恒量的工作基准试剂氧化锌,用少量水湿润,加2mL盐酸溶液20%溶解,加100mL水,用氨水溶液10%将溶液PH调至7~8,加10mL氨-氯化铵缓冲溶液甲PH≈10及5滴铬黑T指示液5g/L,用配制的乙二胺四乙酸二钠溶液滴定至溶液由紫色变为纯蓝色;同时做空白试验;乙二胺四乙酸二钠标准滴定溶液的浓度cEDTA,按式6计算:cEDTA=m×1000(V1−V2)×M (6)式中:m—氧化锌质量,单位为克g;V1—乙二胺四乙酸二钠溶液体积,单位为毫升mL;V2—空白试验消耗乙二胺四乙酸二钠溶液体积,单位为毫升mL;M—氧化锌的摩尔质量,单位为克每摩尔g/molMZnO=81.4082.2乙二胺四乙酸二钠标准滴定溶液cEDTA=0.02mol/L称取0.42g于800℃±50℃的高温炉中灼烧至恒量的工作基准试剂氧化锌,用少量水湿润,加3mL盐酸溶液20%溶解,移入250mL容量瓶中,稀释至刻度,摇匀;取35.00mL~40mL,加70mL水,用氨水溶液10%将溶液PH调至7~8,加10mL氨-氯化铵缓冲溶液甲PH≈10及5滴铬黑T指示液5g/L,用配制的乙二胺四乙酸二钠溶液滴定至溶液由紫色变为纯蓝色;同时做空白试验;乙二胺四乙酸二钠标准滴定溶液的浓度cEDTA,按式7计算:cEDTA=m×(V1250)×1000(V2−V3)×M (7)式中:m—氧化锌质量,单位为克g;V1—氧化锌溶液体积,单位为毫升mL;V2—乙二胺四乙酸二钠溶液体积,单位为毫升mL;V3—空白试验消耗乙二胺四乙酸二钠溶液体积,单位为毫升mL;M—氧化锌的摩尔质量,单位为克每摩尔g/molMZnO=81.408七、硝酸银标准滴定溶液cAgNO3=0.1mol/L1、配制:称取17.5g硝酸银,溶于1000mL水中,摇匀;溶液贮存于密闭的棕色瓶中;2、标定:称取0.22g于500℃~600℃的高温炉中灼烧至恒量的工作基准试剂氯化钠,溶于70mL水中,滴3滴铬酸钾试剂,用配制的硝酸银溶液滴定至溶液由黄色变为橙黄色;同时做空白试验;硝酸银标准滴定溶液的浓度cAgNO3,按式8计算:cAgNO3=m×1000(V1−V2)×M (8)式中:m—氯化钠质量,单位为克g;V1—硝酸银溶液体积,单位为毫升mL;V—空白试验消耗硝酸银溶液体积,单位为毫升mL;2M—氯化钠的摩尔质量,单位为克每摩尔g/molMNaCl=58.442。

氢氧化钠标准溶液的配制与标定实验报告
【配置】取氢氧化钠适量,加水振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日澄清后备用。
氢氧化钠滴定液(1mol/L):取澄清的氢氧化钠饱和溶液54ml,加新煮沸过的冷水定容至1000ml容量瓶中,摇匀。
【标定】氢氧化钠滴定液(1mol/L):取在105℃干燥至恒重的邻苯二甲酸氢钾7.5g(精确至0.0001),加新煮沸过的冷水80ml,振摇使其尽量溶解;加酚酞指示剂2滴,用氢氧化钠滴定,滴定至溶液显粉红色。
同时做空白试验。
m为邻苯二甲酸氢钾的质量/g
V1为氢氧化钠滴定液的消耗体积/ml
V0为空白试验氢氧化钠的消耗体积/ml
204.22为邻苯二甲酸氢钾的摩尔质量数值
【注意事项】①配制此滴定液取用澄清的氢氧化钠饱和溶液和新煮沸的冷水,其目的在于排除碳酸钠和二氧化碳的干扰。
②制备氢氧化钠饱和溶液时,可取氢氧化钠110g,分几次加入盛有100ml水的500ml容量瓶里,边加边搅拌使溶解成饱和溶液,冷却至室温,将溶液连同过量的氢氧化钠转移至聚乙烯塑料瓶中,密塞静置数日后
使碳酸钠结晶和过量的氢氧化钠沉于瓶底,而得到上部澄清的氢氧化钠饱和溶液。
③在滴定临近终点之前,必须使邻苯二甲酸氢钾完全溶解,否则影响将影响滴定结果。
④如需用氢氧化钠滴定液(0.
01、0.
02、0.05mol/L)时,可取氢氧化钠(0.1mol/L)加新煮沸过的冷水稀释而成。

标准溶液配制记录一、实验目的。
本实验旨在记录标准溶液的配制过程,以及相关实验数据,为后续实验提供准确可靠的参考依据。
二、实验原理。
标准溶液是已知浓度的溶液,通常用于分析化学中的定量分析。
在配制标准溶液时,需要根据溶质的化学性质和实验要求,选择适当的溶剂和溶质的质量,按照一定的比例配制而成。
三、实验步骤。
1. 准备实验所需的试剂和仪器设备,包括天平、容量瓶、移液管等。
2. 根据实验要求,选择合适的溶剂和溶质,并按照所需的浓度比例进行称量。
3. 将称量好的溶质溶解于适量的溶剂中,摇匀使其充分溶解。
4. 用容量瓶将溶液定容至刻度线,摇匀混合。
5. 将配制好的标准溶液转移至干净的密封瓶中,标注好溶液的名称、浓度、配制日期等信息。
四、实验数据记录。
| 溶质 | 质量/g | 溶剂 | 体积/mL | 浓度/mol/L | 配制日期 |。
|------|--------|------|---------|------------|----------|。
| NaCl | 5.85 | 水 | 1000 | 0.1 |2022/03/15|。
| KCl | 7.20 | 水 | 1000 | 0.2 |2022/03/16|。
五、实验结果分析。
通过本次实验的记录数据,我们成功配制出了两种浓度不同的标准溶液,分别为0.1mol/L的NaCl溶液和0.2mol/L的KCl溶液。
在实验过程中,我们严格按照配制步骤进行操作,确保了实验结果的准确性和可靠性。
六、实验总结。
本次实验记录了标准溶液的配制过程和相关数据,为后续实验提供了重要的参考依据。
在实验中,我们需要严格按照配制步骤进行操作,确保实验结果的准确性和可靠性。
同时,对于配制好的标准溶液,我们也需要做好标注和保存工作,以便后续实验的使用。
七、实验注意事项。
1. 在配制标准溶液时,需要准确称量溶质和溶剂,严格按照比例进行配制。
2. 配制好的标准溶液需要标注清楚名称、浓度、配制日期等信息,并保存在干净的密封瓶中。
常用滴定液配制与标定乙二胺四醋酸二钠滴定液(0.05mol/L) C10H14N2Na2O8·2H2O=372.24 18.61g→1000ml【配制】取乙二胺四醋酸二钠19g,加适量的水使溶解成1000ml,摇匀。
【标定】取于约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(pH10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1ml乙二胺四醋酸二钠滴定液 (0.05mol/L) 相当于4.069mg 的氧化锌。
根据本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
【贮藏】置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触。
乙醇制氢氧化钾滴定液(0.5mol/L) KOH=56.11 28.06g→1000ml【配制】取氢氧化钾35g,置锥形瓶中,加无醛乙醇适量使溶解并稀释成1000ml,用橡皮塞密塞,静置24小时后,迅速倾取上清液,置具橡皮塞的棕色玻瓶中。
【标定】精密量取盐酸滴定液(0.5mol/L)25ml,加水50ml稀释后,加酚酞指示液数滴,用本液滴定。
根据本液的消耗量,算出本液的浓度,即得。
本液临用前应标定浓度。
【贮藏】置橡皮塞的棕色玻瓶中,密闭保存。
四苯硼钠滴定液(0.02mol/L) (C6H5)4BNa=342.22 6.845g→1000ml【配制】取四苯硼钠7.0g,加水50ml振摇使溶解,加入新配制的氢氧化铝凝胶(取三氯化铝1.0g,溶于25ml水中,在不断搅拌下缓缓滴加氢氧化钠试液至pH8~9),加氯化钠16.6g,充分搅匀,加水250ml,振摇15分钟,静置10分钟,滤过,滤液中滴加氢氧化钠试液至pH8~9,再加水稀释至1000ml,摇匀。
【标定】精密量取本液10ml,加醋酸-醋酸钠缓冲液(pH3.7)10ml与溴酚蓝指示液0.5ml,用烃铵盐滴定液(0.01mol/L)滴定至蓝色,并将滴定的结果用空白试验校正。