普通化学实验报告(中石大2017)
- 格式:docx
- 大小:21.71 KB
- 文档页数:7

普通化学实验报告一、实验目的本次实验旨在通过观察和操作,了解和掌握普通化学的基本实验技能,培养实验观察能力、数据分析能力和问题解决能力。
二、实验原理本实验主要涉及酸碱滴定反应,通过滴定计量液体中的酸碱浓度。
酸碱滴定法是一种常用的化学分析方法,具有快速、准确、灵敏度高等优点。
三、实验步骤1、准备实验用品:酸碱滴定管、三角瓶、容量瓶、滴定剂、被测液体。
2、校准滴定管:使用前需对滴定管进行校准,确保液位在刻度线上。
3、准备被测液体:将被测液体放入容量瓶中。
4、滴定操作:将滴定剂加入滴定管中,开始滴定。
在滴定的过程中,要控制好滴定的速度和时间,并观察被测液体的变化。
5、数据记录:记录滴定过程中的数据,包括滴定量、时间、液体变化等。
6、计算结果:根据记录的数据计算被测液体的浓度。
四、实验结果与数据分析实验数据显示,被测液体的滴定量为毫升,消耗时间为秒。
根据酸碱滴定的反应原理,可以计算出被测液体的浓度为 mol/L。
五、结论通过本次实验,我们掌握了酸碱滴定反应的基本原理和操作方法,学会了如何使用滴定管进行滴定操作和如何计算液体的浓度。
实验过程中需要注意操作规范和数据记录的准确性,以保证实验结果的可靠性。
本次实验不仅提高了我们的化学实验技能,还培养了我们的观察能力、思维能力和解决问题的能力。
一、实验目的:本次实验旨在通过观察和操作,了解化学反应的基本原理,掌握化学实验的基本技能,培养实验观察和实验操作的能力。
二、实验原理:在本次实验中,我们将通过观察镁带在氧气中的燃烧,了解金属与氧气反应的基本原理。
镁是一种较为活泼的金属,可以在氧气中燃烧,生成氧化镁。
这个反应可以表示为:2Mg + O2 → 2MgO。
三、实验材料:1、镁带2、氧气3、酒精灯4、火柴5、镊子6、玻璃片7、砂纸四、实验步骤:1、我们使用砂纸打磨镁带,去除表面的氧化膜。
然后,用镊子取一根打磨好的镁带,将其一端固定在玻璃片的边缘。
2、用火柴点燃酒精灯,将镁带放置在酒精灯火焰上方,观察镁带的反应。

大学化学实验报告(通用4篇)大学化学实验报告(通用4篇)在现实生活中,报告不再是罕见的东西,不同种类的报告具有不同的用途。
其实写报告并没有想象中那么难,下面是小编为大家整理的大学化学实验报告,仅供参考,欢迎大家阅读。
大学化学实验报告1一、实验目的用已知浓度溶液标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测溶液)浓度【本实验氢氧化钠为待测溶液】二、实验原理在酸碱中和反应中,使用一种的酸(或碱)溶液跟的碱(或酸)溶液完全中和,测出二者的,再根据化学方程式中酸和碱的物质的量的比值,就可以计算出碱(或酸)溶液的浓度。
计算公式:c (NaOH)?c(HCl)?V(HCl)c(NaOH)?V(NaOH)或c(HCl)?。
V(NaOH)V(HCl)三、实验用品酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、0、1000mol/L盐酸(标准液)、未知浓度的NaOH溶液(待测液)、酚酞(变色范围8、2~10)1、酸和碱反应的实质是。
2、酸碱中和滴定选用酚酞作指示剂,但其滴定终点的变色点并不是pH=7,这样对中和滴定终点的判断有没有影响?3、滴定管和量筒读数时有什么区别?四、数据记录与处理五、问题讨论酸碱中和滴定的关键是什么?大学化学实验报告2实验名称:酸碱中和滴定时间实验(分组)桌号合作者指导老师一:实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测溶液)浓度【本实验氢氧化钠为待测溶液】二:实验仪器:酸式滴定管、碱式滴定管、锥形瓶、铁架台(含滴定管夹)。
实验药品:0、1000mol/L盐酸(标准溶液)、未知浓度的NaOH溶液(待测溶液)、酸碱指示剂:酚酞(变色范围8~10)或者甲基橙(3、1~4、4)三:实验原理:c(标)×V(标)=c(待)×V(待)【假设反应计量数之比为1:1】【本实验具体为:c(H+)×V(酸)=c(OH—)×V(碱)】四:实验过程:(一)滴定前的准备阶段1、检漏:检查滴定管是否漏水(具体方法:酸式滴定管,将滴定管加水,关闭活塞。

大学生有机化学实验报告总结范文分析化学是一门实践性很强的学科。
分析化学实验课的任务是使我们进一步加深对分析化学基本理论的理解。
正确掌握分析化学实验的基本操作技能。
培养良好的实验习惯和严谨,实事求是的科学态度,提高观察问题,分析问题和解决问题的能力。
为学习后续课程和将来从事实际工作打下良好的基础。
实验是化学的灵魂,是化学的魅力和激发学生学习兴趣的主要源泉,更是培养和发展学生思维能力和创新能力的重要方法和手段。
分析化学实验的意义在于以下几点:首先,分析化学实验能提高学习的兴趣。
其次,分析化学实验能培养我们的观察能力。
最后,实验能培养我们的思维能力。
大一暑期实践期间,我曾随学院学生科协进行了北京市城区饮用水水质调查。
那次活动是我第一次比较系统的作分析化学实验,以下借用几段我对于那次活动的总结。
活动的目的除了在于培养科协成员的分析化学试验能力外,还使成员体验了比较正规的科研项目的步骤-讨论、立题、取样、分析……通过这次活动,科协成员面对涉及外专业或目前学术水平难以达到的课题时,将更有能力与信心运筹帷幄。
调查是学生科协的传统活动-化学实验技能竞赛的拓展。
化学实验技能有机的溶于调查的水硬测量阶段,使单纯的实验提升到科研的高度。
从调查的取样阶段开始,全体成员充分参与到活动当中。
取样的范围是北京市城八区居民的饮用水。
原则上每个城区两个水样。
我被分配采集一个朝阳区的水样。
朝阳区是北京的大区,我选取的社区是位于西大望路____号的新近开发的楼盘-金港国际。
该地点处于泛CBD,也是近期入市的热门地点,我选取的社区定位是白领公寓,室内除有自来水外还有纯净水的管道以及完备的终水系统。
我分别采集了该社区纯净水及自来水的水样各一份,以便比较。
实验阶段中,未学过分析化学的成员得以提前接触到一些高精密仪器,如分析天平。
这为大一的同学今后的学习有较大的积极影响。
虽然因实验仪器使用的不熟练使得失误的频繁发生,但由于活动参与者的认真态度,我们最终得到了较为准确的实验数据。
中国XX大学(油田化学)实验报告实验三钻井液钙侵及处理1. 了解一般淡水钻井液钙侵后性能的变化规律。
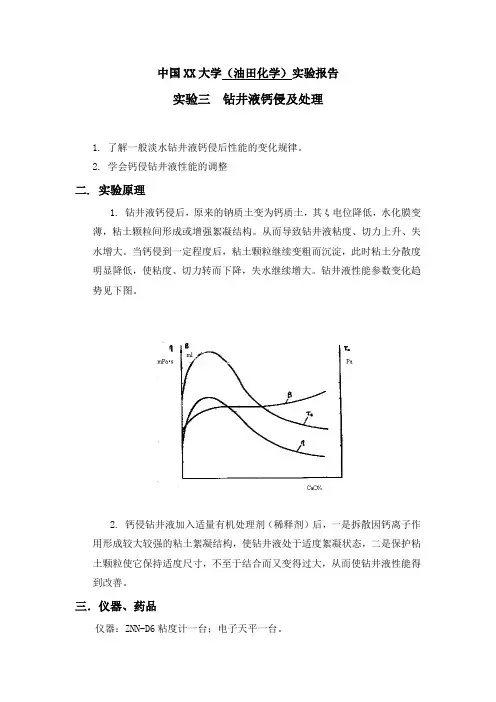
2. 学会钙侵钻井液性能的调整二. 实验原理1. 钻井液钙侵后,原来的钠质土变为钙质土,其ξ电位降低,水化膜变薄,粘土颗粒间形成或增强絮凝结构。
从而导致钻井液粘度、切力上升、失水增大。
当钙侵到一定程度后,粘土颗粒继续变粗而沉淀,此时粘土分散度明显降低,使粘度、切力转而下降,失水继续增大。
钻井液性能参数变化趋势见下图。
2. 钙侵钻井液加入适量有机处理剂(稀释剂)后,一是拆散因钙离子作用形成较大较强的粘土絮凝结构,使钻井液处于适度絮凝状态,二是保护粘土颗粒使它保持适度尺寸,不至于结合而又变得过大,从而使钻井液性能得到改善。
三.仪器、药品仪器:ZNN-D6粘度计一台;电子天平一台。
药品:CMC、降粘剂。
四.实验步骤1.取原浆500ml高搅5分钟,测其性能。
2.各组按下表加生石灰,高速搅拌10分钟后测全套性能。
3.根据加生石灰后的钻井液性能,加适量稀释剂和降失水剂使其性能得到恢复。
处理剂加量参考下表:五.实验数据及处理1.将所得数据及计算结果整理列表,如下所示:表一钻井液钙侵数据记录表数据的计算与处理:(1)测得的是在7.5分钟下的滤失量,经理论推证,30分钟下的滤失量是其两倍,所以:在基浆+CaO液体组成下,×2=25(ml)在基浆+CaO+降粘剂+降虑失剂液体组成下,×2=15(ml)表二钻井液钙侵数据统计表(2)泥浆剪切应力τ0与粘度计读数Ф的对应关系为×(2φ300-φ600):τ以1/2组数据为例,当转数为600时,读数为23格,当转数为300格时,读数为20:τ×(2×20-23)与转数的对应关系为:(3)钻井液的表观粘度ηp=φ600-φ300:ηp同样以1/2组的数据为例,当转数为600时,读数为23格,当转数为300格时,读数为20:ηp根据上面的描述对上面的表格二进行处理得:表二钻井液钙侵数据处理表2.给出钻井液表观粘度、动切力以及失水随生石灰加量的变化曲线并简要解释。

中山大学有机化学实验报告有机化学实验报告2中山大学有机化学实验报告有机化学实验报告2中山大学工学院201*级生物医学工程专业《有机化学》课程实验报告姓名唐颖学号12312042成绩日期同组姓名指导教师戴箭实验名称:丁香酚的提取和分离一、实验目的:1、了解丁香酚的提取、分离方法。
2、掌握水蒸气蒸馏、分液漏斗的液-液萃取等基本操作技术。
二、仪器直形冷凝管、10ml圆底烧瓶、微型蒸馒头、分液漏斗、长滴管、3ml离心管、10ml锥形瓶、5ml量筒、天平三、药品丁香花蕾、乙酸乙酯、5%氢氧化钠、1:1盐酸溶液、PH试纸四、实验原理五、实验步骤及数据记录丁香为桃金娘科植物丁香Syzygiumaromaticum(L.)Merr.et.Perry的花蕾,是一种常用的中药。
丁香含挥发油16-19%,油中主要含有丁香酚(Eugenol,CHO)80-87%,β-丁香烯(β-Caryophyllene,CH)9.12%,乙酰丁香酚(Acetyleugenol)中山大学工学院201*级生物医学工程专业7.33%,此外尚含有其他的微量成分:2-庚酮、水杨酸甲酯、α-丁香烯、苯甲醛、苯甲醇、乙酸苯甲酯、间甲氧基苯甲醛、衣兰烯等。
丁香挥发油(简称丁香油),是一种局部麻醉镇痛药,药典规定丁香油含丁香酚不少于85%。
丁香油主要用于治龋齿,兼有杀菌作用,并用作芳香剂及香料,也可以配制风油精等外用药。
丁香油为无色或淡黄色液体,具有香味和挥发性成分与非挥发性成分,然后再用乙酸乙酯萃取蒸馏出来的挥发性成分,即得丁香油。
丁香酚是一种黄色油状物,沸点bp=225℃,相对密度(比重)d=1.0664,折光率n=1.5410.丁香酚可以溶于氢氧化钠溶液中,以钠盐的形式存在,加酸酸化可使丁香酚游离出来。
因此,为了提取分离丁香中的丁香酚,一般采用水蒸气蒸馏的方法提取其挥发油,然后根据酚羟基的性质,用氢氧化钠溶液萃取分离丁香酚,酸化后再用乙酸乙酯提取,最后蒸馏回收乙酸乙酯,即可以得到丁香酚。


中国石油大学(华东)现代远程教育实验报告课程名称:普通化学/化学原理1 实验名称:电解质溶液-同离子效应实验形式:在线模拟+现场实践提交形式:在线提交实验报告学生姓名: _______________ 学号:________________ *年级专业层次: ________________ 怛提交时间:________ 年________ 月________ 日学习“同离子效应(一)、(二)”实验,详见《普通化学》(《化学原理1》)课件中的"实验教学”-“实验内容”-“电解质溶液”,网址/jpk2013/pthx/fzsy.html ,并回答下面的问题。
一、实验目的(1)加深对弱电解质的解离平衡、同离子效应、盐类水解等基本概念的理解。
了解缓冲溶液的缓冲作用及配制。
(2)掌握难溶电解质的多相离子平衡及沉淀的生成和溶解的条件。
____________________ 3 ________________________________________________________________________________________________________________________________ 0.1 mol - dm Na2S溶液,振荡,观察沉淀的颜色变化,解释所观察到的现象。
3 -3-试管中加入2滴0.1 mol - dm Pb(NQ)2溶液,再用滴管加入4滴0.1 mol - dm N&SQ溶液,有白色沉淀硫酸铅生成;用电动离心机离心沉降,然后在沉淀中加入8滴0.1 mol - dm-3 KI溶液,振荡,发现白色沉淀转为黄色沉淀。
再在沉淀物中加入4滴Na2CQ饱和溶液,振荡,发现黄色沉淀转为白色沉淀。
3-再用滴管加入4滴0.1 mol - dm NaaS溶液,振荡,发现白色沉淀转为黑色沉淀硫化铅。
3 -3-(4) 在三支试管中分别加入5滴0.1 mol - dm MgC2溶液,再逐滴加入2 mol - dm NH水溶液,_3 、. -3此时生成的沉淀是什么?然后分别加入 2 mol - dm HCl溶液、固体NHAc和2 mol - dm NaQH溶液,观察沉淀是否都溶解?解释之。

(最新版)大学化学实验报告(全)化学原理Ⅱ实验王业飞吕开河葛际江戴彩丽焦翠于连香中国石油大学(华东)石油工程学院2019 年 2 月目录前言..........................................................................................1 实验一三组分相图的制备.............................................................3 实验二最大压差法测表面张力....................................................6 实验三溶胶的制备与电泳............................................................11 实验四无机电解质的聚沉作用与高分子的絮凝作用...........................16 实验五乳状液的制备、鉴别和破坏................................................20 实验六聚丙烯酰胺的合成与水解...................................................24 实验七聚合物分子量的测定---粘度法..........................................26 实验八原油/水界面张力测定(滴体积法).......................................31 实验九聚合物综合性能评价.........................................................33 附录一苯-水的相互溶解度.........................................................35 附录二不同温度下水的密度、粘度和表面张力.................................36 附录三某些液体的密度...............................................................37 附录四不同温度时某些液体的表面张力..........................................38 附录五彼此相互饱和的两种液体的界面张力....................................39 附录六不同温度时水的介电常数...................................................39 附录七 722 型分光光度计 (40)1前言一. 化学原理(Ⅱ)实验的目的化学原理(Ⅱ)实验是化学原理(Ⅱ)课程的重要组成部分,其主要目的有以下四点:1. 了解化学原理(Ⅱ)的研究方法,学习化学原理(Ⅱ)中的某些实验技能,培养根据所学原理设计实验、选择和使用仪器的能力;2. 训练观察现象、正确记录和处理实验数据、运用所学知识综合分析实验结果的能力;3. 验证化学原理(Ⅱ)主要理论的正确性,巩固和加深对这些理论的理解;4. 培养严肃认真的科学态度和严格细致的工作作风。

油田化学实验报告目录实验一碱在原油乳化中的作用 (3)实验二絮凝剂在污水处理中的应用 (8)实验三钻井液钙侵及处理 (12)实验四钻井液中固相含量的测定 (17)实验五钻井液中膨润土含量的测定 (19)实验六金属的缓蚀 (21)实验七堵水剂的制备与性质 (24)实验一碱在原油乳化中的作用姓名:GGG班级:石工GG班学号:GGG同组者:GGGG实验时间:20GG.10.11一.实验目的1.观察碱与原油乳化后的现象。
2.学会用不稳定系数法确定使原油乳化的最佳碱浓度范围。
二.实验原理碱(例如NaOH)可与原油中的酸性成分(例如环烷酸)反应,生成表面活性物质。
这些表面活性物质可使原油乳化形成水包油(O/W)乳状液。
水包油乳状液的形成与稳定性对于碱驱和稠油乳化降粘是重要的,例如碱驱中乳化-携带、乳化捕集、自发乳化等机理的发生,稠油乳化降粘中原油乳化分散机理的发生都是以水包油状乳液的形成为前提条件的。
碱浓度是影响碱对原油乳化作用的重要因素。
碱浓度低时,碱与原油反应生成的活性物质少,不利于乳状液的稳定。
若碱浓度过高,一方面,碱可使原油中碳链较长的弱酸反应生成亲油的活性物质,这些亲油的活性物质可抵消亲水活性物质的作用,不利于水包油乳状液的稳定,同时,过量的碱具有盐的作用,也不利于水包油乳状液的稳定,因此,只有合适的碱浓度范围,碱才能与原油作用形成稳定的水包油乳状液。
乳状液的稳定性可用不稳定系数(USI)表示。
不稳定系数按式4-1定义:(4-1)式中USI——不稳定系数,ml;V(t)——乳化体系分出水体积与时间的变化函数;T——乳化体系静止分离的时间,min;从定义式可以看出,不稳定系数越小,乳状液的稳定性越好。
三.仪器与药品1.仪器电子天平(感量0.001g)、10ml具塞刻度试管、秒表、滴管、试管架。
2.药品氢氧化钠、原油、蒸馏水。
四.实验步骤1.取10ml具塞刻度试管7支,分别加入质量分数为的氢氧化钠溶液各5ml,分别用滴管准确加入原油5ml,塞上试管塞子,每只试管各上下震荡30次。

大学化学实验报告范文化学是一门以实验为基础的学科。
化学上的许多理论和定律都是从实验中发现归纳出来的。
那么你们知道大学的化学实验报告要怎么写吗?下面是小编为大家带来的大学化学实验报告范文_大学化学实验总结怎么写,希望可以帮助大家。
大学化学实验报告范文1:一、实验目的1. 了解复盐的制备方法。
2. 练习简单过滤、减压过滤操作方法。
3. 练习蒸发、浓缩、结晶等基本操作。
二、实验原理三、实验步骤四、实验数据与处理 1. 实际产量:2. 理论产量:3. 产率:实验二化学反应速率、活化能的测定姓名:班级:学号:指导老师:实验成绩:一、实验目的1. 通过实验了解浓度、温度和催化剂对化学反应速率的影响。
2. 加深对活化能的理解,并练习根据实验数据作图的方法。
二、实验原理三、实验数据记录及处理1. 浓度对反应速率的影响,求反应级数确定反应级数:m= n=2. 温度对反应速率的影响,求活化能表2 温度对反应速率的影响利用表2中各次实验的k和T,作lg 求出直线的斜率,进而求出反应活化能Ea。
?k?-图,3. 催化剂对反应速率的影响实验三盐酸标准溶液的配制、标定及混合碱的测定1.了解间接法配制标准溶液的方法。
2.学习用双指示剂法测定混合碱中不同组分的含量。
二、实验原理三、实验数据记录及处理1. HCl标准溶液的标定结果2. 混合碱的测量结果大学化学实验报告范文2:实验日期: 20_ 年 11 月 18 日开始时间: 9 时 30 分; 结束时间:11 时 30 分; 实验题目:金属的腐蚀同组者:___编号 NO: 1一、实验目的和要求1) 2) 3) 掌握动电位扫描法测定阳极钝化曲线的方法; 测量金属在0.5mol/L H2SO4 中的阳极极化曲线,确定有关特征电位和电流密度; 测量金属在 0.5mol/L H2SO4+0.5mol/LNaCl 中的阳极极化曲线并考察氯离子对金属钝化行为的影响。
二、实验原理与方法阳极极化曲线一般可分为四个区:1)活性溶解区:从腐蚀电位( ?c )开始,金属溶解按活性溶解的规律进行; 2)过渡区:金属表面开始发生突变,由活态向钝态转化。

(最新版)大学化学实验报告(全)化学原理Ⅱ实验王业飞吕开河葛际江戴彩丽焦翠于连香中国石油大学(华东)石油工程学院2019 年 2 月目录前言..........................................................................................1 实验一三组分相图的制备.............................................................3 实验二最大压差法测表面张力....................................................6 实验三溶胶的制备与电泳............................................................11 实验四无机电解质的聚沉作用与高分子的絮凝作用...........................16 实验五乳状液的制备、鉴别和破坏................................................20 实验六聚丙烯酰胺的合成与水解...................................................24 实验七聚合物分子量的测定---粘度法..........................................26 实验八原油/水界面张力测定(滴体积法).......................................31 实验九聚合物综合性能评价.........................................................33 附录一苯-水的相互溶解度.........................................................35 附录二不同温度下水的密度、粘度和表面张力.................................36 附录三某些液体的密度...............................................................37 附录四不同温度时某些液体的表面张力..........................................38 附录五彼此相互饱和的两种液体的界面张力....................................39 附录六不同温度时水的介电常数...................................................39 附录七 722 型分光光度计 (40)1前言一. 化学原理(Ⅱ)实验的目的化学原理(Ⅱ)实验是化学原理(Ⅱ)课程的重要组成部分,其主要目的有以下四点:1. 了解化学原理(Ⅱ)的研究方法,学习化学原理(Ⅱ)中的某些实验技能,培养根据所学原理设计实验、选择和使用仪器的能力;2. 训练观察现象、正确记录和处理实验数据、运用所学知识综合分析实验结果的能力;3. 验证化学原理(Ⅱ)主要理论的正确性,巩固和加深对这些理论的理解;4. 培养严肃认真的科学态度和严格细致的工作作风。
实验七 堵水剂的制备与性质一、实验目的1. 学会几种堵水剂的制备方法。
2. 掌握几种堵水剂的形成机理及其使用性质。
二、实验原理堵水剂是指从油、水井注入地层,能减少地层产出水的物质。
从油井注入地层的堵水剂称油井堵水剂(或简称堵水剂),从水井注入地层的堵水剂称为调剖剂。
常用的堵水剂有冻胶型堵水剂、凝胶型堵水剂、沉淀型堵水剂和分散体型堵水剂,这些堵水剂的形成机理和使用性质各不相同。
1. 冻胶型堵水剂冻胶(如锆冻胶)是由高分子(如HPAM)溶液转变而来,交联剂(如锆的多核羟桥络离子)可以使高分子间发生交联,形成网络结构,将液体(如水)包在其中,从而使高分子溶液失去流动性,即转变为冻胶。
锆冻胶是油田常用的冻胶型堵水剂。
锆冻胶是由锆的多核羟桥络离子与HPAM 中的羧基发生交联反应而形成的。
体系的pH 值可影响多核羟桥络离子的形成及HPAM 分子中羧基的量,因此,pH 值可影响锆冻胶的成冻时间和冻胶强度。
2. 凝胶型堵水剂凝胶是由溶胶转变而来。
当溶胶由于种种原因(如电解质加入引起溶胶粒子部分失去稳定性而产生有限度聚结)形成网络结构,将液体包在其中,从而使整个体系失去流动性时,即转变为凝胶。
油田堵水中常用的是硅酸凝胶。
硅酸凝胶由硅酸溶胶转化而来,硅酸溶胶由水玻璃(又名硅酸钠,分子式Na2O·mSO2)与活化剂反应生成。
活化剂是指可使水玻璃先变成溶胶而随后又变成凝胶的物质。
盐酸是常用的活化剂,它与水玻璃的反应如下:2222 2 2Na O mSiO HCl H O mSiO NaCl +→+由于制备方法不同,可得两种硅酸溶胶,即酸性硅酸溶胶和碱性硅酸溶胶。
这两种硅酸溶胶都可在一定的条件(如温度、pH 值和硅酸含量)下,在一定时间内胶凝。
评价硅酸凝胶堵水剂常用两个指标,即胶凝时间和凝胶强度。
胶凝时间是指硅酸体系自生成至失去流动性的时间。
凝胶强度是指凝胶单位表面积上所能承受的压力。
3. 沉淀型堵水剂沉淀型堵水剂由两种可反应产生沉淀的物质组成。
中国石油大学油田化学实验报告实验日期: 成绩: 班级: 学号: 姓名: 教师: 王增宝同组者:表面活性剂的性能测定与评价一、实验目的1.了解用指示剂和染料通过显色反应鉴别表面活性剂类型的原理和方法;2.了解离子型表面活性剂克拉夫特点和非离子型表面活性剂浊点的测定方法及不同类型表面活性剂的使用性质;3.学会一种表面活性剂的表面张力的测定原理和方法,并掌握由表面张力计算临界胶束浓度(CMC)的原理和方法,学习Gibbs公示及其应用;4.学会表面活性剂溶液与原油的油水界面张力的测定原理和方法,并掌握超低界面张力在三次采油中的作用原理;5.学会观察表面活性剂溶液与原油混合后的乳化现象;并掌握用不稳定体系数法评价表面活性剂的乳化能力。
二、实验原理表面活性剂分子是由具有亲水性的极性集团和具有憎水性的非极性基团所组成的有机化合物,当它们以低浓度存在于某一体系中时,可被吸附在该体系的表面上,采取极性基团向着水、非极性基团脱离水的表面定向,从而使表面自由能明显降低。
表面活性剂广泛用于石油、纺织、农药、采矿、食品、民用洗涤等各个领域,具有润湿、乳化、洗涤、发泡等重要作用。
1.表面活性剂克拉夫特点和浊点离子型表面活性剂在温度较低时溶解度很小,但随温度升高而逐渐增加,当达到某特定温度时,溶解度急剧陡升,把该温度称为临界溶解温度(又称克拉夫特点)浊点是非离子型表面活性剂的一个特性常数,其受表面活性剂的分子结构和共存物质的影响。
表面活性剂在水溶液中,当温度升到一定值时,溶液出现浑浊。
而不完全溶解的现象,此时该温度称为浊点温度。
2.表面活性剂的表面张力由于静吸引力的作用,处于液体表面的分子倾向于到液体内部来,因此液体表面倾向于收缩。
要扩大面积,就要把内部分子移到表面来,这就要克服静吸引力做功,所做的功转变为表面分子的位能。
单位表面具有的表面能叫表面张力。
在一定温度、压力下纯液体的表面张力是定值。
但在纯液体中加入溶质,表面张力就会发生变化。
普通化学实验报告
实验名称:酸碱中性化反应实验
实验目的:通过酸碱溶液的中性化反应,观察并验证酸碱反应的特点和现象。
实验器材:盛水瓶、试剂瓶、烧杯、酸碱溶液、试管、滴管、指示剂、草纸等。
实验步骤:
1.将盛水瓶中注满蒸馏水,准备一定量的稀酸液A和稀碱液B。
2.分别取2个试管,标记为A和B。
3.用试管A取一定量的稀酸液A,用试管B取一定量的稀碱
液B。
4.向试管A中滴加几滴酸碱指示剂,观察溶液的颜色变化。
5.以滴管逐滴加入试管A中的稀碳酸钠溶液B,同时轻轻搅拌。
6.当溶液颜色出现明显变化时,停止滴加。
7.记录滴加的总体积。
8.重复以上步骤2-7,进行多次实验,取平均值计算。
实验结果:记录每次滴加的碳酸钠溶液体积,计算出每次滴加前后酸溶液和碱溶液的体积变化,根据实验数据可以得出中和反应的化学方程式。
实验数据处理:根据实验结果计算出每次滴加酸溶液与碱溶液的摩尔比例,可以得出实验的平均摩尔比例。
根据摩尔比例和已知酸碱的摩尔数,可以计算出实验中使用的酸碱溶液的浓度。
实验结论:根据实验数据和结果得出酸碱溶液的中和反应符合化学方程式,并根据实验测量的酸碱溶液摩尔比例计算出溶液的浓度。
实验注意事项:
1.实验过程中要注意安全,避免酸碱溶液的直接接触皮肤和眼睛。
2.实验完成后要及时清洗实验器材,防止酸碱溶液残留引起污染。
3.实验时要仔细观察溶液的颜色变化和体积变化,确保实验数
据的准确性。
4.实验前要确保实验器材的干净和无污染,以免影响实验结果。
5.实验完成后要及时整理实验数据和记录实验结果,准备实验
报告。
2017化学专业大学生实习报告范文生产实习是学校为锻炼本科生能力,让我们能更好的与社会相适应而组织的大三本科生的生产实习活动。
接到要去生产实习的通知后,我很高兴,并积极联系,终于将实习地点定在大庆油田水处理与化学研究所。
这是因为:首先,水化室的主要工作是油田水处理,化学剂量开发及检验,和我们的专业有一定的关系;其次,我们的课程当中并未涉及到有关水生细菌的详细知识,在这里进行生产实习可以扩展这方面的知识;我们在实验中所学习的操作方法可以得到应用基于以上几方面的原因,我选择在水处理所开始我的生产实习。
水处理与化学研究所隶属于大庆油田工程设计开发有限公司,原名大庆油田建设设计水处理及油田化学研究室位于黑龙江省大庆市让胡路区油田设计院。
多年来研制出原油破乳剂、油田清防蜡剂、油田防蜡剂、原油降粘剂、原油消泡剂、污水絮凝剂、防垢剂、缓蚀剂等12个系列40余种油田化学剂。
该所现有高中级职称的专业人才32人,博士2人,硕士8人。
xx年通过了国家级计量认证。
同年与哈尔滨工业大学强强联合,成立了哈尔滨工业大学环境科学与工程大庆研发中心。
拥有研究仪器设备100多台,其中进口设备占60%实验室总面积为3000平方米。
微生物实验室,可进行菌种培养驯化分离。
拥有国内规模装备最为先进的三次采油实验室,可进行各种除油及过滤工艺和设备试验可自动合成的高压聚合反应实验室。
由于我的实习时间只有三个星期,故在刘老师的安排下对srb做些认知性的实习,以下为我的主要实习内容大致了解实验室自xx年开始启动的srb抑制课题的一些工艺原理流程硫酸盐还原菌是导致大庆油田地面系统产生硫化物从而造成设备腐蚀、滤料污染等危害的根源;实验室立足于微生物生态抑制,改变以往追求杀灭srb数量的目的,转而以抑制srb活性为目的,是大庆油田系统控制srb危害的新方法,可降低生产运行成本本研究采用的折流板反应器有7个单元格,每个单元格长*宽*高=9.5cm*12cm*42cm,有效体积4.4l,单元格内装1/3高度的活性污泥.反应器上部为排气孔,排气孔的导气管伸到水封瓶液面以下,保持整个系统厌氧状态.水箱中的水通过泵泵入反应器,以推流形式流过各单元格,并从反应器流出。
2017石化实习报告4篇我自xx年10月中旬来河北凯森石化工程有限公司顶岗实习,受到公司各位领导和老师傅的关心和帮助,我能够抓住每一次学习的机会,不怕吃苦,将在学校学到的里理论和现在的实践有机的结合,初步能够做到理论与实践的有机结合,进步很快,使自己对以后的工作和学习更有信心。
在此期间,我先后参加了济南炼油厂的检修和青岛大炼油开工前的准备工作,是我对我们以后的工作环境和工作性质有了更深的了解。
我自xx年10月中旬至xx年12底参加了济南炼油厂的大检修。
我们都被分到班组,和老师傅一起工作,虽然有点累,但学到很多东西。
但是由于在学校对实践的学习相对较少,我们刚进厂时很多东西都没见过,学习起来相对吃力,后来在老师傅的帮助下,大家都进步很快,受到所在班组老师傅的普遍好评,我们的心里有了信心,学习尽头更加高涨,到后来,我们每个人都能独立的干一些的工作。
在此期间,我学会了变送器的安装和调校、调节阀的安装和调校。
变送器的安装及调试在济南炼油厂中,普遍使用的变送器是横河的变送器。
因此对此种变送器的了解相对多一些,eja变送器在安装和使用中有很多注意事项:(一)、eja仪表的安装场所及注意事项保管eja仪表时应注意遵守下列事项,特别是长期保存时。
1、保管场所应满足以下条件:(1)、免遭雨淋。
(2)、很少受冲击和振动。
(3)、满足下列温度、湿度:温度:无内藏指示计-40~85℃带内藏指示计-30~80℃湿度:5~100%rh相对湿度(40℃)最好能保持常温常湿(25℃,65%rh上下)。
2、尽量保持本产品出厂时的原包装状态下保管。
3、保管使用过的产品,应彻底洗净法兰高低压两侧内残留液体。
同时应确认转换部和侧压部是否按要求紧固。
为了长期正确而稳定的使用,应该注意如下几点:1、环境温度安装时尽量避免安装在温度变化大或明显温度的场所。
如果暴露在车间受到热辐射,应采取隔热辐射和通风措施。
2、空气条件安装时避免安装在腐蚀性环境内。
中国石油大学(华东)现代远程教育
实验报告
课程名称:普通化学/化学原理1 实验名称:电解质溶液-同离子效应实验形式:在线模拟+现场实践提交形式:在线提交实验报告学生姓名: _______________ 学号:________________ *
年级专业层次: ________________ 怛
提交时间:________ 年________ 月________ 日
学习“同离子效应(一)、(二)”实验,详见《普通化学》(《化学原理1》)课件中
的"实验教学”-“实验内容”-“电解质溶液”,网址/jpk2013/pthx/fzsy.html ,并回答下面的问题。
一、实验目的
(1)加深对弱电解质的解离平衡、同离子效应、盐类水解等基本概念的理解。
了解缓冲溶液的缓冲作用及
配制。
(2)掌握难溶电解质的多相离子平衡及沉淀的生成和溶解的条件。
____________________ 3 ________________________________________________________________________________________________________________________________ 0.1 mol - dm Na2S溶液,振荡,观察沉淀的颜色变化,解释所观察到的现象。
3 -3
-
试管中加入2滴0.1 mol - dm Pb(NQ)2溶液,再用滴管加入4滴0.1 mol - dm N&SQ溶液,有白色沉淀硫酸铅生成;用电动离心机离心沉降,然后在沉淀中加入8滴0.1 mol - dm-3 KI溶液,振荡,
发现白色沉淀转为黄色沉淀。
再在沉淀物中加入4滴Na2CQ饱和溶液,振荡,发现黄色沉淀转为白色沉淀。
3
-
再用滴管加入4滴0.1 mol - dm NaaS溶液,振荡,发现白色沉淀转为黑色沉淀硫化铅。
3 -3
-
(4) 在三支试管中分别加入5滴0.1 mol - dm MgC2溶液,再逐滴加入2 mol - dm NH水溶液,
_3 、. -3
此时生成的沉淀是什么?然后分别加入 2 mol - dm HCl溶液、固体NHAc和2 mol - dm NaQH溶液,
观察沉淀是否都溶解?解释之。
在三支试管中用滴管分别加入5滴0.1 mol - dm-3 MgC2溶液,再用滴管逐滴加入2 mol - dm-3 NH3
3
-
水溶液,有白色沉淀氢氧化镁生成;用滴管向其中一支试管加入 2 mol - dm HCl溶液,沉淀溶解;用滴
3
-
管向其中另一支试管加入NTAc固体,沉淀溶解;用滴管向最后一支试管中加入 2 mol - dm NaQH沉
淀不溶解。
对比三支试管现象,说明氢氧化镁无酸性。
(5) 在试管中加入2滴0.1 mol - dm-3 CuSQ和2滴0.1 mol - dm-3 N Q S溶液,观察黑色沉淀的生
3
-
成。
离心沉降,弃去清液。
加入10滴6 mol - dm HNQ溶液,微热,沉淀是否溶解?写出反应式。
3 __ 3
用滴管向试管中加入2滴0.1 mol - dm CuSQ,再加入2滴0.1 mol - dm Na?S溶液,有黑色沉淀CuS,
Cu + S = CuS J。
用电动离心机离心沉降,弃去清液,用滴管向试管中加入10滴6 mol - dm-3 HNQ溶液,用酒精灯微
热,沉淀溶解,3CuS+8HN3=3Cu(NQ)2+3S+2NQT +4HQ
五、实验现象及结论
(1)何谓同离子效应?
(2 )盐的水解有哪些类型?试各举一例,并以离子方程式表示。
(3)常见的缓冲溶液有哪几种类型?如何用 1 mol - dm-3 HAc和1 mol - dm-3 NaAc配
3
制100 crn pH = 5的缓冲溶液?
(4)如何用SnCl2配制澄清的SnCl2溶液。
(l)两种含有相同离子的盐(或酸、碱)溶于水时,它们的溶解度(或酸度系数)都会降低,这种现象叫
做同离子效应。
在酸碱平衡和沉淀溶解平衡中都存在同离子效应。
强酸弱碱盐:CuCl 2水解后水溶液呈碱性,水解离子方程式为:Cu2++2Hg T Cu (QH 2+2H
弱酸弱碱盐CHCQQNH电离,阴阳离子都水解。
CHCQQ叶-CHCQOH+
(3)常见的缓冲溶液:常见的缓冲溶液:弱酸及其盐的混合溶液(如HAc与NaAc ),弱碱及其盐的混合溶液(如NH3H2Q与NH4CI)。
在小试管中加入1 cm3 0.l mol dm-3 NH 3水溶液和1滴酚酞指示剂,观察溶液颜色。
再加入少许NH A A C晶体,振荡使其溶解,因同离子效应QH-浓度降低,碱性降低,红色溶
六、思考:
根据Pbl2的溶度积,计算(298K时):
(1)Pbl2在纯水中的溶解度( mol • dm-3);
(2)Pbl2在0.010 mol • dm-3 KI溶液中的溶解度;
(3)Pbl2在0.010 mol • dm-3 Pb(NO 3)2 溶液中的溶解度;
(4)对以上计算结果进行分析、解释。
解:(1) Ksp(Pbl2)=1.39 10-8 Pbl2?Pb2++2l 平衡浓度/mol dm-3 s 2s
••• Ksp(Pbl2)=c(Pb2+).c2(l-) =s.(2s)2 =4s3 =1.39 10-8X v s=1.51 XI0-3 mol dm-3
(2)平衡浓度/mol dm-3 Pbl2?Pb2++2ls 2s+0.010
• Ksp(PbI2)=c(Pb2+).c2(I-) =s.(2s+0.010)2 =1.39 X10-8 •/ s 很小,• 2s+0.010〜0.010 •s=1.39 10-4 mol dm-3
(3)平衡浓度/mol dm-3 • Ksp(PbI2)=c(Pb2+).c2(I-) =(s+0.010).(2s)2 =1.39 10-8 •/s 很小,• s+0.010 〜0.010 • s=5.89 >10-4 mol dm-3 PbI2?Pb2+ + s+0.010 2I2s
(4)计算分析:溶度积的大小反映了物质的溶解能力。
它会受温度的变化以及其他电解质
的溶解影响而改变与弱电解质的离解平衡一样,难溶电解质的溶解平衡也受同离子效应的影响,结果平衡左移溶解度降低
备注:该报告纳入考核,占总评成绩的10%。