2012年高考化学二轮精品复习资料 专题十九 无机推断题突破技巧(同步课件)
- 格式:ppt
- 大小:1.80 MB
- 文档页数:2

突破无机推断题解题障碍的四个技巧无机推断题是一种以元素化合物知识为主,集基本概念、基本理论运用为一体的综合性题目。
这种题型以常见元素及化合物之间的转化为载体,以方框图或其他简明符号给出物质之间的转化关系,考查学生对元素及化合物知识的掌握情况以及灵活运用知识进行分析推理的综合能力。
近几年来,无机推断题在高考中频繁出现,不少同学在解这种题型时存在一定的困难。
这里我将以一道推断题的解题过程集中介绍突破无机推断题常用的四个解题技巧。
【例题】茶是我国人民喜爱的饮品。
某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
(资料:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙[CaC2O4]难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:p H≥13;A1(OH)3:p H≥5.5;Fe(OH)3:p H≥4.1)试根据上述过程及信息填空:(1)步骤②加盐酸的作用是_________________________________________ 。
(2)写出检验Ca2+的离子方程式___________________________。
(3)写出沉淀C所含主要物质的化学式_____________________________(4)写出步骤⑧用A试剂生成血红色溶液的离子方程式_____________________________ (5)步骤⑨的作用是__________________,发生反应的离子方程式______________________________________________(6)猜测步骤⑩的目的是_____________________________________________一、从无到有——教你如何进行资料分析这样一条实验流程型的无机推断题经常会提供一些资料卡。
资料中出现的内容是在解题过程中不可缺少的,这些知识在教科书上没有介绍过,但是基本原理并不复杂,学生可以通过阅读自学掌握。

高三化学二轮专题复习——无机推断知识总结无机推断知识总结一、解题思路和步骤:无机推断题解题思路和步骤:阅读题目一挖掘信息f选择信息一查找突破口一推断整理f得出结论一规范书写★阅读题目:注意限制性语句,专门隐含的条件,找准找全。
★选择信息:将试题信息与大脑或教材知识相比较,进行加工、选择,找岀有用信息。
★查找突破口:突破口这是解题的关键。
突破口能够是反应条件、反应现象、也可能是专门性质(如气体的生成、沉淀的生成、颜色的变化、溶解度、专门反应等)★规范书写的内容:物质的拿称、化学式、结构式、结构简式、电子式、表示物质形成过程的电子表达式、化学方程式、离子方程式、电离方程式。
二、査找突破口需巩固的知识1、物质的特点现象:(1)物质的颜色:有色气体单质:F:、Cl=、03苴他有色单质:Br:(深红色液体,蒸气为红棕色)、L (紫黑色固体)、S (淡黄色固体)、 Cu (紫红色固体)、P(白磷是白色固体,红磷是暗红色固体)、Si (灰黑色晶体)、C (黑色粉未)无色气体单质:%、0:、比有色气体化合物:N0:(红棕色)黄色固体:S、Na©、AgBr (浅黄)、Agl、AgaPOj (黄色)黑色固体:FeO、Fe』:、MnO:、C、CuS、PbS、Ag=S、CuO红色固体:Fe(OH),(红褐色)、FeO (红棕色)、CucO (红色)、Cu (红色)、红磷(暗红〕蓝色固体:五水合硫酸铜(胆矶或蓝矶)CuSO. ・5H:0、Cu(OH)s;绿色固体:七水合硫酸亚铁(绿矶〕FeSO.・7比0:紫黑色固体:KMnOi、碘单质。
有色离子(溶液):Cf (蓝色或绿色)、F』(浅绿)、Fe”(棕黄)、MnO:(紫红色)、Fe(SCN)54(血红色〕、(淀粉遇碘单质(IJ水溶液呈蓝色、 Fe"与苯酚呈紫色)不溶于稀酸的白色沉淀:AgCl、BaSO:、Ag:SO.不溶于稀酸的黄色沉淀:S、AgBr. Agl焰色反应显黄色的是钠元素,显紫色的钾元素(透过蓝色钻玻璃观看)(2)气体特点:常见的气体有:单质:比、Cl=、0=氢化物:讯、H$、HC1.氧化物:CO:、SO:、NO、NO:、CO有机物:CHt、沁 C-Hi. HCHO如能使品红溶液褪色加热又复原红色的气体是S0=; CL能使品红溶液褪色加热不能复原红色:滴有石裁试液的C0:(或SOJ溶液加热后红色变紫色;滴有甲基橙溶液的C0=(或SOJ溶液加热后红色变橙色或黄色等。




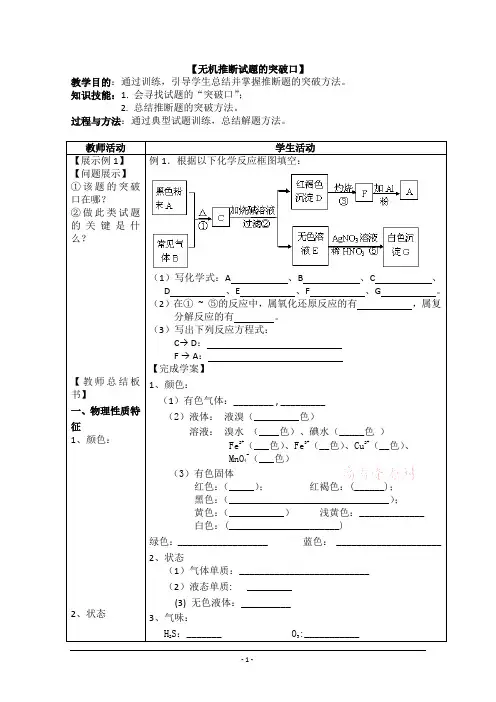
【无机推断试题的突破口】教学目的:通过训练,引导学生总结并掌握推断题的突破方法。
知识技能:1. 会寻找试题的“突破口”;2. 总结推断题的突破方法。
过程与方法:通过典型试题训练,总结解题方法。
灰绿显血红色,加碱出现红褐色沉淀的是:工艺型推断题将磷肥生产中形成的副产物石膏(CaSO 4·2H 2O )转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。
以下在石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO 4·2H 2O 外,还需要 等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: 。
(3)过滤I 操作所得滤液是(NH 4)2SO 4溶液。
检验滤液中含有CO 2-3的方法是: 。
(4)氯化钙结晶水合物(CaSO 4·6H 2O )是目前常用的无机储热材料,选择据是 。
a .熔点较低(29℃熔化)b .能导电c .易溶于水d .无毒(5)上述工艺流程中体现绿色化学理念的是 练习题:1.右图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。
常温下X 是固体,B 和G 是液体,其余均为气体。
根据右图关系推断:(1)化学式:X ,A ,B 。
(2)实验室收集气体D 和F 的方法依次是 法、法。
(3)写出C→E 的化学反应方程式 。
(4)请写出A 与E 反应生成D 的化学方式: 。
2、已知A 、B 、C 均为常见的单质,其中A 为金属,B 、C 为非金属,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。
请回答:(1)若常温下B 、C 均为气体,D 为黑色晶体,A 在周期表中的位置为_________,E 的电子式为_______________,A 和E 在一定条件下反应生成D 的化学方程式为________________________。
(2)若常温下B 为气体,C 为黑色固体,则金属A 的原子结构示意图为______E的结构式为______________,工业上制作机械部件时通常是利用A 的___________(纯金属或合金)。

高三化学二轮专题复习——无机推断知识总结doc高中化学无机推断知识总结一、解题思路和步骤:无机推断题解题思路和步骤:阅读题目一挖掘信息f选择信息一查找突破口一推断整理一得出结论一规范书写★阅读题目:注意限制性语句,专门隐含的条件,找准找全。
★选择信息:将试题信息与大脑或教材知识相比较,进行加工、选择,找出有用信息。
★查找突破口:突破口这是解题的关键。
突破口能够是反应条件、反应现象、也可能是专门性质(如气体的生成、沉淀的生成、颜色的变化、溶解度、专门反应等)★规范书写的内容:物质的名称、化学式、结构式、结构简式、电子式、表示物质形成过程的电子表达式、化学方程式、离子方程式、电离方程式。
二、査找突破口需巩固的知识1、物质的特点现象:(1)物质的颜色:有色气体单质:F:、C1:、03苴他有色单质:B“(深红色液体,蒸气为红棕色)、L (紫黑色固体)、S (淡黄色固体)、Cu (紫红色固体)、P (白磷是白色固体,红磷是暗红色固体)、Si (灰黑色晶体)、C (黑色粉未)无色气体单质:N:、0=、比有色气体化合物:NO:(红棕色)黄色固体:S^ Na:0:% AgBr (浅黄)、Agl、AgjPOi (黄色)黑色固体:FeO、Fe』:、MnO:、C、CuS、PbS、Ag=S、CuO红色固体:Fe(OH),(红褐色)、Fe20,(红棕色)、Cu=0 (红色)、Cu (红色)、红磷(暗红〕蓝色固体:五水合硫酸铜〔胆矶或蓝矶)CuSO, ・5H:0、C U(OH)3;绿色固体:七水合硫酸亚铁(绿矶〕FeSO. - 7H:0:紫黑色固体:KMnO。
、碘单质。
有色离子(溶液1 :Cf (蓝色或绿色)、Ff (浅绿)、Fe”(棕黄)、MnO:(紫红色)、Fe(SC『(血红色〕、〔淀粉遇碘单质(IJ水溶液呈蓝色、Fe”与苯酚呈紫色〕不溶于稀酸的白色沉淀:AgCl、BaSO:、Ag=SO.不溶于稀酸的黄色沉淀:S、AgBr. Agl焰色反应显黄色的是钠元素,显紫色的钾元素(透过蓝色钻玻璃观看)(2)气体特点:常见的气体有:单质:H:、CL、0=氢化物:NH»、H:S、HC1.氧化物:CO:、SO:、NO、NO:、CO有机物:CHt、GHs、CH、HCHO如能使品红溶液褪色加热又复原红色的气体是so:; Cl:能使品红溶液褪色加热不能复原红色:滴有石裁试液的CO:(或SOJ溶液加热后红色变紫色;滴有甲基橙溶液的co=(或SOJ溶液加热后红色变橙色或黄色等。

1.甲、乙、丙是三种常见的单质;A、B、C均是由两种元素组成中学化学中常见的无机物;上述物质间存在如下图所示转化关系(反应条件未注明)。
回答下列问题:(1)若反应①中甲是常见金属,乙是常见非金属固态单质,则A的结构式是,B 的电子式是,C在日常生活中的用途是。
(2)若反应①中甲是常见非金属气态单质,丙是常见金属,甲由短周期元素组成,乙与甲同主族、与丙同周期,且反应①、②、⑤通常在溶液中进行。
请写出下列化学反应的离子方程式:反应①:;反应②:;反应⑤:。
【答案】(1)O=C=O;;用作燃气(2)① 2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;② 2Fe2++Br2=2Fe3++2Br-;⑤Fe+2Fe3+=3Fe2+【解析】(1)根据金属单质和化合物反应产生单质,为Mg和CO2反应生成;(2)根据溶液中反应的特点和非金属单质之间的置换主要考虑卤素之间。
2.下图表示各物质之间的转化关系,其中A、B、C、G为单质。
②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
试回答下列有关问题:(1)M的化学式,Y在实验室中的用途(列举一例)。
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的:。
工业生产中,还常常利用电解X和F的混合物制取。
(3)反应②的化学方程式是___________。
(4)反应④的离子反应方程式是。
【答案】(1)Al2O3;用作干燥剂(2)降低X、Y熔化时的温度,节约能源;Cl2、H2和NaOH(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(4)Al3++3AlO2-+6H2O=4Al(OH)3↓【解析】根据E是一种具有漂白作用的盐,Y易潮解,判断E为Ca(ClO)2,Y为CaCl2,则A和D为氯气和氢氧化钙,F为水,M为氧化铝,L为氢氧化铝。
3.江苏省东临大海,利用海水等可制得多种化工产品。


攻克高考化学推断题一.基于元素周期表的推断1. 元素的基本知识我们将1~20号元素抽出,可以看到,几乎所有的基于元素周期表的推断题,是从这个简单的二十个元素中中衍生出来的。
因此,我们首先要对它们的每一个细节都能烂熟于心,包括元素的符号、名称、具体的位置(周期、族)、原子的基本信息(原子序数、最外层电子数、电子层数、原子结构示意图等)、常见的价态、能形成的离子等等。
解答这一类问题时,我们还应该掌握一些有关元素的基本的特征性的常识。
下面对标有红色字体的元素(单质)的基本特征性知识做一个总结。
1号元素氢:原子半径最小,同位素没有中子,密度最小的气体。
6号元素碳:形成化合物最多的元素,单质有三种常见的同素异形体(金刚石、石墨、富勒烯)。
7号元素氮:空气中含量最多的气体(78%),单质有惰性,化合时价态很多,化肥中的重要元素。
8号元素氧:地壳中含量最多的元素,空气中含量第二多的气体(21%)。
生物体中含量最多的元素,与生命活动关系密切的元素,有两种气态的同素异形体。
9号元素氟:除H外原子半径最小,无正价,不存在含氧酸,氧化性最强的单质。
11号元素钠:短周期元素中原子半径最大,焰色反应为黄色。
12号元素镁:烟火、照明弹中的成分,植物叶绿素中的元素。
13号元素铝:地壳中含量第三多的元素、含量最多的金属,两性的单质(既能与酸又能与碱反应),常温下遇强酸会钝化。
14号元素硅:地壳中含量第二多的元素,半导体工业的支柱。
15号元素磷:有两种常见的同素异形体(白磷、红磷),制造火柴的原料(红磷)、化肥中的重要元素。
16号元素硫:单质为淡黄色固体,能在火山口发现,制造黑火药的原料。
17号元素氯:单质为黄绿色气体,海水中含量最多的元素,氯碱工业的产物之一。
19号元素钾:焰色反应呈紫色(透过蓝色钴玻璃观察),化肥中的重要元素。
20号元素钙:人体内含量最多的矿质元素,骨骼和牙齿中的主要矿质元素。
2. 由基本元素的基本延伸——基本元素间形成的化合物(1)等电子情况请熟记下面的两类特殊的等电子粒子①常见的10电子粒子简单原子或离子:Na+、Mg2+、Al3+、F-分子:CH4、NH3、H2O、HF、Ne复杂离子:NH2- NH4+ H3O+ OH-②常见的18电子粒子简单原子或离子:Ar、K+、Ca2+、Cl-、S2- 分子(氢化物):HCl、H2S、PH3、SH4分子(9+9型):F2、H2O2、N2H4、C2H6、CH3OH、CH3NH2、CH3F、NH2OH复杂离子:HS-注:所谓“9+9型”分子,实际上都是几个9电子的官能团(—OH、—NH2、—CH3、—F)的两两的组合。
高考化学二轮专题训练专题十九无机推断题突破技巧教案(学生版)【无机推断解读】无机推断题是在化学学科的历次高考改革中始终保留的一种基本题型,是高考的热点题型。
它以无机物的结构、性质和相互转化为载体,不仅能全面检查学生对元素及其化合物、物质结构、元素周期律等基础知识的掌握情况,检查学生灵活运用知识的能力,而且能考查学生抽象、求异、发散、收敛,逻辑推理,知识迁移,信息处理等方面的能力,也能很好地与化学实验、计算、基本化学用语,化学基础理论、元素及化合物,有机知识等学科内综合考查,对考生有很好的区分度,预计在今后的理科综合能力考查中,它将依然是化学学科的一种重要题型。
一、无机推断题题型及命题规律无机推断题从试题提供信息的主要方式来看,有阴、阳离子组合推断题、物质转化框图推断题、物质结构推断题等,从能力要求上看,无机物推断已经逐渐从过去的单一考查推理能力转化为对学生的综合能力的考查。
二、无机推断题复习方法和策略。
推断题融元素化合物、基本概念和理论于一体,侧重考查学生思维能力和综合应用能力。
在解无机推断题时,读题、审题相当重要,在读题审题过程中,要认真辩析题干中有关信息,抓住突破口,分析无机推断中的转化关系,仔细推敲,挖掘出隐含条件。
(一)基本思路读题(了解大意)→审题(寻找明显条件、挖掘隐含条件与所求)→解题(抓突破口)→推断(紧扣特征与特殊)→得出结论→正向求证检验读题:读题的主要任务是先了解题目大意,寻找关键词、句,获取表象信息。
切勿看到一点熟悉的背景资料就匆匆答题,轻易下结论,这样很容易落入高考试题中所设的陷阱。
审题:对读题所获信息提炼、加工,寻找明显的或潜在的突破口,更要注意挖掘隐含信息-“题眼”。
“题眼”常是一些特殊的结构、状态、颜色,特殊的反应、反应现象、反应条件和用途等等。
审题最关键的就是找出”题眼”。
解题:找到“题眼”后,就是选择合适的解题方法。
解无机推断题常用的方法有:顺推法、逆推法、综合推理法、假设法、计算法、实验法等。
2012年高考化学大题突破策略1-无机推理题【命题趋势】摒弃了传统的远离真实情境的框图推断题,代之以生产生活中的真实情境为依托,以某个问题为题材,借助于某新材料的制备或应用、物质组成或性质的探究、物质检验或分离的研究等信息设置相关问题,考查学生的逻辑推理能力、信息加工与处理能力、元素化合物知识迁移运用能力。
今年有可能出现无机化合物和有机物相融合的推断题,或“定量分析+推断+小计算”,或离子综合推断等试题。
【突破策略】要关注实验对元素化合物知识的探究和验证功能的指导、以及元素化合物知识在实际生产生活中的应用价值,引导学生关心社会,关心生活,关心科技进展中的各种化学问题,着重培养学生解决实际问题的逻辑思维能力和科学素养,训练结合信息和已有知识书写新的化学方程式的能力。
【例题透析】【例题1】甲同学欲研究某工业废水的治理方案,经过现场观察提出如下假设:废水中可能含有如下离子中的若干种,有的离子浓度可能较大:Fe3+、Al3+、Fe2+、Cu2+、Cl—、CO32-、NO3-、SO42-、SiO32-。
进行了如下实验:Ⅰ.取少量溶液,加入KSCN溶液无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,有红褐色沉淀生成。
过滤,在所得滤液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请推断:(1)该废水中一定不含有的离子是,一定含有的离子是。
请你设计实验方案,检验可能存在的离子。
(2)Ⅱ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)乙同学查阅资料后建议用铝粉除去废水中的NO3-。
过滤Ⅳ中的蓝色沉淀,控制滤液的PH值为10.7左右时,加入铝粉,产生氨气和氮气,且体积比为1︰4,写出该反应的离子方程式。
还原产物是。
若除去0.2mol NO3-,要消耗铝 g(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。