梗阻性黄疸患者血清对人肺微血管内皮细胞肌样分化的影响要点
- 格式:pdf
- 大小:684.86 KB
- 文档页数:4





血液生化全套检查项目及临床意义生化全套检查就是指用生物或化学的方法来对人进行身体检查,生化全套检查内容包括:肝功能(总蛋白、白蛋白、球蛋白、白球比,总胆红素、直接、间接胆红素,转氨酶);血脂(总胆固醇,甘油三酯,高、低密度脂蛋白,载脂蛋白);空腹血糖;肾功能(肌酐、尿素氮);尿酸;乳酸脱氢酶;肌酸肌酶等。
不同的医院,生化全套检查的项目会有差别,但大致的项目不会相差太大。
生化全套检查用途1、用于常规体检普查2、疾病的筛查和确证试验生化全套检查是对身体进行一次全面的检查和对身体情况的一种了解,有时也可以检查出来潜伏的疾病,如乙肝病毒携带者就需要定期的检查,如肝功能检查,防止病情突然发作,及时进行治疗。
生化全套检查项目1.血清丙氨酸氨基转移酶(ALT或GPT)升高:常见于急慢性肝炎、药物性肝损害、脂肪肝、肝硬化、心肌梗塞、心肌炎及胆道疾病等。
2.血清天冬氨酸氨基转移酶(AST或GOT)升高:常见于心肌梗塞发病期、急慢性肝炎、中毒性肝炎、心功能不全、皮肌炎等。
3.血清总蛋白增高:常见于高度脱水症(如腹泻,呕吐,休克,高热)及多发性骨髓瘤。
降低:常见于恶性肿瘤,重症结核,营养及吸收障碍,肝硬化、肾病综合征,溃疡性结肠炎,烧伤,失血等。
4.血清白蛋白增高:常见于严重失水导致血浆浓缩,使白蛋白浓度上升。
降低:基本与总蛋白相同,特别是肝脏病,肾脏疾病更为明显。
5.血清碱性磷酸酶(ALP)升高:常见于肝癌、肝硬化、阻塞性黄疸、急慢性黄疸型肝炎、骨细胞瘤、骨转移癌、骨折恢复期。
另外,少年儿童在生长发育期骨胳系统活跃,可使ALP增高。
注意:使用不同绶冲液,结果可出现明显差异。
6.血清r-谷氨酰基转移酶(GGT或r-GT)升高:常见于原发性或转移性肝癌、急性肝炎、慢性肝炎活动期肝硬化、急性胰腺炎及心力衰竭等。
7.血清总胆红素增高:肝脏疾病,肝外疾病,原发性胆汁性肝硬化溶血性黄疸急性黄疸性肝炎新生儿黄疸慢性活动期肝炎闭塞性黄疸病毒性肝炎胆石症阻塞性黄疸胰头癌肝硬化输血错误8.血清直接胆红素增高:常见于阻塞性黄疸,肝癌,胰头癌,胆石症等。
•临床评价-低剂量普通肝素用于ECMO辅助支持患者抗凝治疗的系统评价黄晓嫡,赵红卫,马永成,杜鹏强,倪铭,王爱凤(阜外华中心血管病医院药学部,河南郑州450000)[摘要]目的:系统评价低剂量普通肝素(UFH)用于体外膜肺氧合(ECMO)辅助支持患者的抗凝治疗。
方法:计算机检索PubMed、EMbase、Cochrane Library、CNKI、维普、万方和CBM数据库,纳入低剂量UFH用于ECMO辅助支持患者抗凝的回顾性队列研究。
根据NOS量表对纳入研究的质量进行评价。
采用RevMan5.3软件进行Meta分析。
结果:共计纳入5篇文献,包括469例患者,试验组(UFH低剂量)215例,对照组(UFH常规剂量)254例。
NOS评分为7~9分。
Meta分析结果显示,试验组和对照组的ECMO血管插管部位出血发生率分别为15.22%和40.74%,胃肠出血发生率分别为7.32%和14.62%,差异均有统计学意义(P<0.05);与对照组相比,试验组的压缩红细胞(PRBC)平均输注单位显著减少(P<0.01)o两组的手术部位出血、肺出血、颅内出血、血栓形成、ECMO撤机以及在院死亡率均无统计学差异(P>0.05)□结论:对于ECMO辅助支持患者,UFH调低剂量可减少ECMO血管插管部位和胃肠等部分出血事件,降低PRBC平均输注单位。
且尚无证据表明,调低UFH剂量会增加患者的血栓形成,延缓ECMO撤机,甚至提高在院死亡率。
受纳入研究质量及数量的限制,研究结果仍需更多大样本、高质量的研究加以验证。
[关键词]普通肝素;低剂量;体外膜肺氧合;抗凝;系统评价[中图分类号]R973+.2[文献标识码]A[文章编号]1672-8157(2020)06-0355-05Systematic review of the anticoagulant regimen of low-dose unfractioned heparin for patients on ECMOHUANG Xiao-jing,ZHAO Hong-wei,MA Yong-cheng,DU Peng-qiang,NI Ming,WANG A.i-feng(pepartment of Pharmacy,Fuwai Central China Cardiovascular Hospital,Zhengzhou450000,China)[ABSTRACT]Objective:To systematically review the anticoagulant regimen of low-dose unfractioned heparin(UFH)for patients on extracorporeal membrane oxygenation(ECMO).Methods:Databases including PubMed,EMbase,Cochrane Library, CNKI,VH\Wanfang and CBMdisc were searched for retrospective cohort studies about low-dose UFH used for patients on ECMO. Newcastle-Ottawa Scale(NOS)was used to evaluate the quality of the included studies.Meta-analysis was conducted by RevMan 5.3software.Results:A total of5cohort studies with a NOS score of7-9and469patients were included.There were215patients in experimental group(low-dose of UFH)and254patients in control group(routine dose of UFH).Results of meta-analysis showed that the rates of ECMO cannula site bleeding in experimental group and control group were15.22%and40.74%respectively,rates of gastrointestmal bleeding in the two groups were7.32%and14.62%respectively.There were significant dififerences between them(P <0.05).Compared with the control group,mean transfusion units of packed red blood cell(PRBC)markedly declined(P<0.01) in experimental group.Meanwhile,there were no statistical differences in rates of surgical site bleeding,pulmonary bleeding,cerebral bleeding,thrombosis,weaning of ECMO and in-hospital mortality between the two groups(P>0.05).Conclusion:For the patients on ECMO,low-dose UFH might help reduce the rates of cannula site bleeding,gastrointestinal bleeding,mean transfusion units of PRBC and had no influences on thrombosis,weaning of ECMO and the in-hospital mortality,which should be further proved by more studies with high quality due to the limitation of the quality and quantity of cohort studies involved in this study.[KEY WORDS]Unfractioned heparin;Low dose;Extracorporeal membrane oxygenation;Anticoagulation;Systematic review体外膜肺氧合(extracorporeal membrane[基金项目]吴阶平医学基金会临床药学专项基金(3206750190904)[通信作者]王爱凤,女,主任药师,研究方向:医院药学。
恶性梗阻性黄疸的治疗现状与进展作者:欧盛秋马亦龙来源:《中外医疗》 2014年第18期欧盛秋马亦龙广西医科大学附属肿瘤医院介入治疗科,广西南宁 530021[摘要] 在临床各类疾病中,恶性梗阻性黄疸是其中治疗难度较高的一种,且会对患者身体造成严重损害。
恶性梗阻性黄疸发病率以及致死率在近年来逐渐上升,并逐步为临床所关注。
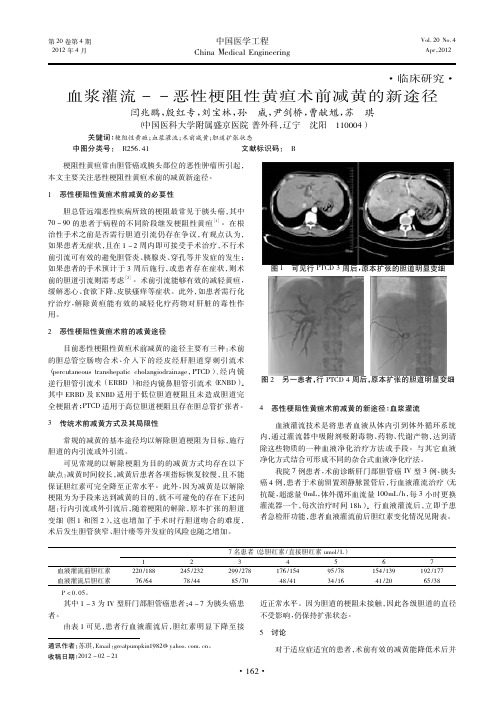
恶性梗阻性黄疸治疗方案较多,主要包括经皮肝穿刺胆道引流(PTCD)、经内镜逆行性胰胆管造影术(ERCP),以及基于此衍生出的其他新型治疗方案。
该研究概述了恶性梗阻性黄疸的治疗现状,对各种治疗方法的特点、优势、不足和进展进行了探讨,以期有所帮助。
[关键词] 恶性梗阻性黄疸;经皮肝穿刺胆道引流;经内镜逆行性胰胆管造影术;治疗[中图分类号] R575[文献标识码] A[文章编号] 1674-0742(2014)06(c)-0197-02[作者简介] 欧盛秋(1972.1-),男,广西合浦人,医学硕士,副主任医师,研究方向:肿瘤介入治疗专业。
恶性梗阻性黄疸(malignant obstructive jaundice, MOJ)多因肝癌、胆管癌、转移性癌以及胰腺癌对左右肝管主干、肝总管以及胆总管造成压迫或者侵犯,引发胆管狭窄,最终导致肝功能损害、胆汁淤积的一系列症状,在临床各类难治性疾病中属于较为常见的一种,往往会对患者机体造成严重损害[1]。
据相关研究发现[2],恶性梗阻性黄疸患者中,能够接受姑息性引流治疗者约为80%,剩余患者即便可以接受根治性手术治疗,5年生存率也极为低下,据统计为5%~8%。
基于此,该研究对恶性梗阻性黄疸的治疗现状与进展做一综述如下,希望为临床诊治恶性梗阻性黄疸有所指导。
1 患者机体病理生理受恶性梗阻性黄疸的影响分析对于恶性梗阻性黄疸患者而言,其通常伴有凝血功能障碍、继发性感染、肝肾功能受损以及免疫功能障碍,若缺乏及时救治,患者往往会因癌肿广泛转移而死亡,或者因病情恶化导致全身性病理生理损害,最终丧失生存机会。
㊃重症医学㊃梗阻性黄疸患者血清对人肺微血管内皮细胞肌样分化的影响陈啟炜㊀杨勇㊀陈兵㊀陈杨㊀李胜㊀王桂兰㊀吴玉龙㊀陈崇会㊀祖宝利㊀易斌鲁开智㊀廖林401420㊀重庆市綦江区人民医院麻醉科(陈啟炜㊁李胜㊁王桂兰㊁吴玉龙㊁陈崇会㊁廖林);400038㊀重庆市,第三军医大学附属西南医院麻醉科(杨勇㊁陈兵㊁陈杨㊁祖宝利㊁易斌㊁鲁开智)通信作者:廖林,Email:liaolinmz@sina.comDOI:10.3760∕cma.j.issn.0254⁃1416.2016.09.027ʌ摘要ɔ㊀目的㊀评价梗阻性黄疸患者血清对人肺微血管内皮细胞(PMVECs)肌样分化的影响㊂方法㊀分离人PMVECs,并传代培养,将培养的人PMVECs分别采用梗阻性黄疸患者血清和健康志愿者血清孵育,于孵育24㊁48和72h(T1 3)时在倒置显微镜下观察原代PMVECs形态,采用Westernblot法检测PMVECs肌性蛋白(α⁃SMA㊁SM⁃MHC㊁capolnin)的表达㊂结果㊀健康志愿者血清孵育PM⁃VECscalponin㊁α⁃SMA蛋白表达阴性,出现少量SM⁃MHC表达,梗阻性黄疸患者血清孵育PMVECscalponin㊁α⁃SMA和SM⁃MHC表达阳性㊂与健康志愿者血清比较,梗阻性患者黄疸血清孵育PMVECsSM⁃MHC表达上调(P<0.05);与T1时比较,T2,3时梗阻性黄疸血清孵育PMVECscalponin㊁α⁃SMA和SM⁃MHC表达上调(P<0.05);与T2时比较,T3时梗阻性黄疸患者血清孵育PMVECscalponin㊁α⁃SMA和SM⁃MHC表达上调(P<0.05)㊂结论㊀梗阻性黄疸患者血清促进PMVECs肌样分化,可能是肺微血管扩张机制之一㊂ʌ关键词ɔ㊀黄疸,阻塞性;㊀血清;㊀肺;㊀内皮,血管;㊀细胞分化基金项目:国家自然科学基金(81170053,81170414)Effectofserumofpatientswithobstructivejaundiceonmyogenicdifferentiationofhumanpulmona⁃rymicrovascularendothelialcells㊀ChenQiwei,YangYong,ChenBing,ChenYang,LiSheng,WangGuilan,WuYulong,ChenChonghui,ZuBaoli,YiBin,LuKaizhi,LiaoLinDepartmentofAnesthesiology,QijiangDistrictPeopleᶄsHospital,Chongqing401420,China(ChenQW,LiS,WangGL,WuYL,ChenCH,LiaoL);DepartmentofAnesthesiology,SouthwestHospital,ThirdMilitaryMedicalUniversity,Chongqing400038,China(YangY,ChenB,ChenY,ZuBL,YiB,LuKZ)Correspondingauthor:LiaoLin,Email:liaolinmz@sina.comʌAbstractɔ㊀Objective㊀Toevaluatetheeffectsoftheserumofpatientswithobstructivejaundiceonmyogenicdifferentiationofhumanpulmonarymicrovascularendothelialcells(PMVECs).Methods㊀Hu⁃manPMVECswereisolatedandthensubcultured.TheculturedPMVECswereincubatedwiththeserumofpatientswithobstructivejaundiceorwiththeserumofhealthyvolunteers.At24,48and72hofincubation(T1⁃3),theinvertedmicroscopewasusedtoobservethemorphologyofprimaryPMVECs.Theexpressionofmuscularproteins(alpha⁃smoothmuscleactin[α⁃SMA],smoothmuscle⁃mysionheavychain[SM⁃MHC],capolnin)inPMVECswasdetectedusingWesternblotanalysis.Results㊀Theexpressionofcal⁃poninandα⁃SMAwasnegative,andafewSM⁃MHCproteinswereexpressedwhenPMVECswereincubatedwiththeserumofhealthyvolunteers;theexpressionofcalponin,α⁃SMAandSM⁃MHCwaspositivewhenPMVECswereincubatedwiththeserumofpatientswithobstructivejaundice.Comparedwiththeserumof万方数据healthyvolunteers,theexpressionofSM⁃MHCwassignificantlyup⁃regulatedwhenPMVECswereincubatedwiththeserumofpatientswithobstructivejaundice(P<0.05).Theexpressionofcalponin,α⁃SMAandSM⁃MHCwassignificantlyup⁃regulatedatT2,3comparedwiththatatT1,andatT3comparedwiththatatT2whenPMVECswereincubatedwiththeserumofpatientswithobstructivejaundice(P<0.05).Conclusion㊀TheserumofpatientswithobstructivejaundicepromotesmyogenicdifferentiationofhumanPMVECs,whichisprobablyoneofthemechanismsunderlyingintrapulmonarymicrovasculardilatation.ʌKeywordsɔ㊀Jaundice,obstructive;㊀Serum;㊀Lung;㊀Endothelium,vascular;㊀Celldifferentia⁃tionFundprogram:NationalNaturalScienceFoundationofChina(81170053,81170414)㊀㊀肝肺综合征是一种由严重肝病导致的肺血管疾病,主要表现为:肺内微血管扩张㊁气体交换障碍㊁动脉血氧和作用异常,在肝硬化患者中发病率高达30%,也可导致围术期肝移植无功能和术后病死率的增加[1⁃3]㊂肺血管重塑可能是其主要发病机制之一[4⁃5]㊂肺微血管内皮细胞(PMVECs)和肺动脉平滑肌细胞(PASMCs)在肺血管重塑的形成过程中起到很重要的作用[6⁃7]㊂对肺血管重塑的病理生理及分子机制的研究主要为动物实验[8⁃9]㊂本研究拟评价梗阻性黄疸患者血清对人PMVECs肌样分化的影响,对肺源性肺血管重塑的研究提供参考㊂材料与方法材料和主要试剂㊀优等胎牛血清(Gibco公司,美国),青霉素⁃链霉素溶液和兔streptavidin⁃HRP试剂盒(带DAB试剂盒,碧云天生物技术研究所),0.01mol∕LPBS(北京中杉金桥生物技术公司),低糖DMEM(Hyclone公司,美国),EDTA㊃2Na和胰蛋白酶(Amresco公司,美国),兔抗人Ⅷ因子相关抗原多克隆抗体和兔抗大鼠CD34多克隆抗体(SantaCruz公司,美国),FITC标记植物凝集素BSI(Sigma公司,美国),TritonX⁃100(北京索莱宝科技有限公司),平滑肌⁃α⁃肌动蛋白(α⁃SMA)和calponin单克隆抗体(Abcam公司,英国),GAPDH一抗(武汉博士德生物工程有限公司),HRP二抗(武汉博士德生物工程有限公司),FITC标记山羊抗兔IgG和DA⁃PI㊁抗荧光淬灭封片液(上海碧云天生物技术公司),生物安全操作柜㊁CO2细胞培养箱㊁振荡器(ThermoFisher公司,美国),低温离心机(Eppendorf公司,德国),电控恒温水浴箱(天津市泰斯特有限公司),BX51荧光显微镜(Olympus公司,日本)㊂人PMVECs的分离与培养㊀人肺组织取自第三军医大学附属第一医院,在获得患者知情并同意的情况下取良性病变肺叶切除的患者,无内分泌㊁血液㊁生殖等疾病,无菌条件下取胸膜下肺组织,切成约1mmˑ1mmˑ1mm大小的组织碎片,采用无血清DMEM培养基洗涤,贴入预先用明胶包被的培养瓶中,加入配置好的DMEM培养液∕胎牛血清(4ʒ1)4ml,置于37ħCO2孵箱静置培养(动作轻柔以避免组织块漂浮)㊂于倒置显微镜下观察,见有细胞从组织块边缘游离后即可吸除组织块,一般在3d后,继续培养,每3d换液培养㊂细胞铺满至培养瓶85%以上时,用EDTA和已配胰蛋白酶1ʒ1混合消化液进行消化,按1ʒ2比例进行传代㊂鉴定原代培养的人PMVECs㊀形态学观察:倒置显微镜下观察细胞形态变化㊂其他实验:(1)植物凝集素BSI结合实验:采用2代细胞进行实验,先将贴壁细胞制备成细胞悬液,接种,加入DMEM∕胎牛血清混合液培养(4ʒ1),待细胞贴壁生长后进行细胞鉴定,PBS洗涤细胞爬片3次ˑ5min;用0.1%TritonX⁃100覆盖细胞浸润15min;于细胞爬片上滴加内源性过氧化物酶封闭液,室温下孵育10min;湿盒内PBS充分洗3次ˑ5min;适量滴加封闭用正常羊血清工作液,孵育10min(室温),勿洗;FITC⁃BSI(25μg∕ml)滴加细胞爬片;室温下避光孵育30min;PBS漂洗3次ˑ3min;用缓冲甘油(50%)封片置荧光显微镜下观察FITC⁃BSI结合情况;(2)Ⅷ因子相关抗原免疫细胞化学染色,细胞爬片处理同上;滴加100μl兔抗人Ⅷ因子相关抗原多克隆抗体(1ʒ50),4ħ冰箱孵育过夜;PBS平衡液洗涤3次,每次5min;适量滴加生物素标记羊抗兔二抗工作液,孵育10min(室温),用PBS平衡液洗涤细胞爬片3次,每次5min;适量滴加HRP标记的链霉亲和素,孵育10min(室温)后用PBS充分冲洗;DAB显色:根据需要,将试剂A和试剂B以1ʒ19的比例混匀后滴加在细胞爬片上,显色完全后用自来水冲洗终止;用苏木素进行复染40s,蒸馏水再次冲洗;室温下进行封片,观察并拍照㊂(3)CD34免疫细胞化学染色(步骤同Ⅷ因子相关抗原免疫细胞化学染色)㊂血清的收集㊀选择梗阻性黄疸患者10例和健康志愿者10名,并获得其知情同意(伦理注册号:ChiCTR⁃OCH⁃12002128)㊂梗阻性黄疸患者年龄万方数据18 60岁,性别不限,结合胆红素102.6 252.2μmol∕L,总胆红素171 342μmol∕L,结合胆红素∕总胆红素比值50% 70%,尿胆红素阳性,尿胆原阴性;谷丙转氨酶40 200U∕L,谷草转氨酶40 200U∕L,碱性磷酸酶200 800U∕L,γ⁃谷氨酰转移酶100 800,阻塞性脂蛋白X300 800g∕L,有梗阻近端胆管扩张的表现(B超㊁CT㊁MRI或MRCP等影像学检查)㊂采血前禁食12h,避免剧烈运动,采血前4h禁茶㊁咖啡和酒,于肘静脉处采血,收集静脉血样约5ml,置37ħ保温1h,然后于3000转∕min,4ħ离心15min(离心半径4cm),在无菌生物安全操作柜下,取上清,经无菌过滤器获取血清约2ml,置于-80ħ冰箱保存待用㊂Westernblot法检测人PMVECs肌性蛋白(cal⁃ponin㊁α⁃SMA和SM⁃MHC)的表达㊀将消化后人PMVECs等份接种于培养瓶内,待细胞长到培养瓶底部面积80%作用,分别加入含10%梗阻性黄疸患者血清或健康志愿者血清的DMEM培养基,孵育24㊁48和72h(T1 3)后随机取不同时点2组细胞3瓶,弃掉上清,在冰上加入蛋白裂解液进行裂解,12000ˑg离心10min,取上清并用分光光度计定量㊂取30μg蛋白进行电泳后开始转膜(恒压12V,转膜60min),转好的PVDF膜浸入含5%脱脂奶粉的溶液封闭2h,4ħ冰箱封闭过夜,分别加入兔抗大鼠α⁃SMA一抗(1ʒ1000)㊁兔抗大鼠calponin一抗(1ʒ20000)孵育过夜,取出PVDF膜,用TBST洗膜3次,将膜置于二氨基联苯胺显色液中显色,出现清洗条带时用清水终止反应,图像分析仪定量分析蛋白的表达水平㊂统计学处理㊀采用GraphpadPrism统计学软件进行分析,正态分布的计量资料以均数ʃ标准差(xʃs)表示,2种血清孵育后各指标的比较采用成组t检验,不同时点各指标比较采用单因素方差分析,P<0.05为差异有统计学意义㊂结㊀㊀果在倒置显微镜下观察原代培养的人PMVECs,单层贴壁生长,状如短梭形或类圆形,大小均匀,胞浆丰富,胞核清晰,呈卵圆形㊂通过植物凝集素BSI结合实验㊁Ⅷ因子相关抗原免疫细胞化学染色和CD34免疫细胞化学染色鉴定为PMVECs㊂健康志愿者血清刺激细胞在倒置显微镜下单层贴壁生长,状如梭形或三角形,呈鹅软石镶嵌状排列,胞核清晰,胞浆丰富,呈卵圆形;实验组培养细胞呈长梭状排列,核呈杆状或椭圆状㊂健康志愿者血清孵育PMVECscalponin㊁α⁃SMA蛋白表达阴性,出现少量SM⁃MHC表达;梗阻性黄疸患者血清孵育PMVECscalponin㊁α⁃SMA和SM⁃MHC表达阳性㊂与健康志愿者血清比较,梗阻性患者黄疸血清孵育PMVECsSM⁃MHC表达上调(P<0.05);与T1时比较,T2,3时梗阻性黄疸血清孵育PM⁃VECscalponin㊁α⁃SMA和SM⁃MHC表达上调(P<0.05);与T2时比较,T3时梗阻性黄疸患者血清孵育PMVECscalponin㊁α⁃SMA和SM⁃MHC表达上调(P<0.05)㊂见表1㊂表1㊀两组人PMVECscalponin㊁α⁃SMA和SM⁃MHC表达的比较(n=3)血清种类指标T1T2T3健康志愿者血清calponin12.1ʃ2.115.7ʃ3.413.1ʃ2.5梗阻性黄疸患者血清26.5ʃ5.1a35.7ʃ3.9ab46.1ʃ4.7abc健康志愿者血清α⁃SMA22.1ʃ2.516.8ʃ1.925.4ʃ2.9梗阻性黄疸患者血清43.2ʃ4.8a54.4ʃ4.1ab76.4ʃ6.4abc健康志愿者血清SM⁃MHC7.2ʃ1.39.8ʃ1.510.1ʃ1.6梗阻性黄疸患者血清7.6ʃ1.710.6ʃ1.5ab13.4ʃ1.7abc㊀㊀注:与健康志愿者血清比较,aP<0.05㊀与T1时比较,P<0.05㊀与T2时比较,P<0.05讨㊀㊀论肝肺综合征的主要病理改变是肺微血管的扩张,扩张血管导致血红蛋白的氧合困难,并进一步加重了低氧血症[10]㊂梗阻性黄疸患者血清可增强人PASMCs增殖和迁移能力,并促进其向合成表型的转换㊂微血管的重要构成细胞为肺微血管内皮细胞㊂肺微血管扩张主要是由PMVECs异常增殖㊁肌样分化引起[11]㊂在肝肺综合征的患者中,主要是由慢性肝病导致多种细胞因子(内毒素㊁内皮素⁃1㊁CO㊁NO和TNF⁃α等)来通过血液循环作用于PM⁃VECs,进而引起其发生异常增殖和肌样分化㊂临床中采集的梗阻性黄疸患者的血清可很好模拟肝肺综合征患者的内环境㊂本研究采用梗阻性黄疸患者血清刺激离体后培养的PMVECs,并在倒置显微镜下观察细胞形态及Westernblot法检测PMVECs肌样分化的情况㊂常用肌样分化的标志性蛋白calponin㊁α⁃SMA和SM⁃MHC,经常用于内皮细胞及成纤维细胞的肌样分化检测㊂本研究结果显示,与正常人血清比较,梗阻性黄疸血清孵育PMVECs形态出现了变化,呈长梭状样排列,核呈杆状或椭圆状,而正常人血清孵育PMVECs呈梭形或多角形,单层性贴壁生长,呈万方数据铺路石样 的排列,大小均匀,胞核清晰,呈卵圆形且胞浆丰富㊂Westernblot结果提示:健康志愿者血清孵育PMVECscalponin㊁α⁃SMA蛋白表达阴性,出现少量SM⁃MHC表达,梗阻性黄疸患者血清孵育PMVECscalponin㊁α⁃SMA和SM⁃MHC蛋白表达阳性;与健康志愿者血清比较,梗阻性患者黄疸血清孵育PMVECsSM⁃MHC表达上调;与T1时比较,T2,3时梗阻性黄疸血清孵育PMVECscalponin㊁α⁃SMA和SM⁃MHC表达上调;与T2时比较,T3时梗阻性黄疸患者血清孵育PMVECscalponin㊁α⁃SMA和SM⁃MHC表达上调㊂这与本研究前期动物实验结果[12]存在一定差异,即梗阻性黄疸患者血清导致的PMVECs肌样分化标志蛋白表达在T2时已达到平台期,其后表达维持在较高水平,但并未显著增加,其具体原因尚待进一步明确㊂综上所述,梗阻性黄疸患者血清促进PMVECs肌样分化,可能是肺微血管扩张机制之一㊂参㊀考㊀文㊀献[1]㊀SpagnoloP,ZeuzemS,RicheldiL,etal.Thecomplexinter⁃relationshipsbetweenchroniclungandliverdisease:areview[J].JViralHepat,2010,17(6):381⁃390.DOI:10.1111∕j.1365⁃2893.2010.01307.x.[2]㊀MagantyK,GhantaR,BejaranoP,etal.Livertransplantationforhepatopulmonarysyndromeduetononcirrhoticportalhyper⁃tension[J].TransplantProc,2011,43(7):2814⁃2816.DOI:10.1016∕j.transproceed.2011.07.003.[3]㊀MorikawaN,HonnaT,KurodaT,etal.Resolutionofhepa⁃topulmonarysyndromeafterligationofaportosystemicshuntinapediatricpatientwithanAbernethymalformation[J].JPediatrSurg,2008,43(2):e35⁃e38.DOI:10.1016∕j.jpedsurg.2007.11.001.[4]㊀ZengJ,YiB,WangZ,etal.EffectofannexinA2onhepatop⁃ulmonarysyndromeratserum⁃inducedproliferationofpulmonaryarterialsmoothmusclecells[J].RespirPhysiolNeurobiol,2013,185(2):332⁃338.DOI:10.1016∕j.resp.2012.09.009.[5]㊀AldenkorttF,AldenkorttM,CaviezelL,etal.Portopulmonaryhypertensionandhepatopulmonarysyndrome[J].WorldJGas⁃troenterol,2014,20(25):8072⁃8081.DOI:10.3748∕wjg.v20.i25.8072.[6]㊀HaganN,Ben⁃ZviA.Themolecular,cellular,andmorpholog⁃icalcomponentsofblood⁃brainbarrierdevelopmentduringembry⁃ogenesis[J].SeminCellDevBiol,2015,38:7⁃15.DOI:10.1016∕j.semcdb.2014.12.006.[7]㊀FonsP,Gueguen⁃DorbesG,HeraultJP,etal.Tumorvascula⁃tureisregulatedbyFGF∕FGFRsignaling⁃mediatedangiogenesisandbonemarrow⁃derivedcellrecruitment:Thismechanismisin⁃hibitedbySSR128129E,thefirstallostericantagonistofFGFRs[J].JCellPhysiol,2015,230(1):43⁃51.DOI:10.1002∕jcp.24656.[8]㊀MartisN,PomaresC,JeandelPY,etal.Hepatopulmonarysyndromeassociatedwithvisceralleishmaniasis[J].ImmunolRes,2015,61(1⁃2):169⁃171.DOI:10.1007∕s12026⁃014⁃8592⁃2.[9]㊀BloomS,KempW,LubelJ.Portalhypertension:Pathophysi⁃ology,diagnosisandmanagement[J].InternMedJ,2015,45(1):16⁃26.DOI:10.1111∕imj.12590.[10]㊀DeQueirosAS,BrandaoSC,MacedoLG,etal.Evaluationofnormalityandreproducibilityparametersofscintigraphywith99mTc⁃MAAinthediagnosisofintrapulmonaryvasculardilata⁃tions[J].AnnNuclMed,2014,29(1):46⁃51.DOI:10.1007∕s12149⁃014⁃0915⁃9.[11]㊀YiB,ZengJ,WangG,etal.AnnexinA1proteinregulatestheexpressionofPMVECcytoskeletalproteinsinCBDLratserum⁃in⁃ducedpulmonarymicrovascularremodeling[J].JTranslMed,2013,11:98.DOI:10.1186∕1479⁃5876⁃11⁃98.[12]㊀王芝,易斌,国斌,等.肝肺综合征大鼠肺微血管内皮细胞肌样分化时转化生长因子β1表达的变化[J].中华麻醉学杂志,2011,31(7):862⁃864.DOI:10.3760∕cma.j.issn.0254⁃1416.WangZ,YiB,GuoB,etal.Theexpressionoftransforminggrowthfactorbeta1indifferentiatedpulmonarymicrovascularen⁃dothelialcellofhepatopulmonarysyndromerat[J].ChinJAnes⁃thesiol,2011,31(7):862⁃864.DOI:10.3760∕cma.j.issn.0254⁃1416.(收稿日期:2016⁃01⁃06)(本文编辑:葛胜辉)更㊀㊀正本刊2016年第36卷第6期693页发表的文章‘富氢液对神经病理性痛大鼠脊髓神经细胞自噬的影响“,作者单位更正如下:300052㊀天津医科大学总医院麻醉科[王慧星(现在天津医科大学第二医院疼痛治疗中心工作)㊁于泳浩㊁陈红光㊁陈亚军㊁何颖㊁王小波];天津医科大学第二医院疼痛治疗中心(史可梅),通信作者:于泳浩,Email:yuyonghao@126.com㊂本刊编辑部万方数据。