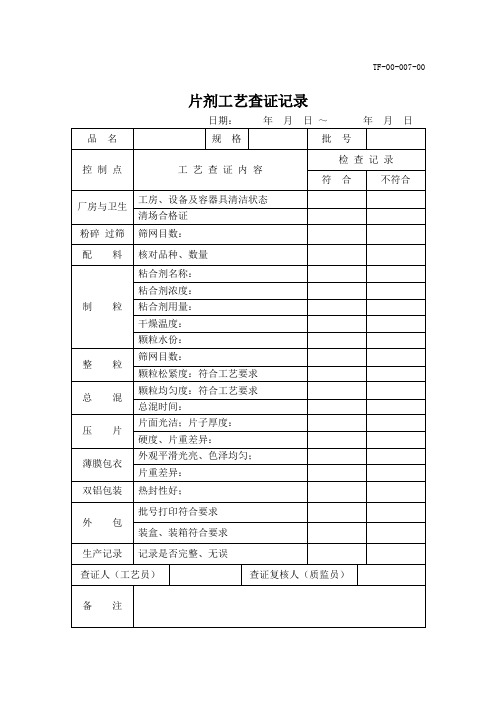
药物制剂的工艺查证记录
- 格式:docx
- 大小:16.81 KB
- 文档页数:4
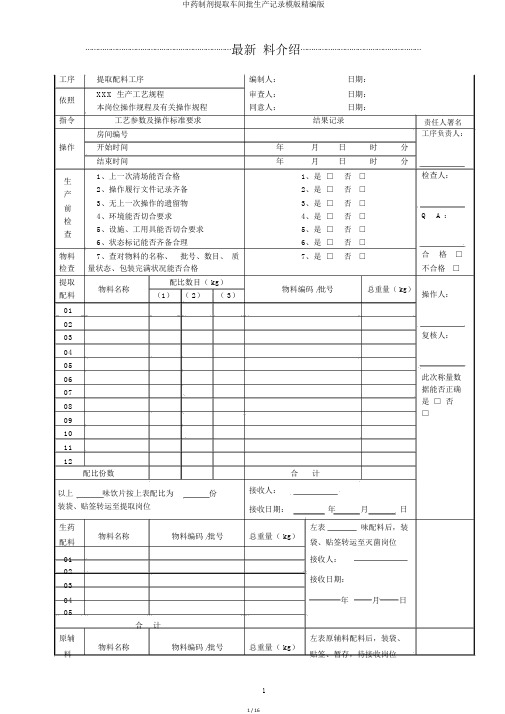
⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯工序提取配料工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录房间编号操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格提取物料名称配比数目( kg)物料编码 /批号总重量( kg)配料(1)( 2)( 3)010203040506070809101112配比份数合计以上味饮片按上表配比为份接收人:装袋、贴签转运至提取岗位接收日期:年月日生药物料名称物料编码 /批号总重量( kg)左表味配料后,装配料袋、贴签转运至灭菌岗位01 接收人:02接收日期:0304 年月日05合计原辅左表原辅料配料后,装袋、责任人署名工序负责人:检查人:Q A :合格□不合格□操作人:复核人:此次称量数据能否正确是□ 否□⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯01 使用02 接收人:03接收日期:0405 年月日合计指令工艺参数及操作标准要求结果记录责任人署名1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A :场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□领料单粘贴处:工序水提工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格提取设施名称:QA 确认本罐投料能否正确无误并署名( X )设施编号:是□否□投饮片名称投料量( kg )饮片名称投料量( kg)料量误差误差及异样状况办理有□无□控制温度: 95~100℃℃蒸汽压力:Mpa第一次加水量:投料量的X 倍kg浸泡时间: X 小时日时分 ~ 日第一次升温时间日时分 ~ 日第一次提取时间: X 小时日时分 ~ 日第二次加水量:投料量的X 倍kg第二次升温时间日时分 ~ 日第二次提取时间: X 小时日时分 ~ 日第三次加水量:投料量的X 倍kg第三次升温时间日时分 ~ 日第三次提取时间: X 小时日时分 ~ 日检查人:Q A:合格□不合格□操作人:复核人:Q A:时分时分时分时分时分时分时分指令工艺参数及操作标准要求结果记录责任人署名1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A :场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□工序浓缩工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号YB-TQ-020 工序负责人:操作开始时间年月日时分结束时间年月日时分检查人:生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□Q A:前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□合格□不合格□设施名称:设施编号:设施编号:操作人:蒸汽压力:Mpa浓一效浓缩温度: 80± 2℃℃一效真空度:Mpa 复核人:缩二效浓缩温度: 70± 2℃℃二效真空度:Mpa浓缩相对密度:( 00℃)(℃)浓缩后称重kg误差误差及异样状况办理有□无□1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A:场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□工序醇提工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分结束时间年月日时分⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格提取设施名称:QA 确认本罐投料能否正确无误并署名设施编号:是□否□投饮片名称投料量( kg )饮片名称投料量( kg)料量误差误差及异样状况办理有□无□控制温度: 80~85℃℃蒸汽压力:Mpa乙醇使用记录物料编码 /批号领用量使用量节余量乙醇( kg)回收乙醇( kg)第一次加醇 (00%) 量:投料量的X 倍kg 乙醇浓度:第一次升温时间日时分 ~ 日第一次提取时间:X 小时日时分 ~ 日第二次加醇 (00%) 量:投料量的X 倍kg 乙醇浓度:第二次升温时间日时分 ~ 日第二次提取时间:X 小时日时分 ~ 日第三次加醇 (00%) 量:投料量的X 倍kg 乙醇浓度:第三次升温时间日时分 ~ 日第三次提取时间:X 小时日时分 ~ 日检查人:Q A:合格□不合格□操作人:复核人:Q A:%时分时分%时分时分%时分时分指令工艺参数及操作标准要求结果记录1、消除生产中产生的荒弃物1、是□否□2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时结束时间日时责任人署名清场人:Q A :分合格□分不合格□⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯工序醇沉工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□检查人:2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□Q A:检5、设施、工用具能否切合要求5、是□否□查⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格清膏重量:kg设施名称:设施编号:醇设施编号:加入乙醇,使含醇量达到00% 含醇量:%沉静置时间: X 小时日时分至日时分误差误差及异样状况办理有□无□乙醇使用记录物料编码 /批号领用量使用量节余量乙醇( kg)回收乙醇( kg)1、消除生产中产生的荒弃物1、是□否□2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分结束时间日时分工序回收乙醇浓缩工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录房间编号操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□设施名称: XXXXX 合格□不合格□操作人:复核人:清场人:Q A:合格□不合格□责任人署名工序负责人:检查人:Q A:合格□不合格□乙回收乙醇订制批号批号:醇回收乙醇量kg浓折算浓度( 20℃)%( 20℃)复核人:缩蒸汽压力:Mpa浓缩温度: 80± 2℃℃真空度:Mpa浓缩相对密度:( 00℃)(℃)浓缩后称重kg误差误差及异样状况办理有□无□1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A:场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□工序灭菌干燥工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□检查人:2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□Q A:检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□合格□检查量状态、包装完满状况能否合格不合格□生药设施名称:QA 确认灭菌投料能否正确无误并署名灭菌设施编号:是□否□操作人:投饮片名称投料量( kg)饮片名称投料量( kg)量复核人:共计误差误差及异样状况办理有□无□蒸汽压力:Mpa Q A:灭菌温度: 115± 2℃℃每锅灭菌时间: 0.5 小时灭菌锅次:锅灭菌时间日时分~ 日时分设施名称:设施编号:设施编号:真空度:Mpa Mpa干干燥温度: 80± 2℃℃℃每锅次干燥时间: 3~4 小时锅次锅次燥干燥时间日时分日时分至日时分至日时分干燥后称重kg( A )灭菌前饮片总重量:kg (B )收A率收率( %)= = %B限度≥ 98.0% 符合□不切合□指令工艺参数及操作标准要求结果记录责任人署名1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A:场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□工序生药粉碎工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录房间编号操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格饮片总重量:kg( A )生药设施名称:粉碎机组设施编号:粉碎设施名称:低温涡流粉碎机组设施编号:误差误差及异样状况办理有□无□检查筛网能否正确、完满是□否□粉碎细度: 000 目目粉碎后称重kg( B )收B收率( %)==%率A责任人署名工序负责人:检查人:Q A:合格□不合格□操作人:复核人:限度≥ 98.0%符合□不切合□1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□3、洁净称量衡器、容用具3、是□否□清4、是□Q A:4、洁净生产地区否□5、采集整理生产文件5、是□否□场QA 确认6、是□6、贴挂状态标记,并经否□开始时间日时分合格□结束时间日时分不合格□工序混淆工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□检查人:产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□Q A:查6、状态标记能否齐备合理6、是□否□7、查对物料的名称、批号、数目、质7、是□否□物料量状态、包装完满状况能否合格稠膏重量:kg 合格□检查生粉重量:kg 不合格□设施名称:设施编号:混淆设施名称:设施编号:操作人:将领取物料均匀分派后加入混淆机中每次混淆时间: XX 分钟稠膏( kg)生粉( kg)混淆时间1 时分至时分复核人:2 时分至时分3 时分至时分4 时分至时分5 时分至时分6 时分至时分误差误差及异样状况办理有□无□1、消除生产中产生的荒弃物1、是□否□2、洁净生产所用设施2、是□否□3、洁净称量衡器、容用具3、是□否□清4、是□4、洁净生产地区否□5、采集整理生产文件5、是□否□场QA 确认6、是□6、贴挂状态标记,并经否□开始时间日时分结束时间日时分工序微波干燥工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录房间编号操作开始时间年月日时结束时间年月日时生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格微波设施名称:干燥温度: 80±2℃干燥设施编号干燥温度干燥次数盘数干燥时间: 1 小时/次1 ℃时分至时2 ℃时分至时3 ℃时分至时4 ℃时分至时5 ℃时分至时误差误差及异样状况办理有□无□干燥后称重kg( A )提取投料总量:kg( B)混淆生粉总量:kg( C)收A -C清场人:Q A:合格□不合格□责任人署名工序负责人:分分检查人:Q A:合格□不合格□操作人:分分分复核人:分分率收率( %)==%B限度: (00±00)%符合□不切合□1、消除生产中产生的荒弃物1、是□否□2、洁净生产所用设施2、是□否□3、洁净称量衡器、容用具3、是□否□清4、是□4、洁净生产地区否□5、采集整理生产文件5、是□否□场QA 确认6、是□6、贴挂状态标记,并经否□开始时间日时分结束时间日时分工序干膏粉碎工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录房间编号操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格干膏重量:kg( A )生药设施名称:设施编号:粉碎设施编号:误差误差及异样状况办理有□无□检查筛网能否正确、完满是□否□粉碎细度: 000 目目粉碎后称重kg( B )收B收率( %)==%率A 清场人:Q A:合格□不合格□责任人署名工序负责人:检查人:Q A:合格□不合格□操作人:复核人:限度≥ 98.0% 符合□不切合□1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□3、洁净称量衡器、容用具3、是□否□清4、是□Q A:4、洁净生产地区否□5、采集整理生产文件5、是□否□场QA 确认6、是□6、贴挂状态标记,并经否□开始时间日时分合格□结束时间日时分不合格□工序批混工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□检查人:产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□Q A:查6、状态标记能否齐备合理6、是□否□7、查对物料的名称、批号、数目、质7、是□否□物料量状态、包装完满状况能否合格药粉重量:kg 合格□检查不合格□设施名称:设施编号:操作人:批混混淆时间: XX 分钟时分至时分批混前物料总量kg( A )批混后称重kg( B )复核人:查验填写中间产品请验单,取样查验取样量:g误差误差及异样状况办理有□无□B收收率( %)==%A率限度≥ 99.0% 符合□不切合□移交人:交药粉重量:kg岗位同中间站进行物料交接接收人:接件数:件指令工艺参数及操作标准要求结果记录责任人署名1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A:场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□请验单粘贴处:。

一、验证目的:证明复方XXX口服液产品生产工艺的可行性,按此工艺能生产出质量均一,稳定合格的产品。
二、适用范围:1.本验证方案适用于复方XXX口服液产品从称量开始至包装工艺的全过程。
2.验证的内容包括各生产工艺设备的适应性,生产工艺参数的有效性及能否连续生产出符合药品标准的合格药品。
3.对生产环境检测及生产用水管理按计划实施。
三、验证负责人及职责:1.制造部工艺负责人:各生产工艺设备根据规定的参数操作,对主要控制参数确认并记录。
2.工务科设备负责人:进行各生产工艺设备的验证。
3.QA部门检杳人员:按取样计划在规定处取样,并按规定检验方法进行中间产品的QA部分检验。
4.QC部门检查人员:按取样计划对样品用规定的检验方法进行检验。
5.QA部门负责人:根据验证资料及验证结果制定验证报告。
6.验证负责人:工厂厂长验证结束后评价工艺的有效性并最终认可。
四、验证概述:复方氨酚甲麻口服液的各生产工艺按批生产记录操作时产品的质量必须符合规定。
1.称量工艺:按照“口服液称量操作规程”及批生产记录中要求称量时误差应在质量检测含量测定称量范围之内,验证称量工艺的有效性。
2.配制工艺:对配制液的性状、相对密度、PH值进行检验,验证配制工艺的有效性。
3.灌封工艺:对灌封产品的装量差异、异物、含量均一性进行检验,验证灌封工艺的有效性。
4.瓶处理工艺:对经瓶处理的瓶进行异物检查,验证瓶处理工艺的有效性。
5.包装工艺:对包装产品进行铝箔封口状态,标签及印字状态进行检查,验证包装工艺的有效性。
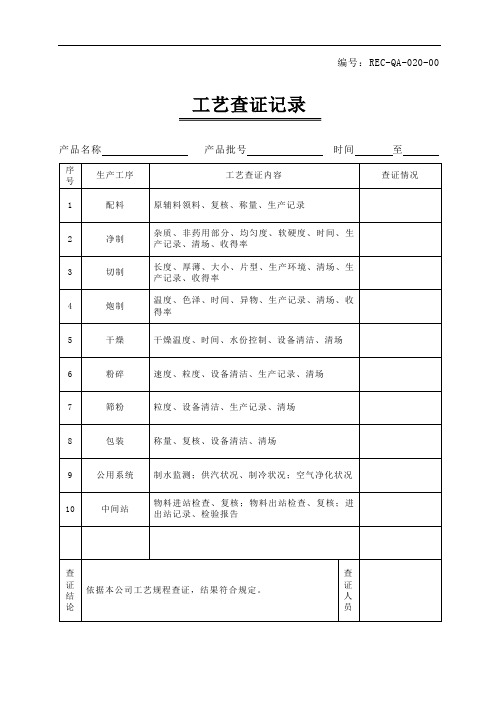
五、各工艺设备概要:见表1六、检测仪器:检测内容项目相对密度pH值中间产品及成品装量差异微生物限度检测仪器比重瓶、电子天平PHS-3C型PH计Angilent1100型HPLC Waters2695-2487型HPLC 电子天平净化试验台、培养箱表1工艺生产设备型号最大生产能力生产厂家称量电子天平SG32001PB303-N32000g310g梅特勒-托利多仪器上海有限公司梅特勒-托利多仪器上海有限公司电子秤XK3130150kg梅特勒-托利多常州衡器有限公司配液罐—2,000L配制贮液罐GP26002,000L吉林省华通制药设备有限公司移送管道— 2.5吨/hr吉林省华通制药设备有限公司灌封灌装机上盖机SFCM-18-06R>3,600瓶/hr廊坊市新明包装机械有限公司SCL-150>3,600瓶/hr廊坊市新明包装机械有限公司瓶处理洗瓶机理瓶机贴签机SRWH-36R—SM100-LZP>600瓶/hr廊坊市新明包装机械有限公司>3,600瓶/hr廊坊市新明包装机械有限公司>3,600瓶/hr廊坊市新明包装机械有限公司包装铝箔封口机FL2000自动捆包机KZB-180>3,600瓶/hr廊坊市新明包装机械有限公司----精品文档七、验证时所需的文件目录:口服液体车间称量岗位操作规程口服液体车间配制岗位操作规程口服液体车间灌封岗位操作规程口服液体瓶处理岗位操作规程口服液体车间称量岗位清场操作规程口服液体车间配制岗位清场操作规程口服液体车间灌封岗位清场操作规程口服液体瓶处理岗位清场操作规程人员进出洁净区净化操作规程物料进入洁净区净化操作规程十万级洁净区容器具清洁操作规程PB303-N电子天平操作规程SG32001电子天平操作规程TCS-150台秤操作规程配液罐操作规程配液罐清洁操作规程移送管道的清洁规程CP2600贮液罐操作规程CP2600贮液罐清洁规程SFCM-18-06R灌装机操作规程SFCM-18-06R灌装机清洁操作规程SRWH-36R洗瓶机操作规程SRWH-36R洗瓶机清洁操作规程理瓶机操作规程理瓶机清洁操作规程口服液贴签机操作规程口服液贴签机清洁规程铝箔封口机操作规程铝箔封口机清洁规程自动捆包机操作规程自动捆包机清洁操作规程中间产品、成品取样操作规程装量差异检查操作规程相对密度测定操作规程异物检查操作规程复方XXX口服液配制溶液检验操作规程复方XXX口服液检验操作规程口服液生产过程监控管理规程PHS-3C pH计操作规程AR2140电子分析天平操作规程Angilent1100系列高效液项色谱操作规程Waters2695-2487型高效液相色谱仪操作规程八、生产工艺流程图:工艺检查操作室工艺流程图制造设备称量室(10万级)△原料△辅料制造部电子秤确认贴标签状态、双人复核品质管理部确认原辅料品名、批号、检验合格证、对称量数量进行复核瓶处理(10万级)○PET○除静电○压缩空气、真空△灭菌纯化水(100℃加热30′)○溶解理瓶机洗瓶机口服液配液罐确认品名、批号\编号、数量、检验合格证确认品名、批号\编号、数量、检验合格证确认品名、批号\编号、数量、检验合格证确认品名、批号\编号、数量、检验合格证性状配制室(10万级)○冷却PH值:4.0~6.0相对密度:1.210~1.230PH值:4.0~6.0相对密度:1.210~1.230○过滤(40μm)○灌封灌封室○HDPE瓶盖(10万级)○筛选○铝箔封口40μm过滤器口服液贮液罐自动灌装机电子天平铝箔封口机灌封及封口外观装量差异,异物检查性状、异物检查、装量差异包装室(一般生产区)○贴签贴签机喷码机外观、封口状态、包装状态、标示项、包装规格、包装材料质量外观、包装状态、标示项、包装规格、包装材料质量○包装自动捆包机成品库(一般生确认入库单成品检验产区)○产成品入库九、各工艺参数及检验项目:1.目的:1.1确认工艺参数的适合性1.2对产品质量有影响的重要工艺参数制定检验计划,通过对检验数据的评价确定最佳工艺条件。
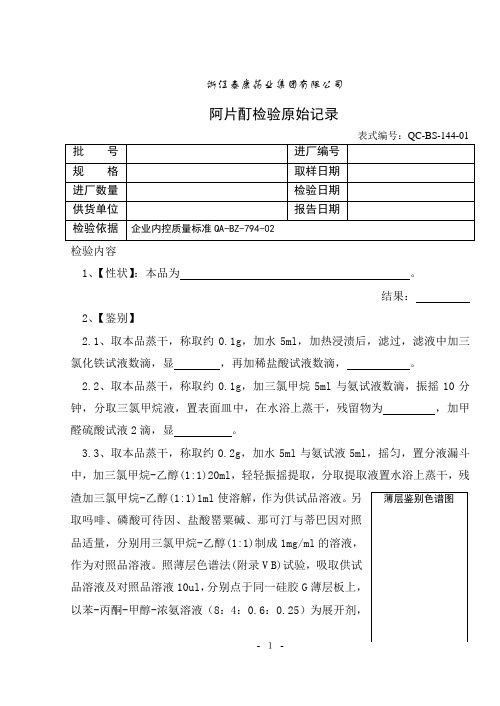
浙江泰康药业集团有限公司阿片酊检验原始记录检验内容1、【性状】:本品为 。
结果:2、【鉴别】2.1、取本品蒸干,称取约0.1g ,加水5ml ,加热浸渍后,滤过,滤液中加三氯化铁试液数滴,显 ,再加稀盐酸试液数滴, 。
2.2、取本品蒸干,称取约0.1g ,加三氯甲烷5ml 与氨试液数滴,振摇10分钟,分取三氯甲烷液,置表面皿中,在水浴上蒸干,残留物为 ,加甲醛硫酸试液2滴,显 。
3.3、取本品蒸干,称取约0.2g ,加水5ml 与氨试液5ml ,摇匀,置分液漏斗中,加三氯甲烷-乙醇(1:1)20ml ,轻轻振摇提取,分取提取液置水浴上蒸干,残渣加三氯甲烷-乙醇(1:1)1ml 使溶解,作为供试品溶液。
另 取吗啡、磷酸可待因、盐酸罂粟碱、那可汀与蒂巴因对照品适量,分别用三氯甲烷-乙醇(1:1)制成1mg/ml 的溶液,作为对照品溶液。
照薄层色谱法(附录V B)试验,吸取供试品溶液及对照品溶液10ul ,分别点于同一硅胶G 薄层板上,以苯-丙酮-甲醇-浓氨溶液(8:4:0.6:0.25)为展开剂,展开取出晾干,喷以碘化铋钾试液,供试品溶液显斑点,其中。
结果:3、【检查】乙醇量:照乙醇量测定法(附录VII E)测定。
测得乙醇量为。
结果:4、【含量测定】仪器:型高效液相色谱仪、固定相:辛烷基硅烷键合硅胶、流动相:0.05mol/L磷酸二氢钾溶液-0.0025mol/L庚烷磺酸钠溶液-乙腈(5:5:2)、检测波长:220nm。
固相萃取柱系统适用性试验:用十八烷基硅烷键合硅胶为填充物;以测定法中相同的处理条件和洗脱条件试验。
精密量取1mg/ml的吗啡对照品溶液1ml,置处理后的固相萃取柱上,同法洗脱,用5ml量瓶收集洗脱液至刻度,摇匀。
分别精密量取该洗脱液和含量测定项下的对照品溶液各10ul,分别注入液相色谱仪。
测定法:取固相萃取柱一支,依次用甲醇-水(3:1)15ml与水5ml冲洗,用pH值约为9的氨水溶液冲洗至流出液pH值约为9,待用。

中药饮片调配质量检查记录一、检查概况二、检查内容1. 药材质量检查- 外观:检查药材外观是否符合质量要求,应光滑均匀,无裂缝、杂质等情况。
- 水分:采用水分仪检测药材的水分含量,应符合国家规定的标准。
- 抗菌指标:采用石蜡块法进行抗菌指标检查,应符合国家规定的标准。
- 重金属含量:采用原子吸收光谱法检测药材中的重金属含量,应符合国家规定的标准。
- 农药残留:采用气相色谱法检测药材中的农药残留情况,应符合国家规定的标准。
2. 药材配比检查- 按照调配单中的配比要求,确认每种药材的重量是否符合要求,记录实际配比与标准配比的偏差情况。
3. 药材混合检查- 将各种药材按照配比要求混合均匀,检查混合后的颜色、气味等是否与标准相符。
4. 包装检查- 检查包装材料是否符合标准,如药袋材料、封口方式等。
- 检查包装的质量,如密封性、包装标签等是否符合要求。
- 检查药材包装的完整性,应无破损、霉变等情况。
三、检查结论经过对中药饮片调配过程的质量检查,检查结果如下:1. 药材质量检查结果:[填写结果:合格/不合格]。
具体检查项的检查结果:- 外观:[填写结果]- 水分:[填写结果]- 抗菌指标:[填写结果]- 重金属含量:[填写结果]- 农药残留:[填写结果]2. 药材配比检查结果:[填写结果:合格/不合格]。
具体偏差情况:- [填写偏差情况]3. 药材混合检查结果:[填写结果:合格/不合格]。
具体检查结果:- [填写混合结果]4. 包装检查结果:[填写结果:合格/不合格]。
具体检查结果:- [填写包装检查结果]四、检查人员五、备注[填写备注]以上为中药饮片调配质量检查记录,检查结果有助于确保中药饮片的质量和安全性。
如有发现不合格情况,应及时采取纠正措施,并记录在调配报告中,以便进一步追踪和改进质量管理体系。
制药企业全套检验记录背景制药企业作为医药行业的重要组成部分,需要对其生产的药品进行严格的检验,以确保药品的质量和安全性。
本文档旨在介绍制药企业进行全套检验时需要记录的内容和相关流程。
检验内容原材料检验制药企业生产药品所需的原材料需要进行检验,确保其符合相关标准和规定。
原材料检验应包括以下内容:•检查原材料的外观、颜色、气味等•检验原材料的纯度和含量•检验原材料是否存在重金属、农药等有害物质在制品检验在制品检验是指在药品生产过程中需要进行的检验,以确保生产过程中的质量控制得到有效实施。
在制品检验应包括以下内容:•检查在制品外观是否正常•检验在制品的含量和纯度是否符合要求•检验在制品中是否存在杂质等不良物质成品检验成品检验是指对制作成功的药品进行检验,以确保药品符合规定的质量标准。
成品检验应包括以下内容:•检查成品的外观、气味、口感等•检验成品中的含量和纯度是否符合要求•检验成品中是否存在杂质等不良物质检验记录制药企业进行全套检验时需要进行详细的记录,各类型记录的主要内容如下:原材料检验记录原材料检验记录应包括以下内容:•原材料名称、规格、批号等基本信息•检验时间和地点•检验方法和结果•检验员及其资质证书信息•药品质量标准在制品检验记录在制品检验记录应包括以下内容:•在制品名称、规格、生产批次等基本信息•检验时间和地点•检验方法和结果•检验员及其资质证书信息•药品质量标准成品检验记录成品检验记录应包括以下内容:•成品名称、规格、生产批次等基本信息•检验时间和地点•检验方法和结果•检验员及其资质证书信息•药品质量标准检验流程制药企业进行全套检验的流程应包括以下步骤:1.原材料检验2.制剂检验3.包装材料检验4.成品检验每一步的检验内容和记录均需严格按照标准和规定执行,并由专业人员进行管理和操作。
总结制药企业进行全套检验对于保证药品的质量和安全性具有重要作用。
在检验过程中需要注意各项检验内容和相关要求,并进行详细的检验记录,以确保药品质量得到有效保障。