最新钠的重要化合物优质课
- 格式:pdf
- 大小:2.28 MB
- 文档页数:16



第二节几种重要的金属化合物课时1 钠的重要化合物(氧化钠和过氧化钠)教学目标(一)知识与技能1.掌握过氧化钠和氧化钠的的性质的异同2.了解过氧化钠的用途(二)过程与方法1.充分利用表格形式,通过比较,掌握知识2.通过实物展示实险演示和学生参与实验相结合的方法,学习元素化合物知识(三)情感态度与价值观培养学生认真细致的科学态度,激发学生的求知欲教学重难点过氧化钠的化学性质教学过程【情景导入]】同学们知道,二氧化碳通常是可以用来灭火的,那么,大家知不知道,有时,二氧化碳却能使物质燃烧起来呢?下面,我们来观看一段视频《过氧化钠与二氧化碳的反应》。
【板书】钠的重要化合物(氧化钠和过氧化钠)一、过氧化钠1.颜色、状态:淡黄色固体2.化学性质(1)与CO2的反应2 Na2O2+2CO2 ==2 Na2CO3+O2环节一【合作探究】[实验3-5] 过氧化钠与水的反应把水滴入盛有少量过氧化钠固体的试管中,立即将带火星的香头放在试管口,检验生成的气体。
用手触摸试管的外壁,有什么感觉?然后向反应后的溶液中滴入1-2滴酚酞试液,有什么现象产生?将所观察的实验现象及所得出的结论填写在导学案上。
【小组展示】现象及结论:1.试管外壁发热,说明反应放热;2.滴加水后产生大量气泡,带火星的香头复燃,说明反应剧烈并生成氧气;3.向试管中滴入酚酞后变红色,说明生成了氢氧化钠。
【教师点评】(如果学生提出刚刚变红的溶液现在褪色了,可告诉学生是过氧化钠的漂白性起作用,引导学生课后查阅资料,在研究性学习的时间加以解决)【板书】(2)与水的反应2Na2O2+2H2O==4NaOH+O2↑【思考与交流1】金属钠着火怎么办?【小组展示】金属钠着火主要生成过氧化钠,所以不能用水或二氧化碳来灭火,得用砂子盖灭。
【思考与交流2】用双线桥法表示Na2O2与H2O、与CO2反应的电子转移情况,并指出氧化剂、还原剂。
【小组展示】环节二【思考与交流3】1.回忆前面所学知识,描述氧化钠的颜色、状态。


第二节几种重要的金属化合物第一课时钠的重要化合物一、三维教学目标:【知识与技能】1、掌握Na2O2的重要的化学性质及其用途。
2、初步掌握Na2CO3与NaHCO3性质的相同与不同。
3、能够写出相应的化学方程式。
【过程与方法】1、通过对Na2O和Na2O2、Na2CO3和NaHCO3性质的探究和比较,培养学生的实验意识和操作技能。
2、通过对实验现象的观察,培养学生的观察能力和分析问题能力。
3、通过知识的比较、归纳,培养学生自主学习获取知识的能力。
【情感态度价值观】1.通过动手实验让学生体验化学的奇妙,激发学生学习化学的兴趣。
通过实验,提高学生对化学是一门以实验为基础的科学的认识。
2.激发学生的求知欲望和学习期望;培养学生认真细致和严谨求实的科学态度。
二、教学重点和难点:重点:钠的化合物的性质难点:Na2O2的性质及其相关化学反应方程式的书写三、教学方法:实验探究法、对比法、归纳法、引导法四、实验准备:仪器:试管、胶塞、带导管的胶塞、酒精灯、火柴、坩埚钳、镊子、石棉网、木条、小烧杯、长导管、量筒、铁架台、三脚架试剂:Na2O2、H2O、脱脂棉、可乐、Na2CO3、NaHCO3、酚酞、稀盐酸、澄清石灰水五、教学设计:六、板书设计:第二节几种重要的金属金属化合物一、钠的重要化合物1.氧化钠和过氧化钠:2.碳酸钠和碳酸氢钠:学生学案:表3:Na2CO3和NaHCO3溶解性的实验:表4:Na2CO3和NaHCO3与稀盐酸反应的实验:表5:Na2CO3和NaHCO3稳定性的实验:课堂练习:★A.基础类:1.下列物质中,有一种物质的颜色与其它三种的颜色不同,这种物质是()(A)NaOH (B)Na2O (C)Na2O2(D)NaHCO32.化学式与其俗名相符的是()(A)纯碱:NaOH (B)火碱:Na2CO3(C)小苏打:NaHCO3(D)熟石灰:CaO3.在呼吸面具和潜水艇里,过滤空气的最佳物质应该是()(A)NaOH (B)Na2CO3(C)Na2O2(D)NaHCO34.下列物质,在空气中能稳定存在的是()(A)NaOH (B)Na2O (C)Na2O2(D)NaCl5. Na 2CO 3中混有少量的NaHCO 3,你怎样用最简单的方法把它除去原理是什么(用方程式说明)6.滴加稀盐酸后产生无色无味气体的溶液中,是否一定含有CO 32-离子?★B .巩固类:1.下面关于Na 2O 2 的说法中不正确的是( )(A )与水反应生成碱和氧气(B )可作为呼吸面具和潜水艇里氧气的来源 (C )是白色固体 (D )能与CO 2反应生成盐和氧气2.假如你不小心,在使用Na 2O 2 时引起了着火,应该用( )来灭火?(A )H 2O (B )CO 2 (C )H 2O 和CO 2 同时用 (D )细沙3.已知在下列反应关系中,E 为淡黄色固体,C 、F 为无色气体,D 为无色液 ②E+C→B+F ③E+D→G+F↑(1)根据上述性质判断A 、B 、C 、D 、E 、F 、G 应为何物,分别写出它们的化学式:A B C D E F G(2)写出相关的化学方程式:① ② ③ ★C .提升类:1.已知在下列反应关系中,E 为淡黄色固体,C 、F 为无色气体,D 为无色液③E+D→G+F↑ ④A+G→B+D(1)根据上述性质判断A 、B 、C 、D 、E 、F 、G 应为何物,分别写出它们的化学式:A B C D E F G (2)写出相关的化学方程式:① ② ③ ④ (3)如果G 溶液中含少量的B 杂质,选用( )可除去B 杂质(A )Ca(OH) 2溶液 (B )稀盐酸(C )CaCl 2溶液(D )Ba(OH) 2溶液该反应的离子方程式为 。

《钠的重要化合物》说课稿《钠的重要化合物》说课稿(通用7篇)作为一名老师,就难以避免地要准备说课稿,认真拟定说课稿,那么优秀的说课稿是什么样的呢?以下是小编为大家整理的《钠的重要化合物》说课稿,仅供参考,希望能够帮助到大家。
《钠的重要化合物》说课稿篇1一、说教材1、教材的地位和作用钠的重要化合物是本章教材的重点之一,本节知识是钠单质性质的延伸和发展,钠单质在化学反应中易失电子转变为钠的化合物,所以钠单质和钠的化合物之间存在着必然的因果关系。
只有既了解了钠单质的性质又了解了钠的化合物性质,才会比较全面的了解钠这种金属。
通过钠单质及钠的重要化合物的学习,既复习巩固了氧化还原反应和离子反应,又为学习其他几种重要金属化合物奠定基础和提供理论模式。
2、教学目标根据《化学课程标准》,结合教材,本着面向全体学生,使学生自主、全面、主动发展的原则,我确定本节课的教学目标如下:【知识与技能】1)掌握钠的重要化合物的性质和用途。
2)通过碳酸钠和碳酸氢钠的对比实验,学生能了解两者性质的差异、掌握二者的转化关系及鉴别方法。
【过程与方法】1)通过碳酸钠和碳酸氢钠的对比学习,学生应初步掌握对比、推理、归纳的能力。
2)教学中通过学生的实验和探究。
可以进一步提高学生的观察能力、实验能力和思维能力。
【情感态度与价值观】1)通过实验探究的过程,学生更容易体会到知识的形成过程,体验到动手合作的乐趣,在交流中养成团结合作的良好品质。
2)通过学习我国化学家侯德榜对世界制碱工业、我国化学工业作出的巨大贡献,增加学生民族自豪感。
3、教学重点难点根据教材及学生特点和已有知识,我确定如下教学重点和难点:教学重点:过氧化钠的性质,碳酸钠和碳酸氢钠的性质及转化。
教学难点:Na2O2的性质。
二、说学情在本节课之前,学生已经学习了氧化还原反应、离子反应、以及钠单质的性质等知识,能够对化学反应的得失电子情况及离子反应的本质做出正确的判断。
在能力上,学生已经初步具备观察能力、实验能力、思维能力,喜欢通过实验探究的方式来研究物质的性质,可以通过对实验现象的分析、对比,归纳出实验结论。

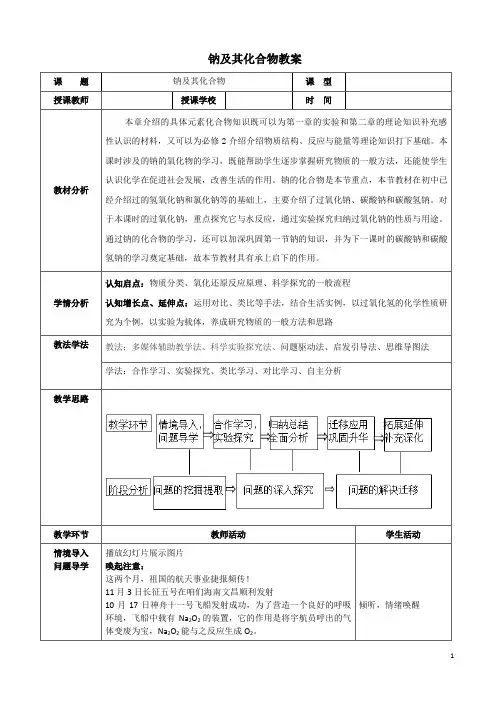
钠及其化合物教案课题钠及其化合物课型授课教师授课学校时间教材分析本章介绍的具体元素化合物知识既可以为第一章的实验和第二章的理论知识补充感性认识的材料,又可以为必修2介绍介绍物质结构、反应与能量等理论知识打下基础。
本课时涉及的钠的氧化物的学习,既能帮助学生逐步掌握研究物质的一般方法,还能使学生认识化学在促进社会发展,改善生活的作用。
钠的化合物是本节重点,本节教材在初中已经介绍过的氢氧化钠和氯化钠等的基础上,主要介绍了过氧化钠、碳酸钠和碳酸氢钠。
对于本课时的过氧化钠,重点探究它与水反应,通过实验探究归纳过氧化钠的性质与用途。
通过钠的化合物的学习,还可以加深巩固第一节钠的知识,并为下一课时的碳酸钠和碳酸氢钠的学习奠定基础,故本节教材具有承上启下的作用。
学情分析认知启点:物质分类、氧化还原反应原理、科学探究的一般流程认知增长点、延伸点:运用对比、类比等手法,结合生活实例,以过氧化氢的化学性质研究为个例,以实验为载体,养成研究物质的一般方法和思路教法学法教法:多媒体辅助教学法、科学实验探究法、问题驱动法、启发引导法、思维导图法学法:合作学习、实验探究、类比学习、对比学习、自主分析教学思路教学环节教师活动学生活动情境导入问题导学播放幻灯片展示图片唤起注意:这两个月,祖国的航天事业捷报频传!11月3日长征五号在咱们海南文昌顺利发射10月17日神舟十一号飞船发射成功,为了营造一个良好的呼吸环境,飞船中载有Na2O2的装置,它的作用是将宇航员呼出的气体变废为宝,Na2O2能与之反应生成O2。
倾听,情绪唤醒任务二:通过“实验探究--原理解析-性质归纳”学习Na2O2的化学性质探究1:Na2O2与H2O反应产物(定性)引导展示:有请小组代表描述实验现象及结论分析探究2:Na2O2与H2O反应滴加酚酞溶液褪色原理(定性)提出困惑:探究1 的实验中,溶液为何褪色?我们可以利用科学探究的方法解决困惑!作出假设:首先我们要做出合理的假设,再进行实验方案设计与探究。

