高中化学 原电池,化学电源
- 格式:ppt
- 大小:1.42 MB
- 文档页数:47




2020-2021 年新高三化学一轮复习讲解《原电池与化学电源》【知识梳理】一、原电池负极正极2原理的应用一个自发进行的氧化还原反应,设计成原电池时反应速率增大。
如在 Zn 与稀硫酸反应时 加入少量CuSO 4 溶液能使产生H 2 的反应速率加快两种金属分别作原电池的两极,一般作负极的金属比作正极的金属活泼使被保护的金属制品作原电池正极而得到保护。
如要保护一个铁制的输水管道或钢铁桥梁等,可用导线将其与一块锌块相连,使锌作原电池的负极设计制作化学电源,设计原电池时,负极材料确定之后,正极材料的选择范围较广,只要合理都可以,电解质溶液一般能够与负极发生反应,或者电解质溶液中溶解的其他物质能 与负极发生反应(如空气中的氧气)例题1、下列说法正确的是。
①电池工作时,负极失去的电子均通过溶液转移到正极上 ②在原电池中失去电子的一极是阴极,发生的是还原反应③原电池的两极一定是由活动性不同的两种金属组成④铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀⑤将铝片和镁片用导线连接后,插入盛有 NaOH 溶液,铝作负极 ⑥电池工作时,电子通过外电路从正极流向负极 ⑦原电池工作时,正极和负极上发生的都是氧化还原反应⑧锌、铜和盐酸构成的原电池工作时,锌片上有 6.5 g 锌溶解,正极上就有 0.1 g 氢气生成 ⑨原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动⑩锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,电池工作一段时间后,乙池溶液的总质量增加⑪盐桥中装有含氯化钾的琼脂,其作用是传递电子⑫原电池装置 中,电极Ⅰ上发生还原反应作原电池的负极[指点迷津]原电池基础知识的易错点:(1) 负极本身不一定都参加反应,如燃料电池中,作为负极的材料本身并不参加反应。
(2) 忽视电极材料与电解质溶液的反应关系,容易误写电极反应式,如Al 负极,在酸性溶液中生成Al 3+,在碱性溶液中生成 AlO -。




第2讲原电池化学电源复习目标知识建构1.理解原电池的构成、工作原理及应用,能书写电极反应式和总反应方程式。
2.了解常见化学电源的种类及其工作原理。
一、原电池1.概念和反应本质原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。
2.形成条件(1)能自发进行的氧化还原反应,一般是活泼性强的金属与电解质反应。
(2)电极,一般是活泼性不同的两电极。
(3)电解质溶液或熔融电解质。
(4)形成闭合回路。
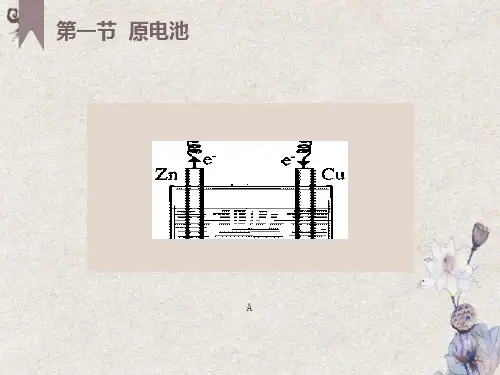
3.工作原理(以铜锌原电池为例)。
(1)两种装置①装置Ⅰ中Zn与Cu2+直接接触,会有部分Zn与Cu2+直接反应,部分化学能转化为热能;②装置Ⅱ中不存在Zn与Cu2+的直接反应而造成能量损耗,电流稳定,且持续时间长。
(2)反应原理电极名称负极正极电极材料锌片铜片Cu2++2e-电极反应Zn-2e-===Zn2+===Cu 反应类型氧化反应还原反应盐桥中离盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极子移向(3)带电粒子移动方向及闭合回路的形成(4)盐桥的组成和作用①盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
②盐桥的作用:a.连接内电路,形成闭合回路;b.平衡电荷,使原电池不断产生电流。
③盐桥中离子移向与电解液中离子流向保持一致。
4.原电池原理的应用(1)比较金属的活动性强弱:原电池中,负极一般是活动性较强的金属,正极一般是活动性较弱的金属(或非金属导体)。
(2)加快化学反应速率:氧化还原反应形成原电池时,反应速率加快。
(3)用于金属的防护:将需要保护的金属制品作原电池的正极而受到保护。
(4)设计制作化学电源。
【判一判】判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)NaOH溶液与稀硫酸的反应是自发进行的放热反应,此反应可以设计成原电池()(2)在原电池中,发生氧化反应的是正极()(3)Mg—Al形成的原电池,Mg一定作负极()(4)原电池工作时,电子从负极流出经导线流入正极,再通过电解质溶液流回负极()(5)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动()(6)带有“盐桥”的原电池一般比不带“盐桥”的原电池效率高()答案(1)×(2)×(3)×(4) ×(5)×(6)√二、化学电源1.一次电池碱性锌锰电负极材料:Zn。

知识清单18原电池化学电源知识点01原电池的工作原理及应用1.原电池的概念和实质(1)概念:将_______能转化为_______能的装置。
(2)实质:利用能______________的氧化还原反应把_______能转化为_______能。
2.原电池的工作原理(1)电极反应:负极:_______电子,发生_______反应正极:_______电子,发生_______反应(2)电子移动方向:从_______极流出沿导线流入_______极,电子_______通过电解质溶液。
(3)离子移动方向:①阴离子向_______极移动,阳离子向_______极移动。
②如果有盐桥:盐桥中的阴离子移向_______区,阳离子移向_______区。
(4)盐桥的作用:①离子通道,形成______________。
②避免_____________________直接反应,减少电流的衰减。
3.原电池的构成条件①形成______________;②两个_______不同的电极,相对较活泼的金属作_______极;③电解质溶液或熔融电解质;④_______的氧化还原反应(一般能对外界_______能量)。
【易错提醒】(1)构成原电池的两电极材料不一定都是金属,正极材料可以为导电的非金属,例如石墨。
两极材料可能参与反应,也可能不参与反应。
(2)两个活泼性不同的金属电极用导线连接,共同插入电解质溶液中不一定构成原电池,必须有一个能自发进行的氧化还原反应。
(3)在判断原电池正负极时,既要考虑金属活泼性的强弱,也要考虑电解质溶液性质。
如Mg-Al-HCl溶液构成的原电池中,负极为Mg;但是Mg-Al-NaOH溶液构成的原电池中,负极为Al,正极为Mg。
4.原电池原理的应用(1)设计制作化学电源①用双线桥分析氧化还原反应的电子转移方向和数目;②分别写出正、负极的电极反应式(半反应式);③根据电极反应式确定半电池的电极材料和电解质溶液:a.电极材料:一般______________作负极,______________(或_________导体)作正极;b.电解质溶液:负极电解液一般是负极金属对应的_________的溶液;正极电解液一般是氧化剂对应的电解质溶液。
课时28原电池、化学电源(含燃料电池)知识点一原电池的工作原理及应用【考必备·清单】1.原电池(1)概念:原电池是把化学能转化为电能的装置。
(2)构成条件电极两极为导体,且存在活动性差异溶液两极插入电解质溶液中回路形成闭合回路或两极直接接触本质看能否自发地发生氧化还原反应(3)工作原理(以锌、铜原电池为例)电极名称负极正极电极材料锌片铜片电极反应Zn-2e-===Zn2+Cu2++2e-===Cu 电极质量变化减小增大反应类型氧化反应还原反应电子流向由Zn沿导线流向Cu盐桥中离子移向盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极a.连接内电路形成闭合回路。
盐桥作用b.维持两电极电势差(中和电荷),使电池能持续提供电流。
(4)负极与正极①负极:发生氧化反应或电子流出的电极。
②正极:发生还原反应或电子流入的电极。
(5)两个移动方向①电子定向移动方向和电流方向a.电子从负极流出经外电路流入正极;b.电流从正极流出经外电路流入负极;故电子定向移动方向与电流方向正好相反。
②离子移动方向阴离子向负极移动(如SO2-4),阳离子向正极移动(如Zn2+和H+,溶液中H+在正极上得电子形成氢气在铜片上冒出)。
[名师点拨]①自发发生的氧化还原反应并不一定是电极与电解质溶液反应,也可以是电极与溶解的O2等发生反应,如将铁与石墨相连插入食盐水中。
②无论是原电池还是电解池,电子均不能通过电解质溶液。
③双液铜、锌原电池(带盐桥)比单液原电池的最大优点是Zn与氧化剂(Cu2+)不直接接触,仅有化学能转化为电能,避免了能量损耗,故电流稳定,放电时间长。
2.原电池原理的四大应用(1)加快氧化还原反应的速率一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。
例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液置换出的Cu能与Zn形成原电池使产生H2的反应速率加快。
(2)比较金属活动性强弱如有两种金属A和B,用导线将A和B连接后,插入到稀硫酸中,一段时间后,若观察到A溶解,而B上有气体放出,则说明A作负极,B作正极,即可以断定金属活动性:A>B。
化学电源-原电池上————————————————————————————————作者:————————————————————————————————日期:电化学——原电池、电解池(上)【知识内容】一、原电池原理1.原电池的反应原理:自发的、放热的氧化还原反应原电池的电路工作原理:(外电路)负极失去电子,电子经导线流向正极。
(内电路)溶液中阴阳离子发生定向移动,向负极移动,向正极移动。
2.原电池的电极和电极反应:以锌铜电池(电解液H2SO4溶液)为例,如右图:负极:锌电极,电子,发生反应,本身溶解;反应:Zn-2e-=Zn2+,阴离子向负极移动;正极:铜电极,电子,发生反应,本身无变化。
反应:阳离子向正极移动,2H++2e-=H2↑3.原电池形成的一般条件:(1)两极:的金属(或一种是金属,另一种是非金属导体)。
(2)电解质溶液:电极必与电解质溶液接触。
(3)形成闭合回路:电极相互接触或用连接,电解质溶液用连接。
特别提醒:原电池形成还有一个隐蔽条件:能发生自发的氧化还原反应【做题技巧】⑴.是否为原电池的判断先分析有无外接电源,有外接电源的为电解池,无外接电源的可能为原电池;然后依据原电池的形成条件分析判断,主要是“四看”:看电极——两极为导体且存在活泼性差异(燃料电池的电极一般为惰性电极),看溶液——两极插入电解质溶液中,看回路——形成闭合回路或两极直接接触,看本质——有无氧化还原反应发生。
⑵.原电池正、负极的确定①由两极的相对活泼性确定。
②根据在两电极发生反应的物质的化合价的升降情况来判断。
③由电极变化情况确定。
④根据某些显色现象确定。
⑤根据外电路中自由电子的运动方向规定:在外电路中电子流出的电极叫负极,电子流入的电极叫正极。
⑥根据内电路中自由离子的运动方向规定:在内电路中阳离子移向的电极叫正极,阴离子移向的电极叫负极。
⑶.电极反应式的书写书写电极反应式是学习电化学的基本功,也是高考和竞赛所必须掌握的知识点。
高考总复习原电池和化学电源【考点梳理】考点一、原电池的概念1.能量的转化原电池:将化学能转变为电能的装置。
电能是现代社会应用最广泛、使用最方便、污染最小的一种二次能源,又称电力。
2.工作原理设计一种装置,使氧化还原反应所释放的能量直接转变为电能,即将氧化反应和还原反应分别在两个不同的区域进行,并使电子转移经过导线,在一定条件下形成电流。
电子从负极(较活泼金属)流向正极(较不活泼金属或碳棒),负极发生氧化反应,正极发生还原反应。
电极电极材料反应类型电子流动方向负极还原性较强的金属氧化反应负极向外电路提供电子正极还原性较弱的金属还原反应正极从外电路得到电子以下是锌铜原电池装置示意图:3.原电池的组成条件(1)两个活泼性不同的电极(材料可以是金属或导电的非金属),分别发生氧化和还原反应。
原电池中两极活泼性相差越大,电池电动势就越高。
(2)电解质溶液,电解质中阴离子向负极方向移动,阳离子向正极方向移动,阴阳离子定向移动成内电路。
(3)导线将两电极连接,形成闭合回路。
(4)有能自发进行的氧化还原反应。
4.原电池的判断方法(1)先分析有无外接电池,有外接电源的为电解池,无外接电源的可能为原电池。
(2)多池相连,但无外电源时,两极活泼性差异最大的一池为原电池,其他各池可看做电解池。
5判断依据负极正极电极材料活泼性较强的金属活泼性较弱的金属或能导电的非金属电子流动方向电子流出极电子流入极电解质溶液中离子定阴离子移向的负极阳离子移向的正极向移动方向发生的反应氧化反应还原反应反应现象溶解的极增重或有气泡放出的极6在原电池构成的闭合电路中,有带电粒子的定向移动。
在外电路上电子从负极经导线上流入正极;在内电路上即在电解质溶液中阴离子移向负极,阳离子移向正极。
具体情况见图:考点二、原电池原理的应用1.加快氧化还原反应的速率例如:在锌与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的速率加快。
2.比较金属活动性强弱例如:有两种金属a和b,用导线连接后插入到稀H2SO4中,观察到a极溶解,b极上有气泡产生。