大鼠皮质脊髓束LuxolFastBlue染色
- 格式:doc
- 大小:32.50 KB
- 文档页数:8

Luxol Fast Blue髓鞘染色液(伊红法)使用说明书货号:G3240有效期:12个月有效。
产品内容:产品名称规格Storage试剂(A):Luxol Fast Blue染色液50ml RT避光试剂(B):Luxol分化液50ml RT试剂(C):伊红染色液50ml RT避光产品简介:髓鞘(myelin sheath)是包裹在神经细胞轴突外面的一层膜,即髓鞘由髓鞘细胞和细胞膜组成,是神经细胞的质膜沿着轴索的轴心螺旋缠绕形成的多层脂双层结构,髓鞘上有郎飞氏结,可使神经冲动跳跃传递。
髓鞘染色在病理诊断中有一定意义,髓鞘的病理变化分为早期、中期和晚期。
在早期着色较深;病变中期阶段的髓鞘变性形成脂滴,可用脂质染色加以显示,后期彻底溃变并被吞噬细胞清除,故不再有髓鞘的阳性结果。
很多疾病都可以引起髓鞘的变化,Luxol Fast Blue髓鞘染色可以显示病理情况下髓鞘是否完整、变性、坏死程度及修复情况,对神经组织的病理诊断和研究均有意义,例如神经纤维受损时,髓鞘可出现膨胀、曲折成球形、断裂或脱鞘完全消失等改变。
操作步骤(仅供参考):1.石蜡切片5~8μm,脱蜡至水;2.95%乙醇稍洗;3.入Luxol Fast Blue染色液,室温过夜(冰冻切片染色时间不超过16h);4.入95%乙醇洗去多余染色液;5.蒸馏水冲洗;6.入Luxol分化液分色15s;7.入70%乙醇分色30s至灰白质清晰;8.蒸馏水冲洗。
(如果分色不足,可重复6~7步骤);9.入伊红染色液,复染30s~2min,水洗;10.用95%、100%乙醇脱水,二甲苯透明,中性树胶封片。
染色结果:髓鞘呈蓝色,背景呈红色。
注意事项:1.分化这一步很关键,应严格控制分化时间,可在镜下观察分化程度。
2.固定液以10%的福尔马林为佳。
3.切片不宜太厚,应控制在8~9μm以内,否则易出现脱片或过染等现象。
4、如室温染色效果不佳或者缩短染色时间,可在56℃下染色。


髓鞘染色液使用说明
规格:100ml×2
有效期:室温保存,6个月有效。
产品简介:
本产品是运用固蓝(luxol fast blue)染色法染脑和髓鞘。
髓鞘(myelin sheath)是一层脂肪组织,包裹在某些神经元的轴突外,具有绝缘作用并提高神经冲动的传导速度,在中枢和外周神经系统中起保护轴突作用。
本染色法可显示正常的髓鞘。
自备材料:
产品名称规格
髓鞘染液A100ml
髓鞘染液B100ml
操作步骤(仅供参考):
1、石蜡切片脱蜡至水;
2、无水乙醇5min;
3、浸入髓鞘染液A在58-60℃条件下染色14h;
4、流水冲洗10min;
5、放入70%乙醇中(无固定时间)
6、浸入髓鞘染液B中,至分色完全(可见中间灰质部分颜色变淡);
7、第5步、6步交替进行;
8、流水冲洗5min;
9、伊红复染数秒(可选);
10,梯度酒精脱水、二甲苯透明、中性树胶封片。
染色结果:
正常髓鞘呈蓝色,脱髓鞘无色,余呈淡红色。
注意事项:
1、髓鞘染液常温密封放置,可保存6个月;100ml髓鞘染液染150张片子为宜,染液可重复利用。
因髓鞘染液中含有酒精所以加温染色时宜密封,不然溶液蒸发,影响染色效果;
2、酒精和髓鞘染液B分化为关键步骤,应交替分化,镜下观察,控制分色;
3、伊红复染可选,如选,宜浅染。

[文章编号]1000-2057(2008)01-0005-03南通大学学报(医学版)Journal of Nantong University (Medical S ciences)2008∶28(1)长期以来,脊髓损伤后皮质脊髓束的再生修复研究一直是神经科学研究的热点。
最近有人尝试运用微电子芯片技术重建皮质脊髓束功能[1]。
此项研究中一个关键指标就是皮质脊髓束在脊髓内定位和走行情况。
常用的组织学染色方法不能显示皮质脊髓束,本实验采用Luxo l Fast Blue 染色法对大鼠皮质脊髓束进行形态学研究,取得良好效果。
1材料和方法1.1材料选用健康成年SD 大鼠6只,清洁级,体重250~300g,雌雄不拘,由南通大学实验动物中心提供。
0.1%L ux ol Fast Blue 液(Sigma 公司),L eicaCM 1900冰冻切片机,显微镜为Leica DM R 显微镜(L 公司,德国)。
1.2方法切片制备:给予大鼠复合麻醉剂(0.2ml/100g 体重),腹腔注射麻醉后开胸,穿心脏经升主动脉灌注,先用温(37℃)生理盐水200ml 冲净血液,再用预冷(4℃)的含4%多聚甲醛的磷酸盐缓冲液500ml 快速灌注固定,1h 后取脑和脊髓放入含4%多聚甲醛的PB 溶液中后固定4~6h,再移入30%蔗糖的PB 溶液中4℃过夜,待组织沉底后取脑(延髓)和脊髓颈、胸、腰、荐段行连续横切面冰冻切片,切片厚度为30μm ,直接贴于预先涂有明胶的载玻片上,置室温下晾干待用。
L ux ol Fast Blue 染色:(1)将切片放入乙醇∶氯仿溶液(无水乙醇和氯仿的体积比为1∶1)中5min ;(2)将切片置入95%乙醇溶液中5min ;(3)0.1%L ux olF B 液中56℃过夜;()5%乙醇溶液5;大鼠皮质脊髓束Luxol Fast Blue 染色*1吕广明**,1吴辉群,2栗卓,3刘苏,1韩笑,1季达峰(1南通大学人体解剖学教研室,神经生物学研究所,江苏省神经再生重点实验室南通226001;2北京朝阳区第二医院耳鼻喉科;3南通大学附属医院康复医学科)[摘要]目的:探讨显示大鼠皮质脊髓束的特殊染色方法。

实验性自身免疫性脑脊髓炎鼠模型建立及其病理特点张健;曾育琦;张静;康德勇;黄天文;陈晓春【摘要】目的:建立髓鞘少突胶质细胞糖蛋白多肽(MOG35‐55)诱发的实验性自身免疫性脑脊髓炎(EAE)小鼠模型,并观察其病理特点。
方法应用M OG35‐55多肽加福氏完全佐剂皮下注射免疫雌性C56BL/6小鼠,观察其临床症状、病理改变及影像学变化。
结果模型组小鼠发病时间为免疫后(12±4)d (8~16d ),发病率83.3%,呈慢性单向过程;H‐E染色模型鼠脊髓白质见大量炎症细胞浸润;罗克沙尔坚牢蓝染色显示,脊髓白质呈片状髓鞘脱失;电镜显示,髓鞘内层呈板层剥脱,轴索肿胀,结构疏松;脊髓M RI检查可见髓内斑片状T2异常高信号。
结论慢性EAE模型具有发病率高、死亡率低、模型稳定、重复性高、制作方便的特点,模型病理改变接近多发性硬化(MS),是研究MS较为理想的动物模型。
%Objective To establish mouse models of experimental autoimmune encephalomyelitis (EAE) induced by peptide myelin oligodendrocyte glycoprotein (MOG35‐55 ) and study their pathological characterization . Methods The female EAE model of C57BL/6 mice (10~12 weeks) were immunized subcutaneously at four sites into the flanks with 300 μg of myelin oligodendrocyte glycoprotein peptide (MOG35‐55 ) with the assistance of Complete Freund's Adjuvant(CFA) and Pertussis toxin (PTX) . We observed the clinical symptoms , histopathologic changes and changes on magnetic resonance scan . Results The experimental group developed the typical symptoms of EAE on (12 ± 4) days after immuniza‐tion with the incidence of 83 .3% and showed a chronic monophasic course . There was a large number of inflammatory cells infiltration and demylination inthelum bar spinal cord . Electron micrographs demon‐strated a considerable amount of the myelin sheaths displayed loose ,vacuoles and splitting . Intramedul‐lary spinal MRI study showed patchy T2 hyperintensityin EAE mice . Conclusion Our study reports a MOG‐indu ced EAE model that has a high incidence and its pathologic changes were similar to multiple sclerosis (MS) ,so it might be an ideal model for the research on MS .【期刊名称】《福建医科大学学报》【年(卷),期】2015(000)001【总页数】4页(P16-19)【关键词】少突神经胶质/免疫学;髓鞘;糖蛋白类/免疫学;脑脊髓炎,自身免疫性,实验性;模型,动物【作者】张健;曾育琦;张静;康德勇;黄天文;陈晓春【作者单位】福建医科大学附属协和医院神经内科,福州350001; 福建医科大学附属协和医院老年病科,福州350001; 福建省老年医学研究所,福州 350001;福建医科大学附属协和医院神经内科,福州350001; 福建医科大学附属协和医院老年病科,福州350001; 福建省老年医学研究所,福州 350001;福建医科大学附属协和医院老年病科,福州350001; 福建省老年医学研究所,福州 350001; 福建省高校老化与变性病重点实验室,福州350001;福建医科大学附属协和医院病理科,福州 350001;福建医科大学附属协和医院神经内科,福州350001; 福建医科大学附属协和医院老年病科,福州350001; 福建省老年医学研究所,福州 350001;福建医科大学附属协和医院神经内科,福州350001; 福建省老年医学研究所,福州350001; 福建省高校老化与变性病重点实验室,福州350001【正文语种】中文【中图分类】R-332;R341.32;R392.11;R744.3;R9712. 福建医科大学附属协和医院老年病科,福州350001;3. 福建省老年医学研究所,福州350001;4. 福建省高校老化与变性病重点实验室,福州350001;5. 福建医科大学附属协和医院病理科,福州350001多发性硬化(multiple sclerosis,MS)是一种病因不明的、主要累及中枢神经系统白质的慢性炎性脱髓鞘疾病。
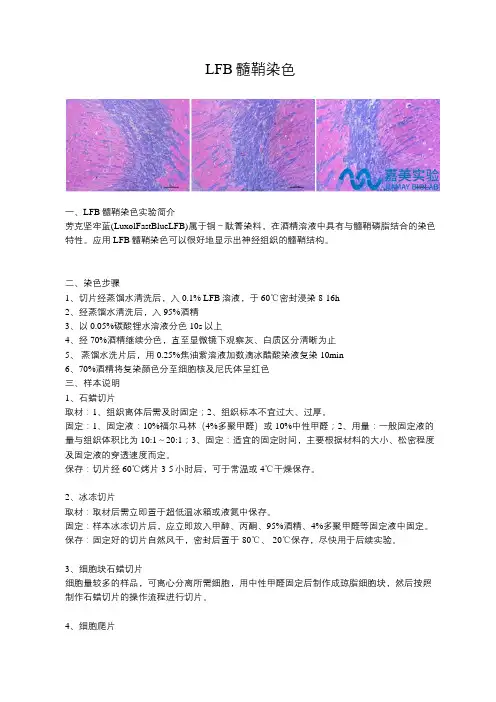
LFB髓鞘染色一、LFB髓鞘染色实验简介劳克坚牢蓝(LuxolFastBlueLFB)属于铜-酞箐染料,在酒精溶液中具有与髓鞘磷脂结合的染色特性。
应用LFB髓鞘染色可以很好地显示出神经组织的髓鞘结构。
二、染色步骤1、切片经蒸馏水清洗后,入0.1% LFB溶液,于60℃密封浸染8-16h2、经蒸馏水清洗后,入95%酒精3、以0.05%碳酸锂水溶液分色10s以上4、经70%酒精继续分色,直至显微镜下观察灰、白质区分清晰为止5、蒸馏水洗片后,用0.25%焦油紫溶液加数滴冰醋酸染液复染10min6、70%酒精将复染颜色分至细胞核及尼氏体呈红色三、样本说明1、石蜡切片取材:1、组织离体后需及时固定;2、组织标本不宜过大、过厚。
固定:1、固定液:10%福尔马林(4%多聚甲醛)或10%中性甲醛;2、用量:一般固定液的量与组织体积比为10:1~20:1;3、固定:适宜的固定时间,主要根据材料的大小、松密程度及固定液的穿透速度而定。
保存:切片经60℃烤片3-5小时后,可于常温或4℃干燥保存。
2、冰冻切片取材:取材后需立即置于超低温冰箱或液氮中保存。
固定:样本冰冻切片后,应立即放入甲醇、丙酮、95%酒精、4%多聚甲醛等固定液中固定。
保存:固定好的切片自然风干,密封后置于-80℃、-20℃保存,尽快用于后续实验。
3、细胞块石蜡切片细胞量较多的样品,可离心分离所需细胞,用中性甲醛固定后制作成琼脂细胞块,然后按照制作石蜡切片的操作流程进行切片。
4、细胞爬片在孔板里做的细胞爬片,爬片取出后,用PBS洗涤2次(根据研究目的,PBS洗涤可选择不做),用4%多聚甲醛4℃固定15分钟,将表面液体吹干,置于-20℃保存。
若在短时间内即开展实验,可在加固定液后,于4℃冰箱中放置一段时间。
5、细胞涂片细胞涂片常用的固定液有95%酒精(最为常用)、酒精-冰醋酸液、乙醚-酒精液和Carney’s液等。
四、注意事项1、常用的固定液为中性甲醛和4%多聚甲醛,能使大多数抗原保存良好,适用于免疫组织化学。

luxol fast blue染色简易流程( 适用于石蜡、冰冻切片)(1)石蜡切片脱蜡,脱水至95%酒精,同时将LFB放置56度预热。
(冰冻切片可能需要脱脂:将切片放入乙醇:氯仿溶液(无水乙醇和氯仿的体积比1:1,现配)中2h,冰冻切片为了防止掉片,可以在37度烘烤2小时);(2)将切片置入95%乙醇溶液中5min;(3)0.1%luxol fast blue溶液中56℃过夜;(冰冻切片不超过16小时,或者45度过夜为好!可以62度左右1-2h)(4)95%乙醇溶液5min;(5)双蒸水3min;(6)0.05%碳酸锂溶液(现配)分化3-5min,70%乙醇溶液继续分化30s;(7)双蒸水洗片;(8)镜下观察脊髓灰、白质分界是否清晰,若分界不清晰,则重复(6)、(7)两个步骤,直至分化清晰为止;(9)70%乙醇溶液3min;(10)0.5%伊红溶液30s;(9,10省略)(11)双蒸水洗片;(12)0.1%焦油紫溶液复染1min;焦油紫复染也可以省略,这样白质灰质分化更清晰。
(13)双蒸水洗片;(14)95%乙醇溶液5min;(15)常规脱水(100%乙醇)、透明(二甲苯)、中性树胶封片。
试剂配方:0.1%LFB(100ml)LFB :0.1g (luxol fast blue:solvent blue 38 (Sigma,S3382))95% ETOH:100ml10%醋酸(冰醋酸):500ul 过滤,避光,室温保存0.1% Cresyl violet solution(结晶紫,100ml)Cresyl violet :0.1gddH2O:100ml10%醋酸(冰醋酸):500ul 过滤0.05%LiCO3溶液(碳酸锂,200ml):LiCO3: 0.1gddH2O:100mlResults:Myelin, including phospholipids ------------------ blue to greenNeuron ---------------------------------------------- pink to violet Positive Controls:Brain, spinal cord.。

《中国组织工程研究》Chinese Journal of Tissue Engineering Research文章编号:2095-4344(2019)31-04979-074979www.CRTER .org·研究原著·柏秋实,男,1997年生,山东省济南市人,汉族,吉林大学白求恩医学部临床医学院在读本科。
并列第一作者:苏胜,男,1997年生,吉林省吉林市人,汉族,吉林大学白求恩医学部临床医学院在读本科。
通讯作者:池光范,博士,博士生导师,副教授,吉林大学基础医学院病理学系,吉林省长春市130021文献标识码:B稿件接受:2019-05-17Bai Qiushi,School of Clinical Medicine,Bethune Medical College,Jilin University,Changchun 130021,JilinProvince,China;Department of Pathology,College of Basic Medical Sciences,KeyLaboratory of Pathophysiology,Ministry of Education,JilinUniversity,Changchun 130021,Jilin Province,ChinaSu Sheng,School of Clinical Medicine,Bethune Medical College,Jilin University,Changchun 130021,JilinProvince,China;Department of Pathology,College of Basic Medical Sciences,KeyLaboratory of Pathophysiology,Ministry of Education,JilinUniversity,Changchun 130021,Jilin Province,ChinaBai Qiushi and Su Shengcontributed equally to this work.Corresponding author:Chi Guangfan,MD,Doctoral supervisor,Associate professor,Department of Pathology,College of Basic Medical Sciences,Key Laboratory of Pathophysiology,Ministry of Education,Jilin University,Changchun 130021,Jilin Province,China脊髓损伤模型大鼠软脊膜下注射2型腺相关病毒免疫荧光染色分析柏秋实1,2,苏胜1,2,王亮佳1,2,郑洋洋2,康娟娟2,徐金影2,池光范2(1吉林大学白求恩医学部临床医学院,吉林省长春市130021;2吉林大学基础医学院病理学系病理生物学教育部重点实验室,吉林省长春市130021)DOI:10.3969/j.issn.2095-4344.1481ORCID:0000-0001-5022-4115(柏秋实);0000-0001-9107-079X(苏胜)文章快速阅读:文题释义:软脊膜:软脊膜是一富有血管的薄膜,由2层组成。

大鼠骨骼双染标本的制作方法张宏;李啸红【期刊名称】《重庆医学》【年(卷),期】2012(041)002【摘要】目的探讨大鼠骨骼双染方法,为制作教学陈列用标本或研究胚胎正常骨骼形态发育以及胚胎骨骼畸形提供基本的实验方法.方法将18 d胎鼠及生后1 d仔鼠去除皮肤、皮下脂肪组织及内脏,用阿利新蓝染液染软骨,再用含氢氧化钾的茜素红染液染骨,最后通过逐级甘油脱水、透明并保存.结果已骨化的骨被茜素红染成红色或紫红色,软骨被阿利新蓝染成蓝色,其他组织为无色透明状,在体视镜下可清楚地观察到骨骼的发育形态.结论采用茜素红和阿利新蓝双染法,可使去除皮肤、皮下脂肪组织及内脏的整体胎鼠和仔鼠骨和软骨获得最佳染色效果,是研究骨和软骨发育较为直观的方法,也是制作教学陈列标本的好方法.%Objective To discuss the methods of rat skeleton double stain,in order to provide basic testing methods for making display samples for teaching or studying the normal skeleton morphological development and the skeletal deformity of embryos. Methods The 18 d fetal rat and filial rat 1 d after birth were removed skin,subcutaneous adipose tissue and viscera,and their cartilages were first dyed by the dye solution of Alcian blue,and then dyed by the dye solution of alizarin red containing potassium hydroxide, and finally dehydratsed by several levels of glycerin,made transparent and stored. Results The ossificated skeletons were dyed to red or amaranth by the alizarin red,the cartilages were dyed to blue by the Alcian blue,and othertissues were transparent. The development morphology of the skeleton could be clearly observed through stereoscope. Conclusion The dual dying method that adopts alizarin red Alcian blue could achieve the best dying effect on the skeletons and cartilages of complete fetal rats and filial rats whoes skins,subcutaneous adipose tissue and viscera had been removed,so it is a relatively direct method to study the development of skeletons and cartilages,and also a good method for making display samples for teaching.【总页数】3页(P153-154,157)【作者】张宏;李啸红【作者单位】遵义医学院珠海校区人体解剖与组织胚胎学教研室,广东珠海,519041;遵义医学院珠海校区人体解剖与组织胚胎学教研室,广东珠海,519041【正文语种】中文【相关文献】1.大鼠骨骼双染标本制作方法及要点 [J], 张宏;李啸红2.大鼠与家兔胎仔骨骼的批量单染和双染法 [J], 荆淑芳;吴纯启;廖明阳3.蛇类浸制标本,剥制标本和骨骼标本的制作方法 [J],4.一种高效又环保的动物骨骼标本制作方法——以猫骨骼标本为例 [J], 谈晓梅;田鑫;杜丽超;牛德彪;惠旭洁;韩若羽;郑吉昌;柳东阳;杨雪峰5.双染法在大鼠骨骼发育毒性研究中的应用 [J], 罗聪;任榕娜;胡渝华;陈新民;叶礼燕;黄隽因版权原因,仅展示原文概要,查看原文内容请购买。

神经组织染色方法的研究概况顾兵1,金建波2,李华南2,王烁宇2【摘要】摘要:神经组织染色是研究神经退行性疾病所必需的一项关键的实验技术。
但是,由于染色步骤的复杂和外界因素的干扰,时常导致染色结果的不稳定。
该文就目前国内外建立的神经组织染色方法,包括尼氏染色、神经元染色、神经胶质细胞染色、髓鞘染色、突触染色和神经纤维染色的原理、优缺点及其应用作一概述,以便指导研究者选用合适的染色方法。
【期刊名称】中国药理学通报【年(卷),期】2011(027)010【总页数】4【关键词】关键词:神经组织;染色方法;尼氏染色;铜银染色;FJ染色;髓鞘染色神经退行性疾病(neurodegenerative diseases)是由大脑或脊髓的神经元或其髓鞘的丧失所致,随着时间的推移而恶化,以导致功能障碍[1]。
采用常规染色技术,如HE染色,疾病的某些特殊病理变化难以完全准确的显现,而借助一些特殊染色可对某一特定结构改变进行选择性的浸染。
但是,由于后者染色步骤过于复杂,流程相对繁琐,受外界因素的干扰比较大,经常导致染色结果的不稳定,进而难以反映病理改变。
目前,系统介绍神经组织染色技术进展的文献甚少,使得神经病理学研究人员,尤其是初学者,难以领会各种染色方法的精髓。
根据浸染组织的不同,将神经组织染色分为尼氏染色、神经元染色、神经胶质细胞染色、髓鞘染色、突触染色和神经纤维染色6种。
本文就发展成熟的神经组织染色方法原理、优缺点及其病理学应用作一综述,并简述其在神经退行性疾病研究中的应用,旨在指导研究者选用合适的染色方法。
1 尼氏染色(Nissl staining)尼氏染色方法是德国病理学家Nissl于1892年创立,其主要根据是神经元胞体内含有大量嗜碱性的尼氏小体。
当组织与某些碱性染料(甲粉紫、甲苯胺蓝、硫堇、焦油紫等)作用时,细胞中的尼氏体能够选择性与其结合而着色。
Lindroos[2]对尼氏染色方法进行了改良,并应用于颅脑组织切片的病理研究。

结缔组织染色法1.Mallory三色染色法蓝色:胶原和网状纤维淡蓝色:软骨、粘液、淀粉样变物质红色:神经胶原纤维、肌纤维、酸性颗粒橘红色:髓鞘、红细胞2.Masson三色染色法绿色:胶原纤维红色:肌纤维橘红色:红细胞3.显示胶原、网状和弹性纤维的三联染色法红色:胶原纤维黑色:网状纤维绿色:弹性纤维淡黄色:肌肉、红细胞胶原纤维染色法1.Van Gieson(V.G)苦味酸-酸性品红法黄色:肌纤维、细胞质、红细胞蓝褐色:胞核2.天狼星红(Sirius red)苦味酸染色法红色:胶原纤维绿色:细胞核黄色:其他网状纤维染色Gordon-Sweets银氨染色法黑色:网状纤维红色:胞核(核固红复染)黄棕色:胶原纤维淡红色:细胞质(红液复染)弹性纤维染色Gomori醛复红染色法*甲醛生理盐水液固定的染色效果最佳显示弹性、胶原纤维的双重组合染色法蓝绿色:弹性纤维红色:胶原纤维黄色:背景肌肉组织染色△横纹肌组织染色Mallory磷钨酸苏木精染色法(PTAH)蓝色:胞核、纤维、肌肉、神经胶质纤维、纤维蛋白、横纹肌黄色或枚红色:胶原纤维、网状纤维软骨基质、骨微紫色:粗弹性纤维(有时)紫蓝色或棕黄色:缺血缺氧早期病变的心肌△早期心肌病变组织染色1.Nagar-Olsen染色法(1974年)红色:缺氧心肌、红细胞黄色或黄棕色:正常心肌蓝色:细胞核2.Poley显示缺氧心肌染色法(1964年)红色:缺氧心肌紫色:胞核绿色:其他组织糖类染色过碘酸-Schiff(PAS)染色法红色:糖原及其他PAS反应阳性物质蓝色:细胞核黏液物质(黏多糖)染色1.Mowry阿尔辛蓝过碘酸雪夫(ABPAS)染色法(1956)红色:中性黏液物质蓝色:酸性黏液物质紫红色:混合性黏液物质2.爱先蓝(PH2.5)法蓝色:唾液酸、弱硫酸化黏液物质、一般粘液红色:胞核不着色:强硫酸化黏液物质3、爱先蓝(PH1.0)法蓝色:含硫酸黏液物质不着色:非硫酸化酸性黏液物质红色:复染后的胞核黑色素染色1.Masson-Fontana黑色素银浸染色法黑色:黑色素及嗜银细胞颗粒红色:胶原纤维浅黄色:背景2.Lillie亚铁染色法暗绿色:黑色素浅绿或不着色:背景黄色:肌纤维和背景含铁血黄素染色Perls blue(普鲁士蓝)反应显示三价铁蓝色:含铁血黄素浅红色:其他组织胆色素染色三氯醋酸染色法绿色:胆色素红色和黄色:其他纤维蛋白染色1.Lendrum等MSB染色法*本法的MSB指马休黄猩红蓝法红色:纤维蛋白紫色:陈旧性纤维蛋白蓝色:细胞核黄色:红细胞2.Gram甲紫染色法蓝黑色:纤维蛋白红色:背景淀粉样物质染色1.刚果红染色法红色:淀粉样物质蓝色:细胞核2.Jurgens甲紫染色法红色或紫红色:淀粉样物质蓝色:细胞核真菌染色1.Grocott六胺银染色法*真菌均被着色黑褐色:菌丝和孢子红色:细胞核淡绿色:背景2.高碘酸复红染色法(1994年)紫红色:真菌浅黄色:红细胞细菌染色1.Gram碱性复红结晶紫染色法蓝色:革兰阳性菌红色:革兰阴性菌、细胞核2.Ziehl-Neelsen抗酸杆菌染色法红色:抗酸杆菌3.胃幽门螺杆菌棕黑色或黑色:胃幽门螺杆菌淡黄色:背景螺旋体染色1.Giemsa染色法蓝—淡紫色:螺旋体、细菌蓝色:细胞质橘黄色:红细胞2.Ryu碳酸钠碱性复红法红色:螺旋体病毒包涵体染色Macchiavello包涵体染色法乙型肝炎表面抗原染色1.Shikata地衣红染色法(1974年)棕色:HBsAg阳性2.醛复红改良染色法(1988年)紫色:乙型肝炎表面抗原阳性物质红色:结缔组织黄色:红细胞及基质3.维多利亚蓝染色法蓝绿色:乙型肝炎表面抗原物质红色:细胞核神经组织染色△神经细胞尼氏小体染色方法1.焦油紫(cresyl violet)染色法紫色:尼氏小体淡紫色:胶质细胞2.Einarson棓酸青蓝染色法黑蓝—紫色:尼氏小体蓝色:核浅灰色:背景3.甲苯胺蓝染色方法深蓝色:尼氏小体淡蓝色:细胞核无色:背景△神经纤维的染色方法1.Holmes神经纤维染色方法黑色:神经纤维灰紫色:背景2.Bielschowsky神经纤维染色方法黑色:神经纤维紫色:背景3.V on Braunmubl神经纤维、扣结、老年斑染色方法黑色:神经纤维、扣结、老年斑浅灰色:背景4.Eager退变神经纤维的染色方法黑色:退变神经纤维浅棕色:背景△神经髓鞘的染色方法1.Weigert—Pal髓鞘染色方法黑蓝色:髓鞘淡灰色:背景2.Weil髓鞘染色方法蓝黑色:髓鞘淡灰色:背景3.Kultshitzky髓鞘染色方法(Heidenhains改良法)蓝黑色:髓鞘淡黄色:背景4.Luxol fast blue髓鞘染色方法蓝色:髓鞘紫色:核仁、尼氏小体5.变色酸2R—亮绿髓鞘染色方法深红色:神经髓鞘绿色:轴索、间质不着色:脱髓鞘纤维6.Marchi退变髓鞘染色方法黑色:退变髓鞘浅棕色:背景△神经胶质细胞染色方法1.Cajal星形细胞染色方法(冷冻切片法)紫黑色:原浆性及纤维性星形细胞2.Naoumenko和Feigin改良的Cajal染色方法(石蜡切片法)黑紫色:星形细胞粉红色:背景3.Weil及Davenport小胶质细胞及少突胶质细胞染色方法黑色:神经胶质细胞、少突胶质细胞黄棕色:背景4.Naou menko及Feigin小胶质细胞石蜡切片染色方法黑色:小胶质细胞灰色:背景神经内分泌细胞染色△亲银反应1.Lillie—Masson二胺银反映法黑色:亲银颗粒细胞红色:细胞核灰黄色:背景ori—Burtner六胺银法黑色:亲银细胞浅红色:背景△嗜银反应1.De Grandi改良硝酸银反应法(1970年)棕黑色:嗜银细胞颗粒红色:细胞核2.碱性重氮反应法橘红色至红色:嗜银细胞颗粒蓝色:细胞核黄色:胞质嗜铬细胞染色1.Giemsa改良染色法红色至紫红色:嗜铬细胞蓝色:皮质细胞粉红色:红细胞2.Wiesel染色法黄绿色:嗜铬细胞质红色:细胞核蓝色:其他肥大细胞染色1.甲苯胺蓝改良染色法紫红色:肥大细胞颗粒蓝色:细胞核2.醛复红法深紫色:肥大细胞颗粒橘黄色:红细胞黄色:其他组织DNA染色1.酸水解—无色品红法紫红色:DNA绿色:细胞质、其他成分2.甲基绿—派洛宁法红紫色:细胞质和核仁内的核糖核酸(RNA)绿色或绿蓝色:细胞核染色质内的脱氧核糖核酸(DNA)脂肪染色苏丹Ⅲ—Mayer苏木精染色(冷冻切片)橘红色:中性脂肪蓝色:细胞核。
·药学研究·苦参素对实验性自身免疫性脑脊髓炎小鼠的改善作用及机制Δ李新雨*,楚尧娟,豆萌萌,马睿,黎思露,朱琳 #(郑州大学第一附属医院药学部,郑州 450052)中图分类号 R 965 文献标志码 A 文章编号 1001-0408(2023)10-1177-05DOI 10.6039/j.issn.1001-0408.2023.10.05摘要 目的 探讨苦参素能否通过调控铁死亡途径发挥对实验性自身免疫性脑脊髓炎(EAE )小鼠的改善作用。
方法 将30只雌性C 57BL/6小鼠随机分为正常组、模型组、苦参素组,每组10只。
模型组和苦参素组小鼠以含灭活结核分枝杆菌和MOG 35-55的抗原乳剂诱导复制EAE 模型。
苦参素组小鼠自免疫后第7天开始腹腔注射苦参素注射液(50 mg/kg ),正常组和模型组小鼠腹腔注射等体积生理盐水,每天1次至免疫后第18天。
记录各组小鼠的神经功能学评分,以苏木精-伊红染色法和勒克斯光蓝染色法分别观察脊髓组织炎症细胞浸润和髓鞘脱失情况,以定量逆转录聚合酶链反应法和Western blot 法分别检测其转铁蛋白受体1(TFR 1)、核受体共激活因子4(NCOA 4)、膜铁转运辅助蛋白(Heph )mRNA 和胱氨酸-谷氨酸反向转运体(xCT )、谷胱甘肽过氧化物酶4(GPx 4)蛋白的表达情况。
结果 与正常组比较,模型组小鼠的累计神经功能学评分显著升高(P <0.01),脊髓组织内炎症细胞浸润和髓鞘脱失现象明显,相关评分均显著升高(P <0.01),髓鞘组织中TFR 1、NCOA 4 mRNA 的表达均显著上调,Heph mRNA 和xCT 、GPx 4蛋白的表达均显著下调(P <0.05或P <0.01)。
与模型组比较,苦参素组小鼠上述指标均显著改善(P <0.05或P <0.01)。
结论 苦参素对EAE 小鼠有一定的改善作用,且这种作用可能与调节铁死亡中的铁代谢途径和xCT/GPx 4通路有关。
— 291 —CHINESE JOURNAL OF ANATOMY V ol.43 No.4 2020 解剖学杂志 2020年第43卷第4期doi : 10.3969/j.issn.1001-1633.2020.04.004·论 著·*江苏特聘教授项目(2016-07);江苏省研究生科研创新计划项目(KYCX17-1800)第1作者 E-mail :****************△通信作者, E-mail :*************.cn收稿日期:2019-12-17;修回日期:2020-04-28大鼠脊髓背角Ⅱ、Ⅲ层神经元的高尔基染色特征*邵采凤1, 2 赵明薇2 陈 茜2 杨 鲲2,3△(1 南通市中医院,南通大学附属南通中医院麻醉科,南通 226001;2 江苏大学医学院解剖学教研室,镇江 212013;3 Department of Neurology ,School of Medicine ,University of MarylandBaltimore 21201,USA )摘要 目的:观察大鼠脊髓背角Ⅱ、Ⅲ层神经元的高尔基染色特征。
方法:取成年SD 大鼠腰段脊髓,采用高尔基染色试剂盒进行银染,方法参照试剂盒说明的步骤进行。
结果:Ⅱ层神经元染色较Ⅲ层数量少,基本局限在本层;可观察到岛细胞和柄细胞及朝腹背侧方向的突起;矢状切片提示这些神经元有较长的吻尾方向突起;各方向轴突有棘突,但数量多寡不同。
Ⅲ层神经元胞体较大,并有多方向投射的树突,树突上多见棘突。
结论:大鼠新鲜脊髓组织可以得到理想的高尔基染色结果,背角Ⅱ、Ⅲ层神经元具有不同形态学特征;这些形态学的不同可能是2层细胞功能差异的基础。
关键词 脊髓;背角Ⅱ层;背角Ⅲ层;高尔基染色法;大鼠Golgi staining of neurons in laminae Ⅱ and Ⅲ of the spinal dorsal horn in rats*Shao Caifeng 1, 2, Zhao Mingwei 2, Chen Qian 2, Yang Kun 2,3△(1. Department of Anesthesiology , Nantong Hospital of Traditional Chinese Medicine , Affiliated TraditionalChinese Medicine Hospital of Nantong University , Nantong 226001; 2. Department of Anatomy , School of Medicine , Jiangsu University , Zhenjiang 212013, China ; 3. Department of Neurology ,School of Medicine , University of Maryland , Baltimore 21201, USA )Abstract Objective : To observe the morphology of neurons in laminae Ⅱ and Ⅲ by Golgi staining. Methods : The spinal cord lumbar segments of adult SD rats were Golgi-stained using a commercially available Golgi-Cox staining kit. The procedures were conducted following the instruction. Results : Lamina Ⅱ showed fewer stained cells and smaller soma. Islet cells and stalked cells were found in this layer with different dendrite orientations. In the sagittal panel , both islet and stalked cells showed rostral-caudal directed dendrites. These neurons showed varied numbers of spines on the dendrites. On the other hand , neurons in laminaⅢ showed larger soma size , multiple dendritesand more spines. Conclusion : The fresh tissue in the spinal cord of rats can be well Golgi stained and neurons in the laminae Ⅱ and Ⅲ of the dorsal horn show different morphology and branch orientations. The difference in morphology may underlie the different functions of these two layers.Key words spinal cord ; lamina Ⅱ; lamina Ⅲ; Golgi staining ; rat脊髓背角是接受、调控并上传伤害性信息的初级门户[1]。
病理学技术专业知识和专业实践能力-5(总分51,考试时间90分钟)A1型题以下每一道题下面有A、B、C、D、E五个备选答案,请从中选择一个最佳答案。
1. 甲苯胺蓝染色法显示神经细胞尼氏小体的结果是A.尼氏小体呈淡蓝色,细胞核深蓝色,背景无色B.尼氏小体呈深蓝色,细胞核淡蓝色,背景无色C.尼氏小体呈深蓝色,细胞核绿色,背景无色D.尼氏小体呈蓝色,细胞核绿色,背景黄色E.尼氏小体呈蓝绿色,细胞核红色,背景无色2. Kullshitsky髓鞘染色法的正确结果是A.髓鞘蓝黑色,背景淡灰色B.髓鞘黑色,背景淡红色C.髓鞘蓝黑色,背景淡黄色D.髓鞘蓝黑色,背景红色E.髓鞘蓝绿色,背景淡灰色3. Cajal星形细胞染色方法的结果是A.原浆性及纤维性星形细胞呈蓝紫色B.原浆性及纤维性星形细胞呈紫黑色C.原浆性及纤维性星形细胞呈蓝绿色D.原浆性星形细胞呈黑色,纤维性星形细胞呈紫色E.原浆性星形细胞呈蓝色,纤维性星形细胞呈紫色4. De Grandi改良反应法的正确结果是A.嗜银细胞颗粒呈黑色,胞核呈橘黄色B.嗜银细胞颗粒呈蓝色,胞核呈红色C.嗜银细胞颗粒呈棕黑色,胞核呈红色D.嗜银细胞颗粒呈蓝紫色,胞核呈淡黄色E.嗜银细胞颗粒呈绿色,胞核呈红色5. 高碘酸复红染真菌的正确结果是A.真菌呈浅黄色,红细胞呈紫红色B.真菌呈紫红色,红细胞呈浅黄色C.真菌呈紫红色,红细胞呈橘黄色D.真菌呈红色,红细胞呈紫红色E.真菌呈浅黄色,红细胞呈橘黄色6. 革兰阳性菌染色最基本的染料是A.碱性品红 B.酸性品红C.结晶紫 D.中性红E.亚甲蓝7. 甲苯胺蓝染色呈异染性的细胞是A.嗜铬细胞 B.垂体嗜碱细胞C.类癌细胞 D.肥大细胞E.巨噬细胞8. Lillie-Masson二胺银染色法显示神经内分泌细胞亲银颗粒呈A.棕色 B.黑色 C.蓝色D.紫色 E.绿色9. 下列关于病毒包涵体的描述错误的是A.病毒致病时,其感染的细胞内常形成包涵体B.DNA病毒一般形成核内包涵体C.RNA病毒一般形成胞质内包涵体D.胞质和胞核内可同时见到包涵体E.病毒包涵体需经特殊染色方可见到10. 真菌用高碘酸复红染色法显示为A.紫色 B.红色C.蓝色 D.绿色E.紫红色11. 下列关于螺旋体的描述错误的是A.螺旋体病是一种传染病B.大小介于细菌和原虫之间C.形状为细长、柔韧弯曲螺旋状D.是一种能自由运动的原核细胞微生物E.HE染色高倍显微镜下可见12. Giemsa螺旋体染色法的正确结果是A.螺旋体及细菌呈蓝到淡紫色,细胞质蓝色,红细胞橘黄色B.螺旋体及细菌呈蓝到淡紫色,细胞质红色,红细胞无色C.螺旋体及细菌呈蓝到淡紫色,细胞质橘黄色,红细胞无色D.螺旋体及细菌呈蓝色,细胞质紫色,红细胞呈红色E.螺旋体及细菌呈蓝色,细胞质绿色,红细胞红色13. Giemsa改良染色法的结果是A.嗜铬细胞呈蓝色,皮质细胞呈黄色,红细胞呈红色B.嗜铬细胞呈黑色,皮质细胞呈蓝色,红细胞呈红色C.嗜铬细胞呈蓝紫色,皮质细胞呈绿色,红细胞呈粉红色D.嗜铬细胞呈红色至紫红色,皮质细胞呈蓝色,红细胞呈粉红色 E.嗜铬细胞呈棕色,皮质细胞呈蓝色,红细胞呈粉红色14. Nao menke和Feigin改良的Cajal染色方法的结果是A.星形细胞呈蓝色,背景呈粉红色B.星形细胞呈紫色,背景呈黄色C.星形细胞呈黑色,背景呈粉红色D.星形细胞呈黑紫色,背景呈粉红色E.星形细胞呈黑紫色,背景呈黄色15. 用于显示小胶质细胞的染色方法是A.Cajal染色法 B.Marchi染色法C.Weigert-Pal染色法D.Nao menke和Feigin染色法E.Holmes染色法16. 用焦油紫染色法,显示尼氏小体的颜色是A.紫色 B.棕色 C.红色D.蓝色 E.绿色17. 用于显示退变神经纤维的染色方法是A.Bielschowsky染色法B.Holmes染色法C.V on Braunmubl染色法D.Eager染色法 E.Weil染色法18. Shikata地衣红染色乙型肝炎表面抗原阳性物质的颜色是A.红色 B.紫色 C.蓝色D.棕色 E.绿色19. 下列不能用于显示神经髓鞘的染色方法是A.Weigert-Pal染色法B.Holmes染色法 C.Kullshitsky染色法D.Luxol fast blue染色法E.Weil染色法20. Weil髓鞘染色法的正确结果是A.髓鞘蓝黑色,背景淡灰色B.髓鞘黑色,背景淡黄色C.髓鞘蓝色,背景淡黄色D.髓鞘蓝黑色,背景红色E.髓鞘蓝绿色,背景淡灰色21. Ziehl-Neelsen染色法区分结核杆菌和麻风杆菌,下列描述错误的是A.两者均显示抗酸杆菌阳性反应B.结核杆菌呈细长和带弯曲的杆状菌,长短粗细不一C.麻风杆菌较短、粗,聚集成堆D.结核杆菌呈红色,麻风杆菌呈黄色E.结核性干酪样坏死灶内显示抗酸杆菌阳性反应可明确诊断22. Bielschowsky神经纤维染色的正确结果是A.神经纤维呈蓝色,背景呈黄色B.神经纤维呈绿色,背景呈黄色C.神经纤维呈黑色,背景呈紫色D.神经纤维呈蓝绿色,背景不着色E.神经纤维呈紫色,背景呈黄色23. Gomori-Burtner六胺银法显示神经内分泌细胞的结果是A.亲银细胞呈黑色,背景呈淡黄色B.亲银细胞呈棕色,背景呈浅红色C.亲银细胞呈紫蓝色,背景呈浅红色D.亲银细胞呈黑色,背景呈浅红色E.亲银细胞呈绿色,背景不着色24. 能同时显示神经纤维、扣结以及老年斑的染色方法是A.Bielschowsky染色法B.Holmes染色法C.V on Braunmubl染色法D.Eager染色法 E.Weil染色法25. 关于胃幽门螺杆菌的描述错误的是A.短杆状,两端微弯的革兰阴性杆菌B.与慢性胃炎和消化性溃疡的发生有关C.具有嗜银性,经硝酸银染色呈棕黑色D.含有蛋白和多糖等物质E.是胃幽门部所独有的致病菌26. Grocott六胺银染色法真菌显示的颜色是A.红色 B.绿色C.紫蓝色 D.黑褐色E.橘黄色27. 抗酸杆菌染色最基本的染料是A.酸性复红 B.碱性复红C.中性红 D.结晶紫E.亚甲蓝28. 锇酸α-萘胺染色法的结果错误的是A.变性髓鞘呈黑色 B.正常髓鞘呈红色C.红细胞呈淡红色 D.结缔组织呈蓝色E.尼氏小体呈紫色29. 能同时显示髓鞘和尼氏小体的染色方法是A.Weigert-Pal染色法B.Marchi染色法 C.Kullshitsky染色法D.Luxol fast blue染色法E.Weil染色法30. 关于亲银反应和嗜银反应的描述错误的是A.都可用于显示神经内分泌细胞染色B.亲银反应指的胞质中的颗粒能直接使银离子还原C.嗜银反应需加入外源性还原剂后才具有银还原性D.无论是亲银反应还是嗜银反应均须加入外源性还原剂才具有银还原性 E.在整个产肽细胞系中,其银染色反应性不一样31. 常用的抗酸杆菌染色方法是A.Giemsa染色法B.Ziehl-Neelsen染色法C.Gram染色法D.Grocott六胺银染色法E.Warthin-starry染色法32. 鉴别疱疹病毒感染时的核内包涵体需用的染色方法是A.HE染色B.Macchiavello包涵体染色法C.Giemsa染色法 D.Gram染色法E.Ziehl-Neelsen染色法33. 用于显示乙型肝炎表面抗原的染色方法是A.地衣红染色法 B.甲苯胺蓝染色法C.高碘酸复红染色法 D.甲基紫染色法E.普鲁士蓝染色法34. HBsAg醛复红改良染色法的结果是A.HBsAg阳性物质呈紫色,结缔组织呈红色,红细胞和基质呈黄色 B.HBsAg阳性物质呈红色,结缔组织呈绿色,红细胞和基质呈黄色 C.HBsAg阳性物质呈红色,结缔组织呈蓝色,红细胞和基质呈黄色 D.HBsAg阳性物质呈紫色,结缔组织呈黄色,红细胞和基质呈红色 E.HBsAg阳性物质呈橙色,结缔组织呈绿色,红细胞和基质呈红色35. Gram碱性复红结晶紫染色法的结果正确的是A.革兰阳性细菌呈蓝色,阴性细菌呈红色,细胞核呈红色B.革兰阳性细菌呈红色,阴性细菌呈蓝色,细胞核呈红色C.革兰阳性细菌呈蓝色,阴性细菌呈紫色,细胞核呈红色D.革兰阳性细菌呈紫色,阴性细菌呈红色,细胞核呈蓝色E.革兰阳性细菌呈黑色,阴性细菌呈红色,细胞核呈绿色36. 维多利亚蓝染色法HBsAg阳性物质的结果是A.HBsAg阳性物质呈黑色,细胞核呈红色B.HBsAg阳性物质呈蓝紫色,细胞核呈红色C.HBsAg阳性物质呈红色,细胞核呈蓝色D.HBsAg阳性物质呈蓝绿色,细胞核呈红色E.HBsAg阳性物质呈蓝色,细胞核呈黄色37. 变色酸2R(chromcmope 2R)-亮绿染色法可把髓鞘染成A.红色 B.黄色 C.蓝色D.绿色 E.紫色38. Weil及Davenport小胶质细胞和少突胶质细胞染色的结果是A.神经胶质细胞和少突胶质细胞呈蓝色,背景黄棕色B.神经胶质细胞和少突胶质细胞呈紫色,背景淡黄色C.神经胶质细胞和少突胶质细胞呈绿色,背景黄色D.神经胶质细胞和少突胶质细胞呈黑色,背景粉红色E.神经胶质细胞和少突胶质细胞呈黑色,背景黄棕色39. Holmes染色法是显示神经组织的A.尼氏小体 B.神经轴突C.星形细胞 D.神经髓鞘E.神经纤维40. Holmes神经纤维染色时,神经纤维呈A.蓝色 B.红色 C.淡棕色D.紫色 E.黑色41. 下列不能用于显示神经内分泌细胞的染色方法是A.碱性重氮反应法B.De Grandi改良硝酸银法C.Lillie-Masson二胺银反应法D.Gomori-Burtner六胺银反应法E.Gomori银染色法42. 碱性重氮反应法嗜银细胞颗粒的颜色是A.棕黑色 B.橘黄色至黄色C.蓝黑色至蓝色 D.黑色E.橘红色至红色43. 用于显示退变髓鞘的染色方法是A.Weiger-Pal染色法B.Marchi染色法 C.Kullshitsky染色法D.Luxol fast blue染色法E.Weil染色法44. 显示产肽激素细胞的亲银反应在浸银后不用A.氧化剂 B.漂白剂C.还原剂 D.媒染剂E.促染剂B型题以下提供若干组考题,每组考题共同在考题前列出A、B、C、D、E五个备选答案,请从中选择一个与考题关系最密切的答案。
大鼠皮质脊髓束的磁共振与DiI示踪对照研究常丽荣;高秀来;张帆;陈亚亮;杨连雪;李坤成;于春水【期刊名称】《中国临床解剖学杂志》【年(卷),期】2007(25)6【摘要】目的:验证Mn2+增强磁共振技术与DiI荧光示踪技术对于大鼠皮质脊髓束的追踪效果,并对两种方法进行比较评价。
方法:采用Wistar大鼠30只,随机分为MnCl2组和DiI组各15只,分别经感觉运动区皮层进行MnCl2(0.8mol/L)注射和5%DiI涂布。
MnCl2组,于术后24h行MR扫描;DiI组动物存活10d后,灌杀、切片、观察。
结果:两种方法在颈髓以上节段对皮质脊髓束的示踪结果一致。
结论:Mn2+增强磁共振技术与DiI荧光示踪技术对皮质脊髓束的示踪效果好,二者结合应用,对临床影像学神经束路追踪研究具有较大的应用价值。
【总页数】3页(P684-686)【关键词】DiI;Mn^2+;磁共振成像;皮质脊髓束【作者】常丽荣;高秀来;张帆;陈亚亮;杨连雪;李坤成;于春水【作者单位】首都医科大学解剖学教研室;首都医科大学宣武医院放射科【正文语种】中文【中图分类】R322.8【相关文献】1.磁共振弥散张量神经束示踪术定量评价早产新生儿皮质脊髓束的临床观察 [J], 何健龙;全显跃;曹满瑞;朱志军;张方璟;杜牧2.生物素葡聚糖胺对大鼠皮质脊髓束的顺行示踪技术研究 [J], 龚标;李长清;李小凤;牛陵川3.生物素葡聚糖胺皮质脊髓束顺行示踪技术在大鼠脊髓损伤模型中的应用 [J], 王星星;查伟光;易林华;郭晓明;Stephen M.Strittmatter4.BDA皮质脊髓束神经顺行示踪在大鼠脊髓损伤模型中的应用 [J], 徐开明;王星星5.生物素化葡聚糖胺示踪显示大鼠皮质脊髓束的实验研究 [J], 郭西良;王昭君;朱兴宝;冯忠堂;王廷华因版权原因,仅展示原文概要,查看原文内容请购买。
皮肤组织神经髓鞘几种染色方法的比较
郝春荣;任大宏;刘绍春
【期刊名称】《中国组织化学与细胞化学杂志》
【年(卷),期】2001(010)003
【摘要】对皮肤组织神经髓鞘应用髓磷脂硷性蛋白(myelin basic protein 简称MBP )免疫组织化学、劳克坚牢蓝(Luxol fast blue ,简称LFB)、砂罗铬花青(solochrome cyanine 简称SC )、KOH-HIO4 -Schiff 四种不同的染色方法进行染色比较.结果显示:MBP 法具有特异性强、背景干净、对比清晰等特点.SC、Schiff法髓鞘着色效果亦较好,但背景中其他组织也着色.只要分化适当,LFB法髓鞘着色鲜明,且有一定特异性.
【总页数】3页(P320-322)
【作者】郝春荣;任大宏;刘绍春
【作者单位】华中科技大学同济医学院病理学教研室;华中科技大学同济医学院病理学教研室;华中科技大学同济医学院病理学教研室
【正文语种】中文
【中图分类】R36
【相关文献】
1.三种视神经髓鞘染色法的比较 [J], 莫静;邵玉红;瞿佳
2.皮肤组织肥大细胞染色的两种方法比较 [J], 吴钦穗;郑曦;徐斌;高美钦
3.固绿髓鞘染色法和Bielschowsky神经轴突染色法在诊断中枢神经脱髓鞘假瘤中
的应用 [J], 曾赛凡;张声
4.两种神经髓鞘染色法的比较 [J], 林华;唐瑞文
5.两种髓鞘染色方法在Cuprizone诱导脱髓鞘小鼠模型中的比较 [J], 张丽;尹琳琳;李林
因版权原因,仅展示原文概要,查看原文内容请购买。
大鼠皮质脊髓束Luxol Fast Blue染色
作者:吕广明,吴辉群,栗卓,刘苏,韩笑,季达峰
【摘要】目的:探讨显示大鼠皮质脊髓束的特殊染色方法。
方法:选用正常成年SD大鼠延髓和脊髓冰冻切片,应用Luxol Fast Blue 染色法进行染色。
结果:Luxol Fast Blue染色后,在延髓和脊髓切片中可见灰质呈淡红色,白质呈蓝色,延髓锥体染成深蓝色。
锥体中Luxol Fast Blue标记的深蓝色阳性纤维,经锥体交叉后至脊髓灰质后连合背侧,沿脊髓后索腹侧深层下行,至荐段后逐渐消失。
在延髓锥体和脊髓颈、胸、腰段后索中,深蓝色的Luxol Fast Blue阳性纤维边界清晰,与周围结构区分明显。
结论:运用Luxol Fast Blue 染色可清楚显示大鼠皮质脊髓束在脊髓内的定位,是一种简便可靠的皮质脊髓束形态学研究方法。
【关键词】皮质脊髓束;Luxol Fast Blue;髓鞘染色;大鼠
[Abstract] Objective: To explore the special staining method for revealing the localization of corticospinal tract in rats. Methods: Luxol Fast Blue staining method was utilized to stain the sections of medulla oblongta and spinal cord of the normal adult Sprague-Dawley rats. Results: In Luxol Fast Blue
staining sections, the gray matter of medulla oblongta and spinal cord was stained in light red, while the white matter around the gray matter was dyed in blue. The dark blue stained Luxol Fast Blue labeled fibers in the pyramid passed through the pyramidal decussation to the contralateral side, descended at the ventral part of posterior funiculus just dorsal to the gray commissure throughout most of the length of the spinal cord and progressively diminished to end at the sacral spinal segments. The Luxol Fast Blue positive fibers in the pyramid and the ventral part of posterior funiculus at cervical, thoracic, lumbar spinal segments were easily discriminated from the surrounding structures. Conclusion: Using Luxol Fast Blue staining method may demonstrate the localization and distribution of corticospinal tract in the spinal cord of rats, which is an easy and effective method in morphological study of corticospinal tract.
[Key Words] Corticospinal tract;Luxol Fast Blue;Myelin stain;Rat
长期以来,脊髓损伤后皮质脊髓束的再生修复研究一直是神经科学研究的热点。
最近有人尝试运用微电子芯片技术重建皮质脊髓束功
能[1]。
此项研究中一个关键指标就是皮质脊髓束在脊髓内定位和走行情况。
常用的组织学染色方法不能显示皮质脊髓束,本实验采用Luxol Fast Blue染色法对大鼠皮质脊髓束进行形态学研究,取得良好效果。
1 材料和方法
1.1 材料选用健康成年SD大鼠6只,清洁级,体重250~300g,雌雄不拘,由南通大学实验动物中心提供。
0.1 % Luxol Fast Blue 液(Sigma公司),Leica CM1900冰冻切片机,显微镜为Leica DMR 显微镜(Leica公司,德国)。
1.2 方法切片制备:给予大鼠复合麻醉剂(0.2 ml/100g体重),腹腔注射麻醉后开胸,穿心脏经升主动脉灌注,先用温(37℃)生理盐水200 ml冲净血液,再用预冷(4℃)的含4%多聚甲醛的磷酸盐缓冲液500 ml快速灌注固定,1 h后取脑和脊髓放入含4%多聚甲醛的PB溶液中后固定4~6 h,再移入30%蔗糖的PB溶液中4℃过夜,待组织沉底后取脑(延髓)和脊髓颈、胸、腰、荐段行连续横切面冰冻切片,切片厚度为30 μm,直接贴于预先涂有明胶的载玻片上,置室温下晾干待用。
Luxol Fast Blue 染色:(1)将切片放入乙醇∶氯仿溶液(无水乙醇和氯仿的体积比为1∶1)中5 min;(2)将切片置入 95%乙醇溶。