高考化学一轮复习排查落实练1化学与STSE练习新人教版08091142.doc
- 格式:doc
- 大小:45.00 KB
- 文档页数:6

人教化学2019高考一轮选习练题(1)含答案李仕才一、选择题1、对物质的量的理解正确的是()A.物质的量就是物质的质量的另一种表达方式,单位是g/molB.物质的量就是物质的数量,数值上等于式量,单位是molC.物质的量就是6.02×1023个微粒的质量,单位是gD.物质的量是国际单位制中的一个物理量,表示含有一定数目微粒的集体【答案】D2、下列离子方程式书写正确的是()A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++OH-+Ba2++SO42-=H2O+BaSO4↓B.FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-C.用两个铜电极电解食盐水:2Cl-+2H2O=2OH-+H2↑+Cl2↑D.用三氯化铁溶液腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+【答案】B【解析】A.溶液呈中性的反应为:2H++2OH-+Ba2++SO42-=2H2O+BaSO4↓,A错误;B.Cl比Br的非金属性强,能将Br-氧化,同时将铁离子氧化,根据电荷守恒和物料守恒,B正确;C.阳极为金属时,将首先失去电子生成Cu2+,负极为H得到电子生成氢气,C错误;D.未配平,2Fe3++Cu=2Fe2++Cu2+,D错误。
故选择B。
3、下列物质的性质和用途描述错误的是A.铜质地漏具有独特的杀菌功能,能较好的抑制细菌生长B.明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用C.铁粉具有还原性,可用作食品袋内的抗氧化剂D.镁燃烧发出耀眼的白光,可以制造照明弹【答案】B【解析】A.细菌是由蛋白质构成的,铜是重金属,可使蛋白质变性,从而杀灭细菌,故A正确;B.明矾溶于水生成胶状物可吸附悬浮于水中的杂质,不能除掉可溶性杂质和细菌等,不能起到消毒杀菌的作用,故B错误;C.铁粉具有还原性,易与氧气反应,可作食品抗氧化剂,故C正确;D.镁能在空气中燃烧发出耀眼的白光,可以用于制造照明弹,故D正确;故答案选B。
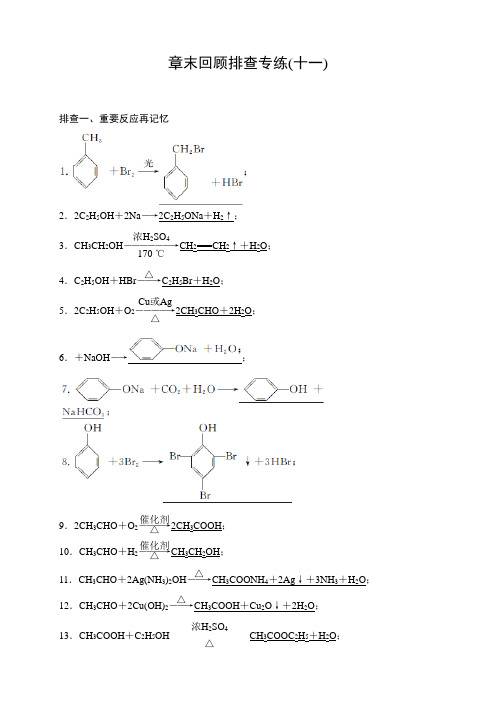
章末回顾排查专练(十一)排查一、重要反应再记忆2.2C 2H 5OH +2Na ―→2C 2H 5ONa +H 2↑;3.CH 3CH 2OH ――――――→浓H 2SO 4170 ℃CH 2===CH 2↑+H 2O ; 4.C 2H 5OH +HBr ――→△C 2H 5Br +H 2O ;5.2C 2H 5OH +O 2――――→Cu 或Ag △2CH 3CHO +2H 2O ; 6.+NaOH ―→;9.2CH 3CHO +O 2―――→催化剂△2CH 3COOH ; 10.CH 3CHO +H 2―――→催化剂△CH 3CH 2OH ; 11.CH 3CHO +2Ag(NH 3)2OH ――→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O ;12.CH 3CHO +2Cu(OH)2――→△CH 3COOH +Cu 2O ↓+2H 2O ;13.CH 3COOH +C 2H 5OH 浓H 2SO 4△CH 3COOC 2H 5+H 2O ;14.CH 3COOC 2H 5+H 2O 稀H 2SO 4△CH 3COOH +C 2H 5OH ;15.乙二醇和乙二酸生成聚酯n HOCH 2—CH 2OH +n HOOC —COOH 一定条件排查二、常考易错再排查1.按碳原子组成的分子骨架分,有机物可分为链状化合物和环状化合物,环状化合物又包括脂环化合物和芳香族化合物。
按官能团分,有机物可分为烃(烷烃、烯烃、炔烃、芳香烃)和烃的衍生物(卤代烃、醇、酚、醛、酸、酯等)。
( )2.具有相同分子式,不同结构的化合物互为同分异构体。
包括碳链异构(如CH 3CH 2CH 2CH 3与)、位置异构(如CH 3CH===CHCH 3与CH 3CH 2CH===CH 2)、官能团异构(如CH 3CH 2OH 与CH 3OCH 3)、顺反异构(顺2-丁烯与反2-丁烯)、手性异构等。
( )3.发生加成反应或加聚反应的有机物分子必须含有不饱和键。
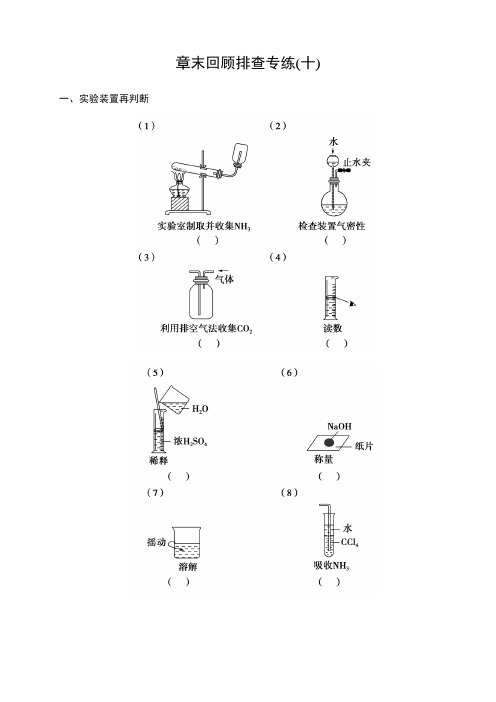
章末回顾排查专练(十)一、实验装置再判断自主核对(1)×(2)√(3)×(4)×(5)×(6)×(7)×(8)√(9)√(10)√(11)×(12)√(13)√(14)×(15)×(16)×(17)×(18)√(19)×(20)√(21)×(22)×(23)√(24)×(25)√二、操作要点再辨析1.如果不慎将酸粘到皮肤或衣物上,立即用较多的水冲洗(如果是浓硫酸,必须迅速用抹布擦拭,然后用水冲洗),再用3%~5%的NaHCO3溶液来冲洗。
() 2.如果将碱溶液粘到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
()3.可直接加热的常见仪器有试管、蒸发皿、坩埚。
其中蒸发皿用于溶液浓缩或蒸发,坩埚用于固体物质的高温灼烧,且二者都需要用坩埚钳夹取。
()4.须垫石棉网加热的常见仪器有烧瓶、锥形瓶、烧杯。
()5.三种计量仪器的读数:①托盘天平:0.1 g;②量筒:0.1 mL;③滴定管:0.01 mL。
其中量筒无“0”刻度,滴定管的“0”刻度在上。
()6.可用石蕊试纸定性检验溶液的酸、碱性。
如用蓝色石蕊试纸置于导管口可检验氨气。
()7.pH试纸可定量(粗略)测定溶液的酸碱性强弱;淀粉KI试纸可检验Cl2等氧化性物质;品红试纸可检验SO2等漂白性物质。
()8.过滤所需的主要仪器有铁架台(附铁圈)、烧杯、漏斗、玻璃棒;蒸发所需的主要仪器有铁架台(附铁圈)、酒精灯、蒸发皿、玻璃棒。
()9.蒸馏是利用液态混合物中各组分的沸点不同,除去易挥发、难挥发或不挥发的杂质的方法。
所需主要玻璃仪器有酒精灯、蒸馏烧瓶、温度计、冷凝管等。
() 10.萃取是利用物质在互不相溶的溶剂里溶解性的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来的方法。
分液是将两种互不相溶的液体分开的操作。

3 43 42019 人教版高考化学一轮训导练(1)及答案一、选择题1.下列叙述中正确的是( )A .物质的溶解过程,实质上就是其电离过程B .H 2SO 4 溶于水能导电,液态 H 2SO 4 不导电,故 H 2SO 4 不是电解质C .1 L 0.1 mol·L -1 的 H 2SO 4 溶液中含有 0.2 mol H +D .1 L 0.1 mol·L -1 的 HClO 溶液中含有 0.1 mol H +解析:非电解质溶解时不存在电离的过程,A 错误;H 2SO 4 溶于水电离出自由移动的离子能导电,H 2SO 4 是电解质,B 错误;H 2SO 4 是强电解质,能完全电离,而HClO 是弱电解质,只能部分电离,C 正确,D 错误。
答案:C2.下列物质在水溶液中的电离方程式书写错误的是()A .NaHCO 3===Na ++H ++CO 2-B .NaHSO 4===Na ++H ++SO 2-C .MgCl 2===Mg 2++2Cl -D .Ba(OH)2===Ba 2++2OH -解析:HCO -是弱酸的酸式酸根离子,不能拆分,A 项书写错误;而 HSO -为强酸的酸式酸根离子,应拆分,B 项书写正确;MgCl 2、Ba(OH)2 分别为可溶性盐和强碱,都属于强电解质,C 、D 项书写正确。
答案:A3.某同学通过系列实验,探究 Cu 及其化合物的性质,下列操作正确且能达到目的的是()A .将铜粉和硫粉混合均匀加热以制取 CuSB .将 Cu 片放入过量浓硫酸中,一段时间后加水以观察 CuSO 4 溶液的颜色C .向 CuSO 4 溶液中加入 NaOH 溶液,过滤洗涤并收集沉淀,加热以制取 CuOD .设计 Cu —Al —浓硝酸原电池,以证明金属活动性:Cu<Al解析:铜粉和硫粉反应生成 Cu 2S ,故 A 错;Cu 与浓硫酸的反应需要加热,故 B 错;Al 在浓硝酸中发生钝化,故在 Cu -Al -浓硝酸原电池中,Cu 发生氧化反应, 作负极,不能证明金属活动性:Cu<Al ,故 D 错。

排查落实练二常考易错的50个离子方程式书写再落实1. 向水中通入氯气:_____________________________________答案:Cl 2+H 2O H ++Cl -+HClO 2. 实验室制备氯气:_______________________________________________________答案:MnO 2+4H ++2Cl -=====△Mn 2++Cl 2↑+2H 2O 3. 工业制漂白粉:_______________________________________________________答案:Cl 2+Ca(OH)2===Ca 2++ClO -+Cl -+H 2O4. 工业制备氯气:_______________________________________________________答案:2Cl -+2H 2O=====电解Cl 2↑+H 2↑+2OH - 5. NH 4HCO 3溶液与过量的KOH 浓溶液共热:_______________________________________________________答案:NH +4+HCO -3+2OH -=====△NH 3↑+CO 2-3+2H 2O 6. NH 4HCO 3溶液与足量的Ba(OH)2溶液混合共热:_______________________________________________________答案:NH +4+HCO -3+Ba 2++2OH -=====△NH 3↑+BaCO 3↓+2H 2O 7. MgSO 4溶液与Ba(OH)2溶液反应:_______________________________________________________答案:Mg 2++2OH -+SO 2-4+Ba 2+===BaSO 4↓+Mg(OH)2↓8. 向NaHCO 3溶液中加入过量澄清石灰水:_______________________________________________________答案:HCO -3+Ca 2++OH -===CaCO 3↓+H 2O9. 向澄清石灰水中加入过量NaHCO 3溶液:_______________________________________________________答案:Ca2++2OH-+2HCO-3===CaCO3↓+CO2-3+2H2O10. 向AlCl3溶液中加入过量氨水:_______________________________________________________答案:Al3++3NH3·H2O===Al(OH)3↓+3NH+411. 向Al2(SO4)3溶液中加入过量NaOH溶液:_______________________________________________________答案:Al3++4OH-===AlO-2+2H2O12. 铝与NaOH溶液反应:_______________________________________________________答案:2Al+2OH-+2H2O===2AlO-2+3H2↑13. 硅与NaOH溶液反应:_______________________________________________________答案:Si+2OH-+H2O===SiO2-3+2H2↑14. 大理石溶于醋酸:_______________________________________________________答案:CaCO3+2CH3COOH===Ca2++2CH3COO-+H2O+CO2↑15. 铜与稀硝酸反应:_______________________________________________________答案:3Cu+2NO-3+8H+===3Cu2++2NO↑+4H2O16. 明矾溶于水形成胶体:_______________________________________________________答案:Al3++3H2O Al(OH)3(胶体)+3H+17. Fe3O4溶于足量稀硝酸:_______________________________________________________答案:3Fe3O4+28H++NO-3===9Fe3++NO↑+14H2O18. 铁和过量稀硝酸反应:_______________________________________________________答案:Fe+4H++NO-3===Fe3++NO↑+2H2O19. 过量铁粉与稀硝酸反应:_______________________________________________________答案:3Fe+8H++2NO-3===3Fe2++2NO↑+4H2O20. 氧化铝溶于NaOH溶液:_______________________________________________________答案:Al2O3+2OH-===2AlO-2+H2O21. 氢氧化铝溶于NaOH溶液:_______________________________________________________答案:Al(OH)3+OH-===AlO-2+2H2O22. 向NaAlO2溶液中通入足量CO2气体:_______________________________________________________答案:AlO-2+2H2O+CO2===Al(OH)3↓+HCO-323. 向苯酚钠溶液中通入少量CO2气体:_______________________________________________________答案:HCO-324. 小苏打与NaOH溶液混合:_______________________________________________________答案:HCO-3+OH-===H2O+CO2-325. CuSO4溶液中通入H2S气体:_______________________________________________________答案:Cu2++H2S===CuS↓+2H+26. 向FeBr2溶液中通入少量氯气:_______________________________________________________答案:2Fe2++Cl2===2Fe3++2Cl-27. 向FeBr2溶液中通入过量氯气:_______________________________________________________答案:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-28. 向FeBr2溶液中通入等物质的量的氯气:_______________________________________________________答案:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-29. 向澄清石灰水中通入过量CO2气体:_______________________________________________________答案:OH-+CO 2===HCO -330. 向Fe(NO 3)2溶液中滴入盐酸:_______________________________________________________ 答案:3Fe 2++NO -3+4H +===3Fe 3++NO↑+2H 2O31. 向沸水中滴加FeCl 3溶液制备Fe(OH)3胶体:_______________________________________________________答案:Fe 3++3H 2O=====△Fe(OH)3(胶体)+3H + 32. 向FeCl 3溶液中加入铜粉:_______________________________________________________ 答案:2Fe 3++Cu===2Fe 2++Cu 2+33. 氢氧化铁溶于氢碘酸溶液:_______________________________________________________ 答案:2Fe(OH)3+6H ++2I -===I 2+2Fe 2++6H 2O34. 用硫氰化钾溶液检验Fe 3+:_______________________________________________________ 答案:Fe 3++3SCN -===Fe(SCN)335. NO 2气体溶于水:_______________________________________________________ 答案:3NO 2+H 2O===2H ++2NO -3+NO36. KMnO 4溶液与浓盐酸反应:_______________________________________________________ 答案:2MnO -4+10Cl -+16H +===2Mn 2++5Cl 2↑+8H 2O37. KClO 3溶液与浓盐酸反应:_______________________________________________________ 答案:ClO -3+5Cl -+6H +===3Cl 2↑+3H 2O38. KMnO 4溶液与H 2O 2反应:_______________________________________________________ 答案:2MnO -4+5H 2O 2+6H +===2Mn 2++5O 2↑+8H 2O39. FeSO 4溶液中加入用H 2SO 4酸化的H 2O 2溶液:_______________________________________________________答案:2Fe2++H2O2+2H+===2Fe3++2H2O40. 0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:_______________________________________________________答案:NH+4+Al3++2SO2-4+2Ba2++4OH-===NH3·H2O+Al(OH)3↓+2BaSO4↓41. 向明矾溶液中加入过量的Ba(OH)2溶液:______________________________________________________________________________________________________________答案:Al3++2SO2-4+2Ba2++4OH-===2BaSO4↓+AlO-2+2H2O42. 亚硫酸钠溶液中加入足量HNO3:_______________________________________________________答案:3SO2-3+2H++2NO-3===3SO2-4+2NO↑+H2O43. 亚硫酸氢钠溶液中滴加硫酸氢钠溶液:_______________________________________________________答案:HSO-3+H+===H2O+SO2↑44. Na2O2与H2O反应:_______________________________________________________答案:2Na2O2+2H2O===4Na++4OH-+O2↑45. 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:_______________________________________________________答案:3ClO-+2Fe(OH)3+4OH-===2FeO2-4+3Cl-+5H2O46. 漂白粉溶液在空气中失效:_______________________________________________________答案:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO47. 硅酸钠溶液与醋酸溶液混合:_______________________________________________________答案:SiO2-3+2CH3COOH===H2SiO3↓+2CH3COO-48. FeCl3溶液中滴入Na2S溶液:_______________________________________________________答案:2Fe3++S2-===2Fe2++S49. Fe2(SO4)3溶液中通入SO2气体:答案:2Fe3++SO2+2H2O===2Fe2++SO2-4+4H+50. 向NaHSO4溶液中滴入Ba(OH)2溶液至SO2-4沉淀完全:_______________________________________________________ 答案:H++SO2-4+Ba2++OH-===BaSO4↓+H2O。

人教化学2019高考一轮训练选(1)李仕才一、选择题1、化学与生活密切相关,下列有关说法错误的是A.硅胶可用作袋装食品的干燥剂B.属于糖类、油脂、蛋白质的物质均可发生水解反应C.煤属于一次能源,电力属于二次能源D.被蜂蚊蛰咬后,可徐抹稀氨水或小苏打溶液减轻疼痛【答案】B【解析】A、硅胶主要成分是硅酸形成的胶体,具有多孔无毒的性质,可作食品干燥剂,A 正确;B、糖类中的单糖不能水解,油脂和蛋白质均可水解,B错误;C、煤可以直接燃烧放出能量,属于一次能源,电力是由其他能源转化而来的,属于二次能源,C正确;D、蜜蜂叮咬后释放出一种蚁酸的物质,稀氨水或小苏打溶液可与蚁酸反应,从而减轻疼痛,D正确。
正确答案为B。
2、25℃时,下列各组离子在指定溶液中一定能大量共存的是( )A.无色透明的溶液中:K+、Cu2+、NO、Cl-B.0.1 mol·L-1CaCl2溶液中:Mg2+、NH、CO、SOC.pH=12的溶液:Na+、K+、SiO、Cl-D.使甲基橙变红的溶液中:Na+、Fe2+、NO、Cl-【答案】C3、向含1 mol NaHCO3的溶液中逐滴加入含b mol Ca(OH)2的溶液,充分反应。
下列说法不.正确..的是 ( )A.滴加Ca(OH)2立即有沉淀生成B.当b=0.5mol时,发生的离子反应:HCO3-+OH-+Ca2+=CaCO3↓+H2OC.当b=1mol时,反应后的溶液中几乎不存在Ca2+D.当b=1.5mol时,往溶液中再通入少量CO2,还会有沉淀生成【答案】B4、下列解释事实的方程式中,不正确...的是A.铜和浓HNO3反应可用于制NO2气体:Cu+ 4HNO3((浓) = Cu(NO3)2 + 2NO2↑+ 2H2O B.“84”消毒液中滴少量白醋可增强漂白性:ClO- + H+ = HClOC.氨水吸收少量SO2防止污染空气:2NH3·H2O + SO2 = 2NH4+ + SO32-+ H2OD.Na2O2在潜艇中可用于吸收二氧化碳并供氧:2Na2O2 +2CO2=2Na2CO3 + O2【答案】B5、右表为周期表的一部分,其中X、Y、W、Z为短周期元素,T单质常温下为液体。
阶段排查落实练(三) 钠、铝、铁及其重要化合物1.钠及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写出离子方程式。
①Na 和H 2O 的反应2Na +2H 2O===2Na ++2OH -+H 2↑ ;②Na 在空气中燃烧2Na +O 2=====点燃Na 2O 2 ;③Na 2O 2和H 2O 的反应2Na 2O 2+2H 2O===4Na ++4OH -+O 2↑ ;④Na 2O 2和CO 2的反应2Na 2O 2+2CO 2===2Na 2CO 3+O 2 ;⑤向NaOH 溶液中通入过量CO 2OH -+CO 2===HCO -3 ;⑥将Na 2CO 3溶液与石灰乳混合CO 2-3+Ca(OH)2===CaCO 3↓+2OH - ;⑦向Na 2CO 3稀溶液中通入过量CO 2CO 2-3+CO 2+H 2O===2HCO -3 ;⑧将NaHCO 3溶液和NaOH 溶液等物质的量混合HCO -3+OH -===CO 2-3+H 2O ;⑨将NaHCO 3溶液与澄清石灰水等物质的量混合HCO -3+Ca 2++OH -===CaCO 3↓+H 2O ;⑩将NaHCO 3溶液与少量澄清石灰水混合2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O 。
2.铝及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Al和NaOH溶液的反应2Al+2OH-+2H2O===2AlO-2+3H2↑;②Al(OH)3和NaOH溶液的反应Al(OH)3+OH-===AlO-2+2H2O ;③Al(OH)3和盐酸的反应Al(OH)3+3H+===Al3++3H2O ;④Al2O3和NaOH的反应Al2O3+2OH-===2AlO-2+H2O ;⑤Al2O3和盐酸的反应Al2O3+6H+===2Al3++3H2O ;⑥NaAlO2和过量盐酸的反应AlO-2+4H+===Al3++2H2O ;⑦向NaAlO2溶液中通入过量CO2气体AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3;⑧将NaAlO2溶液与NaHCO3溶液混合AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3;⑨将NaAlO2溶液与AlCl3溶液混合3AlO-2+Al3++6H2O===4Al(OH)3↓;⑩将AlCl3溶液与NaHCO3溶液混合Al 3++3HCO -3===Al(OH)3↓+3CO 2↑ ;3.铁及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。
人教化学2019高考一轮选训习题(1)李仕才一、选择题1、(2018·江西九江联考)设N A 为阿伏加德罗常数的值。
下列说法正确的是( C )A .0.5 mol Cu 与足量的S 反应转移的电子数为N AB .在粗铜精炼的实验中,阳极质量减少6.4 g ,则电解过程中转移的电子数为0.2N AC .2 gD 2O 和H 2 18O 的混合物中含有的中子数为N AD .46 g 有机物C 2H 6O 中含有极性共价键的数目一定为7N A解析 Cu 与S 反应生成Cu 2S,0.5 mol Cu 与足量的S 反应转移的电子数为0.5N A ,A 项错误;精炼铜时,阳极减少的不都是Cu ,还有Zn 、Fe 、Ni 等杂质金属,所以阳极质量减少6.4 g 时转移的电子数不是0.2N A ,B 项错误;D 2O 和H 2 18O 的摩尔质量相同,均为20 g·mol -1,中子数也相同,均为10,故2 g D 2O 和H 2 18O 的混合物的物质的量是0.1 mol ,所含中子数为N A ,C 项正确;C 2H 6O 可以是乙醇,也可以是二甲醚(CH 3—O —CH 3),若是二甲醚,则46 g C 2H 6O 中含有的极性共价键的数目是8N A ,D 项错误。
2、下列离子方程式书写正确的是( B )A .Cl 2通入水中:Cl 2+H 2O===2H ++Cl -+ClO -B .双氧水加入稀硫酸和KI 溶液:H 2O 2+2H ++2I -===I 2+2H 2OC .用铜作电极电解CuSO 4溶液:2Cu 2++2H 2O=====电解2Cu +O 2↑+4H +D .Na 2S 2O 3溶液中加入稀硫酸:2S 2O 2-3+4H +===SO 2-4+3S↓+2H 2O3、某校化学兴趣小组用如图所示过程除去AlCl 3溶液中含有的Mg 2+、K +杂质离子并尽可能减少AlCl 3的损失。
阶段排查落实练 ( 二)化学物质及其变化一、常考易错的化学基本看法的正误判断1.只含一种分子的物质是纯净物,冰水混杂物是纯净物,只含一种元素的物质也是纯净物( ×)2.混杂物没有固定的组成,所以混杂物没有固定的熔沸点( √)3.与水反应可生成酸的氧化物都是酸性氧化物( ×)4.既能与酸反应又能与碱反应的物质是两性氧化物或是两性氢氧化物( ×)5.非金属氧化物不用然是酸性氧化物,金属氧化物不用然是碱性氧化物( √)6.塑料的老化,橡胶的硫化,石油的裂化,铁、铝的钝化,油脂的硬化,苯的硝化,碳酸钠晶体的风化,油脂的皂化,酸和醇的酯化均属化学变化( √)7.晶体的消融、水的汽化和液化、KMnO4溶液的酸化以及煤的气化和液化均属物理变化( ×)8.一种物质不是电解质就是非电解质( ×)9.含强极性键的微粒组成的物质必然是强电解质( ×)10.强电解质溶液中没有分子( ×)11.强电解质溶液的导电能力不用然强,弱电解质溶液的导电能力不用然弱( √)12.离子化合物是强电解质,共价化合物是弱电解质( ×)13.电解质溶液能导电,是因为在通电时电解质电离产生了自由搬动的离子( ×)14.凡是强酸和强碱反应的离子方程式都可以用+-H + OH ===HO表示 ( ×)215. SO2、NH3溶于水能导电,但SO2、 NH3属于非电解质 ( √)16.液态 HCl 不导电,因为只有HCl 分子;液态 NaCl 能导电,因为有自由搬动的离子 ( √)二、氧化还原反应看法正误判断1.置换反应全部下于氧化还原反应。
因为有单质参加和生成,化合价发生了变化( √) 2.有单质参加的化合反应属于氧化还原反应。
因为单质中元素化合价必然发生变化( √) 3.氧化剂拥有氧化性,反应时自己被氧化,发生氧化反应;还原剂拥有还原性,反应时自己被还原,发生还原反应( ×)4.元素从化合态变为游离态,该元素不用然被还原( √)5.失电子越多,还原性越强,得电子越多,氧化性越强( ×)6.金属阳离子被还原,不用然获取金属单质( √)7.不简单获取电子的物质,必然简单失去电子( ×)8.依照化学反应方程式判断氧化性、还原性强弱时,还原性:还原剂>还原产物;氧化性:氧化剂 >氧化产物 ( √)9.在浓度相差不大的溶液中,一种氧化剂和几种还原剂反应时将依照还原性由强到弱 的序次依次反应; 同理一种还原剂和几种氧化剂反应时将依照氧化性由强到弱的序次依次反应( √)10.元素处于最高价态时必然有强氧化性,如 2-;同理,元素处于最低价态时必然FeO 4 拥有强还原性,如S 2-;元素处于中间价态时,既有氧化性又有还原性,如Fe 2+ 、 SO 2( ×)三、常考易错的离子方程式书写再落实2+2-2+-。
排查落实练一化学与STSE 一、构建知识体系,熟记重要名词
续表
答案可吸入颗粒物、二氧化氮、二氧化硫 5.6 二氧化硫氮氧化物CO2CH4氟利昂氮氧化物碳氢化合物氮氧化合物N、P 塑料煤、石油、天然气
二、化学与STSE知识正误判断
1.赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色。
( ) 答案×
2.PM2.5表面积大,能吸附大量的有毒、有害物质。
( )
答案√
3.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2。
( )
答案×
4.回收废弃塑料制成燃油替代汽油、柴油,可减轻环境污染和节约化石能源。
( ) 答案√
5.铝元素无毒,生活中可以大量使用含铝的膨松剂、净水剂等。
( )
答案×
6.用大量SO2熏制过的柿饼外观光鲜、不易霉变,食用后对人体无害。
( )
答案×
7.服用铬含量超标的药用胶囊会对人的健康造成危害。
( )
答案√
8.使用“填埋法”处理未经分类的生活垃圾。
( )
答案×
9.“火树银花”中的焰火实质上是金属元素的焰色反应。
( )
答案√
10.凡含有食品添加剂的食物对人体健康均有害,不宜食用。
( )
答案×
11.大力开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理。
( ) 答案×
12.高纯度的SiO2对光有很好的折射和全反射作用,可以制成光电池将光能直接转化为电能。
( )
答案×
13.雾霾天车灯照射的光亮通路属于丁达尔现象。
( )
答案√
14.黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的“硝”是指硝酸。
( )
答案×
15.与铜质水龙头连接处的钢质水管易发生析氢腐蚀。
( )
答案×
16.可向海水中加入明矾使海水淡化从而解决淡水供应危机。
( )
答案×
17.不慎误服BaCl2溶液时,除大量吞服鸡蛋清解毒外,还应加服一定量的解毒剂碳酸钠,以便将BaCl2转化成碳酸钡。
( )
答案×
18.为防止病毒传播,可用漂粉精或双氧水对环境进行消毒。
( )
答案√
19.含氟(CF2Cl2)制冷剂的使用是破坏臭氧层的原因之一。
( )
答案√
20.夏天雷雨过后空气特别清新是因为空气中产生了少量二氧化氮。
( )
答案×
21.95%的乙醇溶液能使蛋白质变性,可用于消毒杀菌。
( )
答案×
22.以地沟油为原料加工制成的生物柴油的成分与由石油分馏得到的柴油的成分不同。
( )
答案√
23.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源。
( )
答案√
24.绿色化学的核心是应用化学原理对环境污染进行治理。
( )
答案×
25.泡沫灭火器的内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液。
( )
答案×
26.加碘盐中的碘以碘化钾的形式存在。
( )
答案×
27.光化学烟雾与大量排放碳氢化合物和氮氧化合物有关。
( )
答案√
28.废旧电池会对生态环境和公众健康造成危害,所以废旧电池必须回收再利用。
( ) 答案√
29.现代研制的油漆一般不使用甲醛等化合物,因为这些化合物对人体有害。
( ) 答案√
30.禁止使用含磷洗涤剂,防止水体富营养化。
( )
答案√
精美句子
1、善思则能“从无字句处读书”。
读沙漠,读出了它坦荡豪放的胸怀;读太阳,读出了它普照万物的无私;读春雨,读出了它润物无声的柔情。
读大海,读出了它气势磅礴的豪情。
读石灰,读出了它粉身碎骨不变色的清白。
2、幸福幸福是“临行密密缝,意恐迟迟归”的牵挂;幸福是“春种一粒粟,秋收千颗子”的收获. 幸福是“采菊东篱下,悠然见南山”的闲适;幸福是“奇闻共欣赏,疑义相与析”的愉悦。
幸福是“随风潜入夜,润物细无声”的奉献;幸福是“夜来风雨声,花落知多少”的恬淡。
幸福是“零落成泥碾作尘,只有香如故”的圣洁。
幸福是“壮志饥餐胡虏肉,笑谈渴饮匈奴血”的豪壮。
幸福是“先天下之忧而忧,后天下之乐而乐”的胸怀。
幸福是“人生自古谁无死,留取丹心照汗青”的气节。
3、大自然的语言丰富多彩:从秋叶的飘零中,我们读出了季节的变换;从归雁的行列中,我读出了集体的力量;从冰雪的消融中,我们读出了春天的脚步;从穿石的滴水中,我们读出了坚持的可贵;从蜂蜜的浓香中,我们读出了勤劳的甜美。
4、成功与失败种子,如果害怕埋没,那它永远不能发芽。
鲜花,如果害怕凋谢,那它永远不能开放。
矿石,如果害怕焚烧(熔炉),那它永远不能成钢(炼成金子)。
蜡烛,如果害怕熄灭(燃烧),那它永远不能发光。
航船,如果害怕风浪,那它永远不能到达彼岸。
5、墙角的花,当你孤芳自赏时,天地便小了。
井底的蛙,当你自我欢唱时,视野便窄了。
笼中的鸟,当你安于供养时,自由便没了。
山中的石!当你背靠群峰时,意志就坚了。
水中的萍!当你随波逐流后,根基就没了。
空中的鸟!当你展翅蓝天中,宇宙就大了。
空中的雁!当你离开队伍时,危险就大了。
地下的煤!你燃烧自己后,贡献就大了
6、朋友是什么?
朋友是快乐日子里的一把吉它,尽情地为你弹奏生活的愉悦;朋友是忧伤日子里的一股春风,轻轻地为你拂去心中的愁云。
朋友是成功道路上的一位良师,热情的将你引向阳光的地带;朋友是失败苦闷中的一盏明灯,默默地为你驱赶心灵的阴霾。
7、一粒种子,可以无声无息地在泥土里腐烂掉,也可以长成参天的大树。
一块铀块,可以平庸无奇地在石头里沉睡下去,也可以产生惊天动地的力量。
一个人,可以碌碌无为地在世上厮混日子,也可以让生命发出耀眼的光芒。
8、青春是一首歌,她拨动着我们年轻的心弦;青春是一团火,她点燃了我们沸腾的热血;青春是一面旗帜,她召唤着我们勇敢前行;青春是一本教科书,她启迪着我们的智慧和心灵。