土壤脱氢酶试剂盒说明书
- 格式:doc
- 大小:38.50 KB
- 文档页数:1

技术咨询电话:400-607-9999土壤DNA提取试剂盒(Soil DNAout)货号: M090065产品及特点:由于土壤中有机质含量丰富,尤其是其中的腐殖酸对PCR等后续反应有极大的抑制作用,所以从土壤微生物提取高纯度的DNA一直是十分棘手的问题。
本产品是本公司精心优化的专门用于从各种土壤样品和河海沉积物中提取高质量的DNA的试剂。
1.去污染效果好,OD260/280一般都在1.8以上, OD260/340一般都在3.0以上(表示腐殖酸少),得到的DNA样品原液或稀释液可以直接用于PCR等后续反应。
2.产量高,每克土壤一般可以提取到5 ug 左右DNA,片段长度在30 Kb左右。
3.操作过程简单快速,只需要30分钟。
4.扩容性好,既可以在1.5 mL离心管中微量提取,也可以在50 mL离心管中进行大规模制备。
5.试剂无毒无害, 环保。
规格及成分:成份100 次包装溶液A 50 mL溶液B 50 mL使用手册1份注:溶液A和溶液B均为无色液体,溶液A 4℃保存时会产生沉淀,用前需要65℃溶化并混匀。
运输及保存:常温运输,4℃保存,保存期为一年。
使用方法:1.65℃预热溶液A,待其沉淀溶化后,充分混匀,取0.5 mL加入到1.5 mL塑料离心管中并放置于65℃待用。
2.称取0.1-0.3 g的土壤,加入到含预热溶液A的离心管中,震荡器上剧烈震荡5-10分钟。
如果是扩量操作,可以使用更多土壤和较大离心管。
也可以将同一种土壤在较大离心管中震荡处理,然后再分到1.5 mL离心管中。
注意:不论使用大的还是小的离心管,一定要让管底的土壤震荡起来。
3.将离心管置于65℃水浴中保温至少5分钟。
4.13000-15000 g室温离心3分钟,将上清转移到一新离心管中(上清液一般呈淡黄色或深棕色,具体取决于腐殖酸的含量,上清的体积一般为300-400 µL)。
5.在上清液中加入等体积的溶液B,上下颠倒30秒充分混匀,溶液将呈白色或淡黄色混浊状。

土壤漆酶(Soil Laccase,SL)试剂盒使用说明微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1965规格:100管/48样产品内容:试剂一:液体40mL×1瓶,4℃保存。
工作液:粉剂×2瓶,4℃避光保存,临用前每瓶加10mL试剂一溶解。
产品说明:漆酶(Laccase)是一种含铜的多酚氧化酶,属于铜蓝氧化酶家族,广泛分布于真菌和高等植物中,具有较强的氧化还原能力,在纸浆生物漂白,环境污染物降解和木质纤维素降解以及生物检测方面有非常广泛的应用。
漆酶分解底物ABTS产生ABTS自由基,在420nm处的吸光系数远大于底物ABTS,测定ABTS自由基的增加速率,可计算得漆酶活性。
自备实验用品及仪器:天平、低温离心机、可见分光光度计、1mL玻璃比色皿、震荡仪。
测定操作1.分光光度计计/酶标仪预热30min,调节波长到420nm,蒸馏水调零。
对照管测定管样本(g)0.020.02试剂一(μL)250工作液(μL)25037℃震荡反应10min,冰浴5min,分别取出上清200μL于420nm处测定吸光值,记为A对照管和A测定管。
△A=A测定管-A对照管2.酶活性计算公式a.用微量石英比色皿测定的计算公式如下酶活性定义:每克土壤每分钟氧化1nmol底物ABTS所需的酶量为一个酶活力单位(U)。
SL活性(nmol/min/g)=△A/(ε×d)×V反总÷W÷T=0.694×△A÷Wε:ABTS毫摩尔消光系数:36L/mmol/cm;d:比色皿光径,1cm;V反总:反应总体积,0.25mL;W,样本质量,g;T:反应时间,10min。
b.用96孔板测定的计算公式如下酶活性定义:每克土壤每分钟氧化1nmol底物ABTS所需的酶量为一个酶活力单位(U)。
SL活性(nmol/min/g)=△A/(ε×d)×V反总÷W÷T=1.388×△A÷Wε:ABTS毫摩尔消光系数:36L/mmol/cm;d:比色皿光径,0.5cm;V反总:反应总体积,0.25mL;W,样本质量,g;T:反应时间,10min。

植物脱氢酶(PDHA)活性检测试剂盒说明书微量法注意:正式测定前务必取2-3个预期差异较大的样本做预测定。
货号:BC3125规格:100T/48S产品内容:试剂一:粉剂×2瓶。
使用前加少量水溶解,定容至50mL,避光、4℃保存(尽量现配现用)。
试剂二:液体100mL×2瓶,4℃保存。
试剂三:乙酸乙酯,自备。
产品说明:生物体的脱氢酶(Plant dehydrogenase,PDHA)的活性在很大程度上反映了生物体的活性状态,能直接表示生物细胞对其基质降解能力的强弱。
受氢体2,3,5-氯化三苯基四氮唑(2,3,5-Triphenyl Tetrazolium Chloride,即TTC)在细胞呼吸过程中接受氢以后,其还原产物三苯基甲替(TriphenylFormazone,即TFF)呈现红色,在波长485nm处有最大吸收峰,采用分光光度法于485nm测定其吸光值,即得植物脱氢酶活性。
试验中所需的仪器和试剂:台式离心机、可见分光光度计/酶标仪、水浴锅、微量玻璃比色皿/96孔板(非聚苯乙烯/聚丙烯材质)、可调式移液枪、研钵/匀浆器、冰、蒸馏水、乙酸乙酯(不允许快递,请用户自备)。
操作步骤:一、样品处理:称取0.1g的植物组织,用双蒸水清洗3-4次,用滤纸吸干水分,备用。
二、测定步骤:1、可见分光光度计/酶标仪预热30min以上,调节波长至485nm,乙酸乙酯调零。
2、操作表:取5mLEP管依次加入对照管测定管样品(g)0.10.1试剂一(mL)1试剂二(mL)21充分混匀,37℃,暗培养3h,取出后立即冰浴5min,去滤液,尽量用滤纸吸干样品,置于研钵/匀浆器中。
试剂三(mL)11充分研磨(建议在通风橱操作)后全部移至于离心管中,用少量试剂三冲洗研钵,一起加入离心管,用试剂三定容至2mL,10000rpm/min,4℃,离心5min,取200μL上清至微量玻璃比色皿或96孔板中,测定485nm下的吸光值。

土壤过氧化氢酶(Solid-Catalase,S-CAT)试剂盒使用说明微量法注意:正式测定前务必取2-3个预期差异较大的样本做预测定货号:BC0105规格:100管/48样产品内容:试剂一:液体×1瓶,4℃保存;临用前加入29.7mL蒸馏水充分溶解后待用;用不完的试剂4℃保存;试剂二:粉剂×1瓶,4℃保存;临用前加入1mL蒸馏水充分溶解待用,用不完的试剂4℃保存;试剂三:液体×1瓶,4℃保存。
产品说明:S-CAT是土壤微生物代谢的重要酶类,在H2O2清除系统中具有重要作用。
H2O2在240nm下有特征吸收峰,通过测定与土壤反应后溶液在此波长下吸光度的变化,即可反应S-CAT活性的高低。
需自备的仪器和用品:紫外分光光度计/酶标仪、台式离心机、水浴锅、可调式移液器、微量石英比色皿/96孔板(UV板)和蒸馏水操作步骤:一、样品处理:新鲜土样自然风干或37度烘箱风干,过30~50目筛。
二、测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至240nm,蒸馏水调零。
2、加样表试剂名称测定管无基质管无土管风干土样(g)0.030.03试剂一(μL)260260双蒸水(μL)26025℃振荡培养20min试剂二(μL)101010混匀8000g,25℃离心5min,取全部上清试剂三(μL)303030混匀,取200uL至微量石英比色皿或96孔板中,240nm处记录各管吸光值A。
注意:每个测定管要设一个无基质管,无土管只要做一管。
三、S-CAT活性计算:A、用微量石英比色皿测定的计算公式如下单位的定义:每天每g风干土样催化1μmol H2O2降解定义为一个酶活力单位。
计算公式:S-CAT(μmol/d/g)=[(A无土管-A测定管+A无基质管)×V反总÷(ε×d)×106]÷W÷T=16.5×(A无土管-A测定管+A无基质管)V反总:反应体系总体积,3×10-4L;ε:过氧化氢摩尔消光系数,4.36×104L/mol /cm;d:比色皿光径,1cm;T:反应时间,20min=1/72d;W:样本质量,0.03g。
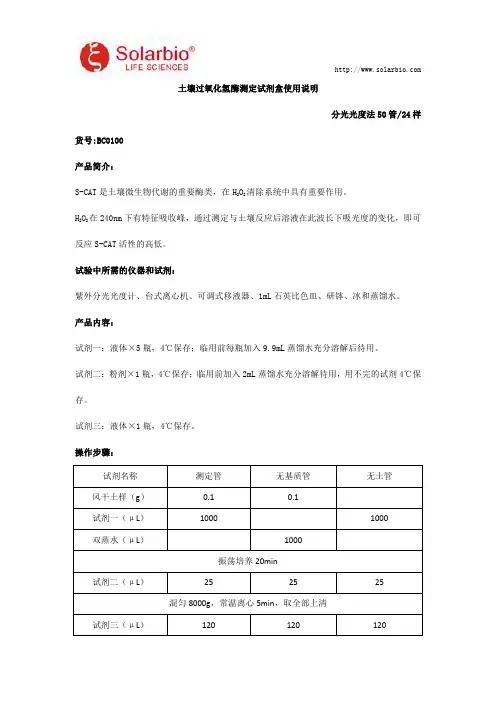
土壤过氧化氢酶测定试剂盒使用说明分光光度法50管/24样货号:BC0100产品简介:S-CAT 是土壤微生物代谢的重要酶类,在H 2O 2清除系统中具有重要作用。
H 2O 2在240nm 下有特征吸收峰,通过测定与土壤反应后溶液在此波长下吸光度的变化,即可反应S-CAT 活性的高低。
试验中所需的仪器和试剂:紫外分光光度计、台式离心机、可调式移液器、1mL 石英比色皿、研钵、冰和蒸馏水。
产品内容:试剂一:液体×5瓶,4℃保存;临用前每瓶加入9.9mL 蒸馏水充分溶解后待用。
试剂二:粉剂×1瓶,4℃保存;临用前加入2mL 蒸馏水充分溶解待用,用不完的试剂4℃保存。
试剂三:液体×1瓶,4℃保存。
操作步骤:试剂名称测定管无基质管无土管风干土样(g )0.10.1试剂一(μL )10001000双蒸水(μL )1000振荡培养20min试剂二(μL )252525混匀8000g ,常温离心5min ,取全部上清试剂三(μL )120120120混匀,用蒸馏水调零,240nm 处记录各管A 值。
注意:每个测定管要设一个无基质管,无土管只要做一管。
S-CAT 活力的计算:单位的定义:每天每g 风干土样催化1μmol H 2O 2降解定义为一个酶活力单位。
计算公式:S-CAT(U/g)=[(A 无土管-A 测定管+A 无基质管)×V 反总÷(ε×d)×106]÷W÷T=18.9×(A 无土管-A 测定管+A 无基质管)V 反总:反应体系总体积,1.145×10-3L;ε:过氧化氢摩尔消光系数,4.36×104L/mol/cm;d:比色皿光径,1cm;T:反应时间,20min=1/72d;W:样本质量,0.1g。

脱氢酶活性测定(一)基本原理利用2,3,5-三苯基四氮唑氯化物(TTC)为基质(氢受体),由于土壤中脱氢酶的作用使之形成红色的TPF,两者在一定范围内呈线性关系,因此,用比色法测定其形成量作为土壤脱氢酶的活性指标。
(二)实验试剂1、酶促反应试剂(1)0.5mol/L三(羟甲基)氨基甲烷-盐酸缓冲液,pH7.6:2mol/L三(羟甲基)氨基甲烷溶液50mL与1mol/L盐酸溶液75mL混合,加蒸馏水定容到200mL。
(2)0.5%TTC溶液:TTC0.5g溶于0.5mol/L三(羟甲基)氨基甲烷-盐酸缓冲液中,定容到100mL。
2、测定试剂(1)甲醇(2)TPF标准溶液:称取TPF30mg,置于100mL容量瓶中,用甲醇定容到100mL,此溶液浓度即为1μg/Ml.再用甲醇稀释该溶液,配制成25、50、75、100、150ng/mL的标准溶液。
(三)操作步骤1)称取通过2mm筛的土样5g于带塞试管(0.7*15.0cm)中,加入TTC溶液5mL,充分混合。
2)同时设置对照,即在试管内加入三(羟甲基)氨基甲烷-盐酸缓冲液5mL 以替代土壤与TTC。
3)将以上试管置暗处30℃保温培养12h后,分次少量地加入甲醇100mL,移入带塞三角瓶中,用振荡机震荡1h,过滤。
4)取滤液用分光光度计(波长485nm)测定其光密度。
以甲醇作为空白。
5)用上述同样方法测定不同浓度TPF标准溶液光密度,在半对数纸上绘制标准曲线。
6)根据减去空白的光密度查标准曲线,即可求出产生的TPF的量,该量(μg/g 干土)即表示脱氢酶活性。
脱氢酶的活性可按下式计算:土壤脱氢酶活性(μg TPF/g干土)=C×V/dwtC:滤液中TPF的量(μg/mL)(由标准曲线查知);V:滤液的体积(mL);dwt:烘干土壤重量(g)。

货号:MS2103 规格:100管/96样丙酮酸脱氢酶(Pyruvate dehydrogenase,PDH)试剂盒说明书微量法正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:PDH(EC 4.1.1.1)广泛存在于动物、植物、微生物和培养细胞中,是丙酮酸脱氢酶复合体(PDHC)催化丙酮酸氧化脱羧的限速酶,催化丙酮酸脱梭生成羟乙基-TPP,把糖酵解和三羧酸循环连接起来。
测定原理:PDH催化丙酮酸脱氢,同时还原2,6-二氯酚靛酚(2,6-DCPIP),从而导致600nm光吸收的减少。
自备实验用品及仪器:可见分光光度计/酶标仪、水浴锅、台式离心机、可调式移液器、微量石英比色皿/96孔板、研钵、冰和蒸馏水。
试剂的组成和配制:试剂一:100mL×1瓶,-20℃保存;试剂二:20mL×1瓶,-20℃保存;试剂三:1.5mL×1支,-20℃保存;试剂四:液体20mL×1瓶,4℃保存;试剂五:粉剂×1瓶,4℃保存;样本的前处理:组织、细菌或细胞中胞浆蛋白与线粒体蛋白的分离:1、称取约0.1g组织或收集500万细胞,加入1mL试剂一和10uL 试剂三,用冰浴匀浆器或研钵匀浆。
2、将匀浆600g,4℃离心5min。
3、弃沉淀,将上清液移至另一离心管中,11000g,4℃离心10min。
4、上清液即胞浆提取物,可用于测定从线粒体泄漏的PDH(此步可选做)。
5、在步骤④的沉淀中加入200uL试剂二和2uL 试剂三,超声波破碎(冰浴,功率20%或200W,超声3秒,间隔10秒,重复30次),用于线粒体PDH活性测定。
测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至605nm,蒸馏水调零。
2、样本测定(1)在试剂五中加入19mL试剂四充分溶解,置于37℃(哺乳动物)或25℃(其它物种)水浴10min;用不完的试剂分装后-20℃保存,禁止反复冻融;(2)在微量石英比色皿或96孔板中加入10μL样本和190μL试剂五,混匀,立即记录605nm 处初始吸光值A1和 1min后的吸光值A2,计算ΔA=A1-A2。

货号:MS2914 规格:100管/96样土壤过氧化物酶(Solid- Peroxidase,S-POD)试剂盒说明书微量法正式测定前务必取 2-3 个预期差异较大的样本做预测定测定意义:S-POD主要来源于土壤微生物,能够氧化土壤有机物质产生过氧化物,在腐殖质的形成过程中具有重要作用。
测定原理:S-POD催化有机物质氧化成醌,后者在430nm有特征光吸收。
自备实验用品及仪器:可见分光光度计/酶标仪、台式离心机、水浴锅、可调式移液器、微量石英比色皿/96孔板、乙醚50mL(不允许快递)和蒸馏水。
试剂组成和配制:试剂一:粉剂×1瓶,临用前加入10mL蒸馏水,用不完的试剂仍4℃保存;试剂二:液体2mL×1瓶,4℃保存;试剂三:液体5mL×1瓶,4℃保存;试剂四:乙醚50mL×1瓶,4℃保存;(自备)样品处理:新鲜土样自然风干或37度烘箱风干,过30~50目筛。
测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至430nm,蒸馏水调零。
A(注意:1、因乙醚粘度小,易掉液,吸取前需先将枪头在上层液里润洗2~3次,再转移测定;2、乙醚易挥发,转移到96孔板后立即测定,最好一个一个测定)。
S-POD活力计算:a.用微量石英比色皿测定的计算公式如下标准条件下测定的回归方程为y = 8.97x -0.003;x为标准品浓度(mg/mL),y为吸光值A。
单位的定义:每天每g土样中产生1mg 紫色没食子素定义为一个酶活力单位。
S-POD活力(mg/d/g 土样)=(A+0.003) ÷8.97×V反总÷W÷T=80×(A+0.003)T:反应时间,1h=1/24d; V反总:反应体系总体积0.6mL;W:样本质量,0.02g。
第1页,共1页b.用96孔板测定的计算公式如下标准条件下测定的回归方程为y = 4.485x -0.003;x为标准品浓度(mg/mL),y为吸光值A。

土壤试剂盒操作手册和常见问题FastDNA Spin Kit for Soil实验步骤1.Add up to 500 mg of soil sample to a Lysing Matrix E tube.在裂解介质管E中最多加入500mg土壤样品。
注意:推荐最多加入500mg土壤样品,含水量比较多的土壤或者碎屑多的土壤可适量减少样品量。
2.Add 978 μL Solution Phosphate Buffer to sample in Lysing Matrix E tube.在裂解介质管E中加入978μl Sodium Phosphate Buffer3.Add 122 μL MT Buffer.What’s happening: Begin to solubilize membrane proteins with detergents as well asextra-cellular proteins and contaminations in soil.加入122μl MT Buffer发生的反应:用洗涤剂溶解细胞膜蛋白以及细胞外蛋白和土壤中的污染物。
注意:为了得到更好的样品处理效果,加入土壤样品及两个缓冲液后,在裂解介质管中仍能保留有250-500μl空间。
4.Homogenize in the FastPrep Instrument for 40 seconds ata speed setting of 6.0What’s happening: mechanical disruption of cell walls of soil organisms and releasing nucleic acids into the protective buffer.将样品置于FastPrep?仪器上匀浆40s,速度为6.0m/s发生的反应:机械破碎土壤微生物的细胞壁,将核酸释放入保护缓冲液中。

土壤过氧化物酶(Solid-Peroxidase,S-POD)试剂盒使用说明分光光度法货号:BC0890规格:50管/48样产品说明:S-POD主要来源于土壤微生物,能够氧化土壤有机物质产生过氧化物,在腐殖质的形成过程中具有重要作用。
S-POD催化有机物质氧化成醌,后者在430nm有特征光吸收。
自备用品:可见分光光度计、台式离心机、水浴锅、可调式移液器、1mL玻璃比色皿、乙醚100mL(不允许快递)、研钵、冰和蒸馏水。
产品内容:试剂一:粉剂×2瓶,临用前每瓶加入10mL蒸馏水,用不完的试剂仍4℃保存;试剂二:液体5mL×1瓶,4℃保存;试剂三:液体10mL×1瓶,4℃保存;试剂四:乙醚50mL×2瓶,4℃保存;(自备)操作步骤:1、样品处理:新鲜土样自然风干或37℃烘箱风干,过30-50目筛。
2、测定步骤:试剂名称测定管风干土样(g)0.05试剂一(μL)400试剂二(μL)100振荡混匀,30℃恒温培养1h试剂三(μL)200试剂四(μL)1750振荡数次室温静置30min,用蒸馏水调零,取1mL上层液于430nm处测定吸光值A。
3、S-POD活力计算:标准条件下测定的回归方程为y=8.97x-0.003;x为标准品浓度(mg/mL),y为吸光值A。
单位的定义:每天每g土样中产生1mg紫色没食子素定义为一个酶活力单位。
S-POD活力(U/g土样)=(A+0.003)÷8.97×V反总÷W÷T=131×(A+0.003) T:反应时间,1h=1/24d;V反总:反应体系总体积2.45mL;W:样本质量,0.05g。

土壤过氧化氢酶(S-CAT)活性检测试剂盒说明书微量法货号:UPLC-MS-4001规格:100T/48S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件试剂一液体0.3mL×1瓶2-8℃保存试剂二粉剂×1支2-8℃保存试剂三液体3mL×1瓶2-8℃保存溶液的配制:1、试剂一:液体置于试剂瓶内EP管中,使用前需将EP管先离心。
临用前取0.05mL试剂一加入9.95mL蒸馏水稀释待用或者按比例配制。
用不完的试剂2-8℃保存一周;2、试剂二:临用前加入1mL蒸馏水充分溶解待用,用不完的试剂2-8℃保存4周。
产品说明:S-CAT是土壤微生物代谢的重要酶类,在H2O2清除系统中具有重要作用。
H2O2在240nm下有特征吸收峰,通过测定与土壤反应后溶液在此波长下吸光度的变化,即可反应S-CAT活性的高低。
S-CAT2H2O2(240nm)2H2O+O2注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:紫外分光光度计/酶标仪、台式离心机、水浴锅、可调式移液器、微量石英比色皿/96孔板(UV板)、研钵、30~50目筛和蒸馏水、。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)新鲜土样自然风干或37℃烘箱风干,过30~50目筛。
二、测定步骤1、分光光度计/酶标仪预热30min以上,调节波长至240nm,分光光度计用蒸馏水调零。
2、加样表(1.5ml EP管):试剂名称测定管无基质管无土管风干土样(g)0.030.03试剂一(μL)260260蒸馏水(μL)26025℃振荡培养20min试剂二(μL)101010混匀8000g,25℃离心5min,取全部上清试剂三(μL)303030混匀,取200μL至微量石英比色皿或96孔板(UV板)中,240nm处记录各管吸光值A。
土壤过氧化氢酶测定试剂盒使用说明土壤过氧化氢酶测定试剂盒是一种用于测定土壤中过氧化氢酶的活性的试剂盒。
过氧化氢酶是一种存在于许多生物体中的酶,可以催化过氧化氢的分解,从而降解氧自由基和有毒物质,保护生物体免受氧化应激的损害。
测定土壤中过氧化氢酶的活性可以评估土壤的抗氧化能力和生态环境质量,对于土壤生态系统的保护和恢复具有重要意义。
以下是土壤过氧化氢酶测定试剂盒的使用说明:1.准备样品:将所需分析的土壤样品取出并均匀搅拌。
为了保证测定结果的准确性,应尽量避免样品受到阳光直射和高温暴晒。
2.样品处理:取适量的土壤样品,加入适量的磷酸盐缓冲液,将样品与缓冲液充分混合,制成10%的悬浊液。
注意,样品的悬浊液应立即使用,以免样品的活性受到影响。
3. 获取初始吸光度:将10%的悬浊液分装到比色皿中,使用试剂盒中提供的分光光度计,以520nm的波长测定吸光度,作为初始吸光度。
4.加入底物:向每个比色皿中加入适量的底物,根据试剂盒的规格进行计算。
底物是用来催化过氧化氢的分解反应的物质,通过测定底物被催化后生成的产物的吸光度变化来间接测定过氧化氢产生的多少。
5.反应时间:将反应混合物充分搅拌,并将比色皿放置在恒温水浴中,保持适宜的温度条件,通常为25℃。
根据试剂盒的说明书,确定适当的反应时间,通常为15分钟。
6.结束反应:在反应时间结束后,加入终止液或稀酸停止反应。
终止液可以中和反应混合物中的残余过氧化氢。
7. 获取终止吸光度:使用分光光度计,在520nm的波长下测定反应终止后的吸光度。
8.计算结果:根据试剂盒的说明书,使用给定的方程式或标准曲线计算出样品中过氧化氢酶的活性。
9.数据分析:根据得到的结果,进行数据的分析和统计,以评估土壤中过氧化氢酶的活性水平和土壤的抗氧化能力。
使用土壤过氧化氢酶测定试剂盒时1.操作过程中注意个人安全,避免直接接触试剂和废液,避免吸入试剂挥发物。
2.严格按照试剂盒的说明书进行操作,遵循实验室操作规范,确保实验过程的准确性和可重复性。
土壤脱氢酶活性的测定一、实验原理脱氢酶的正式命名是AH:B氧化还原酶,广泛存在于动植物组织和微生物细胞内,它能酶促一定的基质中脱出氢而进行氧化作用。
脱氢酶的种类因电子供给体和接受体的特异性而有不同。
单位时间内脱氢酶活化氢的能力表现为它的酶活性。
通过测定土壤中微生物的脱氢酶活性,可以了解微生物对土壤中有机物的氧化分解能力,即土壤酶的活性。
已知受氢体可接受脱氢酶脱出的氢原子,根据接收氢原子的量可以判断脱氢酶的活性。
如无色的氯化三苯基四氮唑(TTC,俗称红四唑)接受氢后变成红色的三苯基甲瓒(TF),根据产生红色的色度进行比色定量分析,就可以判断脱氢酶的活性。
通常,吸光度越大(红色越深),脱氢酶活性越大。
二、实验材料、试剂和仪器1.材料:过0.9mm孔径筛的土壤样品,8g2.试剂:0.36%Na2SO3溶液,15mlTris-HCl缓冲液(PH=7.6),45ml0.4%TTC,7.6mlNa2S2O4,十几粒甲醛,10ml丙酮,20ml3.仪器:50ml具塞比色管,6只比色管架,1只1~5ml移液枪,1只(枪头3个)100~1000ul移液枪1只(枪头1个)药匙1个水浴锅1个分光光度计1台分析天平1台离心管4只培养箱1台离心机1台三、实验步骤1.标准曲线的绘制(1)按下表配制系列浓度的TTC标准溶液。
(2)显色。
用药匙向每只比色管中各加入少许连二亚硫酸钠(Na2S2O4),混匀,使TTC 全部还原为红色的TF。
用1~5ml移液枪向各管滴加1ml甲醛终止反应,摇匀后再加入2ml丙酮震荡摇匀,37℃水浴10min。
(3)测定吸光度,绘制标准曲线。
在485nm波长下测定各管溶液的吸光度A,并以A为纵坐标,TTC浓度为横坐标,绘制出TTC标准曲线。
2.土壤脱氢酶活性的测定(1)培养并显色(此步骤由助教预先完成)。
首先,按下表向四只离心管中分别加入以下物质然后,将以上四只离心管避光,37℃保温培养12~24h。
土壤生物化学指标测定一、土壤脱氢酶(dehydrogenase)活性测定(比色法)(一)分析意义脱氢酶能酶促脱氢反映,它起着氢的中间传递题的作用。
在土壤中,碳水化合物和有机酸的脱氢酶作用比较活跃,他们可以作为氢的工体。
脱氢酶能自基质中析出氢而进行氧化作用。
(二)方法选择与原理Lenhard(1956)最先提出用TTC作为氢的受体生成红色的TF,进行闭塞测定,以溶液的光密度值表示酶活性。
后来对上述的方法做了不同的改进和完善。
用土壤有机质作为氢的供体或用葡萄糖做氢的供体,用生成的TF数量或换算成氢的体积来表示脱氢酶的活性。
(三)试剂配制1、0.5%TTC溶液2、甲苯3、Tris-HCl缓冲液Ph7.6:0.1M三羟甲基氨基甲烷(12.114g/L)50ml 与0.1MHCl38.5ml混合后,用水稀释至100ml。
4、硫化钠5、0.1mol/L葡萄糖溶液。
(四)实验步骤1、标准曲线的绘制:称取相当于50mg纯品量的已烘干的TTC于50 ml比色管中,定容,制成1 mg/L的母液。
分别向6支50ml比色管中依次注入1、2、3、4、5、6mL mg/ml 标准TTC溶液,用蒸馏水定容,是为工作液:取7只带塞比色管(50ml)依次加入2 mL Tris-HCl演算缓冲液,1 mL不同浓度的TTC工作液,1 mL10%硫化钠新配溶液,摇匀,放置20分钟;反应完全后,准确加入10ml甲苯,振摇。
完全提取TF,稳定数分钟,取上层有机溶液在紫外分光光度计492nm处闭塞(在比色皿中也需稳定2分钟)绘制标准曲线。
2、操作过程:取0.5g新鲜土壤,置于50ml 比色管中,依次加入2mlTris-HCl盐酸缓冲液、1ml 0.1mol/L葡萄糖溶液、1ml 0.5% TTC溶液,震荡均匀,离心(4000转/分)5分钟后,将甲苯提取液在分光光度计492 nm处闭塞测定。
同时设无土壤和无TTC的对照(以蒸馏水替代)。
3、结果计算:脱氢酶活性=TF含量/0.5g —土壤含水量脱氢酶活性,以24h后1g干土中TF的生成量表示。
土壤脱氢酶测定-TTC还原法土壤脱氢酶测定-TTC还原法仪器:试管、定量滤纸、三角瓶、分光光度计、摇床、Ph计试剂:TTC(氯化三苯基四氮唑)、浓HCl、Tris(三强甲基氨基甲烷)、甲醇、TPF(三苯基甲臜za)配制:1.Ph 7.6 、0.5mol/L Tris 缓冲溶液:60.57g Tris溶于水,用1mol/LHCl(按浓盐酸:水=1:1比例配制)准确调pH至7.6,定容至1000ml;2.1% TTC溶液:1g TTC溶于上述缓冲液,定容至100ml;3.1%葡萄糖溶液:1g葡萄糖溶于水,定容至100ml;测定步骤:1.4g过2mm(10目)筛新鲜土样于试管(25ml),加1%TTC 溶液2ml,1%葡萄糖溶液2ml,摇匀;同时每个处理设置用Tris缓冲液2ml 代替TTC对照;2.试管于恒温箱(烘箱)暗室37℃培养24h,加甲醇20ml(少量多次),移入50ml三角瓶,摇床(180-220r/min)振荡1h,过滤;3.先用量筒测量滤液体积,然后将滤液于分光光度计485nm处测定吸光度值,用水和待测液润洗,直接测量下一个样品。
4.整个实验设置无土壤对照(加TTC溶液和葡萄糖溶液各2ml)。
标准曲线制备:1.准确称取TPF 50mg于250ml 甲醇中,母液浓度为200mg/L。
2.吸取0,0.25,0.5,1.0,1.5,2.0,2.5ml母液于25ml容量瓶,用甲醇定容,TPF浓度分别为0,2,4,8,12,16,20mg/L。
脱氢酶活性计算:脱氢酶活性(mgTPF/g干土/h)=(c*v)/(干土质量*24)c:滤液中TPF的浓度(标准曲线查);v:滤液的体积;干土质量:2g鲜土烘干后的质量;24:暗室培养的时间。
货号:MS2906 规格:100管/48样土壤脱氢酶(Soil dehydrogenase, sDHA)试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:土壤脱氢酶(Soil dehydrogenase, sDHA)的活性可以反映土壤体系内活性微生物量以及其对有机物的降解活性,可以作为土壤微生物的降解性能指标。
测定原理:氢受体 2, 3, 5 - 氯化三苯基四氮唑(2,3,5-Triphenyl Tetrazolium Chloride, TTC)在细胞呼吸过程中接受氢以后,被还原为三苯基甲鐟(Triphenyl Formazone, TF),TF 呈现红色,在波长485nm处有最大吸收峰,采用分光光度法于485nm测定其吸光值,即得土壤脱氢酶活性。
自备实验仪器及用品:筛子、天平、恒温培养箱或水浴锅、低温离心机、可见分光光度计/酶标仪、微量石英比色皿/96 孔板、冰、蒸馏水、丙酮(不允许快递,请用户自备)。
试剂的组成和配制:试剂一:粉剂×1 瓶,使用前加 5mL 水溶解,4℃避光保存(尽量现配现用)。
试剂二:液体 20mL×1 瓶,4℃保存。
试剂三:丙酮,自备。
样品处理:1. 土壤样品:准确称取过40目筛的新鲜土壤样品约0.1g(以保证TTC与土壤颗粒充分接触)。
2. 污泥样品:污泥用蒸馏水洗涤,10000g,25℃,离心10min,弃上清,反复3-4次。
测定步骤和操作表:1、分光光度计/酶标仪预热 0min,调节波长至485nm。
脱氢酶活力计算:酶活单位定义:在 37℃时,每克样品每小时使反应体系 OD 值每增加0.01为一个酶活单位。
计算公式:脱氢酶活性(U/g)=A 485 ÷0.01÷T÷W= 16.67×A 485 ÷WT:培养时间,h;W:样品质量,g第1页,共2页注意事项:1. 配制好的试剂一避光保存于 4℃,最好在一周内使用,若出现红色,则不能使用。
货号: QS2906 规格:50管/48样
土壤脱氢酶试剂盒说明书
可见分光光度法
注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:
土壤脱氢酶(Soil dehydrogenase, sDHA)的活性可以反映土壤体系内活性微生物量以及其对有机物的降解活性,可以作为土壤微生物的降解性能指标。
测定原理:
氢受体2, 3, 5 - 氯化三苯基四氮唑(2,3,5-Triphenyl Tetrazolium Chloride, TTC)在细胞呼吸过程中接受氢以后,被还原为三苯基甲鐟(Triphenyl Formazone, TF),在波长485nm处有最大吸收峰,采用分光光度法于485nm测定其吸光值,即得土壤脱氢酶活性。
自备实验仪器及用品:
筛子、天平、恒温培养箱或水浴锅、低温离心机、可见分光光度计、玻璃比色皿,冰、蒸馏水、甲醇(不允许快递,请用户自备)。
试剂的组成和配制:
试剂一:粉剂×1瓶,使用前加10mL试剂二溶解,4℃避光保存(尽量现配现用)。
试剂二:液体20mL×1瓶,4℃保存。
试剂三:甲醇,自备。
样品处理:
新鲜土样自然风干或37度烘箱风干,过30~50目筛。
脱氢酶活力计算:
标准曲线:y = 0.0422x - 0.0312;R2 = 0.9988;x为标准品浓度(μg/mL),y为吸光值。
酶活单位定义:在37℃时,每克土壤样品每天催化产生1μgTF为一个酶活性单位。
sDHA(μg/ d /g 土样)=(△A+0.0312)÷ 0.0422×V反总÷W÷T= 47.39×(△A+0.0312)÷W
V反总:反应总体积,2mL;T:培养时间,1d;W:样品质量,g
注意事项:
配制好的试剂一避光保存于4℃,最好在一周内使用,若出现红色,则不能使用
第1页,共1页。