第四章 酸碱滴定法
- 格式:doc
- 大小:107.50 KB
- 文档页数:10









第四章酸碱滴定法第四章酸碱滴定法酸碱滴定法(acid-base titrations)是以⽔溶液中的质⼦转移反应为基础的滴定分析⽅法。
⼀般酸、碱以及能与酸碱直接或间接发⽣质⼦反应的物质,⼏乎都可以⽤酸碱滴定法测定。
因此,酸碱滴定法是分析化学的基础内容之⼀。
这个⽅法的关键问题是计量点的确定。
因为酸碱反应通常不发⽣外观的变化,在滴定中需选⽤适当的指⽰剂,利⽤它的变⾊作为到达计量点的标志。
因为不同的指⽰剂的变⾊有其不同的pH,⽽不同类型的酸碱反应的计量点时pH⼜不相同,为了正确地确定计量点,就需要选择⼀个刚好能在计量点时变⾊的指⽰剂。
要解决这个问题,必须了解滴定过程中溶液pH的变化情况。
因此,在学习酸碱滴定时,不仅要了解指⽰剂的变⾊原理和变⾊范围,同时也要了解滴定过程中溶液pH的变化规律和指⽰剂的选择原则,以便能正确地选择合适的指⽰剂,获得准确的分析结果。
基于上述原因,我们先讨论酸碱溶液平衡的基本原理,然后再介绍酸碱滴定中的理论及应⽤。
第⼀节⽔溶液中的酸碱平衡⼀、酸碱的质⼦理论根据质⼦理论,凡能给出质⼦(H+)的物质是酸,能接收质⼦的物质是碱。
酸碱关系可⽤下式表⽰:酸HA与碱A-处于⼀种相互依存的关系中,即:HA失去质⼦转化为它的共轭碱A-,A-得到质⼦后,转化为它的共轭酸HA,则HA与A-被称为共轭酸碱对。
如:由上述酸碱的半反应可知:酸碱可以是中性分⼦,也可以是阳离⼦或阴离⼦,酸碱是相对的。
⼜如:离⼦(H2PO4-)在H3PO4-H2PO4-共轭体系中为碱,⽽在H2PO4--HPO42-共轭体系中为酸。
同⼀物质在某些场合是酸,⽽在另⼀场合是碱,其原因是共存物质彼此间给出质⼦能⼒相对强弱不同。
因此同⼀物质在不同的环境(介质或溶剂)中,常会引起其酸碱性的改变。
既能给出质⼦⼜能接受质⼦的物质称为两性物质。
酸碱质⼦理论认为,酸碱反应的实质是质⼦转移。
例如HAc在⽔中离解,溶剂⽔就起着碱的作⽤,否则HAc⽆法实现其在⽔中的离解,即质⼦转移是在两个共轭酸碱对间进⾏。
第四章酸碱滴定法1.基本概念(1)混合指示剂:两种或两种以上指示剂相混合,或一种指示剂与另一种惰性染料相混合。
利用颜色互补原理,使终点颜色变化敏锐。
(2)滴定反应常数(K t):是滴定反应平衡常数。
强碱(酸)滴定强酸(碱):K t=1/K w=1014;强碱(酸)滴定弱酸(碱):K t=K a(b) /K w。
K t值越大,该滴定反应越完全,滴定突跃越大。
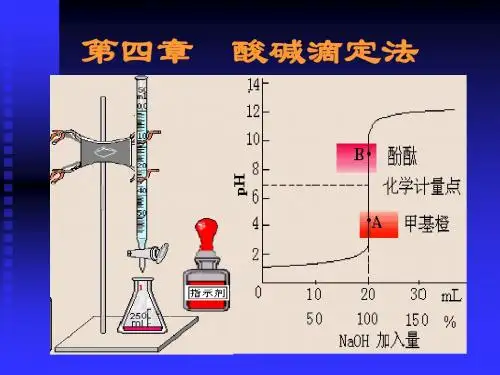
(3)滴定曲线:以滴定过程中溶液pH值的变化对滴定体积(或滴定百分数)作图而得的曲线。
(4)滴定突跃:化学计量点附近(±0.1%)pH的突变。
(5)滴定误差:滴定终点与化学计量点不一致引起的误差,与指示剂的选择有关。
(6)质子溶剂:能给出质子或接受质子的溶剂。
包括酸性溶剂、碱性溶剂和两性溶剂。
(7)无质子溶剂:分子中无转移性质子的溶剂。
包括偶极亲质子溶剂和惰性溶剂。
(8)均化效应和均化性溶剂:均化效应是指当不同的酸或碱在同一溶剂中显示相同的酸碱强度水平;具有这种作用的溶剂称为均化性溶剂。
(9)区分效应和区分性溶剂:区分效应是指不同的酸或碱在同一溶剂中显示不同的酸碱强度水平;具有这种作用的溶剂称为区分性溶剂。
2.基本原理(1)酸碱指示剂的变色原理:指示剂本身是一类有机弱酸(碱),当溶液的pH改变时,其结构发生变化,引起颜色的变化而指示滴定终点。
酸碱指示剂的变色范围:pH=pK HIn±1;理论变色点:pH=pK HIn(2)选择指示剂的原则:指示剂变色的pH范围全部或大部分落在滴定突跃范围内,均可用来指示终点。
(3)影响滴定突跃范围的因素:①酸(碱)的浓度,c a(b)越大,滴定突跃范围越大。
②强碱(酸)滴定弱酸(碱),还与K a(b)的大小有关。
K a(b)越大,滴定突跃范围越大。
(4)酸碱滴定的可行性:强碱(酸)滴定一元弱酸(碱):c a(b)K a(b)≥10-8,此酸、碱可被准确滴定。
多元酸(碱):c a1(b1)K a1(b1)≥10-8,c a2(b2)K a2(b2)≥10-8,则两级离解的H+均可被滴定。
第四章酸碱滴定法(65题)(一)A型题在以下选项中选出一个最符合题意的答案。
1.酸碱滴定法的标准溶液是()。
A.NaOH B.Na2CO3C.HAcD.NH3·H2O E.Na2B4O7·10H2O2.标定HCl溶液的基准物质是()。
A.NaOH B.Na2CO3C.HAcD.NH3·H2O E.KHC8H4O43. 标定NaOH溶液的基准物质是()。
A.HAc B.Na2CO3C.KHC8H4O4D.NH3·H2O E. NaOH4. 测定HAc含量选用的指示剂为()。
A.石蕊 B. 甲基橙 C. 酚酞D.甲基红 E. 中性红5. 用甲基橙为指示剂测定Na2CO3含量,其HCl与Na2CO3反应完全时,物质的量之比为()。
A.2:1 B. 1:2 C. 1:1D.3:1 E. 1:36. NaOH标准溶液测定HAc含量时,用酚酞为指示剂,终点颜色是()。
A.无色 B. 淡红色 C. 红色D.黄色 E. 橙色7. HCl标准溶液测定NH3·H2O含量,应选择的指示剂是()。
A.甲基橙 B. 酚酞 C. 百里酚酞D.中性红 E. 以上均可8. 可用碱标准液直接测定的物质的条件为()。
A.cKa≥10-8的酸 B. cKb≥10-8的碱 C. NaOHD.NH3·H2O E. H2CO39. 可用酸标准溶液直接测定的物质的条件为()。
A.cKa≥10-8的酸 B. cKb≥10-8的碱 C. NaOHD.NH3·H2O E. H2CO310. 测定硼砂含量实践操作正确的是()。
A.左手控制滴定管活塞流速,右手旋摇锥形瓶B. 右手控制滴定管活塞流速,左手旋摇锥形瓶C. 用托盘天平称取硼砂质量D.用移液管移取谁的体积E. 将硼砂加热溶解后立即加入指示剂11. 在用邻苯二甲酸氢钾基准物标定NaOH的实践操作中,正确的是()。
A.用酸式滴定管盛装NaOH溶液B. 排碱式滴定管尖端气泡时,是将胶管中的玻璃珠往上移动C. 用碱式滴定管盛装NaOH溶液D.排碱式滴定管尖端气泡时,是将胶管中的玻璃珠往下移动E. 选用甲基橙指示剂指示终点12.酚酞指示剂的变色范围及颜色是()。
A.8.0(无色)~10.0(红色) B. 8.0(红色)~10.0(无色)C. 3.1(红色)~4.4(黄色) D.3.1(黄色)~4.4(红色)E. 4.4(红色)~6.2(黄色)13. 甲基橙指示剂的变色范围及颜色是()。
A.8.0(无色)~10.0(红色) B. 8.0(红色)~10.0(无色)C. 3.1(红色)~4.4(黄色) D.3.1(黄色)~4.4(红色)E. 4.4(红色)~6.2(黄色)14. 甲基红指示剂的变色范围及颜色是()。
A.8.0(无色)~10.0(红色) B. 8.0(红色)~10.0(无色)C. 3.1(红色)~4.4(黄色) D.3.1(黄色)~4.4(红色)E. 4.4(红色)~6.2(黄色)15. 酸碱指示剂一般属于()。
A. 无机物B. 有机盐C. 有机酸D. 有机碱E. 有机弱酸或弱碱16. 强酸强碱的滴定,化学计量点的酸碱性是()。
A. pH﹤7B. pH﹥7C. pH=7D. 强酸性E. 强碱性17. 强酸滴定弱碱,化学计量点酸碱性是()A. pH﹤7B. pH﹥7C. pH=7D. 强酸性E. 强碱性18. 强碱滴定弱酸,化学计量点酸碱性是()A. pH﹤7B. pH﹥7C. pH=7D. 强酸性E. 强碱性19. 判断二元弱酸能被滴定,并有两个滴定突跃的条件是()A. cKa2≥10-8 B. Ka1/Ka2≥104 C. cKb2≥10-8D. Kb1/Kb2>104 E. cKa2≥10-8;Ka1/Ka2≥10420. 二元弱碱能被滴定,并有两个滴定突跃的条件是( )A. cKa2≥10-8;Ka1/Ka2≥104 B. Ka1/Ka2≥104C. cKb2≥10-8 D. cKb≥10-8;Kb1/Kb2≥104E. Kb1/Kb2>10421. 酸碱指示剂的变色范围是()A. pH=PKHIn ±0.1 B. pH=PKHIn±0.2 C. pH=PKHIn±1D. pH=PKHIn ±2 E. pH=PKHIn±322. 混合指示剂的优点包括,颜色变化敏锐,变色范围()A. 不一定B. 多样C. 宽D. 窄E. 以上均是23. 标定HCl溶液时用Na2CO3为基准物质,称取Na2CO30.6817g,以甲基橙为指示剂,用去HCl溶液26.50ml,HCl溶液的浓度为()mol/L。
(M=105.99)A. 0.4800 B. 0.4854 C. 0.4850D. 0.048E. 0.48624. 在1.000g粗铵盐中加过量NaOH溶液,产生的氨经蒸馏吸收在50.00ml0.5000 mol/L的盐酸中,过量的酸用0.5000 mol/L NaOH标准溶液滴定,用去1.56ml,该样品中的NH3的质量分数为()A. 0.4140B. 0.4141C. 0.4125D. 0.4122E. 0.412425. OH-的共轭酸是()。
A. H+B. H2O C.H3O+D. O2-E. 以上均不是26. 在下列各组酸碱组分中,不属于共轭酸碱对的是()A. HOAc-NaOAcB. H3PO4-H2PO4-C. +NH3CH2COOH-NH2CH2COO- D. H2CO3-HCO3-E. 以上均不是27. 水溶液中共轭酸碱对K a与K b的关系是()A. K a·K b=1B. K a·K b=K wC. K a/K b=K wD. K b/K a=K wE. 以上均不是28. 浓度相同的下列物质水溶液的pH最高的是()A. NaClB. NH4Cl C. NaHCO3D. Na2CO3E. HCl29. 今有一磷酸盐溶液的pH = 9.78, 则其主要存在形式是()(已知H3PO4的解离常数p K a1 = 2.12,p K a2 = 7.20,p K a3 = 12.36)A. HPO42- B. H2PO4- C. HPO42- + H2PO4D. H2PO4-+ H3PO4E. HPO42-+ H3PO430. 以下溶液稀释10倍时pH改变最小的是()A. 0.1 mol·L-1 NH4OAc溶液B. 0.1 mol·L-1 NaOAc溶液C. 0.1 mol·L-1 HOAc溶液D. 0.1 mol·L-1 HCl溶液E. 0.1 mol·L-1HAc溶液31. 以下溶液稀释10倍时pH改变最大的是()A. 0.1 mol·L-1 NaOAc-0.1 mol·L-1 HAc溶液B. 0.1 mol·L-1 NaAc溶液C. 0.1 mol·L-1 NH4Ac-0.1 mol·L-1 HOAc溶液D. 0.1 mol ·L -1 NH 4Ac 溶液E. 0.1 mol ·L -1 NH 4OAc 溶液32. 欲配制pH=9的缓冲溶液,应选用( ) A. NH 2OH(羟氨) (p K b =8.04) B. NH 3·H 2O (p K b = 4.74) C. CH 3COOH (p K a = 4.74) D. HCOOH (p K a = 3.74) E. 以上均不能选用33. 欲配制pH=5的缓冲溶液,下列物质的共轭酸碱对中最好选择( ) A. 一氯乙酸(K a = 1.4×10-3) B. 甲酸(K a = 1.8×10-4) C. 乙酸(K a = 1.8×10-5) D. 氨水(K b = 1.8×10-5) E. 醋酸34. 用NaOH 滴定某一元酸HA ,在化学计量点时,[H +]的计算式是( )A. a HA K c ⋅B. -B HAa c c K ⋅C.a A w -K c K ⋅ D. -A wa c K K ⋅E.-A ac K 35. 配制HCl 标准溶液用( )法。
A. 直接配制法B.间接配制法C. 置换法D. 滴定法E. A 、B 选项均可 36. 配制NaOH 标准溶液用( )法。
A. 直接配法B.间接配制法C. 置换法D. 滴定法E. A 、B 选项均可 37. NaOH 要先配成饱和溶液是因为( )A .由于固体NaOH 易吸收空气中的H 2O 生成Na 2CO 3。
B. 由于固体NaOH 易吸收空气中的H 2CO 3生成Na 2CO 3。
C. 由于固体NaOH 易吸收空气中的CO 2生成Na 2CO 3。
D.由于固体NaOH易吸收空气中的SO2生成Na2SO4。
E. 由于固体NaOH易吸潮。
38. 血浆中CO2结合力的测,可采用()法。
A. 返滴定法B.间接滴定法C. 置换滴定法D. 直接滴定法E. A、B选项均可(二)B型题备选答案在前,试题在后,每组题均对应同一组备选答案,每题只有一个正确答案,每个备选答案可重复选用,也可不选用。
(39~43题共用备选答案)A.NaOH B.HCl C.靛蓝D.甲基橙 E. 酚酞39. 测定碱类化合物的含量,应使用的标准溶液是()。
40. 测定酸类化合物的含量,应使用的标准溶液是()。
41. 测定弱酸含量,选用的指示剂是()。
42. 测定弱碱含量,选用的指示剂是()。
43. 强碱滴定强酸最好的指示剂是()。
(44~48题共用备选答案)A.8.0(无色)~10.0(红色) B. 6.7(黄色)~8.4(红色)C. 3.1(红色)~4.4(黄色) D.2.9(红色)~4.0(黄色)E. 4.4(红色)~6.2(黄色)44. 酚酞指示剂的变色范围及颜色为()45. 甲基橙指示剂的变色范围及颜色为()46. 甲基红指示剂的变色范围及颜色为()47. 酚红指示剂的变色范围及颜色为()48. 甲基黄指示剂的变色范围及颜色为()(三)X型题每题的备选答案中有2个或2个以上正确答案。
少选或多选均不得分。
49. 可作为酸碱滴定法的标准溶液是()。
A.HCL B.NaOH C.HAcD.H2SO4E.NH3·H2O50. 只能用间接方法配制的标准溶液有()A.AgNO3B.NaOH C.NaClD.HCl E.Na2CO351. 影响滴定弱酸的滴定突跃大小因素有()。
A.滴定程序 B. 酸的浓度 C. 酸的电离常数D.指示剂 E. 滴定速度52. 影响指示剂变色范围大小的因素有()A. 速度B. 温度C. 溶剂D.指示剂的用量 E. 滴定程序53. 酸碱滴定法可直接测定哪些物质的含量()。