厦门大学分析化学课程作业015参考答案
- 格式:pdf
- 大小:99.27 KB
- 文档页数:3

分析化学习题册答案第一章 绪论一、填空题1. 分析方法 分析原理2. 定量分析 定性分析 结构分析3. 化学分析 仪器分析二、简答题答 试样的采集和制备-试样分解-干扰组分的分离-分析测定-结果的计算和评价。
第二章误差与数据处理一、填空题1、系统,偶然2、系统,偶然,真实值,平均值3、0.002,0.0035,1.7%4、精密度,标准5、空白,对照,增加平行测定的次数量6、±0.02 ,±0.0002,20,0.27、5,28、准确,不确定9、3 10、28.70 11、系统,系统,偶然二、选择题1、A2、D3、B4、B5、D6、D7、B8、A9、B 10、C 11、C 三、简答题1.解:(1)产生系统误差。
通常应该烘干至恒重,于干燥器中冷却至室温后,置于称量瓶中,采用差减法称量。
(2)使测量结果产生系统误差。
一般可通过空白试验来消除由此引起的系统误差。
(3)产生偶然误差。
原因是滴定管读数的最后一位是估计值,是不确定的数字。
(4)产生系统误差。
应该使用基准物质重新标定NaOH 标准溶液的浓度。
(5)滴定终点颜色把握不准,深浅不一致,由此带来的误差正负不定,属于偶然误差。
2.称取0.1000g 的试样时,称量的相对误差为0.1%;称取1.000试样时的相对误差为0.01%。
因为分析天平的绝对误差为±0.1mg ,所以称量的绝对误差一样大,称量的准确度好象一致,但二者的相对误差不一样大,称量1.000g 试样的相对误差明显小于称量0.1000 g 试样的相对误差。
因此,用相对误差表示准确度比绝对误差更为确切。
3.甲的报告是合理的,因为取样质量只有两位有效数字,限制了分析结果的准确度,使分析结果最多也只能保留两位有效数字。
四、计算题1.解:应先计算出纯(NH 4)2SO 4试剂中氮的理论含量,再与测定结果进行比较。
ω(B)(理论值)=%100132.13214.01100%)SO)((NH(N)2424⨯⨯=⨯M M =21.21%绝对误差为:21.14%-21.21%=-0.07% 相对误差为:%.%..0301002121070-=⨯-2.解:计算过程(略),结果如下:第一组:1d = 0.24% S 1 = 0.28% RSD 1= 0.74% 第二组:2d =0.24% S 2 = 0.33% RSD 2= 0.87%第二组数据中的最大值为38.3,最小值为37.3;第一组的最大值为38.4,最小值为37.6。

分析化学习题与部分思考题参考答案第1章 绪论1.1 30.0mL 0.150mol ·L -1的HCl 溶液和20.0mL 0.150mol ·L -1的Ba(OH)2溶液相混合,所得溶液是酸性、中性、还是碱性?计算过量反应物的浓度。
答案:12L 0.015mol 230.0)(20.030.00.15020.00.1502)过)((Ba(OH)-⋅=⨯+⨯-⨯⨯=量c1.2 称取纯金属锌0.3250g ,溶于HCl 后,稀释到250mL 容量瓶中,计算c (Zn 2+)。
答案:132L 0.01988mol 250.065.39100.3250)(Zn -+⋅=⨯⨯=⋅=V M m c1.3 欲配制Na 2C 2O 4溶液用于标定KMnO 4溶液(在酸性介质中),已知14L 0.10mol KMnO 51-⋅≈⎪⎭⎫⎝⎛c ,若要使标定时两种溶液消耗的体积相近,问应配制多大浓度(c )的Na 2C 2O 4溶液?要配制100mL 溶液,应称取Na 2C 2O 4多少克? 答案:O 8H 10CO 2Mn16H O 5C 2MnO 2222424++=++++--⎪⎭⎫⎝⎛=⎪⎭⎫ ⎝⎛4224O C Na 21KMnO 51n n ()()42242244O C Na O C Na 21KMnO KMnO 51V c V c ⋅⎪⎭⎫⎝⎛=⋅⎪⎭⎫ ⎝⎛ 若:)O C Na ()KMnO (4224V V ≈ 则:14422L 0.050mol KMnO 5121)O C (Na -⋅=⎪⎭⎫⎝⎛=c c g 67.00.134********.0)O C Na (3422=⨯⨯⨯=-m1.4 用KMnO 4法间接测定石灰石中CaO 的含量(见例1.6),若试样中CaO 含量约为40%,为使滴定时消耗0.020mol ·L -1 KMnO 4溶液约30mL ,问应称取试样多少克? 答案:()g21.0 %10010208.5630020.05%40 %10010CaO 21KMnO KMnO 51CaO)(3344=⨯⨯⨯⨯⨯=⨯⨯⎪⎭⎫ ⎝⎛⋅⋅⎪⎭⎫ ⎝⎛=s s s m m m M V c w1.5 某铁厂化验室常需要分析铁矿中铁的含量。


厦门大学-分析化学-复习题及答案————————————————————————————————作者:————————————————————————————————日期:2习题 1(酸碱滴定一)1.用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1的甲酸溶液,化学计量点pH是多少?计算用酚酞做指示剂(pH =9.0)时的终点误差。
(参考答案)答:2.用mol·L-1的HCl溶液滴定20.00 mL mol·L-1的,化学计量点前后0.1%的pH是多少?若用酚酞做指示剂(PT为9.0)计算终点误差。
(参考答案)答:化学计量点前0.1%:3.用0.1000 mol·L-1 HCl溶液滴定20.00 mL0.1000 mol·L-1的NaOH,若NaOH溶液中同时含有0.1000 mol·L-1的NaAc。
计算化学计量点以及化学计量点前后0.1%时的pH。
若滴定到pH7.0,终点误差有多大?(参考答案)答:(1) 化学计量点时,体系中有0.0500 mol·L-1 NaAc。
4.用0.2000 mol·L-1HCl溶液滴定0.2000 mol·L-1一元弱碱B(p K b=6.0),计算化学计量点的pH和化学计量点前后0.1%的pH。
若所用溶液的浓度都是0.0200 mol·L-1,结果又如何?(参考答案)答:(1)化学计量点时(2)当浓度为0.0200 mol·L-1时5.计算0.1000 mol·L-1NaOH滴定0.1000 mol·L-1至pH=5.0和pH=10.0时的终点误差。
(参考答案)滴定至pH=5.0,相当于滴定至6.用克氏定氮法测定试样含氮量时,用过量的100 mL0.3 mol·L-1HCl吸收氮,然后用0.2 mol·L-1NaOH标准溶液返滴。

第三章思考题与习题1.指出在下列情况下,各会引起哪种误差?如果是系统误差,应该采用什么方法减免? 答:(1)系统误差中的仪器误差。
减免的方法:校准仪器或更换仪器。
(2)系统误差中的仪器误差。
减免的方法:校准仪器或更换仪器。
(3)系统误差中的仪器误差。
减免的方法:校准仪器或更换仪器。
(4)系统误差中的试剂误差。
减免的方法:做空白实验。
(5)随机误差。
(6)系统误差中的操作误差。
减免的方法:多读几次取平均值。
(7)过失误差。
(8)系统误差中的试剂误差。
减免的方法:做空白实验。
2解:因分析天平的称量误差为mg 2.0±。
故读数的绝对误差g a 0002.0±=E根据%100⨯T E =E ar 可得 %2.0%1001000.00002.01.0±=⨯±=E ggg r%02.0%1000000.10002.01±=⨯±=E ggg r这说明,两物体称量的绝对误差相等,但他们的相对误差并不相同。
也就是说,当被测定的量较大时,相对误差就比较小,测定的准确程度也就比较高。
3解:因滴定管的读数误差为mL 02.0±,故读数的绝对误差mL a 02.0±=E 根据%100⨯TE =E ar 可得 %1%100202.02±=⨯±=E mL mLmL r%1.0%1002002.020±=⨯±=E mLmL mLr这说明,量取两溶液的绝对误差相等,但他们的相对误差并不相同。
也就是说,当被测定的量较大时,测量的相对误差较小,测定的准确程度也就较高。
5答::0.36 应以两位有效数字报出。
6答::应以四位有效数字报出。
7答::应以四位有效数字报出。
8答::甲的报告合理。
因为在称样时取了两位有效数字,所以计算结果应和称样时相同,都取两位有效数字。
9解:根据方程2NaOH+H 2C 2O 4·H 2O==Na 2C 2O 4+4H 2O 可知,需H 2C 2O 4·H 2O 的质量m 1为: g m 13.007.1262020.01.01=⨯⨯= 相对误差为 %15.0%10013.00002.01=⨯=E ggr则相对误差大于0.1% ,不能用H 2C 2O 4·H 2O 标定0.1mol·L -1的NaOH ,可以选用相对分子质量大的作为基准物来标定。


分析化学思考题参考答案(无节操复制)注:参考答案仅供参考祝大家取得好成绩!!第二章误差及分析数据的统计处理思考题答案1 正确理解准确度和精密度,误差和偏差的概念。
答:准确度表示测定结果和真实值的接近程度,用误差表示。
精密度表示测定值之间相互接近的程度,用偏差表示。
误差表示测定结果与真实值之间的差值。
偏差表示测定结果与平均值之间的差值,用来衡量分析结果的精密度,精密度是保证准确度的先决条件,在消除系统误差的前提下,精密度高准确度就高,精密度差,则测定结果不可靠。
即准确度高,精密度一定好,精密度高,准确度不一定好。
2 下列情况分别引起什么误差?如果是系统误差,应如何消除?(1)砝码被腐蚀;答:系统误差。
校正或更换准确砝码。
(2)天平两臂不等长;答:系统误差。
校正天平。
(3)容量瓶和吸管不配套;答:系统误差。
进行校正或换用配套仪器。
(4)重量分析中杂质被共沉淀;答:系统误差。
分离杂质;进行对照实验。
(5)天平称量时最后一位读数估计不准;答:随机误差。
增加平行测定次数求平均值。
(6)以含量为99%的邻苯二甲酸氢钾作基准物标定碱溶液;答:系统误差。
做空白实验或提纯或换用分析试剂。
3 用标准偏差和算术平均偏差表示结果,哪一个更合理?答:标准偏差。
因为标准偏差将单次测定的偏差平方后,能将较大的偏差显著地表现出来。
4 如何减少偶然误差?如何减少系统误差?答:增加平行测定次数,进行数据处理可以减少偶然误差。
通过对照实验、空白实验、校正仪器、提纯试剂等方法可消除系统误差。
5 某铁矿石中含铁39.16%,若甲分析结果为39.12%,39.15%,39.18%,乙分析得39.19%,39.24%,39.28%。
试比较甲、乙两人分析结果的准确度和精密度。
答:通过误差和标准偏差计算可得出甲的准确度高,精密度好的结论。
x1 = (39.12+39.15+39.18)÷3 =39.15(%) x2 = (39.19+39.24+39.28) ÷3 = 39.24(%)E1=39.15-39.16 =-0.01(%) E2=39.24-39.16 = 0.08(%)6 甲、乙两人同时分析同一矿物中的含硫量。

[标签:标题]篇一:2014厦门大学833分析化学考研真题思睿厦大考研网2014厦门大学833分析化学考研真题Ⅶ历年真题试卷与答案解析历年考研真题试卷厦门大学2005年招收攻读硕士学位研究生入学考试试题与答案解析科目代码:833科目名称:分析化学招生专业:环境科学、环境管理考生须知:答案必须使用墨(蓝)色墨水(圆珠)笔;不得在试卷(草稿)纸上作答;凡未按规定作答均不予评阅、判分一、简答题1. 简述定量分析的一般过程?2. 简要说明t分布曲线与标准正态分布曲线的异同点。
3. 简述生活用水的COD的测定方法。
4. 分析化学中酸碱平衡的处理是基于什么理论,简述内容。
5. 影响EDTA络合滴定中pM·突跃的因素有哪些?怎样影响的?6. 下列基准物:金属锌、重铬酸钾、十水硼酸钠和氯化钠分别用于何种滴定法中何种标准溶液的标定。
7. 为什么硫酸钡可以通过控制沉淀条件获得晶形沉淀,而氯化银却不能?8. 什么是分光光度法中的吸收曲线?制作吸收曲线的目的是什么?二、计算题1. 用比色皿法测定血浆样品的葡萄糖含量。
已知该项常规分析的总体标准偏差为0.10,应客户的要求将95%置信水平的置信区间控制在±0.12mol/L,至少应测定几次?(2005)f345678910∞t3.182.782.572.452.372.312.262.231.962. 现有1.0mol/LNaH2PO4溶液和1.0mol/L酒石酸氢钾溶液各100ml。
要使溶液的pH值增加1.0个pH单位,分别需加1.0mol/L NaOH溶液多少ml?请比较计算结果,说明为是什么(离解常数依次为2.16,7.21,12.32;3.04,4.37)3. 在pH=1时,用0.02000mol/L的EDTA标准溶液滴定含0.02mol/LBi3+和0.02molPb2+的混合液中的Bi3+。
计算说明Pb2+是否干扰测定?副反应主要是酸效应还是Pb2+对Y4-的副反应?(lgKBiY=27.94,lgKPbY=18.04,pH=1时lgaY(H)=18.01)4. 试剂厂生产FeCl3.6H2O试剂,国际规定二级品含量不低于99.0%,三级品不低于98.0%;现称取0.500g样品将其溶于水,向所得溶液中加少量盐酸酸化,并加入过量碘化钾充分反应,再用0.100mol/L的硫代硫酸钠滴定,其反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6,滴定至终点用去Na2S2O3标准液18.17ml,试通过计算确定此样品属于哪一级产品?5. 计算AgCl沉淀在pH=8.00,络合剂L的总浓度c(L)=0.10mol/L溶液中的溶解度。

目录第1章绪论 (1)第2章分析化学中的误差和数据处理 (1)一、内容提要 (1)二、重点与难点 (5)三、思考题与习题选解 (6)第 3 章化学分析法导论 (17)一、内容提要 (17)二、重点与难点 (18)三、思考题与习题选解 (18)第4章酸碱平衡与酸碱滴定法 (24)一、内容提要 (24)二、重点和难点 (32)三、思考题与习题选解 (32)第5章配位滴定法 (60)一、内容提要 (60)二、重点和难点 (62)三、思考题和习题选解 (62)第6章氧化还原滴定法 (75)一、内容提要 (75)二、重点和难点 (76)三、思考题与习题选解 (76)第7章沉淀滴定法 (91)一、内容提要 (91)二、重点和难点 (93)三、思考题和习题选解 (93)第8章重量分析法 (100)一、内容提要 (100)二、重点和难点 (101)三、思考题与习题选解 (101)第9章分析化学中的样品制备及常用分离方法 (107)一、内容提要 (107)二、重点与难点 (111)三、思考题与习题选解 (112)第1章 绪论第2章 分析化学中的误差和数据处理本章要求1.掌握绝对误差、相对误差、系统误差、偶然误差、精密度、准确度、有效数字及显著性检验、质量保证与质量控制、不确定度等基本概念。
2.掌握误差的产生原因及减免方法。
3.掌握准确度和精确度的表示方法及有关计算。
4.掌握有效数字的修约规则及运算规则、显著性检验的目的和方法、可疑数据的取舍方法、置信区间的含义及表示方法。
5.了解误差传递的规律和处理变量之间关系的统计方法——相关与回归。
6.理解分析结果的可靠性、分析方法的可靠性。
7.理解分析过程的质量保证与质量控制(分析前、分析中、分析后)。
8.了解不确定度的评估过程。
一、内容提要本章要求读者掌握绝对误差、相对误差、系统误差、偶然误差、精密度、准确度、有效数字及显著性检验、质量保证与质量控制、不确定度等基本概念;误差的产生原因及减免方法;准确度和精确度的表示方法及有关计算;有效数字的修约规则及运算规则、显著性检验的目的和方法、可疑数据的取舍方法、置信区间的含义及表示方法;了解误差传递的规律和处理变量之间关系的统计方法——相关与回归;理解分析结果的可靠性、分析方法的可靠性;理解分析过程的质量保证与质量控制(分析前、分析中、分析后);了解不确定度的评估过程。

《分析化学》习题参考答案(仪器部分)- (1)屏蔽效应和去屏蔽效应(2)自旋偶合和自旋分裂(3)化学位移和偶合常数(4)化学等价核和磁等价核(1)屏蔽效应:原子核外电子运动在外加磁场H0作用下产生与外加磁场方向相反的次级磁场,造成核实际受到的磁场强度减弱。
去屏蔽效应:烯烃、醛、芳环中,π电子在外加磁场作用下产生环流,使氢原子周围产生感应磁场,如果感应磁场的方向与外加磁场相同,即增加了外加磁场,所以在外加磁场还没有达到Ho时,就发生能级的跃迁,称为去屏蔽效应,该区域称为去屏蔽区。
(2)自旋偶合:相邻核自旋产生核磁矩间的相互干扰的现象。
自旋裂分:由自旋偶合引起的共振峰分裂现象。
(3)化学位移在一定的辐射频率下,处于不同化学环境的有机化合物中的自旋核,产生核磁共振的磁场强度或共振吸收频率不同的现象。
偶合常数:多重峰的峰间距;用来衡量偶合作用的大小。
(4)化学等价核:化学位移完全相同的核。
磁等价核:分子中的一组化学等价核,若它们对组外任何一个核都是以相同的大小偶合,则这一组核为磁等价核。
2.下列哪一组原子核不产生核磁共振信号,为什么?2119121211216H、147N 9F、6C 6C、1H 6C、8O并不是是所有原子核都能产生核磁共振信号,原子核能产生核磁共振现象是因为具有核自旋,其自旋量子数须不等于0。
质量数和质子数均为偶数的原子核,自旋量子数为0 ,质量数为奇数的原子核,自旋量子数为半整数,质量数为偶数,质子数为奇数的原子核,自旋量子数为整数。
由此,126C、168O这一组原子核都不产生核磁共振信号。
3.为什么强射频波照射样品,会使NMR信号消失,而UV与IR吸收光谱法则不消失?自旋核在磁场作用下,能级发生分裂,处在低能态核和处于高能态核的分布服从波尔兹曼分布定律,当B0 = 1.409 T,温度为300K时,高能态和低能态的1H核数之比为处于低能级的核数比高能态核数多十万分之一,而NMR信号就是靠这极弱过量的低能态核产生的。
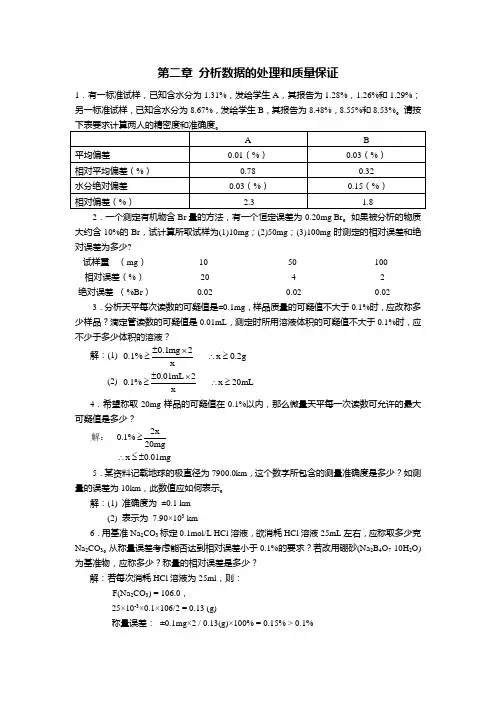
第二章 分析数据的处理和质量保证1.有一标准试样,已知含水分为1.31%,发给学生A ,其报告为1.28%,1.26%和1.29%;另一标准试样,已知含水分为8.67%,发给学生B ,其报告为8.48%,8.55%和8.53%。
请按2.一个测定有机物含Br 量的方法,有一个恒定误差为-0.20mg Br 。
如果被分析的物质大约含10%的Br ,试计算所取试样为(1)10mg ;(2)50mg ;(3)100mg 时测定的相对误差和绝对误差为多少? 试样重 (mg ) 10 50 100 相对误差(%) -20 -4 -2 绝对误差 (%Br )-0.02-0.02-0.023.分析天平每次读数的可疑值是±0.1mg ,样品质量的可疑值不大于0.1%时,应改称多少样品?滴定管读数的可疑值是0.01mL ,测定时所用溶液体积的可疑值不大于0.1%时,应不少于多少体积的溶液?解:(1) 0.1mg 20.1% x 0.2g x±⨯≥∴≥(2) 0.01mL 20.1% x 20mL x±⨯≥∴≥4.希望称取20mg 样品的可疑值在0.1%以内,那么微量天平每一次读数可允许的最大可疑值是多少?2x0.1%20mg x 0.01mg≥∴≤±解:5.某资料记载地球的极直径为7900.0km ,这个数字所包含的测量准确度是多少?如测量的误差为10km ,此数值应如何表示。
解:(1) 准确度为 ±0.1 km(2) 表示为 7.90×103 km6.用基准Na 2CO 3标定0.1mol/L HCl 溶液,欲消耗HCl 溶液25mL 左右,应称取多少克 Na 2CO 3。
从称量误差考虑能否达到相对误差小于0.1%的要求?若改用硼砂(Na 2B 4O 7·10H 2O)为基准物,应称多少?称量的相对误差是多少?解:若每次消耗HCl 溶液为25ml ,则:F(Na 2CO 3) = 106.0, 25×10-3×0.1×106/2 = 0.13 (g)称量误差: ±0.1mg×2 / 0.13(g)×100% = 0.15% > 0.1%F(Na 2B 4O 7·10H 2O) = 381.425×10-3×0.1×381.4/2 = 0.48(g)称量误差: ±0.1×2(mg)/0.48(g)×100% = 0.042% < 0.1%7.托盘天平读数误差为±0.1g ,分析样品应称至多少,才能保证可疑值不大于1%? 解: 0.1g1% x 10g x±≥≥ 8.测定固体氯化物中氯的百分含量,结果为59.83,60.04;60.45;59.88;60.33;60.24;60.28;59.77。
第一章 绪 论1. 解释下列名词:(1)仪器分析和化学分析;(2)标准曲线与线性范围;(3)灵敏度、精密度、准确度和检出限。
答:(1)仪器分析和化学分析:以物质的物理性质和物理化学性质(光、电、热、磁等)为基础的分析方法,这类方法一般需要特殊的仪器,又称为仪器分析法;化学分析是以物质化学反应为基础的分析方法.(2)标准曲线与线性范围:标准曲线是被测物质的浓度或含量与仪器响应信号的关系曲线;标准曲线的直线部分所对应的被测物质浓度(或含量)的范围称为该方法的线性范围。
(3)灵敏度、精密度、准确度和检出限:物质单位浓度或单位质量的变化引起响应信号值变化的程度,称为方法的灵敏度;精密度是指使用同一方法,对同一试样进行多次测定所得测定结果的一致程度;试样含量的测定值与试样含量的真实值(或标准值)相符合的程度称为准确度;某一方法在给定的置信水平上可以检出被测物质的最小浓度或最小质量,称为这种方法对该物质的检出限。
2. 对试样中某一成分进行5次测定,所得测定结果(单位g mL 1)分别为 0.36,0。
38,0.35,0。
37,0.39。
(1) 计算测定结果的相对标准偏差;(2) 如果试样中该成分的真实含量是0。
38 g mL 1,试计算测定结果的相对误差。
解:(1)测定结果的平均值37.0539.037.035.038.036.0=++++=x g mL 1标准偏差122222120158.015)37.039.0()37.037.0()37.035.0()37.038.0()37.036.0(1)(-=⋅=--+-+-+-+-=--=∑mL g n x x s ni i μ 相对标准偏差 %27.4%10037.00158.0%100=⨯=⨯=x s s r(2)相对误差 %63.2%10038.038.037.0%100-=⨯-=⨯-=μμx E r 。
3. 用次甲基蓝二氯乙烷光度法测定试样中硼时,为制作标准曲线,配制一系列质量浓度B (单位mg L 1)分别为0.5,1。
分析化学各章节习题(含答案)第一章误差与数据处理1-1 下列说法中,哪些是正确的?(1)做平行测定的目的是减小系统误差对测定结果的影响。
(2)随机误差影响精密度,对准确度无影响。
(3)测定结果精密度高,准确度不一定高。
(4)只要多做几次平行测定,就可避免随机误差对测定结果的影响。
1-2 下列情况,将造成哪类误差?如何改进?(1)天平两臂不等长(2)测定天然水硬度时,所用蒸馏水中含Ca2+。
1-3填空(1)若只作两次平行测定,则精密度应用表示。
(2)对照试验的目的是,空白试验的目的是。
(3)F检验的目的是。
(4)为检验测定结果与标准值间是否存在显著性差异,应用检验。
(5)对一样品做六次平行测定,已知d1~d5分别为0、+0.0003、-0.0002、-0.0001、+0.0002,则d6为。
1-4用氧化还原滴定法测定纯品FeSO4·7H2O中铁的质量分数,4次平行测定结果分别为20.10%,20.03%,20.04%,20.05%。
计算测定结果的平均值、绝对误差、相对误差、平均偏差、相对平均偏差、标准偏差及变异系数。
1-5有一铜矿样品,w(Cu) 经过两次平行测定,分别为24.87%和24.93%,而实际w(Cu)为25.05%,计算分析结果的相对误差和相对相差。
1-6某试样5次测定结果为:12.42%,12.34%,12.38%,12.33%,12.47%。
用Q值检验法和4d检验法分别判断数据12.47%是否应舍弃?(P = 0.95)1-7某分析人员测定试样中Cl的质量分数,结果如下:21.64%,21.62%,21.66%,21.58%。
已知标准值为21.42%,问置信度为0.95时,分析结果中是否存在系统误差?1-8 在不同温度下测定某试样的结果如下:10℃::96.5%,95.8%,97.1%,96.0%37℃:94.2%,93.0%,95.0%,93.0%,94.5%试比较两组数据是否有显著性差异?(P = 0.95)温度对测定是否有影响?1-9某试样中待测组分的质量分数经4次测定,结果为30.49%,30.52%,30.60%,30.12%。
有机化学习题与答案厦门大学有机化学习题与答案(厦门大学)第一章绪论习题一、根据下列电负性数据:判断下列键中哪个极性最强?为什么?答案 <请点击>二、(a) F2、HF、BrCl、CH4、CHCl3、CH3OH诸分子中哪些具有极性键?(b) 哪些是极性分子?答案 <请点击>三、下列各化合物有无偶极矩?指出其方向。
答案 <请点击>四、根据O和S的电负性差别,H2O和H2S相比,哪个的偶极-偶极吸引力较强,哪个的氢键较强?答案 <请点击>五、写出下列化合物的路易斯电子式。
答案 <请点击>六、把下列化合物由键线式改写成结构简式。
七、下面记录了化合物的元素定量分析和相对分子质量测定的结果,请计算它们的化学式。
(1) C:65.35%,H:5.60%,相对分子质量 110(2) C:70.40%,H:4.21%,相对分子质量 188(3) C:62.60%,H:11.30%,N:12.17%,相对分子质量 230(4) C:54.96%,H:9.93%,N:10.68%,相对分子质量 131(5) C:56.05%,H:3.89%,Cl:27.44%,相对分子质量 128.5(6) C:45.06%,H:8.47%,N:13.16%,Cl:33.35%,相对分子质量 106.5答案 <请点击>八、写出下列化学式的所有的构造异构式。
答案 <请点击>第一章绪论习题(1)1、什么是烃、饱和烃和不饱和烃?点击这里看结果2、什么是烷基?写出常见的烷基及相应的名称。
点击这里看结果3、给下列直链烷烃用系统命名法命名点击这里看结果4、什么是伯、仲、叔、季碳原子,什么是伯、仲、叔氢原子?点击这里看结果5、写出己烷的所有异构体,并用系统命名法命名。
点击这里看结果6、写出符合下列条件的烷烃构造式,并用系统命名法命名:1.只含有伯氢原子的戊烷2.含有一个叔氢原子的戊烷3.只含有伯氢和仲氢原子的已烷4.含有一个叔碳原子的已烷5.含有一个季碳原子的已烷6.只含有一种一氯取代的戊烷7.只有三种一氯取代的戊烷8.有四种一氯取代的戊烷9.只有二种二氯取代的戊烷点击这里看结果7、写出2-甲基丁烷和2,2,4-三甲基戊烷的可能一氯取代物的结构式,并用系统命名法命名。