高中化学 1.2.2元素周期表同课异构(B案)鲁科版必修2
- 格式:ppt
- 大小:1.74 MB
- 文档页数:9
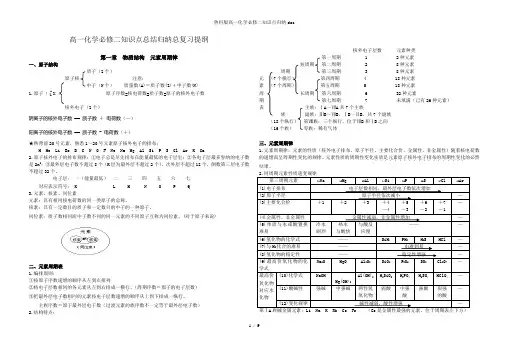
Z 高一化学必修二知识点总结归纳总复习提纲第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.原子( A X )原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)阴离子的核外电子数== 质子数+电荷数(—)阳离子的核外电子数== 质子数 - 电荷数(+)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子....。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数(过渡元素的族序数不一定等于最外层电子数)2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。


第1章原子结构元素周期律第2节元素周期律和元素周期表1.2.2元素周期表一、单选题1.已知某离子的结构示意图为,下列说法中正确的是()A.该元素位于第2周期ⅡA族B.该元素位于第2周期Ⅱ族C.该元素位于第3周期0族D.该元素位于第3周期ⅡA族【答案】D【解析】该微粒对应元素的原子序数为12,故为镁元素,镁元素在元素周期表中位于第3周期ⅡA族,D项正确。
2.国际理论与应用化学联合会已正式确定了第114号和第116号元素的名称缩写为Fl、Lv。
下列有关这两种元素的说法错误的是()A.两种元素位于同一周期B.116号元素位于ⅡA族C.两种元素都是活泼的非金属元素D.114号元素的原子半径比116号元素的大【答案】C【解析】第114号元素和第116号元素分别处于第7周期ⅡA族和ⅡA族,均为金属元素,A项、B项正确,C 项错误;依据同周期元素原子半径递变规律可知,114号元素的原子半径比116号元素的大,D项正确。
3.下列说法不正确的是()A.ⅡA族元素又叫碱金属元素,ⅡA族元素又叫卤族元素,0族元素又叫稀有气体元素B.元素周期表中共有七个周期C.元素周期表有7个主族,7个副族,1个0族,1个Ⅱ族,共18纵列D.X2+的核外电子数目为18,则X在第4周期第ⅡA族【答案】A【解析】第ⅡA族元素(除氢外)又叫碱金属元素,第ⅡA族元素又叫卤族元素,0族元素又叫稀有气体元素,A项错误;元素周期表有七个横行,称为七个周期,B项正确;元素周期表中有18纵列,除8、9、10三个纵列叫做Ⅱ族外,其余每个纵列各为一族,有7个主族、7个副族和1个0族,C项正确;X2+的核外电子数为18,则X原子的核外电子数为20,X的原子结构示意图为,X位于第4周期ⅡA族,D项正确。
4.短周期元素A、B、C在周期表中的位置如下图所示,其中B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是()AB CA.B、Mg、SiB.Be、Na、AlC.O、P、ClD.C、Al、P【答案】C【解析】根据短周期元素A、B、C在周期表中的位置可知,A一定在第2周期,B、C在第3周期。


元素周期律和元素周期表【教材分析】本节教材采用归纳总结的方法引导学生探索元素的性质(元素原子最外层电子排布、原子半径以及主要化合价、原子得失电子能力)和原子结构的关系从而归纳出元素周期律,揭示元素周期律的实质;再在元素周期律的基础上引导他们发现周期表中元素排布的规律,认识元素周期表的结构,了解同周期、同主族元素原子结构的特点,为下一节学习同周期元素性质的递变规律,预测同主族元素的性质奠定基础;同时,以铁元素为例,展示了元素周期表中能提供的有关元素的信息和金属与非金属的分区;最后以II a族、VA族、过渡元素为例分析了同族元素结构与性质的异同。
【教学目标】知识与技能目标1.让学生认识元素周期表的结构以及周期、族的概念,2.理解原子结构与元素在周期表中的位置间的关系。
过程与方法目标1.通过对获取的大量事实和数据等信息进行加工、分析,培养学生学归纳、概括能力、口头表达能力和交流能力。
2.通过探究,激发学生主动学习的意识。
并且掌握从大量的事实和数据中分析总结规律、透过现象看本质等科学抽象的方法。
情感态度与价值观目标1.通过对元素周期律的发现及元素周期表的编制过程的了解,使学生正确认识科学发展的历程,并以此来引导自己的实践,同时促使他们逐渐形成为科学献身的高贵品质。
2.使学生了解元素周期律和周期表的意义,认识事物变化由量变引起质变的规律,对他们进行辩证唯物主义教育。
【教学重难点】1.元素周期表的结构、周期的概念。
2.元素在周期表中的位置与原子结构的关系。
【教学准备】1.画出前三周期元素的原子结构示意图。
2.观察附录中的元素周期表一共有多少行?多少列?分别有多少种元素?3.查一查在周期表中同学们熟悉的元素在周期表中的位置【教学方法】启发诱导阅读探究讨论归纳。
【课时安排】1课时【教学过程】一、复习提问:1.元素周期律的定义?2.元素周期律的实质?3.随着原子序数的递增,元素的哪些性质呈现周期性变化?4.影响微粒半径大小的因素及半径大小比较的方法?请举例说明二、学生复习、讨论:学生回答:(四位同学单独回答)1.定义:元素的性质随着原子序数的递增而呈周期性变化的规律。

高中化学元素周期律和元素周期表(第一课时)学案 鲁科版必修2学习内容 学习目标:采用归纳总结的方法引导学生探索元素的性质(元素原子最外层电子排布、原子半径 以及主要化合价、原子得失电子能力)和原子结构的关系从而归纳出元素周期律,揭示元素周期 律的实质 学习重点:元素的性质与原子结构的关系 学习难点:元素的性质与原子结构的关系 【回顾•预习】1、原子序数: 在数值上: 原子序数= 2、完成课本11---12页的内容。
对于第二小题学习小组中 A1 B1 C1利用柱状图完成,A2 B2 C2利用折线图完成。
总结规律: 1、 2、 原子序数 电子层数 最外层电子数 达到稳定结构时最外层电子数1〜23〜1011 〜18结论:。
(图见书P11)。
1:【自主•合作•探究】 探究一观察总结仔细观察预习作业,讨论后总结规律如下表 3〜9号兀素 Li Be B C N O F Ne 原子半径/pm 152111 88 77 7066 64一变化趋势11〜17号元素Na Mg Al Si P S Cl Ar原子半径/pm18616014311711010499一变化趋势(完成书P12图1-3)结论:。
[拓展11、电子层数相同的元素(除稀有气体元素)的原子半径:探究二、[交流讨论]仔细观察所给表格,完成表 2的填空;并请相互讨论随着元素核电荷数的递 增,元素的原子半径变化有何规律,总结如下。
学 习指 导即 时感 悟自我 宀 完 成, 回顾 知 识。
了解 新知引入 新 知, 探索新知2、 当原子的电子层数不同而最外层电子数相同时,元素的原子半径:3、 阳离子半径和阴离子半径与对应的原子半径之间的大小关系: 半径大小比较,r(Na) r(Na+),r(CI) r(CI-),电子层排布相同的阴阳离子:原子序数为11〜17的元素的最高化合价和最低化合价的变化规律 是 。
原子序数为11〜17的元素的最高化合价和最低化合价的数值与原子核外最外层电子数的关系总结:元素周期律:【当堂达标】1、元素性质呈现周期性变化的基本原因是 A •元素的原子量逐渐增大 B •核外电子排布呈周期性变化 C .核电荷数逐渐增大 D •元素化合价呈周期性变化 2、 原子序数11〜17号的元素,随核电荷数的递增而逐渐变小的是A •电子层数B •最外层电子数 3、 下列元素的原子半径依次减小的是 A. Na 、Mg 、Al B. O 、 I 4、 下列微粒半径之比大于1的是 A • r(K+)/r(K) B • r(Ca)/r(Mg) C • 5、某元素X 的气态氢化物化学式为 层上有6个电子B •该元素最高正价氧化物的化学式为 元素最高正价氧化物对应水化物的化学式为H2XO4C .原子半径 N 、F C. P 、( D •元素最高化合价 ( ) Si 、Al D. C 、Si 、 r(S)/r(P) D • r(Cl)/r(Cl —) H2X ,下面的叙述不正确的是 XO2 C • A •该元素的原子最外电子 该元素是非金属元素 D .该 总结 知识总结提升【作业】【拓展•延伸】1、下列元素原子半径最大的是A、LiB、FC、NaD、Cl2 .下列递变情况不正确的是A、Na、Mg、Al最外层电子数依次增多B、P、S、Cl最高正价依次升高C、C、N、O最低负价的绝对值依次增大D、Li、Na、K原子半径依次增大3、原子半径由小到大,且最高正价依次降低的是A. Al、Mg、NaB. N、O、FC. Ar、Cl、S4、以下说法正确的是A.核电荷数越大,原子半径越大B.核电荷数越大,原子半径越小C.电子层多一层的元素的原子半径一定比电子层少一层的元素的原子半径大D、电子层数相同的元素原子(稀有气体除外)其半径随原子序数的递增而减小5、有A、B、C、D四种元素,最高正价依次为+1、+4、+5、+7,其核电荷数按B、C、D、A 顺序增大。

第1章原子结构元素周期律第2节元素周期律和元素周期表1.2.2元素周期表本课时是教材第一章第二节第二课时的内容,该课时包括元素周期表。
首先在学习原子核外电子排布的基础上,了解元素周期表的绘制原则,了解族和周期的概念。
学生在初中也了解了元素周期表的简单概念,但是不清楚元素周期表的编写原则,对于族和周期的分类也不是非常清晰。
通过本课时的学习,学生可以建立原子结构的简单模型,理解元素周期表尤其是短周期元素的编写方式,为今后元素周期律的学习打下坚实的基础。
宏观辨识与微观探析:从微观上理解原子核外电子排布的基本规律,明确宏观上的元素周期表与微观上的原子核外电子排布之间的关系,理解元素的排列规律。
证据推理与模型认知:建立原子结构的微观模型,理解门捷列夫利用已知元素的性质推理出元素周表的科学思想。
科学精神与社会责任:通过对元素周期表的学习,认识化学知识的规律性,理解化学知识从实验到理论,再由理论推测出实验结果的科学精神。
重点:元素周期表的结构难点:元素周期表中元素的排列与原子核外电子排布的关系多媒体一、知识回顾1.在原子中:原子序数=质子数=核电荷数=核外电子数2.质量数=质子数+中子数3.元素原子得失电子的能力与原子的最外层电子数、核电荷数和电子层数均有关系。
4.元素的性质随着原子序数的递增而呈周期性的变化。
二、导语元素周期律帮助人们认识了看似杂乱无章的化学元素之间的相互联系和内在的变化规律。
元素周期表是元素周期律的具体表现形式,是学习和研究化学科学的重要工具。
三、讲授新课展示课件:元素周期表活动一:与同伴交流,你对元素周期表认知有多少?从中能获取哪些信息?板书:初步认识元素周期表门捷列夫绘制的第一张元素周期表是按照元素的相对原子质量来排列的,随着科学家对原子结构认识的不断深入,元素周期表中元素的排列依据也由相对原子质量改为核电荷数。
元素周期表中元素的排列方式:将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。



课时2 元素周期表目标与素养:1.了解元素周期表的结构以及周期、族等的概念,理解原子结构与元素在周期表中位置的关系。
(宏观辨识与微观探析)2.了解ⅡA族、ⅤA族和过渡元素的某些性质和用途。
(证据推理与模型认知)一、元素周期表1.元素周期表与元素周期律的关系元素周期表是元素周期律的具体表现形式。
2.元素周期表与元素信息3.元素周期表的编排原则4.元素周期表的结构(1)周期(7个横行,7个周期)5(1)元素周期表中金属与非金属的分区(2)分界线附近元素的性质既表现金属元素的某些性质,又表现非金属元素的某些性质。
二、元素周期表中的部分重要元素和焰色反应1.元素周期表中的重要元素某些金属或它们的化合物在灼烧时火焰呈现特征颜色的反应,如钠:黄色,钾:浅紫色。
微点拨:钾的火焰颜色要透过蓝色钴玻璃观察。
1.判断正误(正确的打“√”,错误的打“×”)(1)ⅠA族全部是金属元素。
( )(2)最外层电子数等于2的元素均为ⅡA族元素。
( )(3)铁是过渡元素,但不是副族元素。
( )(4)元素周期表中位于金属元素与非金属元素分界线附近的元素属于过渡元素。
( )(5)元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素。
( )[答案] (1)×(2)×(3)√(4)×(5)×2.在元素周期表中,第1、2、3、4周期元素的数目分别是( )A.2、8、8、18 B.2、8、18、18C.2、18、18、18 D.2、8、18、32A [元素周期表中,1至6周期元素数目分别为2、8、8、18、18、32。
]3.关于元素周期表的说法正确的是( )A.元素周期表有7个周期,8个主族B.元素周期表有18个纵列,共16个族C.短周期元素中可能有副族元素D.最外层电子数相同的元素一定在同一族B [元素周期表中有7个主族,A错;短周期为1、2、3周期,不包含副族元素,C错;He和Mg最外层电子数都是2,但不在同一主族,D错。