两组分系统的液固平衡
- 格式:ppt
- 大小:2.49 MB
- 文档页数:54
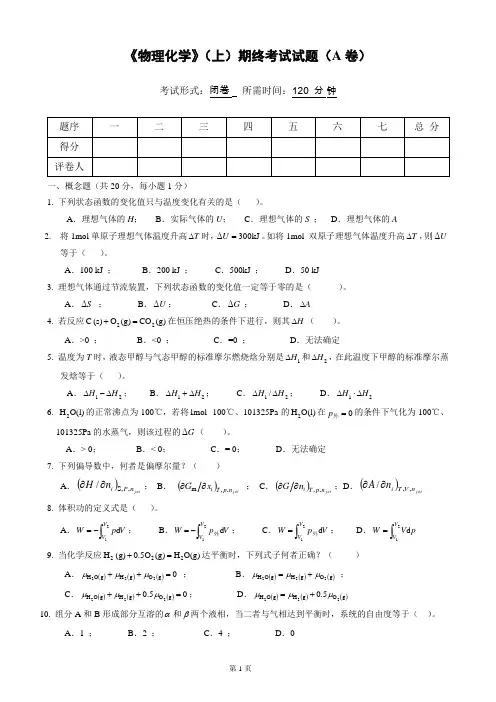



物理化学( 本)科阶段练习一.概念题1.理想气体的总压等于其各组分的分压之和。
对2.理想气体简化的微观模型是:(1) 分子没有体积 ;(2)分子间没有相互作用 。
3.实际气体的压缩因子Z 可以等于1。
对4.由水的相图可以看出,在101325 Pa 的压力下,–5℃的冰可以与–5℃的水平衡共存。
对 5.在热力学中,功分为体积功和非体积功。
试写出体积功的定义式 V p V V ⎰-21d 外。
6.热力学第一定律W Q U +=∆的适用条件是 封闭系统 。
式V Q U =∆的适用条件是 封闭系统、恒容和只做体积功 。
式p Q H =∆的适用条件是 封闭系统、恒压和只做体积功 。
7.一化学反应在恒容绝热的条件下进行,反应后系统的温度和压力均高于反应前的,则系统的U ∆ = 0。
8.气体的热力学标准状态为:压力为0.1MPa 下处于理想气体状态的气态纯物质。
对 9.在25℃时,下列关系式正确的是 (3) 。
()1 g)O,H (g ,(H 2o m f 2o m cH H ∆=∆) ()2 g),CO (C (2o m f o m c H H ∆=∆,金刚石)()3 g)(CO,g)(CO,g),(CO o m c o m f 2o m fH H H ∆+∆=∆10.在Pa 101325和100℃下,液态水变为水蒸气的过程 是 可逆过程。
11.p Q 与V Q 之间的换算关系为RT n Q Q p V )(∆-=。
12.卡诺热机的工作效率与它使用的工作介质种类 无关 。
13.试写出克劳修斯不等式⎰≥-∆-BAT QS0d 环。
14.绝热可逆膨胀过程的m S ∆必定为零。
对15.理想气体的热力学能U 和焓H 仅是温度的函数。
对16.一物质的热力学能为U 、焓为H ,则H > U 。
17.焦耳-汤姆逊效应的热力学特征是: 0=∆H 。
18.0d ≥S 作为过程的可逆性判据,其适用条件是:绝热过程或孤立系统中的过程 。





实验四二组分固-液平衡相图的测绘一、实验目的1. 掌握热分析法测绘Sn-Bi二组分固-液平衡相图的原理和方法。
2. 学会JX-3DA型金属相图测试仪的使用方法。
二、实验原理测绘二组分固-液平衡相图常用的实验方法是热分析法,其原理是将一种金属或合金熔融后,使之均匀冷却,每隔一定时间记录一次温度,表示温度与时间关系的曲线叫步冷曲线。
当熔融体系在均匀冷却过程中无相变化时,其温度将连续均匀下降得到一光滑的冷却曲线; 当体系内发生相变时,则因体系产生的凝固热与自然冷却时体系放出的热量相抵偿,冷却曲线就会出现转折或水平线段,转折点或水平线段所对应的温度,即为该组成合金的相变温度。
利用冷却曲线所得到的一系列组成和所对应的相变温度数据,以横轴表示混合物的组成,纵轴上标出开始出现相变的温度,把这些点连接起来,就可绘出相图。
二元简单低共熔体系的冷却曲线具有下图所示的形状。
用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态,因此必须保证冷却速度足够慢才能得到较好的效果(常用调压变压器或设置一定的保温功率控制电炉的冷却速度为6-8℃/min,因为小心控制冷却速度是实验成败的关键)。
此外,在冷却过程中,一个新的固相出现以前,常常发生过冷现象,轻微过冷则有利于测量相变温度;但严重过冷现象,却会使折点发生起伏,使相变温度的确定产生困难。
遇此情况,可延长dc线与ab线相交,交点e即为转折点温度。
三、仪器药品JX-3DA型金属相图测试仪1套;天平。
Sn(化学纯);Bi(化学纯);石墨粉;硅油四、实验步骤1. 样品配制用感量0.1g台称分别配制含铋0%,10%、30%、58%、70%、80%、90%和100%的铋锡混合物各100g分别置于对应的坩埚中,并在样品上方各覆盖一层石墨粉。
插入对应编号的热电偶(为改善导热性能应在热电偶套管内加些硅油)。
2. 测绘步冷曲线图3 JX-3DA型金属相图测试仪(1)按图3连接好各部件。
打开电源开关,预热10min。
第四章 相平衡单元测试卷一、选择题(每小题1分,共30分)1. 只要知道纯物质的饱和蒸汽压与温度的定量关系,即可得到二元混合物气液平衡相图的是 。
A :实际溶液;B :理想溶液;C :理想稀溶液2. 对于二元理想混合物的气液平衡相图(恒温),以下说法不正确的是 。
A :液相线示意了溶液的蒸气压随液相组成的变化关系;B :液相线为直线是理想混合物的一个特征;C :液相线为泡点线3. 对于二元理想混合物的气液平衡相图(恒温),以下说法不正确的是 。
A :气相线示意了溶液的蒸气压随气相组成的变化关系;B :气相线为曲线;C :气相线为露点线4. 对于二元理想混合物的气液平衡相图(恒压),以下说法不正确的是 。
A :液相线为泡点线,气相线为露点线;B :液相线示意了沸点随液相组成的变化;C :液相线为直线5. 如二元混合物气液平衡相图中出现正偏差时,下列正确的说法是 。
A : i i i x p p *<;B :正偏差强烈时,可形成最高恒沸混合物;C :正偏差强烈时,可形成最低恒沸混合物6. 如二元混合物气液平衡相图中出现负偏差时,下列正确的说法是 。
A : *i i i p p x >;B :负偏差强烈时,可形成最低恒沸混合物;C :负偏差强烈时,可形成最高恒沸混合物7. 二元混合物气液平衡相图中出现正偏差的原因,不正确的说法是 。
A :溶液中不同组分分子间相互作用较强;B :第二种物质的加入使分子的缔合程度降低;C :溶液中不同组分分子间的相互吸引比纯物质弱8. 二元混合物气液平衡相图中出现负偏差的原因,不正确的说法是 。
A :溶液中不同组分分子间相互作用较强;B :不同组分间生成氢键而相互缔合;C :溶液中不同组分分子间的相互吸引比纯物质弱9. 关于恒沸混合物,不正确的说法是 。
A :恒沸混合物是一种具有确定组成的化合物;B :恒沸混合物并不是一种具有确定组成的化合物;C :在恒沸点,泡点线与露点线重合10. 二元系的气液平衡相图(恒压)中,恒沸点的自由度为 。