高中化学选修五——有机化学基础入门(精选课件)
- 格式:doc
- 大小:171.00 KB
- 文档页数:8









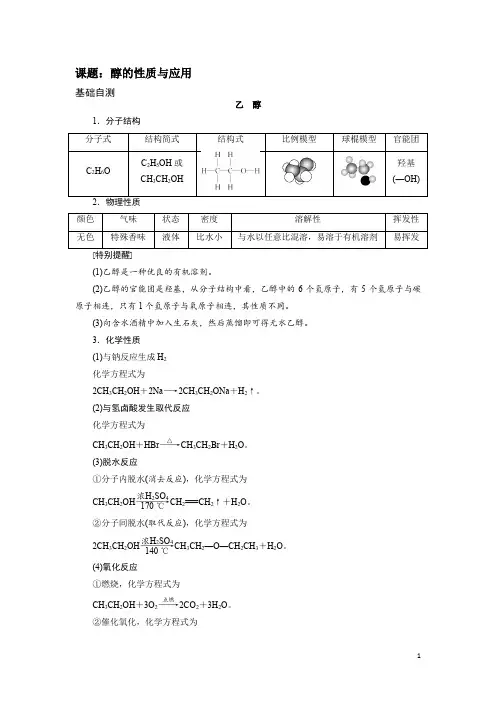
课题:醇的性质与应用基础自测乙 醇1.分子结构(1)乙醇是一种优良的有机溶剂。
(2)乙醇的官能团是羟基,从分子结构中看,乙醇中的6个氢原子,有5个氢原子与碳原子相连,只有1个氢原子与氧原子相连,其性质不同。
(3)向含水酒精中加入生石灰,然后蒸馏即可得无水乙醇。
3.化学性质 (1)与钠反应生成H 2 化学方程式为2CH 3CH 2OH +2Na ―→2CH 3CH 2ONa +H 2↑。
(2)与氢卤酸发生取代反应 化学方程式为CH 3CH 2OH +HBr ――→△CH 3CH 2Br +H 2O 。
(3)脱水反应①分子内脱水(消去反应),化学方程式为 CH 3CH 2OH ――――→浓H 2SO 4170 ℃CH 2===CH 2↑+H 2O 。
②分子间脱水(取代反应),化学方程式为2CH 3CH 2OH ――――→浓H 2SO 4140 ℃CH 3CH 2—O—CH 2CH 3+H 2O 。
(4)氧化反应①燃烧,化学方程式为CH 3CH 2OH +3O 2――→点燃2CO 2+3H 2O 。
②催化氧化,化学方程式为2CH 3CH 2OH +O 2――→Cu 或Ag △2CH 3CHO +2H 2O 或CH 3CH 2OH +CuO ――→△CH 3CHO +Cu +H 2O 。
(5)酯化反应乙醇与乙酸发生酯化反应的化学方程式为CH 3CH 182OH +CH 3COOH 浓H 2SO 4△CH 3CO 18OCH 2CH 3+H 2O 。
(1)钠与水反应要比乙醇剧烈的多,这是因为乙醇羟基上的氢比水难电离,乙醇属于非电解质。
(2)乙醇在170 ℃和140 ℃都能脱水,这是分子中存在羟基的缘故。
在170 ℃发生的是分子内脱水,在140 ℃发生的是分子间脱水,说明外界条件不同时,脱水的方式不同,产物也不同。
石棉绒或氧化铝也可作为乙醇发生消去反应的催化剂。
(3)乙醇分子的官能团是羟基,它决定了乙醇的化学性质,但乙基(—CH 2CH 3)对羟基也有影响。
课题:羧酸的性质及应用基础自测乙酸的结构与性质1.物理性质 俗称 颜色 气味 状态 熔沸点 挥发性 溶解性 醋酸(纯净的乙酸称为冰醋酸) 无色 刺激性 液 低 易 易溶于水和有 机溶剂分子式 (化学式)结构式结构简式官能团 (特征基团) 比例模型C 2H 4O 2CH 3COOH 结构简式—COOH 名称羧基(1)弱酸性①乙酸在水溶液里部分电离产生H +,电离方程式为CH 3COOH CH 3COO -+H +,从而使乙酸具有酸的通性。
②乙酸的酸性强于碳酸,常见几种物质的酸性强弱顺序为:乙酸>碳酸>苯酚>HCO -3。
(2)酯化反应①乙酸与醇反应的化学方程式为②羧酸与醇发生酯化反应时,酸脱羟基,醇脱氢;酯化反应一般是可逆反应。
③乙酸和乙醇反应时,增大乙酸乙酯产率的方法:移去产物乙酸乙酯或增大乙醇的浓度。
1.羟基氢原子的活泼性比较含羟基的物质比较项目醇水酚羧酸羟基上氢原子活泼性―――→逐渐增强在水溶液中电离程度极难电离难电离微弱电离部分电离酸碱性中性中性很弱的酸性弱酸性与Na反应反应放出H2反应放出H2反应放出H2反应放出H2与NaOH反应不反应不反应反应反应与NaHCO3反应不反应不反应不反应反应放出CO2能否由酯水解生成能不能能能(1)反应机理羧酸与醇发生酯化反应时,一般是羧酸分子中的羟基与醇分子中羟基上的氢原子结合生成水,其余部分结合生成酯,用示踪原子法可以证明。
(2)基本类型①一元醇与一元羧酸之间的酯化反应。
CH3COOH+C2H5OH浓硫酸△CH3COOC2H5+H2O②二元羧酸与一元醇之间的酯化反应。
HOOC—COOH+2C2H5OH浓硫酸△C2H5OOC—COOC2H5+2H2O③一元羧酸与二元醇之间的酯化反应。
2CH3COOH+HOCH2CH2OH浓硫酸△CH3COOCH2CH2OOCCH3+2H2O④二元羧酸与二元醇之间的酯化反应。
此时反应有两种情况:⑤羟基酸的自身酯化反应。
高中化学选修五——有机化学基
础入门
有机化学基础入门
一、有机物概述
1。
概念:有机化合物简称有机物,是指含碳的化合物,除CO、CO2、碳酸盐等之外。
2。
特点:①一般不溶于水,易溶于有机物;
②熔沸点较低,易气化;
③一般可燃;
④一般为非电解质,故其水溶液一般不导电;
⑤有机反应速率小,副反应多,故化学反应方程式一般用“→”.
3.成键方式:有机化合物中的原子的化学键数必须满足:
原子C H O/S
N
/P
卤素原
子
键
数
41231
形成物质时,可以是单键,双键,三键,也可以是链状或者环状,如:
4.表达方式:同一有机物有多种不同的表示方法,其中最常用的为结构简式。
表达方式特点实例注意事项
分子式/CxHy O z N w C3H8、C10H16O3N2①由分子组成的物质
化学式等才有分子式,有机物一
般都有.②其中O、N的
次序不限。
最简式/实验式所有原子
最简整数
比
C4H8的最简式为
CH2;
C6H12O6的最简式
为CH2O
C3H8的最简式和分子式
相同
结构式画出所有
的键
结构简式
能体现结
构,但省略
了一些键
①仅.能省略单键,双
键、三键均不可省略;
②单键中仅横着的键
可省略,竖着的键不能
省略;③碳氢键均可省
略;④支链(即竖直方
向的键)写在上下左右
均可,且无区别
键线式
用线表示
键,省略碳
氢原子
①仅.碳和氢可以省略;
②每个转角和端点均
表示碳原子 ,但若端
点写出了其它原子,则
表示碳原子被取代
球棍模型
球表示原
子,键表示
化学键
①必须符合每种原子
的键数;②球的大小必
须与原子半径对应一
致
比例模型化学键被
省略
球的大小表示原子的
相对大小
绝大多数情况下,有机化学方程式中除燃烧用分子式外,其它方程式有机物一律写结构简式。
5.同分异构现象:即相同分子式,不同结构的现象.相互间互称为同分异构体。
如:
6.取代基与官能团
(1)取代基:指有机物去氢后剩余的原子或原子团,它们均是一个有机片段,可以相互连接成有机物。
如:
(2)官能团:指能体现有机物特殊性质的原子或原子团,由此可划物质类别。
如:
官能团碳碳双
键
碳碳三
键
卤素原
子
羟基醚键醛基
对应结
构
物质类
别
烯烃炔烃卤代烃醇或酚醚醛官能团羰基羧基酯基氨基硝基……对应结
构
……
物质类
别酮羧酸酯
氨基化
合物
硝基化
合物
……
7.有机物的分类
ﻬ二、烷烃
1.定义:烃分子中的碳原子之间只以单键结合成链状,碳原子剩余的价键全部跟氢原子相结合,使每个碳原子的化合价都已充分利用,都达到“饱和”。
这样的烃叫做饱和烃,又叫烷烃....文档交流仅供参考...
(1)关键词:①烃:指只含C和H的有机物;
②饱和烃:指只含单键,不含碳碳双键、碳碳三键的烃。
类似有饱和醇、饱和醛等;
③链状:链状的饱和烃叫烷烃,环状的饱和烃叫环烷烃。
(2)烷烃的通式:CnH2n+2。
任何有机物的氢原子数都不能大于烷烃,比如C10H24O3N不存在。
2.同系物:即同一系列的物质。
比如烷烃这一系列互称为同系物,环烷烃之间也互为同系物,但烷烃和环烷烃之间不是同系物。
它的概念是指结构相似,分子组成相差若干个(不小于1个)CH2的有机物之间....文档交流仅供参考...
(1)关键词:①结构相似:指含有相同的官能团;
②分子组成:指分子式上相差CH2,而不是结构式上相差。
(2)“四同”比较:
同位素同素异形体同系物同分异构体
字面解析元素周期表
中相同位置
的核素
同种元素不
同形态的物
质
同一系列的
物质
相同分子式
不同结构的
物质
对象核素(不是单质同一系列有任何物质
物质)机物间,有机物
无机物均可
实例12C和14C 金刚石和石
墨
甲烷和乙烷
正丁烷和异
丁烷
性质异同化学性质相
同(因为同
一元素),物
理性质(比
如质量)不
同
化学性质相
似(因为同
一元素的单
质),物理性
质不同(因
为不同物
质)
化学性质相
似(因为结
构相同),物
理性质递变
(因为增加
CH2)
化学性质、
物理性质均
不同(因为
不同物质)
互称为同系物的物质之间不可能是同分异构体,反之亦然.
3.烷烃的命名
(1)普通命名法:又称为习惯命名法,用于简单有机物的命名。
①碳原子数在10个以内,依次用“天干"(甲、乙、丙、丁、戊、已、庚、辛、壬、癸)代表碳原子数,其后加上“烷”字;碳原子数在10个以上,用汉字数字表示(如十二烷)。
...文档交流仅供参考...
②同一烷烃,出现同分异构体时,支链由少到多依次加上前缀,正异新。
如:
(2)系统命名法:适用于任何有机物的系统的命名方法.
步骤:①选主链. 原则:a、碳链最长;b、一样长时,支链最多。
如:
②对主链碳编号。
原则:a、从支链近端开始编号;
b、一样时,甲基优先。
如:
③命名. 原则:a、先简单基团再复杂基
团;b、阿拉伯数字之间用
“,”相隔,阿拉伯数字和
汉字之间用“-”相连;
如:...文档交流仅供参考...
4。
等效氢与卤代物种类数
(1)等效氢:即相同效果的氢.因为有机物是空间结构,故其在纸平面上只是投影,凡是在空间中一样的H原子即称为等效氢,它们被卤素取代后的产物相同.等效氢有两种:①对称;②旋转重合。
如:...文档交流仅供参考...
(2)一卤代物:即用一个卤素原子取代一个氢原子剩下的有机物。
有几种等效氢就有几种一卤代物。
如:
(3)二卤代物:即一卤代物的一卤代物。
方法是先用等效氢找出一卤代物,再找它的一卤代物。
如:
(4)多卤代物:若烷烃有n个氢,则其m卤代物(m〈n)种类数与(n—m)卤代物种类数相同。
如:C3H8的二氯代物和六氯代物种类数都是4种,因为前者是找两个氯的相对位置,后者是找两个氢的相对位置。
...文档交流仅供参考...
5.同分异构体的书写:方法是先写碳骨架,再补充氢原子(利用碳四个键),具体规则为:
①主链碳由长到短;
②支链碳由中间到两边,注意避免重复;不能改变主链碳数;
③两个支链时,先定一个,再定另一个.如:
6.有机物的物理性质
(1)溶解性:有机物除了醇、醛、酸外基本均不溶于水,有机物和有机物是互溶的.
(2)密 度:有机物密度一般比水小,比水大的常见物质是:CC l4、溴苯、硝基苯等。
(3)熔沸点:同系物随相对分子质量增大,熔沸点升高。
如烷烃随碳数增加,熔沸点增大;
烷烃的同分异构体之间,支链越多,熔沸点越低,如
正戊烷〉异戊烷>新戊烷。
常温下碳数小于等于4的烃为气态,烃的含氧衍生
物仅HCH O(甲醛)为气体。
(4)颜 色:高中阶段的有机物一般为无色。
7.烷烃的化学性质
(1)燃烧:有机物完全燃烧产物均为CO 2、H 2O 等;不完全燃烧会产生黑烟(碳单质)、CO 等。
①烃的完全燃烧通式:222C H ()O CO H O 4
2
点燃
++−−−→+x y y y x x
②规律:a、求算n(CO 2):n(H 2O ),只能求最简式;要求分子式得算n(有机物):n(C O2):n(H 2O),即1mol 有机物燃烧得x mo l碳和y mo l氢;...文档交流 仅供参考...
b 、等物质的量....
的烃耗氧量大小,比较4
+y x 即可.如:C 3H8
(4
+y x =5)比C 4H 6(4
+y x =5.5)耗氧量小;
c 、等质量..
的烃耗氧量大小,比较y x
即可.如:C 3H 8(y
x
=2.67)比C 4H 6(4
+y x =1。
5)耗氧量大.
(2)取代反应:即取而代之的意思。
烷烃有几个氢原子,就可以被卤素原子取代几次。
如:
产物为它们的混合物。
产物中CH 3C l为气体,其它三种有机产物为液体.
同理,每mol 乙烷(C 2H 6)最多可以与6mol Cl6反应,共有(1+2+2+2+1+1=9)种有机产物。
...文档交流 仅供参考...
(3)烷烃的高温裂解:烷烃受热均可分解,产物为C 、烯烃、炔烃等。
如:
42CH C+2H 高温
−−−→
81841048C H C H C H 高温−−−→+ 或 818383624C H C H C H +C H 高温
−−−→+等。