人教版高中化学选修5有机化学基础知识点
- 格式:docx
- 大小:10.16 KB
- 文档页数:2

第五章进入合成有机高分子化合物的时代第一节合成高分子化合物的基本方法一、合成高分子化合物的基本反应类型1.加成聚合反应(简称加聚反应)(1)特点①单体分子含不饱和键(双键或三键);②单体和生成的聚合物组成相同;③反应只生成聚合物。
—(2)加聚物结构简式的书写将链节写在方括号内,聚合度n在方括号的右下角。
由于加聚物的端基不确定,通常用“—”表示。
如聚丙烯的结构式。
(3)加聚反应方程式的书写①均聚反应:发生加聚反应的单体只有一种。
如②共聚反应:发生加聚反应的单体有两种或多种。
如2.缩合聚合反应(简称缩聚反应)?(1)特点①缩聚反应的单体至少含有两个官能团;②单体和聚合物的组成不同;③反应除了生成聚合物外,还生成小分子;④含有两个官能团的单体缩聚后生成的聚合物呈线型结构。
(2)缩合聚合物(简称缩聚物)结构简式的书写要在方括号外侧写出链节余下的端基原子或原子团。
如'(3)缩聚反应方程式的书写单体的物质的量与缩聚物结构式的下角标要一致;要注意小分子的物质的量:一般由一种单体进行缩聚反应,生成小分子的物质的量为(n-1);由两种单体进行缩聚反应,生成小分子的物质的量为(2n-1)。
①以某分子中碳氧双键中的氧原子与另一个基团中的活泼氢原子结合成水而进行的缩聚反应。
②以醇羟基中的氢原子和酸分子中的羟基结合成水的方式而进行的缩聚反应。
③以羧基中的羟基与氨基中的氢原子结合成H2O的方式而进行的缩聚反应。
^特别提醒单体与链节不同,如单体是CH2===CH2,链节为—CH2—CH2—,加聚物与单体结构上不相似,性质不同,不为同系物。
如分子中无。
加聚反应缩聚反应不同点反应物单体必须是不饱和的!单体不一定是不饱和的,但必须要含有某些官能团生成物生成物只有高分子化合物生成物除高分子化合物外,还有水、卤化氢、氨等小分子化合物聚合物分子组成与单体相同%分子组成与单体不完全相同相同点反应物可以是同一种单体,也可以是不同种单体,生成物是高分子化合物二、高分子化合物单体的确定1.加聚产物、缩聚产物的判断判断有机高分子化合物单体时,首先判断是加聚产物还是缩聚产物。

第四章生命中的基础有机化学物质第一节油脂学习目标核心素养1.了解油脂的概念。
2.理解油脂的组成和结构,了解油脂的物理性质和用途。
3.理解油脂的化学性质,油脂的皂化反应和氢化反应。
1.通过油和脂的宏观状态,结合油和脂的结构区别,从微观化学键的角度认识油和脂区别的本质原因。
(宏观辨识与微观探析)2.通过油脂的皂化和氢化反应,认识油脂在生产生活中的重要应用,感受化学对社会发展的重大贡献。
(科学态度与社会责任)3.通过油脂的结构特点,依据结构决定性质的理论模型,分析和预测油脂的化学性质。
(证据推理与模型认知)一、油脂的组成与结构1.组成(1)油脂是高级脂肪酸与甘油形成的酯,属于酯类化合物。
(2)组成元素:C、H、O。
2.结构油脂的结构可表示为。
3.分类4.常见的高级脂肪酸【判一判】判断下列说法是否正确。
①油脂属于酯类,对应的醇不一定是丙三醇 ( × )提示:油脂是酯类的一种,特点为对应的酸和醇分别为高级脂肪酸和丙三醇。
②天然油脂都是混合物,没有固定的熔、沸点 ( √ )提示:天然油脂大多为混合物。
③同种简单甘油酯可组成纯净物,同种混合甘油酯也可以组成纯净物 ( √ ) 提示:无论简单甘油酯还是混合甘油酯,只要只有一种成分,就是纯净物。
【微思考】油脂和乙酸乙酯是否为同系物?提示:否。
油脂为高级脂肪酸的甘油酯,含有3个酯基,乙酸乙酯含有1个酯基,不是同系物。
二、油脂的性质 1.物理性质:色、味、态纯净的油脂是无色、无味的,但一般油脂因溶有维生素和色素等而有颜色和气味 密度密度比水的小,为0.9~0.95 g·cm -3 熔、沸点天然油脂是混合物,无固定的熔、沸点 溶解性 难溶于水,易溶于有机溶剂,工业上根据这一性质,常用有机溶剂来提取植物种子里的油。
油脂本身也是一种较好的溶剂2.化学性质:(1)油脂的水解反应(以硬脂酸甘油酯为例)——油脂的共性:1 mol 油脂完全水解的产物是1 mol 甘油和3 mol 高级脂肪酸(或盐)。
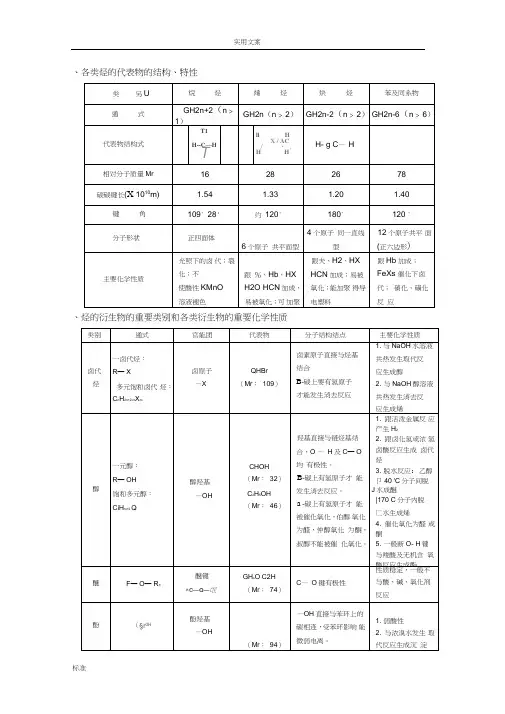
、各类烃的代表物的结构、特性、烃的衍生物的重要类别和各类衍生物的重要化学性质三、有机物的鉴别鉴别有机物,必须熟悉有机物的性质(物理性质、化学性质),要抓住某些有机物的特征反应,选用合适的试剂,一一鉴别它们。
1常用的试剂及某些可鉴别物质种类和实验现象归纳如下:2 •卤代烃中卤素的检验取样,滴入NaOH溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 溶液,观察沉淀的颜色,确定是何种卤素。
3 •烯醛中碳碳双键的检验(1)若是纯净的液态样品,则可向所取试样中加入溴的四氯化碳溶液,若褪色,则证明含有碳碳双键。
(2)若样品为水溶液,则先向样品中加入足量的新制C U(OH)2悬浊液,加热煮沸,充分反应后冷却过滤,向滤液中加入稀硝酸酸化,再加入溴水,若褪色,则证明含有碳碳双键。
★若直接向样品水溶液中滴加溴水,则会有反应:一CHO + Br2 + H20 T —COOH +2HBr 而使溴水褪色。
4. 二糖或多糖水解产物的检验若二糖或多糖是在稀硫酸作用下水解的,则先向冷却后的水解液中加入足量的NaOH 溶液,中和稀硫酸,然后再加入银氨溶液或新制的氢氧化铜悬浊液,(水浴)加热,观察现象,作出判断。
5. 如何检验溶解在苯中的苯酚?取样,向试样中加入NaOH溶液,振荡后静置、分液,向水溶液中加入盐酸酸化,再滴入几滴FeCb溶液(或过量饱和溴水),若溶液呈紫色(或有白色沉淀生成),则说明有苯酚。
★若向样品中直接滴入FeCb溶液,则由于苯酚仍溶解在苯中,不得进入水溶液中与卩63+进行离子反应;若向样品中直接加入饱和溴水,则生成的三溴苯酚会溶解在苯中而看不到白色沉淀。
★若所用溴水太稀,则一方面可能由于生成溶解度相对较大的一溴苯酚或二溴苯酚,另一方面可能生成的三溴苯酚溶解在过量的苯酚之中而看不到沉淀。
6. 如何检验实验室制得的乙烯气体中含有CH2= CH、SO、CO、HO?将气体依次通过无水硫酸铜、品红溶液、饱和Fe2(SO4)3溶液、品红溶液、澄清石灰水、(检验水)(检验SQ)(除去SO)(确认SQ已除尽)(检验CO)溴水或溴的四氯化碳溶液或酸性高锰酸钾溶液(检验CH2= CH)。

第三节蛋白质和核酸学习目标核心素养1.了解氨基酸的组成和结构,知道氨基酸的两性。
2.了解氨基酸的组成、结构特点和主要化学性质,知道氨基酸和蛋白质的关系。
3.了解蛋白质的组成、结构和性质(盐析、变性、水解、颜色反应等)。
了解氨基酸、蛋白质与人体健康的关系。
4.认识蛋白质、酶、核酸等物质与人体健康的关系。
1.从微观官能团的角度理解氨基酸、蛋白质性质和核酸的性质,形成结构决定性质的观念,能从宏观和微观相结合的视角分析和解决实际问题。
(宏观辨识与微观探析)2.从蛋白质的性质出发,具有较强的问题意识,设计实验方案,并能对实验进行评价和优化。
(科学探究与创新意识)3.认识蛋白质和核酸在生命科学发展中的重要应用,感受化学对社会发展的重大贡献。
(科学态度与社会责任)一、氨基酸的结构与性质1.概念和结构:(1)概念:羧酸分子中烃基上的氢原子被氨基取代的化合物。
(2)结构:α-氨基酸的结构简式为,官能团为氨基(—NH2)和羧基(—COOH)。
(3)常见的氨基酸。
俗名结构简式系统命名甘氨酸α-氨基乙酸丙氨酸α-氨基丙酸谷氨酸2-氨基-1,5-戊二酸苯丙氨酸α-氨基苯丙酸2.氨基酸的性质:(1)物理性质。
颜色状态熔点溶解性水强酸或强碱乙醇、乙醚无色晶体较高大多数能溶能溶难溶(2)化学性质。
①两性。
氨基酸分子中既含有羧基,又含有氨基,是两性化合物,因而能与酸、碱反应生成盐。
a.α 氨基酸与盐酸的反应:。
b.α 氨基酸与氢氧化钠的反应:。
②成肽反应。
两个氨基酸分子(可以相同,也可以不同),在酸或碱的存在下加热,通过一分子的氨基和另一分子的羧基间脱去一分子水,缩合成含有肽键()的化合物的反应,称为成肽反应。
例如,氨基酸二肽或多肽蛋白质。
【微思考】既能与酸反应,又能与碱反应的物质有哪些?提示:氨基酸、Al、Al2O3、Al(OH)3、弱酸的酸式盐(如NaHCO3)、弱酸的铵盐[如(NH4)2CO3]。
【教材二次开发】教材介绍了氨基酸的成肽反应,成肽反应的反应机理是什么?有哪些成肽方式?提示:酸脱羟基、氨脱氢。

人教版高中化学选修5有机化学基础知识点有机化学基础第一章认识有机化合物第一节有机化合物的分类第二节有机化合物的结构特点第三节有机化合物的命名第四节研究有机化合物的一般步骤和方法归纳与整理复习题第二章烃和卤代烃第一节脂肪烃第二节芳香烃第三节卤代烃归纳与整理复习题第三章烃的含氧衍生物第一节醇酚第二节醛第三节羧酸酯第四节有机合成归纳与整理复习题第四章生命中的基础有机化学物质第一节油脂第二节糖类第三节蛋白质和核酸归纳与整理复习题第五章进入合成有机高分子化合物的时代第一节合成高分子化合物的基本方法第二节应用广泛的高分子材料第三节功能高分子材料归纳与整理复习题结束语——有机化学与可持续发展高二化学选修5《有机化学基础》知识点整理2010-2-26一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
(3)具有特殊溶解性的:①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
②苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。




⼈教版有机化学选修5实验及知识点⼈教版有机化学(选修5)教材全部实验总结整理归纳P17实验1-1.蒸馏实验:蒸馏:利⽤互溶液体混合物中各组分沸点不同(⼀般相差30℃以上)进⾏分离提纯的⼀种⽅法。
【注意】仪器:蒸馏烧瓶、冷凝管、接引管(尾接管)、锥形瓶②温度计⽔银球位于⽀管⼝处③冷却⽔的通⼊⽅向:进⽔⽔流与⽓流⽅向相反。
④沸点⾼⽽不稳定的液态物质可以考虑减压蒸馏。
⑤要加⼊碎瓷⽚(未上釉的废瓷⽚)防⽌液体暴沸,使液体平稳沸腾。
⑥蒸馏烧瓶盛装溶液体积最⼤为烧瓶体积的2/3。
p18:实验1-2;苯甲酸的重结晶:重结晶:将已知的晶体⽤蒸馏⽔溶解,经过滤、蒸发、冷却等步骤,再次析出晶体,得到更纯净的晶体的过程。
【溶剂要求】①杂质在此溶剂中的溶解度很⼩或溶解度很⼤,易于除去;②被提纯的有机物在此溶剂中的溶解度受温度的影响较⼤,即热溶液中溶解度⼤,冷溶液中的溶解度⼩。
【主要步骤】加热溶解、趁热过滤、冷却结晶【注意事项】①为了减少趁热过滤过程中损失苯甲酸,应在趁热过滤前加⼊少量蒸馏⽔,避免⽴即结晶,且使⽤短颈漏⽃。
②较为复杂的操作:漏⽃烘热、滤纸⽤热液润湿、马上过滤、漏⽃下端越短越好。
p19:萃取:利⽤物质在互不相溶的溶剂中溶解度的不同,将物质从⼀种溶剂转移到另⼀溶剂中,从⽽进⾏分离的⽅法。
1、萃取包括液-液萃取和固-液萃取。
2、常⽤的萃取剂有⼄醚、⽯油醚、⼆氯甲烷、CCl4等【萃取剂的选择】①萃取剂与原溶剂不互溶、不反应②溶质在萃取剂中的溶解度远⼤于在原溶剂中的溶解度③溶质不与萃取剂发⽣任何反应分液:常⽤于两种互不相溶的液体的分离和提纯。
p19:实践活动:⽤粉笔分离菠菜叶中的⾊素,研磨时⽤到仪器研钵。
p32:实验2-1:⼄炔的实验室制取及性质:1. 反应⽅程式:2. 此实验能否⽤启普发⽣器,为何?不能,因为 1)CaC2吸⽔性强,与⽔反应剧烈,若⽤启普发⽣器,不易控制它与⽔的反应;2)反应放热,⽽启普发⽣器是不能承受热量的;3)反应⽣成的Ca(OH)2微溶于⽔,会堵塞球形漏⽃的下端⼝。


⾼中化学选修五第⼀章知识点总结 化学有机物分⼦结构是⾼中化学中的难点和重点,也是⾼中化学各⼤型考试中必考的知识点之⼀。
下⾯店铺给你分享化学选修五第⼀章知识点,欢迎阅读。
化学选修五第⼀章知识点⼀、有机化合物的分类 【说明】有机物的化学性质是由官能团决定的,因此必须掌握官能团的结构。
化学选修五第⼀章知识点⼆、有机化合物的结构特点 1、碳原⼦的成键特点 ①碳原⼦价键为四个; ②碳原⼦间的成键⽅式:C—C、C=C、C≡C; ③碳链:直线型、⽀链型、环状型等; ④甲烷分⼦中,以碳原⼦为中⼼,4个氢原⼦位于四个顶点的正⾯体⽴体结构。
2、常见有机分⼦的空间构型: 甲烷:正四⾯体型 ⼄烯:平⾯型 苯:平⾯正六边型 ⼄炔:直线型 3、有机化合物的同分异构现象主要种类 ①碳链异构:因碳原⼦的结合顺序不同⽽引起的异构现象。
②位置异构:因官能团或取代基在碳链或碳环上的位置不同⽽引起的异构现象。
CH3—CH2—C≡CH和CH3—C≡C—CH3 ③官能团异构(⼜称类别异构):因官能团不同⽽引起的同分异构现象。
CH3CH2OH CH3-O-CH3 ④其他类型(如顺反异构和旋光异构,会以信息给予题的形式出现)。
对映异构:(D—⽢油醛)和 (L—⽢油醛) 4、同分异构体的书写⽅法规律: ①判断类别:根据有机物的分⼦组成判定其可能的类别异构(⼀般⽤通式判断)。
②写出碳链:根据有机物的类别异构写出各类异构的可能的碳链结构(先写最长的碳链,依次写出少⼀个碳原⼦的碳链,把余下的碳原⼦挂到相应的碳链上去)。
③移动官能团位置:⼀般是先写出不带官能团的烃的同分异构体,然后在各条碳链上依次移动官能团的位置,有两个或两个以上的官能团时,先上⼀个官能团,依次上第⼆个官能团,依此类推。
④氢原⼦饱和:按“碳四键”的原理,碳原⼦剩余的价键⽤氢原⼦去饱和,就可得所有同分异构体的结构简式。
化学选修五第⼀章知识点三、有机化合物的命名:(烷烃的命名是烃类命名的基础) 1、习惯命名法: 碳原⼦数在⼗以下的,依次⽤甲、⼄、丙、丁、戊、⼰、庚、⾟、壬、癸来表⽰。
专题12 有机化学基础(选修5)一、常见的反应类型1.取代反应:一上一下,取而代之①烷烃的取代:光照、纯卤素单质,,……。
① 苯的溴代:催化剂、纯卤素单质② 的硝化:浓H 2SO 4 50~60℃(水溶液)③ 的磺化:70~80℃(水溶液)+ HO-SO 3H -SO 3H + H 2O⑤醇的分子间脱水: 浓H 2SO 4 ΔRCOOH + R'CH 2OHRCOOCH 2R ′+ H 2O 2CH 3CH 2OHCH 3CH 2OCHCH 32+ H 2O⑥醇的溴代 △CH 4 + Cl 2CH 3Cl + HCl 光 CH 3Cl + Cl 2CH 2Cl 2 + HCl 光R-OH + H-Br → R-Br + H 2OCH 3CH 2OH +HBrCH 3CH 2Br + H 2O⑦苯酚的溴代: 饱和溴水⑧酯化反应:酸脱羟基醇脱氢浓H 2SO 4:催化剂、吸水剂⑨酯的水解RCOOR ′+ H 2ORCOOH + R'OH RCOOR ′+ NaOHRCOONa + R'OH ⑩卤代烃的水解R -X+H 2OR -OH + HX CH 3CH 2Br+H 2OCH 3CH 2OH + HBr2.加成反应①乙烯的加成CH 2=CH 2 + Br 2 → BrCH 2H 2BrCH 2=CH 2 + HX → CH 3CH 2X②乙炔的加成 △CH 2=CH 2 + H 2O CH 3CH 2OH催化剂加热、加压CH ≡CH + 2Br 2 → CHBr 2CHBr 2CH ≡CH + HCl →催化剂→Δ→ CH 2=CHCl④ 苯的加成⑤醛、酮的加成3232CH CHO+H CH CH OH ∆−−−→催化剂 2+H ∆−−−→催化剂3.消去反应① 醇的消去CH 3CH 2OHCH 2=CH 2↑+H 2O(条件为加热170,浓 H 2SO 4)浓H 2SO 4:催化剂、脱水剂 ②卤代烃的消去CH 3CH 2C1+NaOHCH 2=CH 2↑+NaC1+H 2O4.氧化反应①醇的催化氧化② 醛的氧化3232CH CHO+O 2CH COOH −−−→催化剂2RCHO+O 22RCOOH ()3334322CH CHO 2Ag NH OH CH COONH 2Ag 3NH H O ∆⎡⎤+−−→+↓++⎣⎦()()34332224Ag NH OH NH CO 4Ag 6NH 2H O ∆⎡⎤+−−→+↓++⎣⎦ 32322CH CHO 2Cu(OH)CH COOH Cu O 2H O ∆+−−→+↓+催化剂醇 △③有机物的燃烧④苯的同系物被KMnO4/H+氧化⑤烯烃、炔烃、二烯烃与KMnO4/H+反应5.还原反应①乙醛的还原CH3CHO + H2→催化剂→Δ→CH3CH2OH②乙炔、乙烯、苯与H2加成6.加聚反应①烯烃的加聚n CH2=CH2→催化剂→Δ→-[-CH2-CH2-] n-②炔烃的加聚n CH2≡CH2→催化剂→Δ→-[-CH=CH-] n-③二烯烃的加聚④卤代烯烃的加聚nCH2 = CHCl⑤丙烯腈的加聚7.缩聚反应①二元羧酸与二元醇的缩聚②羟基酸的缩聚n CH3-CH-COOH →H-[-O-CH-CO-]n-OH + (n-1)H2O | |OH CH3③氨基酸的缩聚n CH 3-CH-COOH → H-[-NH-CH-CO-]n -OH + (n-1)H 2O| |NH 2 CH 3④二元羧酸与二元胺的缩聚二、基本营养物质1.糖类①单糖葡萄糖(C 6H 12O 6):五羟基醛①加成反应②酯化反应③C 6H 12O 6 →酒化酶→ 2C 2H 5OH + 2CO 2④银镜反应⑤与新制Cu(OH)2悬浊液反应果糖(C 6H 12O 6) 五羟基酮②二糖C 12H 22O 11+HC 6 H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖C 12H 22 O 11+H 2C 6H 12O 6 麦芽糖葡萄糖 ③多糖纤维素(C 6H 1O O 5)n +nH 2O nC 6H 12O 6催化剂2.油脂①水解酸性C17H35COO-CH2CH2-OH C17H35COO-CH +3H2O 3C17H35COONa+CH-OH C17H35COO-CH22-OH 碱性(皂化反应)②氢化(硬化)4.蛋白质①两性(以氨基酸为例)②水解:水解最终产物是α-氨基酸③盐析:物理变化④变性:化学变化加热强酸、强碱、重金属盐有机物⑤颜色反应:含苯环的蛋白质遇浓HNO3生成黄色物质⑥灼烧有焦羽毛气味3.氨基酸①两性成肽反应二.基础知识总结1.需水浴加热的反应有:银镜反应、乙酸乙酯的水解、苯的硝化、糖的水解凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
催化剂加热、加压有机化学知识点归纳一、有机物的结构与性质1、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
烷烃分子中的每个C 原子的四个价键也都如此。
C) 物理性质:1.常温下,它们的状态由气态、液态到固态,且无论是气体还是液体,均为无色。
一般地,C1~C4气态,C5~C16液态,C17以上固态。
2.它们的熔沸点由低到高。
3.烷烃的密度由小到大,但都小于1g/cm^3,即都小于水的密度。
4.烷烃都不溶于水,易溶于有机溶剂 D) 化学性质:①取代反应(与卤素单质、在光照条件下),,……。
②燃烧 ③热裂解C 16H 34 C 8H 18 + C 8H 16 ④烃类燃烧通式: O H 2CO O )4(H C 222y x y x t x +++−−−−→−点燃⑤烃的含氧衍生物燃烧通式: O H 2CO O )24(O H C 222y x z y x z y x +-++−−−−→−点燃(2)烯烃: A) 官能团: ;通式:C n H 2n (n ≥2);代表物:H 2C=CH 2B) 结构特点:键角为120°。
双键碳原子与其所连接的四个原子共平面。
C) 化学性质:①加成反应(与X 2、H 2、HX 、H 2O 等)CH 4 + Cl 2CH 3Cl + HCl 光CH 3Cl + Cl 2CH 2Cl 2 + HCl 光 CH 4 + 2O 2CO 2 + 2H 2O 点燃CH 4 C + 2H 2高温 隔绝空气C=C CH 2=CH 2 + H 2OCH 3CH 2OH催化剂加热、加压CH 2=CH 2 + Br 2BrCH 2CH 2Br CCl 4 原子:—X 原子团(基):—OH 、—CHO (醛基)、—COOH (羧基)、C 6H 5— 等 化学键: 、—C ≡C — C=C 官能团 CaO△催化剂②加聚反应(与自身、其他烯烃)③燃烧④氧化反应 2CH 2 = CH 2 + O 2 2CH 3CHO D) 实验室制法:乙烯:CH 3CH 2OH C H 2CH 2浓H 2SO 4+↑H 2O 170℃E) 反应条件对有机反应的影响:CH 2=CH -CH 3+HBrCH 3CH CH 3Br(氢加在含氢较多碳原子上,符合马氏规则)CH 2=CH -CH 3+HBr CH 3-CH 2-CH 2-Br (反马氏加成) (3)炔烃:A) 官能团:—C ≡C — ;通式:C n H 2n —2(n ≥2);代表物:HC ≡CHB) 结构特点:碳碳叁键与单键间的键角为180°。
人教版高中化学选修5有机化学基础知识点
人教版高中化学选修5有机化学基础知识点
一、确定文章类型
本文属于说明文,旨在向读者介绍人教版高中化学选修5有机化学基础知识点。
二、关键词
1、有机化合物
2、有机物分子结构
3、官能团
4、反应类型
三、有机化学基础知识
1、有机化合物
有机化合物是指含碳元素的化合物,其中主要是碳氢元素,也包含其他元素,如氧、氮、硫等。
有机化合物的特点是其分子结构复杂,且具有特定的官能团。
2、有机物分子结构
有机化合物的分子结构主要涉及碳原子的成键和立体化学。
碳原子因其四个价键,可以形成四面体结构。
通过单键、双键和三键,碳原子能够与其他原子形成稳定的键。
此外,有机分子的立体结构对其化学性质和反应活性具有重要影响。
3、官能团
官能团是决定有机化合物性质的关键结构单元。
常见的官能团包括羟基、羰基、羧基、卤素原子、氨基等。
这些官能团在反应中起着重要作用,能够与其它官能团发生化学反应,从而改变有机化合物的性质。
4、反应类型
有机化学反应主要包括取代、加成、消除、氧化还原、聚合等类型。
这些反应涉及到官能团的转化和新的化合物的生成。
理解反应类型及其机理对于学习有机化学至关重要。
四、总结
本文对人教版高中化学选修5有机化学基础知识点进行了简要介绍,包括有机化合物、有机物分子结构、官能团和反应类型。
这些基础知识对于理解有机化学和从事相关领域的研究和工作至关重要。
通过学习和掌握这些知识,我们可以更好地理解有机化合物的性质、合成和转化,从而为未来的化学研究和应用奠定坚实的基础。
有机化学的不断发展也为我们的生活和工业生产带来了诸多便利和改变。